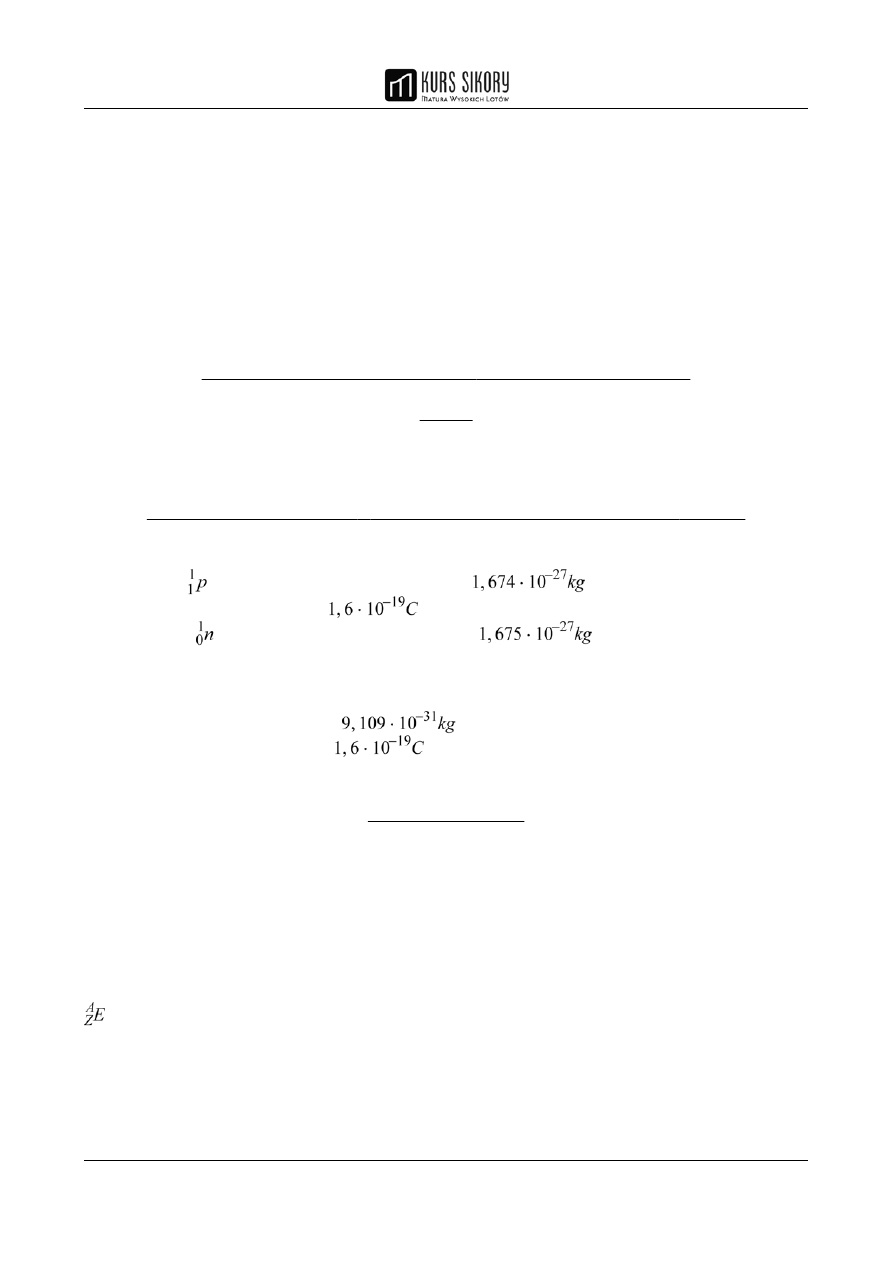
KURS DWULETNI – CHEMIA
KOMPENDIUM MATURALNE 00
Redaktor: p. Prof. Anna Stolarczyk
Edytor: zespół edytorów
Kompendium to zawiera najważniejsze pojęcia, których rozumienie jest niezbędne dla
efektywnego uczestnictwa w zajęciach na Kursie Sikory.
TEMAT: BUDOWA ATOMÓW I CZĄSTECZEK
ATOM
Atom jest najmniejszą częścią pierwiastka, zachowującą jego właściwości. Składa się z jądra oraz
elektronów znajdujących się w przestrzeni wokółjądrowej.
CHARAKTERYSTYKA CZĄSTEK, Z KTORYCH ZBUDOWANE SĄ ATOMY
Atom zbudowany jest z:
1. jądra złożonego z:
• protonów – są to cząstki elementarne o masie
, czyli około 1,0073 u, i
jednostkowym ładunku dodatnim
• neutronów – są to cząstki elementarne o masie
, czyli około 1,0087 u,
elektrycznie obojętne
2. chmury elektronowej złożonej z elektronów e
-
– są to cząstki elementarne o masie 1836 razy
mniejszej od masy protonu, równej
, czyli około 0,00055 u, będące nośnikami
jednostkowego ładunku ujemnego
JĄDRO ATOMOWE
Jądro atomowe opisuje się za pomocą liczb jądrowych:
• atomowej Z – która określa liczbę protonów (p
+
) w jądrze
• masowej A – która określa sumę protonów i neutronów (n
0
) w jądrze
Protony i neutrony nazywa się nukleonami.
Atom o określonej liczbie protonów i neutronów w jądrze (lub zbiór atomów identycznych pod
względem liczby Z i liczby A) nazywa się nuklidem i najczęściej zapisuje w następujący sposób:
.
Masa atomowa jest to liczba określająca, ile razy masa danego atomu jest większa od atomowej
jednostki masy µ (µ = 1,66 • 10
– 27
kg). Masa atomowa zależy przede wszystkim od liczby
nukleonów.
1/26
KM9DCH000
www.kurssikory.pl
ROK XIV
PIERWIASTEK CHEMICZNY
Pierwiastek chemiczny jest zbiorem atomów o tej samej liczbie atomowej Z.
Izotopy są to atomy danego pierwiastka różniące się liczbą neutronów w jądrze, np.:
i
Atomy izotopów różnią się masą.
MASA ATOMOWA PIERWIASKTKA
Masa atomowa pierwiastka (m
at
) – jest średnią ważoną mas atomowych wszystkich naturalnych
izotopów danego pierwiastka .
m
n
– masa atomowa izotopu n
x
n
% – zawartość procentowa danego izotopu (wyrażona w % masowych)
ENERGIA WIĄZANIA
Wielkością charakteryzującą stabilność jąder atomowych jest energia wiązania jądra. Im wyższa
energia tym wyższa trwałość jądra atomowego.
Trwałe jądra mają pierwiastki, w których:
1.
gdzie:
L
n
– liczba neutronów
L
p
– liczba protonów
2. Liczba masowa A < 209
W innych przypadkach jądra ulegają samorzutnym rozpadom, wśrod ktorych wyróżnia się:
1. Przemianę α: polega ona na emisji cząstek α (jąder helu
), składających się z dwóch
protonów i dwóch neutronów. W wyniku przemiany powstaje nowy pierwiastek o liczbie atomowej
mniejszej o 2 i liczbie masowej mniejszej o 4:
2/26
KM9DCH000
www.kurssikory.pl
ROK XIV
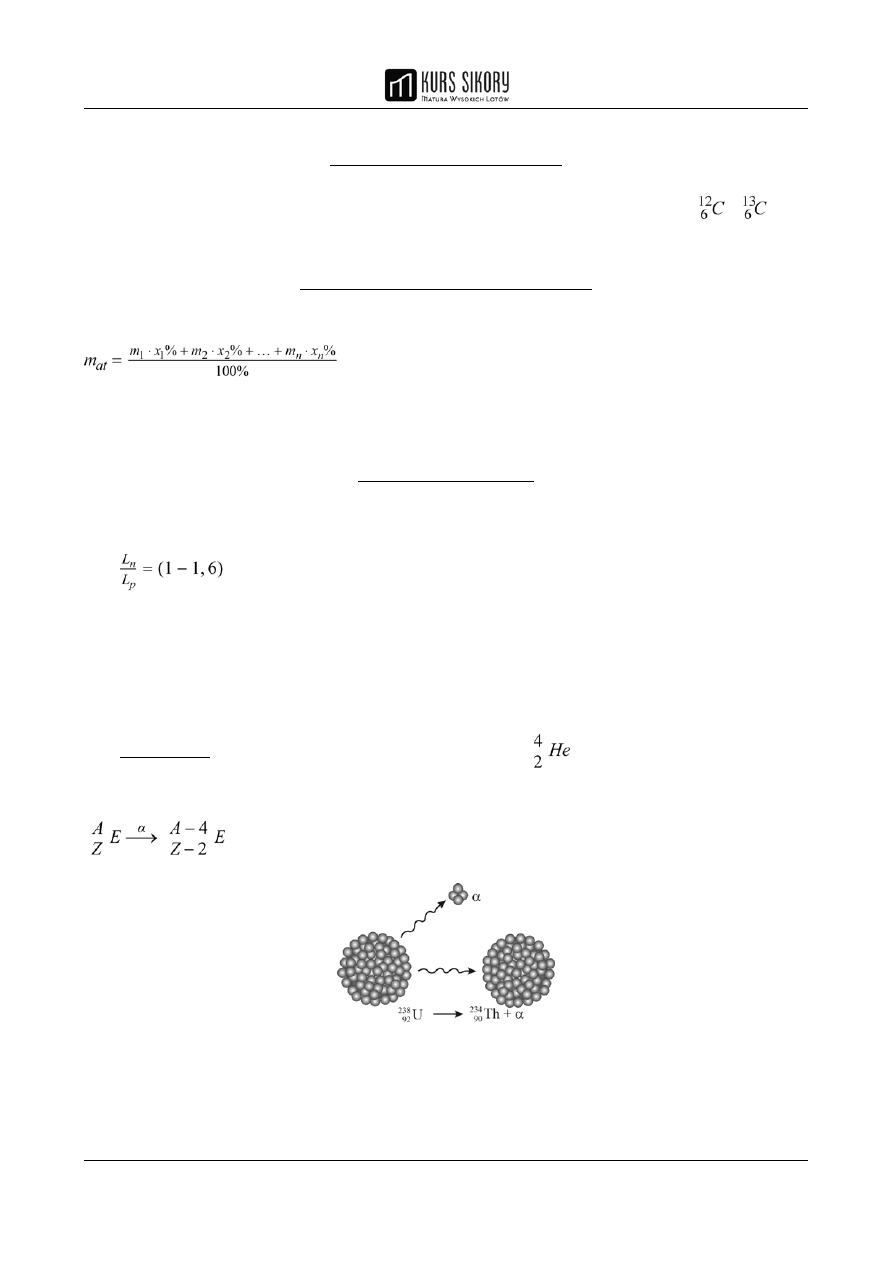
2. Przemianę β
-
: polega ona na emisji cząstek β
-
, czyli elektronów, pochodzących z rozpadu
neutronów w jądrze atomowym:
W wyniku tej przemiany tworzą się atomy pierwiastków o takiej samej liczbie masowej oraz liczbie
atomowej o 1 większej od liczby atomowej pierwiastka wyjściowego:
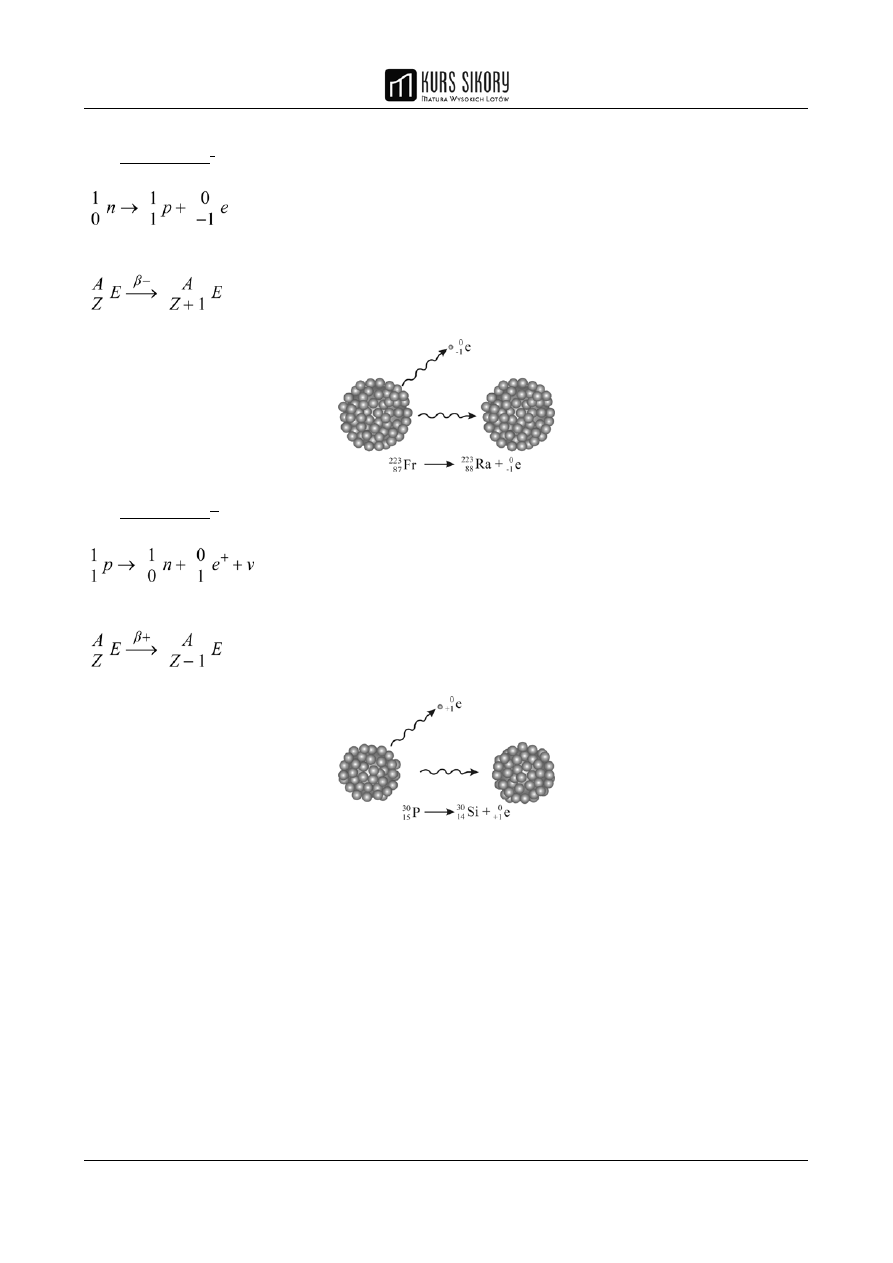
3. Przemiana β
+
– polega na emisji z jądra atomowego elektronu dodatniego (pozytonu)
powstałego w wyniku rozpadu protonu na neutron, pozyton i neutrino
W wyniku emisji pozytonu następuje zmniejszenie liczby atomowej o 1 przy zachowaniu tej samej
wartości liczby masowej nuklidu.
3/26
KM9DCH000
www.kurssikory.pl
ROK XIV

Ćwiczenie maturalne 1 (1 pkt.)
Zidentyfikuj nuklidy ukryte pod symbolami X, Y, Z, T w przedstawionym ciągu przemian
promieniotwórczych oraz zapisz odpowiednie równania:
U → Th
+
He
Rozwiązanie
235
92
231
90
4
2
Th → Pa
+
e
231
90
231
91
0
-1
Pa → Ac
+
He
231
91
227
89
4
2
Ac → Th
+
e
227
89
227
90
0
-1
OKRES POŁOWICZNEGO ROZPADU
Miarą trwałości jądra atomowego jest okres polowicznego rozpadu czyli czas, po upływie
którego połowa początkowej liczby jąder atomowych N
0
, a tym samym połowa masy danego
izotopu promieniotworczego, ulega rozpadowi w wyniku przemiany jądrowej.
Zmianę masy próbki izotopu po czasie t określa wzór:
Gdzie:
m – masa po czasie t
m
0
– masa początkowa
– liczba okresów połowicznego rozpadu
4/26
KM9DCH000
www.kurssikory.pl
ROK XIV
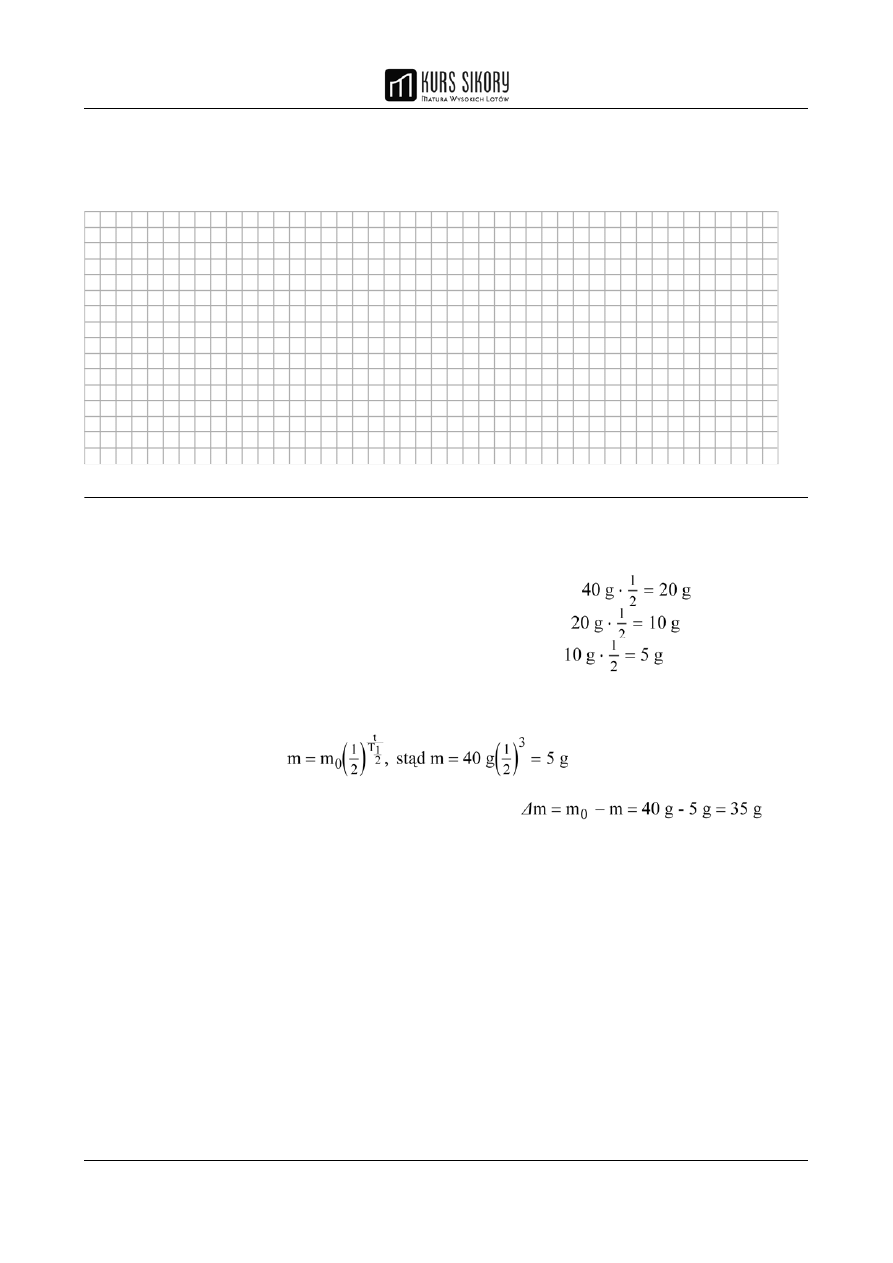
Ćwiczenie maturalne 2 (3 pkt.)
Próbka pewnego materiału promieniotwórczego zawiera obecnie 40 g izotopu
60
Co o okresie
półtrwania równym 5 lat. Oblicz, ile gramów tego izotopu rozpadnie się w ciągu najbliższych
15 lat.
I sposób:
Rozwiązanie
1 pkt za poprawną metodę obliczenia.
1 pkt za poprawne wykonanie obliczeń kolejnych mas izotopu, który
uległ rozpadowi w kolejnych (trzech) okresach pięciu lat:
masa izotopu, która uległa rozpadowi w ciągu pierwszych pięciu lat:
masa izotopu, która uległa rozpadowi w ciągu kolejnych pięciu lat:
masa izotopu, która uległa rozpadowi w ciągu ostatnich pięciu lat:
1 pkt za zsumowanie obliczonych trzech mas: m = 20 g + 10 g + 5 g = 35 g
II sposób:
1 pkt za poprawną metodę obliczenia masy, która pozostała (nie uległa rozpadowi):
obliczenie pozostałej masy:
1 pkt za poprawny wynik liczbowy obliczenia masy, która pozostała: 5 gramów
1 pkt za poprawne obliczenie masy, która uległa rozpadowi:
lub za każdy inny poprawny sposób rozwiązania zdania – łącznie 3 pkt.
MATURZYSTO PAMIĘTAJ!
Zwróć uwagę na opisane w kluczu sposoby rozwiązania zadania oraz na punkty przyznawane za
poszczególne etapy rozwiązań. W ten sposób są punktowane wszystkie zadania maturalne.
5/26
KM9DCH000
www.kurssikory.pl
ROK XIV
MECHANIKA KWANTOWA
Pozajądrową budowę atomu opisuje mechanika kwantowa.
POJĘCIA DOTYCZĄCE ELEKTRONÓW
Oto najważniejsze pojęcia, dotyczące elektronów:
• zasada nieoznaczoności Heisenberga – nie jest możliwe jednoczesne dokładne określenie
położenia i pędu elektronu, a jedynie prawdopodobieństwo jego przebywania w danym obszarze.
• orbital atomowy – najmniejszy obszar w przstrzeni wokółjądrowej, w którym
prawdopodobieństwo przebywania elektronu jest największe.
• równanie Schrödingera – równanie, ktorego rozwiązaniami są funkcje falowe, pozwalające
na opisanie orbitalu atomowego.
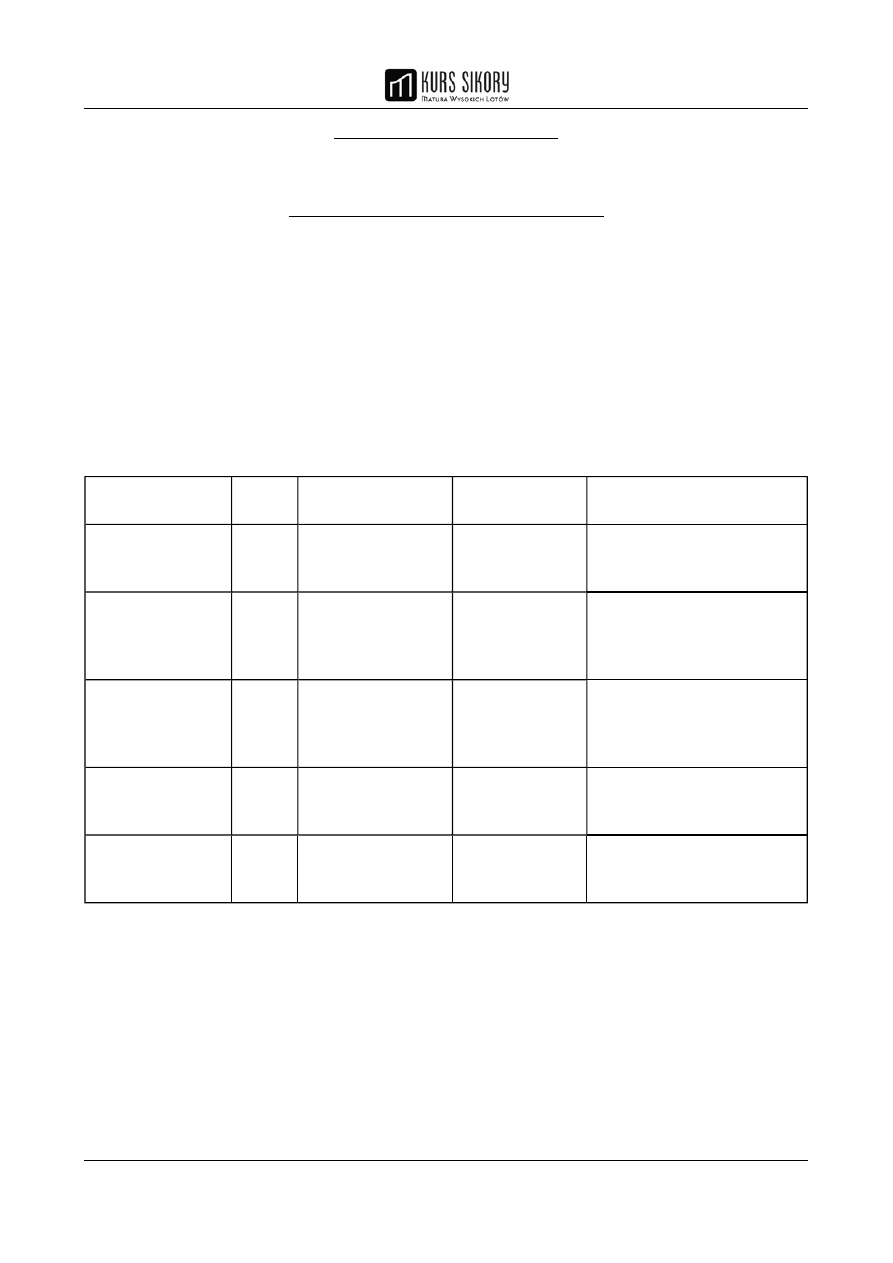
• liczby kwantowe – 5 liczb określających stan kwantowy elektronu oraz cechy orbitalu
atomowego: wielkość, kształt, orientację przestrzenną
Nazwa liczby
kwantowej
Symbol Liczba możliwych
wartości
Możliwe
wartości
Znaczenie liczby
Główna liczba
kwantowa
n
bez ograniczeń
kolejne liczby
naturalne 1, 2, 3,
...
kwantuje energię i decyduje
o rozmiarach orbitali
Orbitalna liczba
kwantowa
l
zależy od głównej
liczby kwantowej i
wynosi n
kolejne liczby
całkowite od 0
do
n – 1 włącznie
kwantuje kręt (orbitalny
moment pędu) i decyduje
o kształcie orbitalu
Magnetyczna
liczba kwantowa
m
zależy od orbitalnej
liczby kwantowej i
wynosi 2l + 1
liczby całkowite
od –l do +l z
zerem włącznie
kwantuje rzut krętu na
wyróżniony kierunek i
decyduje o orientacji
przestrzennej orbitalu
Spinowa liczba
kwantowa
s
jednakowa dla
wszystkich
elektronów
1/2
kwantuje spin
Magnetyczna
spinowa liczba
kwantowa
m
s
2
+1/2 lub –1/2
kwantuje rzut spinu na
wyróżniony kierunek
6/26
KM9DCH000
www.kurssikory.pl
ROK XIV

KONFIGURACJA ELEKTRONOWA PIERWIASTKA
Konfiguracja elektronowa pierwiastka – przypisanie elektronów powłokom, podpowłokom i
poziomom orbitalnym.
Zasady zapełniania orbitali:
1. zakaz Pauliego: atom nie może mieć dwóch elektronów o takich samych wartościach
wszystkich czterech liczb kwantowych
2. zasada minimum energii – elektrony opisywane są w pierwszej kolejności przez orbitale o
najniższej energii: 1s,2s,3s,3p,4s,3d,4p,5s, itd.
3. reguła Hunda – w obrębie danej podpowloki liczba niesparowanych elektronów powinna być
jak największa; elektrony te mają jednakowy spin; elektrony sparowane tworzą się po wypełnieniu
pojedynczymi elektronami wszystkich poziomów orbitalnych podpowłoki
7/26
KM9DCH000
www.kurssikory.pl
ROK XIV
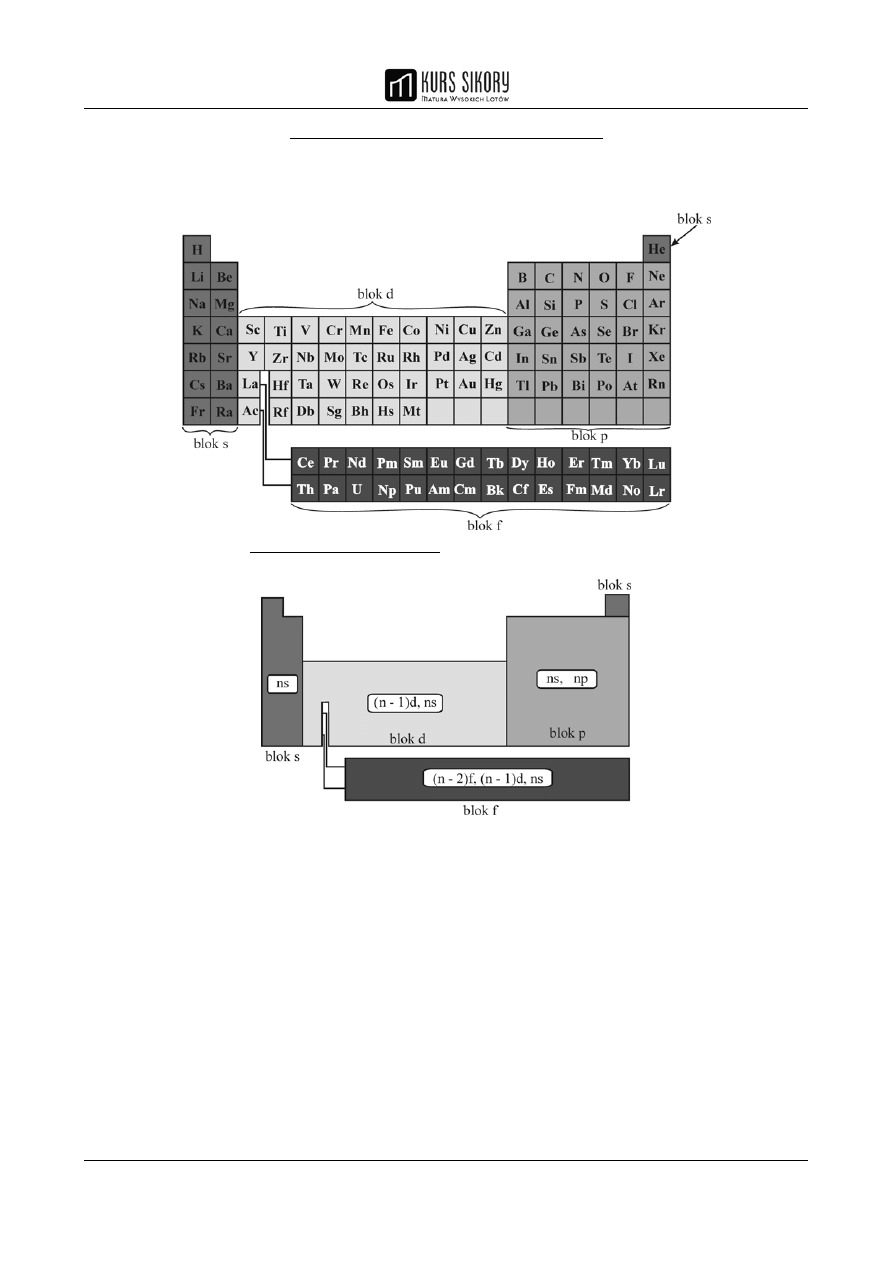
UKŁAD OKRESOWY PIERWIASTKÓW
Układ okresowy pierwiastków pozwala określić:
• budowę atomu i konfigurację elektronową pierwiastka
Oto zapis konfiguracji elektronów walencyjnych pierwiastków bloków energetycznych s, p,d, f:
• charakter chemiczny i aktywność pierwiastka.
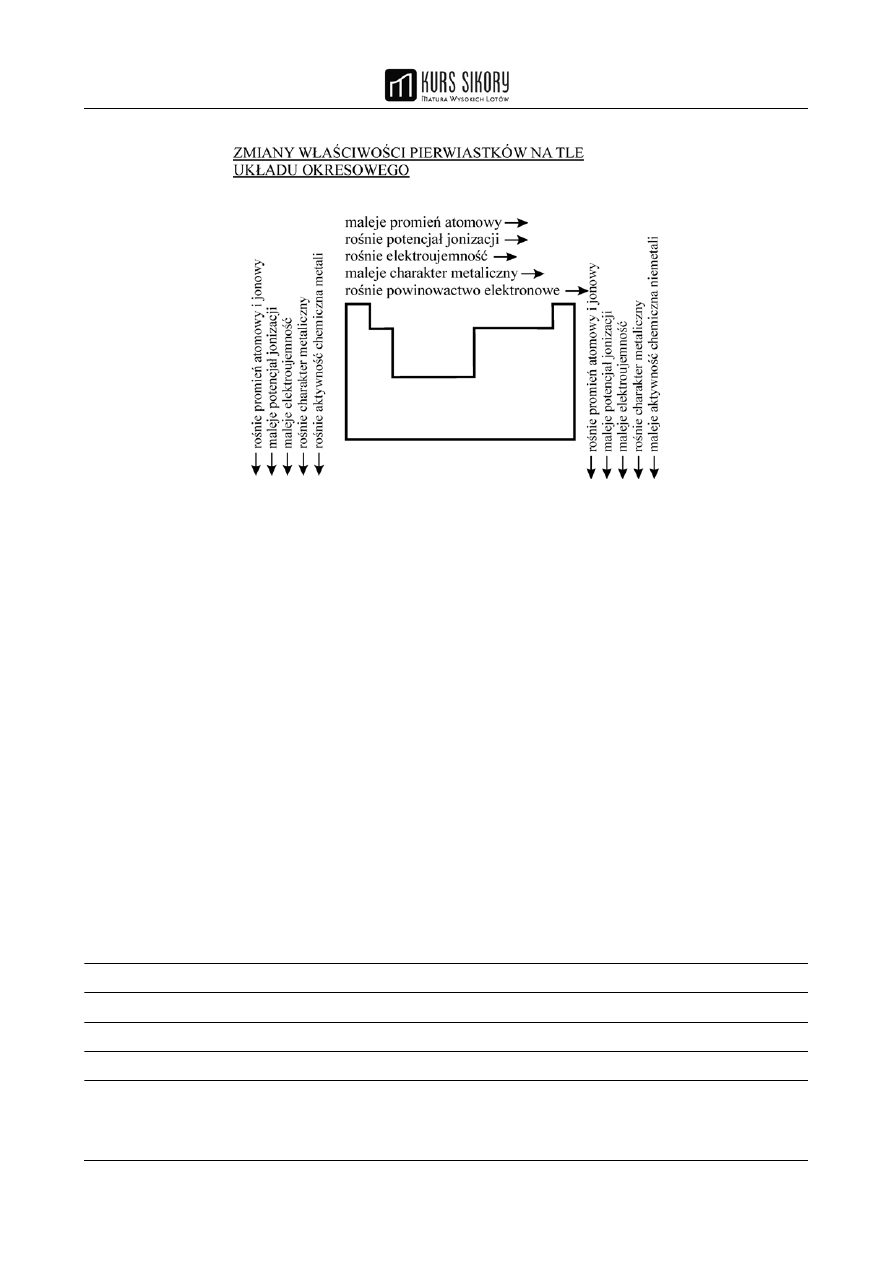
Poniższy schemat ilustruje zmiany najważniejszych wlaściwości pierwiastkow na tle układu
okresowego
8/26
KM9DCH000
www.kurssikory.pl
ROK XIV
• stopnie utltenienia, jakie może on przyjmować w związkach chemicznych
Zapamiętaj, że:
1. pierwiastki metaliczne przyjmują dodatnie stopnie utlenienia;
• pierwiaski bloku s przyjmują tylko jeden dodatni stopień utlenienia
• pierwiastki bloku d i metale należące do bloku p mogą występować na różnych dodatnich
stopniach utlenienia
2. pierwiastki niemetaliczne bloku p mogą przyjmować zarówno dodatnie stopnie utlenienia,
jak i przyjmować elektrony przekształcając się w aniony
MATURZYSTO PAMIĘTAJ!
Wykonując zadania, zwróć uwagę na wszystkie polecenia, które dane zadanie zawiera. Za każde
można otrzymać 1 pkt.
Ćwiczenie maturalne 3 (2 pkt.)
Rubid jest pierwiastkiem o masie atomowej 85,47 u. W przyrodzie występuje on jako mieszanina
dwóch izotopów o liczbach masowych 85 i 87.
Zapisz konfigurację elektronową atomu rubidu na powłokach i podpowłokach oraz skrócony zapis
konfiguracji elektronowej z zastosowaniem gazu szlachetnego. Określ liczbę elektronów
walencyjnych.
9/26
KM9DCH000
www.kurssikory.pl
ROK XIV
Podanie konfiguracji elektronowej na
Rozwiązanie
• powłokach:
37
Rb K
2
L
8
M
18
N
8
O
1
• podpowłokach: 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
5s
1
(1 pkt)
Podanie skróconego zapisu konfiguracji elektronowej z zastosowaniem gazu szlachetnego:
37
Rb
[Kr]5s
1
Określenie liczby elektronów walencyjnych:
37
Rb 5s
1
(1e walencyjny)
(1 pkt)
Ćwiczenie maturalne 4 (1 pkt.)
Uszereguj poniższe atomy według:
a) wzratającego promienia atomowego
b) malejącej elektroujemności
c) wzrastającego charakteru metalicznego
d) malejącej energii jonizacji
Li, Be, N, Ne, Na
a) N, Be, Li, Ne, Na
Rozwiązanie
b) Na, Li, Be, N
c) N, Be, Li, Na
d) Ne, N, Be, Li, Na.
10/26
KM9DCH000
www.kurssikory.pl
ROK XIV

Ćwiczenie maturalne 5 (4 pkt.)
Atom pewnego pierwiastka E w stanie podstawowym, ma następującą konfigurację:
1s
2
2s
2
2p
6
3s
2
3p
4
Uzupełnij poniższą tabelkę, dotyczącą tego pierwiastka:
Liczba elektronów
walencyjnych
Stopień utlenienia w
związku z wodorem
Najwyższy stopień
utlenienia w związku z
tlenem
Konfiguracja
elektronowa prostego
jonu
Rozwiązanie
(po 1 pkt – za każde uzupełnienie)
Liczba elektronów
walencyjnych
Stopień utlenienia w
związku z wodorem
Najwyższy stopień
utlenienia w związku z
tlenem
Konfiguracja
elektronowa prostego
jonu
6
-II
VI
1s
2
2s
2
2p
6
3s
2
3p
6
11/26
KM9DCH000
www.kurssikory.pl
ROK XIV

WIĄZANIA CHEMICZNE
Zdolność atomu danego pierwiastka do przyjmowania elektronów nazywa się elektroujemnością
(EN) określa w skali liczbowej Paulinga ( od 0,7 do 4,0) .Jej wartość pozwala przewidzieć
właściwości pierwiastka, np. niska EN – metal o dużej aktywności wysoka EN – aktywny niemetal
Elektroujemności pierwiastków pozwalają także przewidzieć rodzaj wiązań, jakie mogą utworzyć w
wyniku reakcji chemicznej.
Wiązanie chemiczne – sposob oddziaływania między atomami tworzącymi cząsteczkę; atomy
tworzą cząsteczki, gdyż dążą do uzyskania stabilnej konfiguracji elektronowej: dubletowej lub
oktetowej.
Rodzaje wiązań chemicznych:
• jonowe – elektrostatyczne oddziaływanie między jonami dodatnimi i ujemnymi, powstałymi w
wyniku wzajemnej jonizacji atomów rózniących się znacznie elektroujemnością (∆EN > 1,7, ∆EN
to różnica elektroujemności)
• kowalencyjne – oddziaływanie polegające na tworzeniu się między atomami wspólnych par
elektronowych.
• liczba wiązań kowalencyjnych, które może tworzyć dany atom, jest równa liczbie jego
niesparowanych elektronów
• wspólne pary tworzą elektrony o przeciwnie skierowanych spinach
• następuje nalożenie się orbitali walencyjnych i wytworzenie orbitali cząsteczkowych
( molekularnych):
• typu – gdy walencyjne orbitale atomowe nakladają się liniowo
• typu – gdy walencyjne orbitale atomowe nakladają się bocznie
12/26
KM9DCH000
www.kurssikory.pl
ROK XIV

Wiązanie kowalencyjne jest niespolaryzowane, gdy wspólna para elekronowa jednakowo
oddziałuje z każdym z jąder atomowych cząsteczki np.w cząsteczkach homoatomowych typu H
2
,
O
2
(∆EN < 0,4).
Wiązanie kowalencyjne jest spolaryzowane, gdy wspólna para elektronowa jest przesunięta w
stronę pierwiastka o wyższej elektroujemności (∆EN 0,4-1,7).
• koordynacyjne (donorowo – akceptorowe) – oddziaływanie polegające na uwspólnieniu par
elektronowych pochodzących od jednego z atomów-donora pary elektronowej , np w jonie NH
4
+
donorem pary elektronowej jest N ,akceptorem jon H
+
• metaliczne – oddziaływnie między gazem elektronowym( poruszające się swobodnie elektrony
walencyjne), a kationami, które tworzą sieć krystaliczną metalu
• wiązanie wodorowe, ktore jest oddziaływaniem między odrębnymi czasteczkami ,np. wody,
etanolu, fluorowodoru lub fragmentami dużych czasteczek, np białek; atom wodoru o cząstkowym
ładunku dodatnim odziałuje z silnie elektroujemnym atomem mającym wolną parę
elektronową ,najczęściej są to atomy O, N, F
13/26
KM9DCH000
www.kurssikory.pl
ROK XIV
Ćwiczenie maturalne 6 (5 pkt.)
Ustal rodzaj wiązań w każdym z następujących związków chemicznych:
Związek Rodzaj
wiązań
Związek Rodzaj
wiązań
Ca Br
2
HI
I
2
NaH
PH
3
BaO
HBr
H
2
S
Al I
3
HNO
2
Rozwiązanie
Związek Rodzaj wiązań
Związek Rodzaj wiązań
CaBr
2
jonowe
HI
kowalencyjne spolaryzowane w
stronę jodu
I
2
kowalencyjne
NaH
jonowe
PH
3
kowalencyjne
BaO
jonowe
HBr
kowalencyjne spolaryzowane w stronę
bromu
H
2
S
kowalencyjne spolaryzowane w
stronę siarki
AlI
3
jonowe
HNO
2
kowalencyjne spolaryzowane w
stronę tlenu
Po 1 pkt za każde 2 poprawnie wpisane rodzaje wiązań.
MATURZYSTO PAMIĘTAJ!
9 Pamiętaj o korzystaniu z tablicy elektroujemności w/g Paulinga
9 Pamiętaj, że sole mają budowę jonową niezależnie od różnicy elektroujemności pierwiastków, z
których są zbudowane
14/26
KM9DCH000
www.kurssikory.pl
ROK XIV
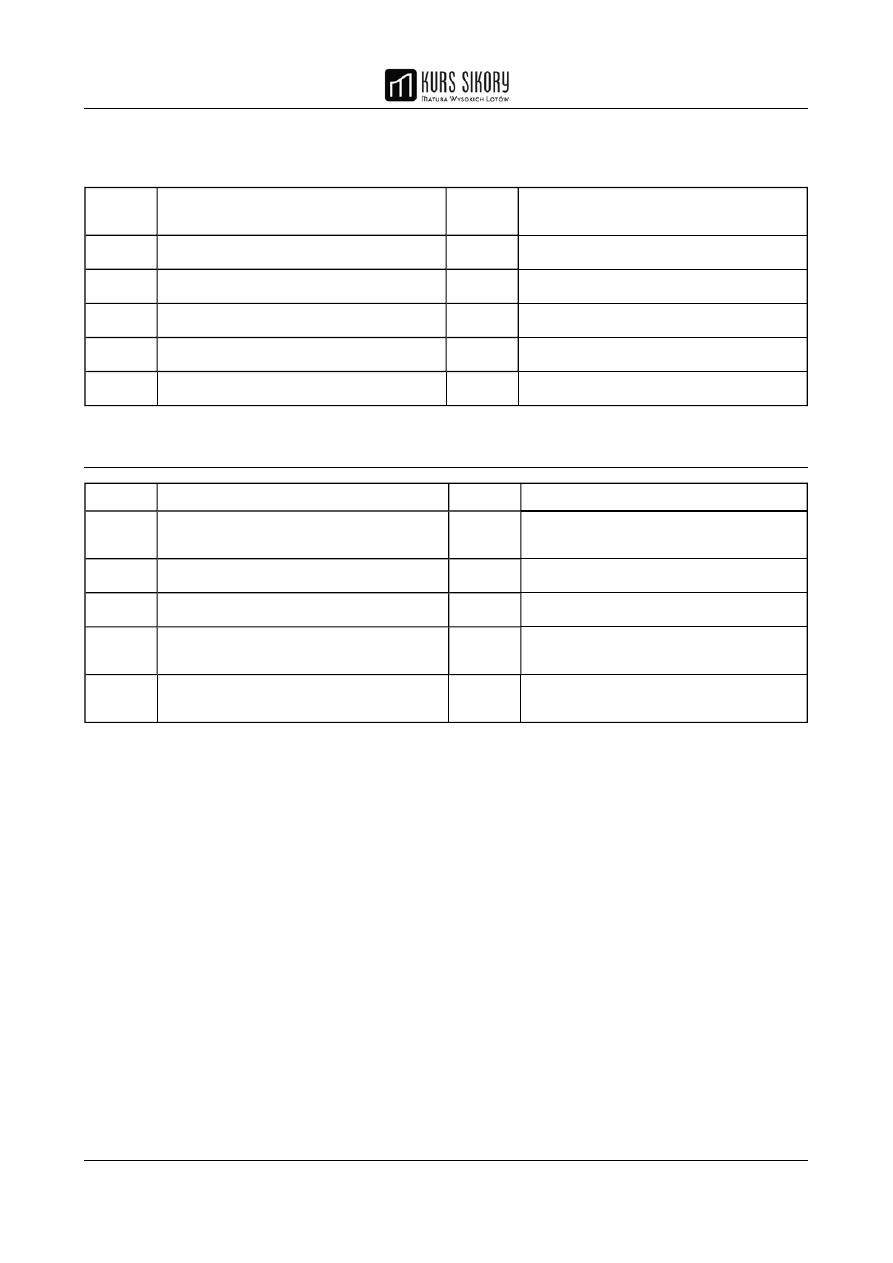
ORBITALE ATOMOWE
Walencyjne orbitale atomowe niektórych pierwiastków są zhybrydyzowane . Orbitale różniące się
energią i kształtem (nierównocenne) przeksztalcają się w orbitale o tej samej energii i kształcie
(rownocenne) i w tym stanie oddziałują z innymi atomami tworząc cząsteczki.
Przykład hybrydyzacji typu sp (digonalna)
Najczęściej spotykane typy hybrydyzacji opisuje tabela.
HYBRYDYZACJA ORBITALI
Typ
hybrydyzacji
Nazwa
hybrydyzacji
Orientacja przestrzenna orbitali Kształt
przestrzenny
hybryd
Charakterystyczny
kąt
atomowych zhybrydyzowanych
sp
digonalna
liniowy
180 °
sp
2
trygonalna
trójkątny
120 °
sp
3
tetraedryczna
(tetragonalna)
tetraedryczny 109 ° 28'
STRUKTURA PRZESTRZENNA CZĄSTECZEK
Struktura przestrzenna cząsteczek zależy od wzajemnego ułożenia orbitali molekularnych
występujących w tych cząsteczkach.
15/26
KM9DCH000
www.kurssikory.pl
ROK XIV

Ćwiczenie maturalne 7 (1 pkt.)
Uzupełnij tabelę, a następnie wykonaj polecenia.
1. Uzupełnij tabelę.
Wzór
cząsteczki
Typ hybrydyzacji atomu
centralnego
Układ przestrzenny orbitali
hybrydyzowanych
CCl
4
CS
2
H
2
O
SO
2
2. Narysuj wzory elektronowe podanych cząsteczek.
3. Wśród podanych cząsteczek wskaż niepolarne, w których występują wiązania kowalencyjne
polarne.
4. Wybierz z tabeli cząsteczki zdolne do tworzenia wiązań wodorowych i narysuj odpowiedni
dimer.
16/26
KM9DCH000
www.kurssikory.pl
ROK XIV
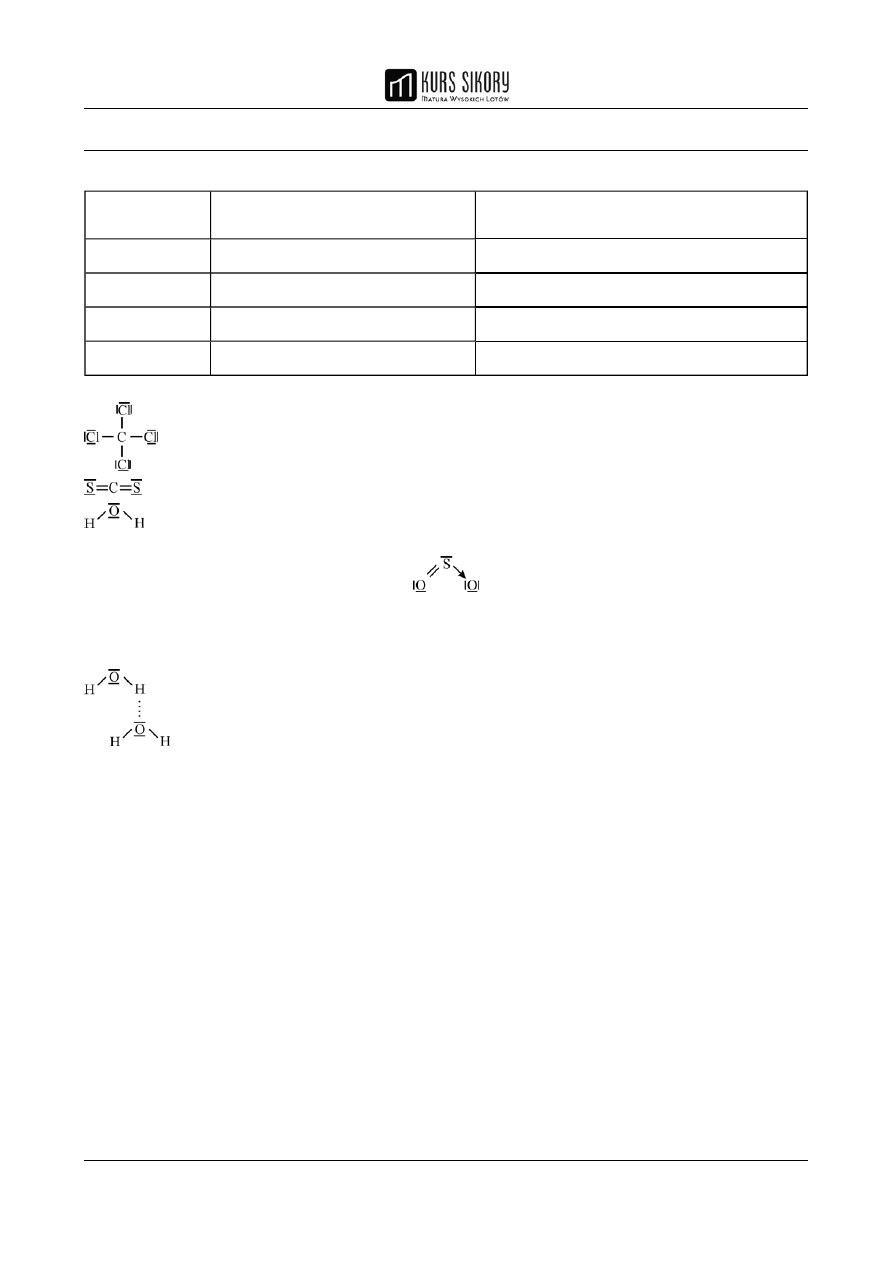
1.
Rozwiązanie:
Wzór
cząsteczki
Typ hybrydyzacji atomu
centralnego
Układ przestrzenny orbitali
hybrydyzowanych
CCl
4
sp
3
tetraedryczny
CS
2
sp
liniowy
H
2
O
sp
3
tetraedryczny
SO
2
sp
2
trygonalny
2.
3.
niepolarne: CCl
4
, CS
2
4.
MATURZYSTO PAMIĘTAJ!
Zwróć uwagę na wzory elektronowe przedstawione w kluczu. Tylko za pełny zapis wzoru
(uwzględniający także wolne pary elektronowe) otrzymuje się punkty.
17/26
KM9DCH000
www.kurssikory.pl
ROK XIV
TEMAT: KLASYFIKACJA ZWIĄZKÓW NIEORGANICZNYCH
WODORKI
Wodorki są to związki metali i niemetali z wodorem.
Numer grup
1
2
13
14
15
16 17
Maksymalna
wartościowość
I
II
III
IV
III
II
I
Wzór ogólny wodorku
odpowiadający
wartościowości max.
EH EH
2
EH
3
EH
4
EH
3
H
2
E HE
Ćwiczenie maturalne 8 (8 pkt.)
Podaj wzory sumaryczne wodorków i określ charakter chemiczny każdego z nich.
Symbol
pierwiastka
Wzór
sumaryczny
wodorku
Charakter
chemiczny
wodorku
Symbol
pierwiastka
Wzór
sumaryczny
wodorku
Charakter
chemiczny
wodorku
K
Al
C
Mg
P
I
N
S
Rozwiązanie
1 pkt za każdy prawidłowo wypelniony rząd
Symbol
pierwiastka
Wzór
sumaryczny
wodorku
Charakter
chemiczny
wodorku
Symbol
pierwiastka
Wzór
sumaryczny
wodorku
Charakter
chemiczny
wodorku
K
KH
Zasadowy
Al
AlH
3
Zasadowy
C
CH
4
Obojętny
Mg
MgH
2
Zasadowy
P
PH
3
Zasadowy
I
HI
Kwasowy
N
NH
3
Zasadowy
S
H
2
S
Kwasowy
MATURZYSTO PAMIĘTAJ!
W zadaniu tym należy określić charakter chemiczny wodorków. Przypomnij sobie, jak podane
związki zachowują sie wobec wody, kwasów i zasad!
18/26
KM9DCH000
www.kurssikory.pl
ROK XIV
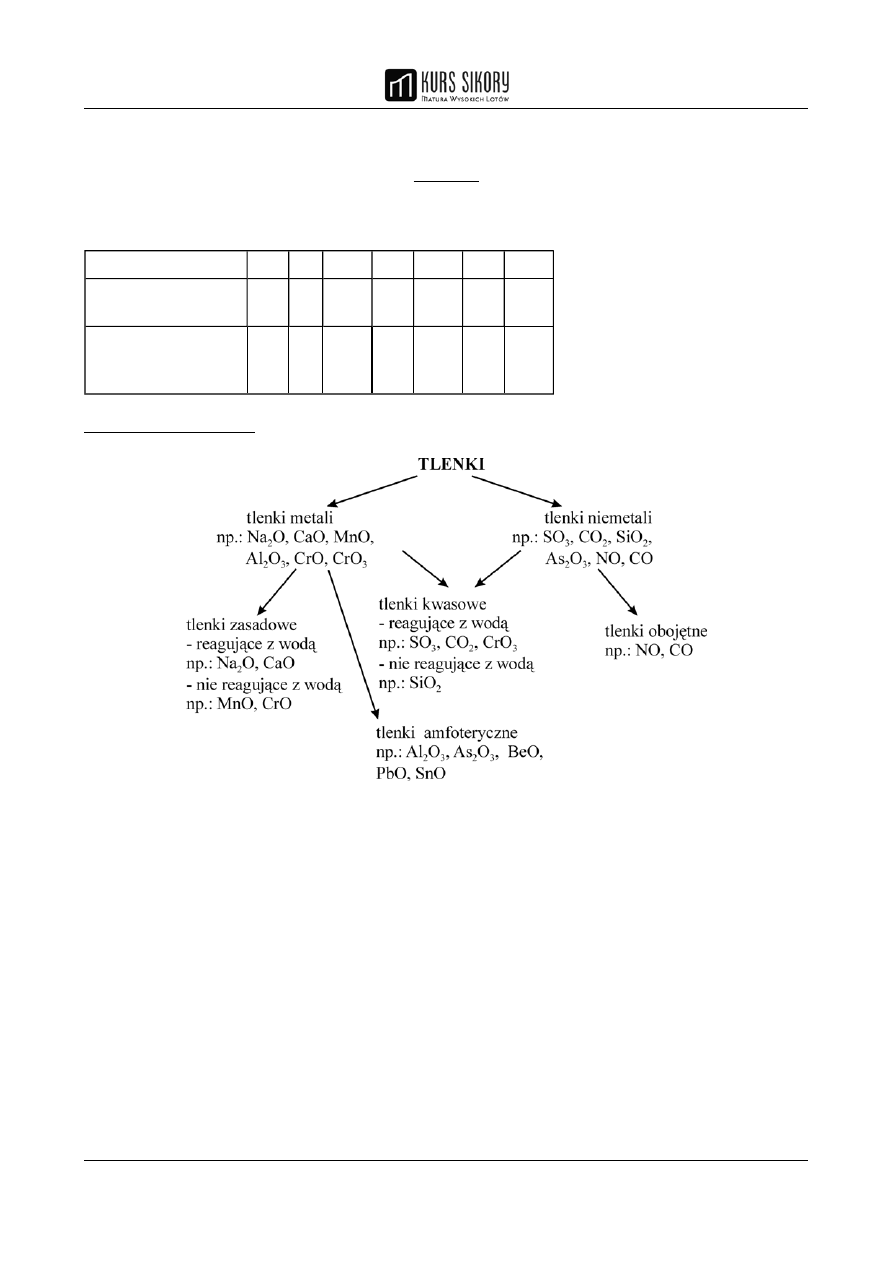
TLENKI
Tlenki są połączeniami pierwiastka z tlenem. Ich skład zależy od wartościowości danego
pierwiastka.
PODZIAŁ TLENKÓW
Numer grup
1
2
13
14
15
16
17
Maksymalna
wartościowość
I
II
III
IV
V
VI
VII
Wzór ogólny tlenku
odpowiadający
wartościowości max.
E
2
O EO E
2
O
3
EO
2
E
2
O
5
EO
3
E
2
O
7
19/26
KM9DCH000
www.kurssikory.pl
ROK XIV
Ćwiczenie maturalne 9 (8 pkt.)
Podaj wzory sumaryczne tlenków, w których pierwiastek ma najwyższy stopień utlenienia i określ
charakter chemiczny każdego z nich.
Symbol pierwiastka Wzór sumaryczny tlenku Charakter chemiczny tlenku
K
C
P
N
S
Al
Mg
Cl
Rozwiązanie
Symbol pierwiastka Wzór sumaryczny tlenku Charakter chemiczny tlenku
K
K
2
O
Zasadowy
C
CO
2
Kwasowy
P
P
2
O
5
Kwasowy
N
N
2
O
5
Kwasowy
S
SO
3
Kwasowy
Al
Al
2
O
3
Amfoteryczny
Mg
MgO
Zasadowy
Cl
Cl
2
O
7
Kwasowy
20/26
KM9DCH000
www.kurssikory.pl
ROK XIV

WODOROTLENKI
Wodorotlenki są to związki nieorganiczne, w których wzorze wyróżnia się symbol metalu i grupę
wodorotlenową . Wzór ogólny wodorotlenków to:
Me(OH)
n
n – liczba jednowartościowych grup OH równa wartościowości metalu
Wodorotlenki dzielimy ze względu na:
1. rozpuszczalność w wodzie
• dobrze rozpuszczalne w wodzie – wodorotlenki litowców
• trudno rozpuszczalne w wodzie – pozostale wodorotlenki
2. stopień dysocjacji:
• mocne zasady – wodorotlenki litowców i berylowców z wyjatkiem Be(OH)
2
, Mg(OH)
2
• słabe zasady – pozostale wodorotlenki
3. charakter chemiczny:
• zasadowe – wodorotlenki litowców i berylowców z wyjatkiem Be(OH)
2
oraz niektóre
wodorotlenki metali bloku d, np.Fe(OH)
2
, Cr(OH)
2
, Mn(OH)
2
. Wodorotlenki zasadowe reagują z
kwasami, a nie reagują z zasadami.
• amfoteryczne – wodorotlenki reagujące z mocnymi kwasami i mocnymi zasadami np.:
Zn(OH)
2
+ 2HCl → ZnCl
2
+ 2H
2
O
Zn(OH)
2
+ 2NaOH → NaZnO
2
+ 2H
2
O
21/26
KM9DCH000
www.kurssikory.pl
ROK XIV
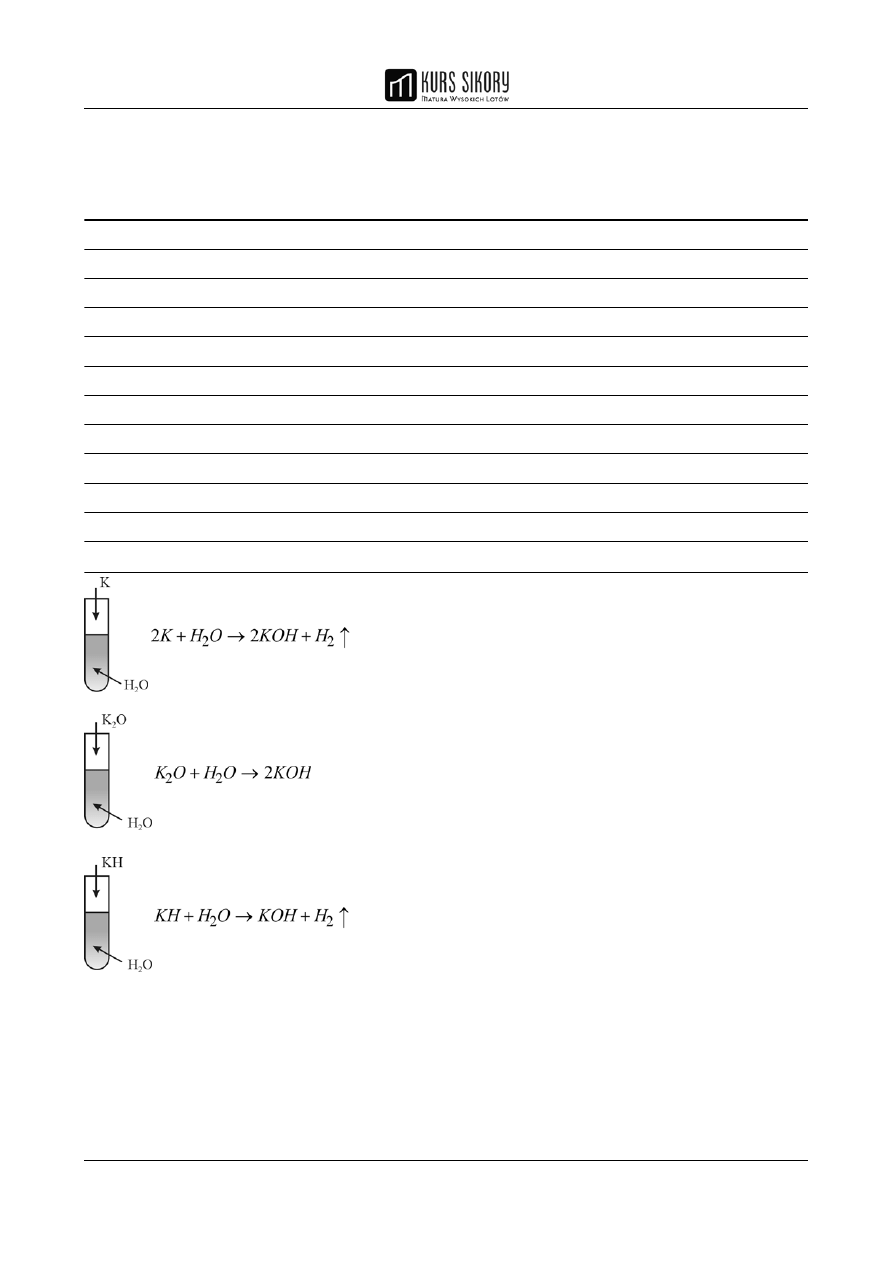
Ćwiczenie maturalne 10 (3 pkt.)
Zaproponuj trzy metody otrzymywania wodorotlenku potasu. Przedstaw schematyczne rysunki i
napisz równania reakcji chemicznych.
Rozwiązanie
MATURZYSTO PAMIĘTAJ!
Zwróć uwagę, że przedstawione w zadaniu sposoby otrzymywania KOH
dotyczą tylko wodorotlenkow litowców i berylowców ( z wyjątkiem berylu)
22/26
KM9DCH000
www.kurssikory.pl
ROK XIV
Ćwiczenie maturalne 11 (1 pkt.)
Zaprojektuj doświadczenie za pomocą którego wykażesz amfoteryczny charakter Al(OH)
3
.
Podaj
• schemat rysunku
• przewidywane obserwacje
• równania reakcji w formie jonowej
• wnioski
23/26
KM9DCH000
www.kurssikory.pl
ROK XIV
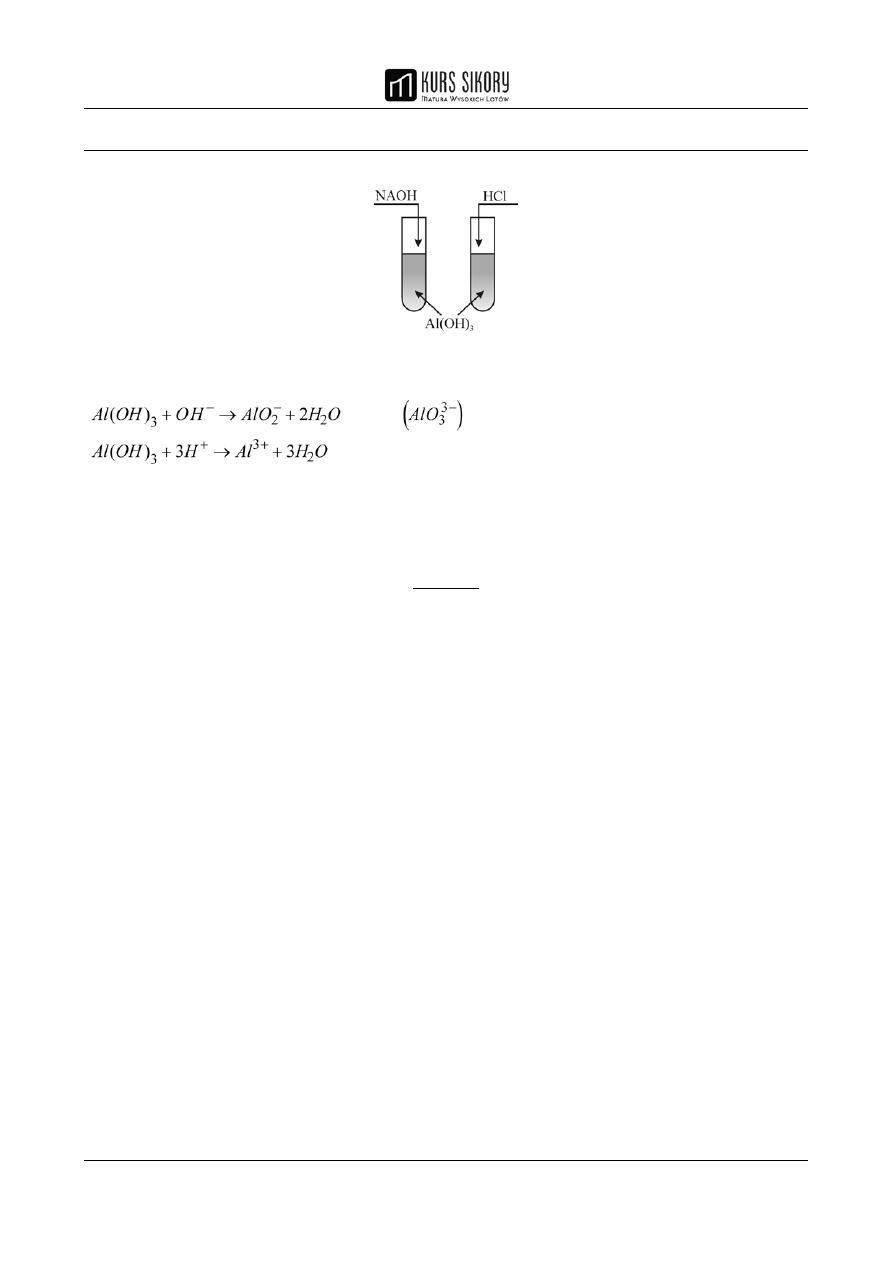
• schemat rysunku:
Rozwiązanie
• przewidywane obserwacje: biały osad znika
• wnioski: w obu probówkach zaszły reakcje
• równania reakcji:
MATURZYSTO PAMIĘTAJ!
Twoj opis doświadczenia powinien być zgodny z kluczem, musi zawierać wypunktowane
elementy!
KWASY
Kwasy są to związki nieorganiczne zbudowane z wodoru i reszty kwasowej R. Wzor ogólny:
H
n
R
Kwasy dzielimy ze wzgledu na:
1. budowę reszty kwasowej
• tlenowe
• beztlenowe
2. liczbę atomów wodoru odszczepiających się w postaci kationu
• jednoprotonowe, np.HBr
• wieloprotonowe, np. H
2
SO
4
3. stopień dysocjacji:
• mocne : HI, HCl, HBr, HClO
4
, H
2
SO
4
, HNO
3
• slabe: pozostałe
• właściwości utleniające:
• utleniające: H
2
SO
4 stęż
, HNO
3 stęż.
, HNO
3 rozc.
• nieutleniające – pozostałe
24/26
KM9DCH000
www.kurssikory.pl
ROK XIV

Ćwiczenie maturalne 12 (3 pkt.)
Podaj wzory i nazwy tlenków, które są bezwodnikami rzeczywistymi lub teoretycznymi
następujących kwasów:
Kwas
Tlenek kwasowy (nazwa) Tlenek kwasowy (wzór sumaryczny)
Kwas siarkowy (IV)
Kwas fosforowy (V)
Kwas krzemowy
Kwas chromowy (VI)
Kwas azotowy (III)
Rozwiązanie
Kwas
Tlenek kwasowy (nazwa) Tlenek kwasowy (wzór sumaryczny)
Kwas siarkowy(IV)
Tlenek siarki(IV)
SO
2
Kwas fosforowy(V)
Tlenek fosforu(V)
P
4
O
10
Kwas krzemowy
Tlenek krzemu ( IV)
SiO
2
Kwas chromowy (VI) Tlenek chromu(VI)
CrO
3
Kwas azotowy (III)
Tlenek azotu (III)
N
2
O
3
Za 5 dobrych odpowiedzi – 3 punkty
Za 4 dobrych odpowiedzi – 2 punkty
Za 3 dobre odpowiedzi – 1 punkt
Za 0-2 dobre odpowiedzi – 0 punktów
25/26
KM9DCH000
www.kurssikory.pl
ROK XIV
SOLE
Sole to związki o wzorze ogolnym
Me
r
R
m
oraz (NH
4
)
r
R, w ktorym:
Me – metal
r – liczba kationow metalu lub NH
4
+
R – reszta kwasowa
m – liczba reszt kwasowych
Sole dzielimy na:
1. obojętne np. NaBr – bromek sodu
2. wodorosole np. KHSO
4
wodorosiarczan VI potasu
3. hydroksosole np. Al(OH)
2
Cl chlorek diwodorotlenek glinu
Ćwiczenie maturalne 13 (6 pkt.)
Ułóż sześć równań chemicznych otrzymywania soli dobierając substraty spośród następujących
związków:
Al
2
O
3
, Rb
2
O, Cu, KOH, HNO
3
.
1. Al
2
O
3
+ 6HNO
3
→ 2Al(NO
3
)
3
+ 3H
2
O
Rozwiązanie
2. Al
2
O
3
+ 2KOH → 2KAlO
2
+ H
2
O
3. Rb
2
O + 2HNO
3
→ 2RbNO
3
+ H
2
O
4. Cu + 4HNO
3st.
→ Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O
5. 3Cu + 8HNO
3rozc.
→ 3Cu(NO
3
)
2
+ 2NO + 4H
2
O
6. KOH + HNO
3
→ KNO
3
+ H
2
O
(po 1 pkt za każde prawidłowe równanie reakcji)
MATURZYSTO PAMIĘTAJ!
9 znajomość metod otrzymywania soli,
9 prawidłowy zapis równań reakcji i ich stechiometrię.
26/26
KM9DCH000
www.kurssikory.pl
ROK XIV
Wyszukiwarka
Podobne podstrony:
budowa atomow i czasteczek , Budowa atomów i cząsteczek
budowa atomów i cząsteczek sprawdzian, VIII L.O
budowa atomów i cząsteczek sprawdzian VIII L O
Budowa atomów i cząsteczek, LICEUM różne, CHEMIA
budowa atomów i czasteczek sprawdzian
Masa atomowa i cząsteczkowa, NAUKA, chemia, lab
chemia, BUDOWA ATOMÓW, WIĄZANIA
Chemia labolatorium, Grupy funkcyjne, Grupa funkcyjna jest to charakterystyczne ugrupowanie atomów w
budownictwo, wewnetrzna budowa atomow, 1
MASA ATOMOWA I CZĄSTECZKOWA PIERWISTKA
BUDOWA ATOMOW W1
Budowa atomów i prawa chemiczne SPRAWDZIAN, do wykorzystania w szkole
Budowa i wlasnosci czasteczkowe gazow
więcej podobnych podstron