
dr inż. Tomasz Tarko, prof. dr hab. inż. Tadeusz Tuszyński
Katedra Technologii Fermentacji i Mikrobiologii Technicznej
Akademia Rolnicza im. H. Kołłątaja w Krakowie
Alkohol metylowy (MeOH) został otrzymany po raz pierwszy w 1661 r.
przez Roberta Boyle’a podczas destylacji drewna i dlatego nazywany
jest również „spirytusem drzewnym”. Jest bezbarwną, łatwo palną i kla-
rowną cieczą o temperaturze wrzenia 64,7
o
C i gęstości 0,79 g/cm
3
.
Metanol jest związkiem toksycznym. Przyjmuje się, że zagrożenie
zdrowia występuje już po spożyciu od 6 do 10 g MeOH, a większe
ilości (30 do 50 g) mogą przyczynić się do ciężkiego zatrucia, a nawet
śmierci. Dawka letalna mieści się w zakresie od 50 do 75 g, a dla
kobiet jest znacznie niższa. Jego niewielka ilość jest wydalana przez
drogi oddechowe wraz z powietrzem, ale większość usuwana jest
z organizmu z moczem, w postaci metabolitów. Alkohol metylowy
utleniany jest w organizmie tylko częściowo, a produktami reakcji są
silnie trujące związki: aldehyd i kwas mrówkowy, które prowadzą do
kwasicy metabolicznej.
Aldehyd mrówkowy denaturuje białko i blokuje procesy oksydacji,
a przede wszystkim oksydatywną dekarboksylację w siatkówce oka.
Procesy te mogą doprowadzić do zapalenia nerwu wzrokowego oraz
pełnej ślepoty. Jeszcze większe zagrożenie występuje w obecności eta-
nolu, który jest również utleniany do aldehydu i kwasu octowego.
Szkodliwość alkoholu metylowego dla niektórych zwierząt jest niższa
niż etanolu i stanowi wyjątek od reguły Richardsona – toksyczność
alkoholu wzrasta w miarę zwiększania się ilości atomów węgla w czą-
steczce. Dawka śmiertelna 50% populacji (LD50 – ang. lethal dose)
dla myszy wynosi 177 mM/kg masy ciała, natomiast w przypadku
etanolu – 54 mM/kg.
Objawy zatrucia metanolem pojawiają się najczęściej już po kilku
godzinach od jego spożycia, a pierwszymi jego symptomami mogą być:
zaburzenia wzroku, oznaki upojenia alkoholowego, nudności i wymioty
oraz bóle brzucha, głowy, oczu i mięśni łydek. W zatruciach przewle-
kłych występują ponadto objawy bezsenności, niewydolności krążenia,
nieżyt przewodu pokarmowego i dróg oddechowych, a także zapalenie
nerek i wątroby oraz zaburzenia psychiczne i śpiączka.
Źródła alkoholu metylowego
Pektyny w surowcach roślinnych są podstawowym potencjalnym
źródłem występowania metanolu w produktach spożywczych, jednak
sama ich obecność nie jest wystarczającym powodem do stwierdzenia
wolnego alkoholu metylowego. Konieczne jest jego uwolnienie ze
zmetylowanego polimeru kwasu D-D-galakturonowego. Ilość MeOH
obecna w produktach spożywczych uzależniona jest głównie od
zawartości pektyn w surowcach stosowanych do produkcji, stopnia
ich estryfikacji metanolem, aktywności macierzystych pektynoeste-
raz (PE), obecności mikroorganizmów oraz od stosowanej metody
obróbki i przetwarzania. Teoretycznie można wyliczyć ilość MeOH
w końcowym produkcie. Jeśli wszystkie grupy karboksylowe w po-
ligalakturonianie zbudowanym z co najmniej 25 członów kwasu
galakturonowego są zestryfikowane metanolem, to ilość grup me-
toksylowych wynosi 16,32%, a stopień estryfikacji – 100%. W 1 kg
niektórych surowców pochodzenia roślinnego może znajdować się
nawet ponad 5 g metanolu.
Niewielka deestryfikacja grup metoksylowych może mieć miejsce
już w czasie dojrzewania, a głównie przejrzewania płodów rolnych.
Zasadnicza ilość metanolu powstaje jednak podczas procesów roz-
drabniania surowców, maceracji, tłoczenia i fermentacji.
Należy zwrócić uwagę, że konsumpcja surowców i produktów
zawierających pektyny tylko w niewielkim stopniu przyczynia się do
uwalniania alkoholu metylowego. Pektyny należą do polisacharydów
trudno przyswajalnych, ponieważ w przewodzie pokarmowym czło-
wieka nie ma systemów enzymatycznych zdolnych do ich rozkładu.
Składniki te są przemieszczane do niżej położonych części jelita i tam
dopiero ma miejsce ich rozkład przez mikroorganizmy jelitowe, które
charakteryzują się aktywnością enzymów pektynolitycznych. Określoną
rolę w deestryfikacji pektyn może mieć również pH żołądka (około 2,0)
oraz jelita grubego (5,8-8,8).
Potencjalnym źródłem metanolu w surowcach i produktach pochodze-
nia roślinnego są również substancje ligninowo-celulozowe i inne związki
(garbniki, barwniki), które zawierają grupy metoksylowe. Stosunkowo
wysoką zawartością potencjalnego metanolu charakteryzują się np. pieprz
i drewno dębowe (od 7 do 53 g/kg). W procesie przemian żywności
oraz w przewodzie pokarmowym człowieka nie dochodzi zazwyczaj do
uwalniania metanolu z substancji ligninowo-celulozowych.
Streszczenie
Alkohol metylowy należy do związków toksycznych, dlatego trzeba
monitorować jego zawartość w produktach spożywczych. Wysoką
czułością i dokładnością oznaczania metanolu charakteryzuje się
metoda chromatograficzna. Techniki kolorymetryczne odznaczają
się niższą dokładnością oraz nieznacznym zawyżaniem wyniku
w stosunku do rzeczywistego stężenia MeOH w próbach.
Summary
The methyl alcohol content in food products should be controlled
as it is one of the toxic compounds. The chromatographic method
of methanol determination is characterized by high sensitivity and
accuracy, whereas the colorimetric techniques are distinguished
by lower precision and slight overestimation of the result in relation
to the actual MeOH concentration in samples.
Słowa kluczowe
alkohol metylowy, metody oznaczania metanolu
Key words
methyl alcohol, methanol determination methods
Metanol i metody
jego oznaczania
laboratorium przemysłowe
Laboratorium |
7
/2006
32

Czynniki wpływające
na powstawanie metanolu
Z możliwych trzech dróg deestryfikacji pektyn (enzymatycznej, chemicznej
i termicznej) największy udział w uwalnianiu grup metoksylowych ma
pektynoesteraza (EC 3.1.1.11). W wyniku działania tego specyficznego
enzymu, który występuje prawie we wszystkich roślinach, powstają pektyny
o niższym stopniu zestryfikowania lub kwasy pektynowe oraz uwalniany
jest metanol. Aktywność PE w owocach roślin zmienia się w zależności od
stopnia ich dojrzałości. Oprócz macierzystej pektynoesterazy, występującej
w surowcach roślinnych, enzym ten wytwarzany jest przez wiele gatunków
grzybów, bakterii i drożdży. Optimum pH dla PE roślinnych i bakteryj-
nych kształtuje się w granicach od 5,5 do 9,5, a grzybowych – od 4,5 do 7,0.
Optymalny zakres temperatury działania pektynoesteraz uzależniony jest
również od ich pochodzenia i najczęściej zawiera się w granicach 30-50
o
C.
Inaktywacja tego enzymu następuje zwykle w temperaturze od 65 do 85
o
C,
w zależności od źródła jego występowania.
W celu ograniczenia ilości MeOH w winach i destylatach owoco-
wych można stosować obróbkę termiczną moszczu i miazgi przed fer-
mentacją (85
o
C, 15-30 min). Należy jednak zauważyć, że podgrzewanie
moszczów i zacierów przyczynia się do pogorszenia właściwości orga-
noleptycznych wyrobu gotowego. Wykazano również, że jony żelaza,
a także etanol oraz związki polifenolowe hamują aktywność PE.
Podwyższone wydzielanie metanolu towarzyszy również stosowaniu
preparatów enzymatycznych z aktywnością enzymów pektynolitycz-
nych, które zwiększają wydajności tłoczenia owoców i przyspieszają
klarowanie moszczów. Ograniczenie tego zjawiska można osiągnąć
po zastosowaniu preparatów z aktywnością liazy pektynianowej, która
depolimeryzuje łańcuch pektyny bez uwalniania metanolu.
Metody identyfikacji i oznaczania
alkoholu metylowego
Pod względem właściwości chemicznych metanol jest bardzo zbliżony
do etanolu i zazwyczaj w próbach poddawanych analizie oba te alkoho-
le występują łącznie. W praktyce ich rozdział jest bardzo utrudniony,
stąd metodyki stosowane do ilościowego oznaczania MeOH muszą
uwzględniać obecność alkoholu etylowego i eliminować jego ewentu-
alny wpływ na końcowy wynik oznaczenia.
Metody fizyczne (piknometria i refraktometria) nie nadają się do
oznaczeń metanolu w stężeniach poniżej 1%, szczególnie przy nad-
miarze etanolu. Najczęściej zastosowanie w analityce znajdują metody
kolorymetryczne i chromatograficzne.
Metody kolorymetryczne
Grupa metod kolorymetrycznych, przystosowanych do ilościowego
oznaczania zawartości metanolu, opiera się na reakcji tego składnika z od-
powiednim odczynnikiem tworzącym w jego obecności barwny kompleks.
Intensywność zabarwienia powstałego kompleksu w próbach badanych
porównuje się z gęstością optyczną roztworów wzorcowych o znanym
stężeniu alkoholu metylowego, w których przeprowadzono również reakcję
barwną. Pomiaru absorbancji dokonuje się na spektrofotometrze przy
długości fali charakterystycznej dla powstałego kompleksu. Warunkiem
prawidłowego odczytu jest prostoliniowy przebieg krzywej wzorcowej,
w przedziałach absorbancji odpowiadającej odczytywanym wartościom
metanolu w próbach badanych (spełnianie prawa Lamberta-Beera).
Chemizm oznaczania metanolu we wszystkich metodach koloryme-
trycznych jest zbliżony. Metanol w badanej próbie zostaje utleniony
w środowisku kwaśnym nadmanganianem potasu, a nadmiar KMnO
4
redukuje się kwasem szczawiowym.
3CH
3
OH + 2KMnO
4
+ H
2
SO
4
o 3HCHO + K
2
SO
4
+ 2MnO
2
+ 4H
2
O
33
laboratorium przemysłowe
Laboratorium |
7
/2006
33
5(COOH)
2
+ 2KMnO
4
+ 3H
2
SO
4
o 10CO
2
+ 2MnSO
4
+ 8H
2
O + K
2
SO
4
Po odbarwieniu roztworu wprowadza się do środowiska reakcji
odczynnik tworzący barwny kompleks z formaldehydem. Istnieje kilka
substancji chemicznych wywołujących reakcję charakterystyczną dla
formaldehydu:
– odczynnik Schiffa (fuksyna w stężonym kwasie siarkowym);
– kwas chromotropowy;
– pentano-2,4-dion.
Metoda z odczynnikiem fuksynosiarkowym
Polega na tworzeniu barwnego kompleksu formaldehydu z odczyn-
nikiem fuksynosiarkowym. Roztwór zawierający metanol przybiera
zabarwienie fioletowe, osiągając maksimum po 15-20 minutach, a po-
miaru dokonuje się przy długości fali 580 nm. Ponieważ etanol również
tworzy kompleks z odczynnikiem fuksynosiarkowym, bardzo istotne
jest, aby zarówno wszystkie badane próby, jak i roztwory wzorcowe,
charakteryzowały się takim samym stężeniem alkoholu etylowego. Poza
metanolem i etanolem do powstawania barwy w tej metodzie anali-
tycznej przyczyniają się także wyższe alkohole, co może prowadzić do
zawyżania wyników. Spośród nich najbardziej intensywne zabarwienie
daje alkohol izobutylowy, nieco słabsze – amylowy, natomiast propanol
nie wpływa na tworzenie barwy. Należy jednak podkreślić, że alkohole
fuzlowe występują głównie w napojach alkoholowych, a ich zawartość
nie przekracza zwykle 0,5% i w praktyce występuje tylko niewielkie
zawyżenie wyników oznaczenia (około 0,005%).
Metoda z kwasem chromotropowym
Została ona opracowana przez Mathersa do oznaczania zawartości
alkoholu metylowego w wyrobach spirytusowych. Metanol utlenia
się w środowisku kwaśnym do formaldehydu przy pomocy roztworu
nadmanganianu potasu. Ilość utlenionego MeOH jest proporcjonalna
do całkowitego jego stężenia w roztworze. Pozostały nadmiar nad-
manganianu potasu i wytworzony w wyniku reakcji tlenek manganu
rozkłada się pirosiarczynem sodu.
W następnej kolejności do środowiska reakcji wprowadza się roz-
twór kwasu chromotropowego (1,8-dihydro-3,6-disulfonaftalenowego)
w stężonym kwasie siarkowym. Podczas ogrzewania w 70
o
C tworzy
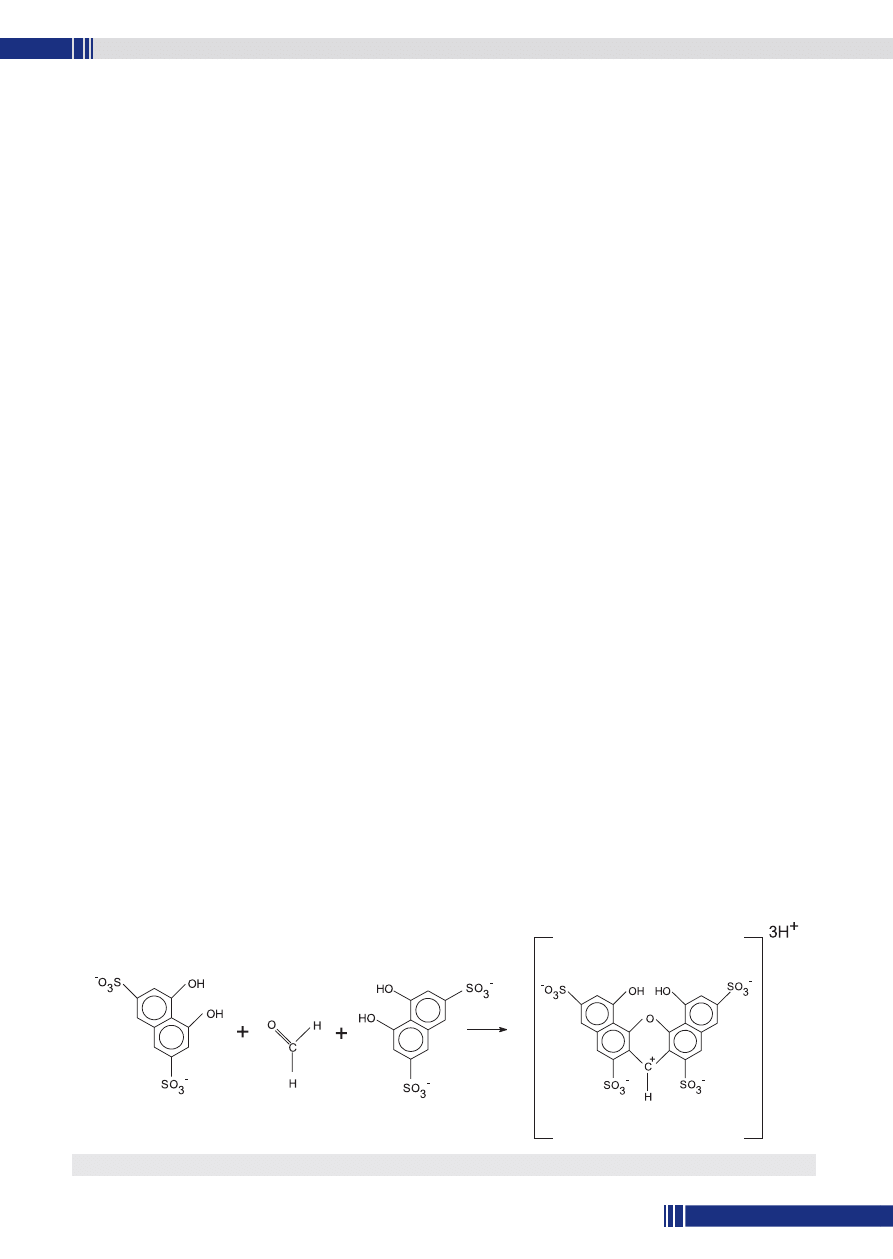
się z formaldehydem fioletowy kompleks barwny (rys. 1), którego
maksimum absorbancji odpowiada długości fali 570 nm.
Metoda ta jest specyficzna dla formaldehydu powstałego z utleniania
metanolu, inne aldehydy (z wyjątkiem akroleiny) nie tworzą barwy. Spo-
śród pozostałych substancji w reakcję barwną z kwasem chromotropowym
nie wchodzą: propanol, butanol, aceton i glukoza oraz kwasy: szczawiowy,
mlekowy, winowy i cytrynowy. Działanie zakłócające barwę kompleksu
wykazują natomiast: gliceryna (barwa żółta i zielona fluorescencja) i fur-
furol (barwa brązowa) oraz arabinoza, laktoza i sacharoza (barwa żółta).
Celem uniknięcia błędów należy zatem roztwór oddestylować.
Podobnie jak w poprzedniej metodzie, bardzo istotnym czynnikiem
jest stężenie alkoholu etylowego w analizowanych próbach. Podczas
utleniania mieszaniny metanolu i etanolu można otrzymać stałe ilości
formaldehydu tylko wówczas, gdy analizowane roztwory zawierają takie
samo całkowite stężenie EtOH. Przyjmuje się, że optymalny udział
etanolu w badanych próbach powinien wynosić 5% obj. Roztwory
o wyższym stężeniu należy rozcieńczyć, a gdy ich moc jest niższa,
wprowadza się do badanej próby spirytus bezmetanolowy w celu
podwyższenia stężenia do 5% obj.
Oznaczenie metanolu z pentano-2,4-dionem
Metoda polega na utlenieniu metanolu przy udziale kwaśnego nad-
manganianu potasu, redukcji jego nadmiaru i barwnej reakcji wytwo-
rzonego formaldehydu z pentano-2,4-dionem. W wyniku tej reakcji
powstaje 3,5-diacetylo-1,4-dihydro-2,6-metylopirydyna barwy żółtej,
której gęstość optyczna odczytywana jest na spektrofotometrze, przy
długości fali 412 nm. Utlenianie metanolu przeprowadza się najczęściej
2-procentowym roztworem nadmanganianu potasu, w temperaturze
0
o
C, przez 15 minut. Redukcję nadmiaru KMnO
4
wykonuje się w czasie
1 h, przy użyciu arseninu sodowego, a do zakwaszania roztworu używa
się 0,12 M kwasu solnego lub siarkowego.
Metoda z pentano-2,4-dionem charakteryzuje się wysoką precyzją
i może być wykorzystywana do oznaczania zawartości MeOH we krwi.
Znalazła także zastosowanie do ciągłego oznaczania aktywności pek-
tynoesterazy poprzez pomiar wydzielonego metanolu w preparatach
pektynolitycznych i sokach owocowych.
Metody z wykorzystaniem oksydazy alkoholowej (AO)
Istnieje kilka sposobów oznaczania stężenia metanolu w próbkach, po
wcześniejszym utlenieniu MeOH, przy użyciu oksydazy alkoholowej.
W wyniku reakcji powstaje formaldehyd, który może być oznaczony
ilościowo metodami kolorymetrycznymi. Oprócz omówionych wcze-
śniej technik kolorymetrycznych wykorzystuje się obecnie wiele innych
związków tworzących barwne kompleksy z formaldehydem. Można
do tej grupy zaliczyć odczynnik Nasha (amoniak z acetyloacetonem),
purpulad (4-amino-3-hydrazyno-5-merkapto-1,2,4-triazol) oraz MBTH
(N-metylobenzotiazolino-2-hydrazon).
Odczynnik Nasha charakteryzuje się stosunkowo wysoką specyficz-
nością do metanolu w obecności etanolu, co oznacza, że zawartość
EtOH w próbach nie będzie miała istotnego wpływu na wynik. Pomiaru
absorbancji dla tego związku dokonuje się przy długości fali 412 nm.
Rys. 1. Powstawanie barwnego kompleksu formaldehydu z kwasem chromotropowym.
laboratorium przemysłowe
Laboratorium |
7
/2006
34
Z kolei reakcja z purpuradem wyróżnia się trzykrotnie wyższą czu-
łością w odniesieniu do odczynnika Nasha oraz dużą selektywnością
względem metanolu – 59 razy wyższą w odniesieniu do poprzedniej
metody. Stanowi on jeden z bardziej przydatnych związków przy
oznaczaniu metanolu w próbach zawierających etanol.
Największą czułość stwierdza się jednak w reakcji z N-metyloben-
zotiazolino-2-hydrazonem – ponad 7-krotnie wyższą w odniesieniu do
odczynnika Nasha. Wadą tej metody jest jednak mniejsza specyficzność
w obecności etanolu. Może ona być przydatna do oznaczania bardzo
niskich stężeń metanolu w próbach nie zawierających alkoholu etylowe-
go. W przypadku roztworów etanolowych konieczne jest wyrównanie
mocy zarówno w próbkach badanych, jak i roztworach modelowych,
niezbędnych do wykreślenia krzywej wzorcowej.
Innym sposobem oznaczania metanolu przy wykorzystaniu oksydazy
alkoholowej jest analiza z użyciem rodnika ABTS [kwas 2,2’-azyno-
-bis (3-etylenobenzotiazolinowy)]. Podczas reakcji AO z metanolem
wydziela się nadtlenek wodoru, który charakteryzuje się zdolnością
do usuwania wolnych rodników. Stopień odbarwienia roztworu ABTS
ocenia się po wprowadzeniu H
2
O
2
wydzielonego w reakcji enzymatycz-
nej. Ilościową analizę zawartości metanolu przeprowadza się metodą
spektrofotometryczną przy długości fali 734 nm. Krzywą kalibracyjną
wykreśla się na podstawie reakcji ABTS ze znanymi stężeniami Troloxu
(syntetyczna witamina E). Wpływ na dokładność tej techniki anali-
tycznej mają obecne w analizowanym roztworze związki zdolne do
zmiatania wolnych rodników, np. kwas askorbinowy lub polifenole.
Wszystkie sposoby ilościowego oznaczania zawartości metanolu
z wykorzystaniem oksydazy alkoholowej charakteryzują się bardzo
wysoką czułością i mogą być wykorzystywane m.in. do oceny szybkości
rozkładu pektyn z udziałem pektynoesterazy oraz zawartości MeOH
we krwi, moczu oraz sokach i napojach.
Metody chromatograficzne
Do ilościowego oznaczania zawartości alkoholu metylowego wykorzy-
stuje się najczęściej chromatografię gazową. W zależności od stężenia
MeOH w analizowanych próbach można wcześniej roztwór zatężać,
poprzez destylację lub ekstrakcję z rozpuszczalnikami organicznymi
(heksan, chloroform).
Rozdział składników mieszaniny przeprowadza się zwykle na śred-
niopolarnych kolumnach kapilarnych klasy Carbowax (30 lub 50 m,
I od 0,35 do 0,5 mm, warstwa filmu: 0,2-0,3 Pm) z użyciem detektora
płomieniowo-jonizacyjnego (FID). Identyfikacji ilościowej dokonuje się
na podstawie porównania pola powierzchni piku metanolu z polem
powierzchni standardu wewnętrznego, którym jest zwykle pentanol.
Związek ten z reguły nie występuje w produktach powstałych w wyniku
fermentacji (wino lub piwo) czy destylacji (napoje spirytusowe) oraz
w płynach ustrojowych (krew, mocz).
Wykorzystanie innych rodzajów detektorów, np. wychwytu elek-
tronów, wymaga użycia deuterowanego alkoholu metylowego jako
standardu wewnętrznego.
W metodach chromatograficznych stosuje się zwykle programowanie
temperatury, które uzależnione jest w dużej mierze od rodzaju zasto-
sowanej kolumny i detektora. Metanol jest związkiem silnie lotnym
(temperatura wrzenia 64,7
o
C), należy zatem stosować powolny wzrost
temperatury, aby uniknąć nakładania się innych pików o podobnym
czasie retencji (octan etylu, etanol).
Połączenie chromatografu gazowego (GC) ze spektrometrem ma-
sowym (MS) należy również do bardzo rozpowszechnionych technik
w analityce związków lotnych. Zastosowanie detekcji MS pozwala na
zwiększenie czułości pomiaru do ppb (ang. parts per billion) i eliminuje
konieczność stosowania wzorca wewnętrznego.
W ciągu ostatnich kilkunastu lat dokonano także istotnego postępu
w zakresie przygotowania prób do oznaczeń chromatograficznych. W celu
przyspieszenia zatężania roztworów stosuje się kolumny z wypełnieniem
odpowiednim sorbentem – SPE (solid phase extraction). Próbę badaną
przepuszcza się w dowolnej ilości przez kolumnę SPE, a następnie wypłu-
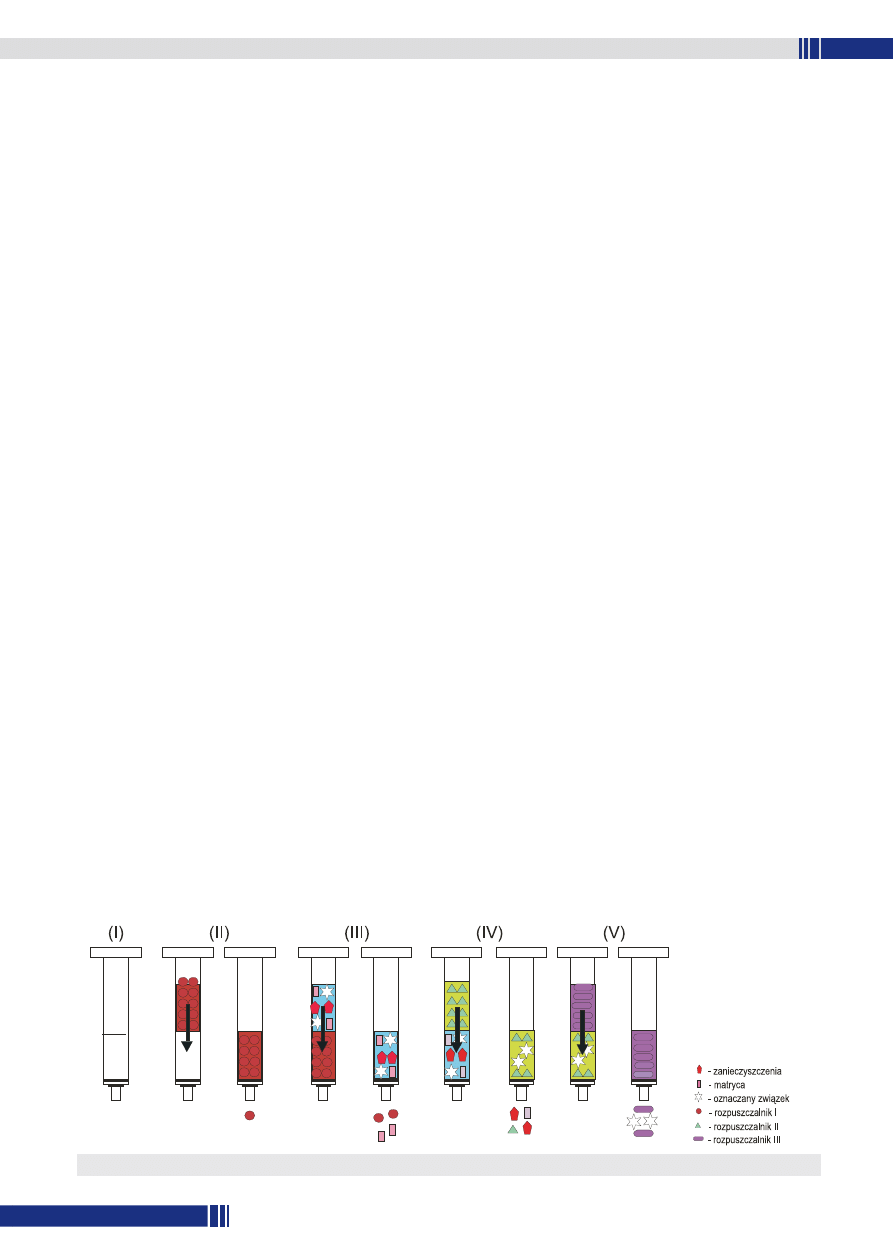
kuje zaadsorbowane związki przy użyciu silnego rozpuszczalnika (rys. 2).
Wyeliminowanie kłopotliwych destylacji i ekstrakcji umożliwia skrócenie
czasu analizy oraz uzyskanie większej czułości pomiaru.
Kolejnym sposobem zatężania prób jest zastosowanie włókien
SPME (ang. solid phase microextraction) w systemie zanurzeniowym
lub HeadSpace (HS). Włókno z sorbentem (np. polidimetylosiloksan),
umieszczone w specjalnej igle, wprowadza się w pierwszej kolejności nad
warstwę analizowanego roztworu, który jest termostatowany, a następnie
przenosi do dozownika chromatografu gazowego (rys. 3, s. 36). Sposób
ten całkowicie eliminuje konieczność zatężania prób, ponaddziesięcio-
krotnie skraca czas pomiaru i istotnie ogranicza błędy analityczne.
Metody chromatograficzne są obecnie powszechnie wykorzystywane do
oznaczania metanolu w różnych roztworach. Ich wysoka czułość pozwala
na określanie zawartości metanolu z dokładnością do ppm (ang. parts per
million, 10
-6
), a nawet ppb (10
-9
). Różne modyfikacje technik chromatogra-
ficznych są stosowane w przemyśle spożywczym, chemicznym i kosmetycz-
nym do oznaczania metanolu i innych związków lotnych, w diagnostyce
medycznej (badania krwi i moczu) oraz innych dziedzinach.
Metoda miareczkowa Zeisela
Zasługuje na wzmiankę jako jedyna procedura ilościowego oznacza-
nia zawartości alkoholu metylowego, nie oparta na oznaczeniach
kolorymetrycznych. Wykorzystuje się w niej reakcję polegającą na
Rys. 2. Ekstrakcja w układzie ciecz-ciało stałe SPE (Katalog Merck).
(I) –
kolumienka ekstrakcyjna
z adsorbentem
(II) – przepłukanie kolumienki
rozpuszczalnikiem I
(III) – przepuszczanie próbki przez
kolumienkę – adsorpcja
oznaczanego związku
(IV) – wymywanie zanieczyszczeń
rozpuszczalnikiem II
(V) – wymywanie analitu
rozpuszczalnikiem III
35
laboratorium przemysłowe
Laboratorium |
7
/2006
35

przekształceniu metanolu w jodek metylowy przy użyciu kwasu jodo-
wodorowego, według reakcji:
CH
3
OH + HJ o CH
3
J + H
2
O
Nadmiar kwasu jodowodorowego użytego do oznaczenia można
odmiareczkować i obliczyć ilość metanolu obecnego w próbie,
który związał się z jodem. Metoda charakteryzuje się jednak niską
powtarzalnością wyników, głównie z powodu małej stabilności jodku
metylowego, i jej zastosowanie jest bardzo ograniczone.
Inne metody
Rozproszenie promieni Rentgena (ang. X-ray scattering)
W celu identyfikacji alkoholi (C
1
-C
4
) wykorzystuje się szerokokątne
rozproszenie promieni Rentgena w temperaturze pokojowej. W wyniku
pomiaru uzyskuje się odległości wiązań C-O oraz C-C i porównuje
z obrazem wiązań alkoholi wzorcowych.
Spektroskopia w bliskiej podczerwieni
Do bardzo niskich stężeń metanolu w środowiskach bezwodnych można
stosować spektroskopię w bliskiej podczerwieni – NIR (ang. near infrared)
– w zakresie długości fali od 1100 nm do 2500 nm. Metoda wykorzysty-
wana jest m.in. do określania stężenia metanolu w tetrachlorku węgla.
W wyniku pomiaru uzyskuje się nieliniowe spektra, które potwierdzają
obecność wiązań wodorowych, pochodzących od metanolu.
Polikrystaliczna elektroda platynowa
Metoda została opracowana do oznaczania zawartości metanolu i pro-
duktów jego utleniania w paliwach. Polega ona na czteroelektronowym
rozkładzie alkoholu metylowego do CO
2
i pomiarze potencjałów
na polikrystalicznej elektrodzie platynowej:
Pt + CH
3
OH o Pt-(CH
3
OH)
Pt-(CH
3
OH) o Pt-(CH
3
O) + H
+
+ e
-
Pt-(CH
3
O) o Pt-(CH
2
O) + H
+
+ e
-
Pt-(CH
2
O) o Pt-(CHO) + H
+
+ e
-
Pt-(CHO) o Pt-(CO) + H
+
+ e
-
M + H
2
O o M-(H
2
O)
Pt-(CO) + M-(H
2
O) o Pt + M + CO
2
+ 2H
+
+ 2e
-
Określenie produktów utleniania paliw zawierających metanol jest
bardzo istotne w konstruowaniu odpowiednich katalizatorów chronią-
cych środowisko przed emisją szkodliwych składników.
Podsumowanie
Metanol jest wysoce toksycznym związkiem, w dawce około 50 g powo-
dującym zatrucia, a nawet śmierć. Występuje w większości produktów
spożywczych pochodzenia roślinnego, w formie wolnej lub związanej,
w pektynach, strukturach lignino-celulozowych i innych związkach,
które zawierają grupy metoksylowe (-OCH
3
). Głównym jednak źródłem
MeOH w produktach spożywczych pochodzenia roślinnego są pekty-
ny. Ich hydroliza połączona z uwalnianiem metanolu może zachodzić
pod wpływem czynników biologicznych (enzym PE) i fizycznych
(hydroliza kwasowa i zasadowa). Występujące zwykle w surowcach
i produktach spożywczych ilości MeOH nie stanowią zagrożenia dla
zdrowia i życia konsumentów. Dotychczas nie stwierdzono kumulo-
wania się tego alkoholu w organizmach ludzi i zwierząt.
Z uwagi na wysoką szkodliwość metanolu należy monitorować jego
zawartość w produktach spożywczych. Spośród omawianych metod
oznaczania MeOH największym uznaniem cieszy się technika chro-
matograficzna. Charakteryzuje się ona wysoką czułością (ppb) oraz
powtarzalnością wyników (odchylenia standardowe V około 1,5%).
Istotne skrócenie przygotowania prób osiąga się poprzez zastosowanie
mikroekstrakcji SPE lub SPME. Analiza chromatograficzna znajduje
zastosowanie w wielu gałęziach przemysłu, m.in. w przemyśle spożyw-
czym, oraz w diagnostyce medycznej.
Techniki kolorymetryczne odznaczają się niższą dokładnością
(V około 10%) oraz nieznacznym zawyżaniem wyniku w stosunku
do rzeczywistego stężenia metanolu w próbach. Metoda z kwasem
chromotropowym jest mniej czasochłonna od podobnej procedury
analitycznej z użyciem odczynnika fuksynosiarkowego (prostsze
przygotowanie reagentów) i wygodniejsza w stosowaniu. Spektrofoto-
metryczna ocena zawartości metanolu w próbach nie wymaga ponadto
zakupu stosunkowo kosztownego sprzętu laboratoryjnego.
Piśmiennictwo
1. Anthon G., Barrett D.M.: Comparison of three colorimetric reagents in the de-
termination of methanol with alcohol oxidase. Application to the assay of pectin
methylesterase. “J. Agric. Food Chem.”, 2004, 52, 3749-3753.
2. Determination of volatile substances and methanol of spirit drinks. “Official Journal
of the European Communities”, 2000, 36-46.
3. Katalog produktów laboratoryjnych Merck, 2003-2004.
4. Krajewski
W.:
Oznaczanie metanolu w destylatach owocowych – krytyczna ocena
metod. Praca magisterska, AR, Kraków 1987.
5. Krełowska-Kułas M.: Badanie jakości produktów spożywczych. PWN, Warsza-
wa 1993.
6. Li Y., Brown Ch.W.: Near infrared spectroscopic determination of alcohols-solving
non-linearity with linear and non-linear methods. “J. Near Infrared Spectrosc.”,
1999, 7, 55-62.
7. Magdic S., Pawliszyn J.: Determination of acetone and C
1
-C
4
alcohols using auto-
mated SPME. “Varian SPME Application Note”, No 14, 1995.
8. Pendergrass S.M.: Methanol, NIOSH Manual of Analytical Methods (NMAM).
Fourth Edition, Atlanta, 2000.
9. Produkty i akcesoria do chromatografii i analizy – katalog Supelco, 2003-2004.
10. Savary B.J., Nunez A.: Gas chromatography-mass spectrometry method for determi-
ning the methanol and acetic acid contents of pectin using headspace solid-phase
microextraction and stable isotope dilution. “J. Chromatogr. A”, 2003, 1017,
151-159.
11. Tapan N.A., Prakash J.: Determination of the methanol decomposition mechanism
on a polycrystalline platinum electrode. “Turkish J. Eng. Env. Sci.”, 2005, 29,
95-103.
12. Tuszyński T.: Fizyczne, chemiczne i biotechnologiczne aspekty występowania
metanolu w moszczach i destylatach owocowych. Rozprawa habilitacyjna nr 136,
Kraków 1990.
13. Tuszyński T.: Metanol niepożądanym składnikiem produktów spożywczych. „Przem.
Spoż.”, 1987, 7, 186-189.
14. Tuszyński T.: Oznaczanie metanolu w moszczach, winach i destylatach owocowych
– krytyczna ocena metod. „Bromat. Chem. Toksykol.”, 1989, 22(2), 108-114.
15. Vahvaselka K.S., Serimaa R., Torkkeli M.: Determination of liquid structures of the
primary alcohols methanol, ethanol, 1-propanol, 1-butanol and 1-octanol by X-ray
scattering. “J. Appl. Cryst.”, 1995, 28, 189-195.
Rys. 3. Kolejność czynności wykonywanych podczas mikroekstrakcji
metodą analizy fazy nadpowierzchniowej (HS-SPME): 1) stan początkowy,
2) przebicie membrany i wysunięcie włókna, 3) ekstrakcja, 4) wsunięcie
włókna do igły, 5) wyciągnięcie igły.
K
at
alog Supelco
laboratorium przemysłowe
Laboratorium |
7
/2006
36
Wyszukiwarka
Podobne podstrony:
Białka i metody ich oznaczania w mleku
Ćwiczenie 3 Materia organiczna gleby i metody jej oznacz ania
Środki konserwujące w zywności i metody ich oznaczania
Pojęcie kosztu kapitału przedsiębiorstwa i metody jego obliczania
Metody ilościowego oznaczania drobnoustrojów, Studia - materiały, semestr 4, Mikrobiologia żywności
Pojęcie kapitału ludzkiego i metody jego pomiaru, magisterka II rok, Obrona
02 Pojęcia ogólne Masy cząsteczkowe i metody ich oznaczania
BÓL PORODOWY I METODY JEGO ŁAGODZENIA
Rozwj dziecka i metody jego oceny
STRES I METODY JEGO PRZEZWYCIĘŻANIA, PSYCHOLOGIA, Stres
Chemiczne zanieczyszczenia żywności i metody ich oznaczania
Bankowość II, Ryzyko zagranicznych operacji bankowych i metody jego ograni
Ćwiczenie 3 Materia organiczna gleby i metody jej oznacz ania
Przeciwutleniacze jako dodatki do żywności oraz metody ich oznaczania
więcej podobnych podstron