
1
S A C H A R Y D Y (CUKRY)
Aleksander Kołodziejczyk styczeń 2007
Cukrami
(
sacharydami
) nazywane są polihydroksyaldehydy i polihydroksyketony oraz niektóre
ich pochodne. Związkami o najmniejszej masie cząsteczkowej, które spełniają tę definicję to
aldehyd glicerynowy
i
dihydroksyaceton
.
H
O
CH
2
OH
OH
H
CH
2
OH
CH
2
OH
O
dihydroksy-
aceton
C
C
C
aldehyd
D
-glicerynowy
W literaturze cukry znane są też pod nazwą
węglowodanów
, jako że skład atomowy wielu z nich
odpowiada sumarycznemu wzorowi [C(HOH)]
n
. Nie jest ona jednak zalecana, ponieważ wzór
sumarycznych nie wszystkich cukrów jest adekwatny do wielokrotności ugrupowania C(HOH).
Rozróżniane są
dwie główne grupy cukrów
:
-
aldozy
– homologi
aldehydu glicerynowego
i
-
ketozy
– homologi
dihydroksyacetonu
.
W zależności od liczby atomów węgla w cząsteczce cukru, dzielą się one na:
triozy
,
tetrozy
,
pentozy
,
heksozy
i
heptozy
. Warto zwrócić uwagę na to, że nazwa składa się z liczebnika
podającego liczbę atomów węgla i charakterystycznej dla cukrów końcówki –
oza
.
Inny podział cukrów oparty jest na ich zdolności do
kondensacji
(polimeryzacji).
Sacharydami
prostymi
nazywane są cukry, które ulegają
hydrolizie
. Do cukrów prostych należy
aldehyd
glicerynowy
(
gliceroza
),
ryboza
,
glukoza
,
fruktoza
i wiele innych. Jeżeli cząsteczka cukru składa
się z dwóch lub więcej reszt cukrów prostych to należy on do
sacharydów złożonych
. Jego
hydroliza prowadzi do cukrów prostych. Najbardziej znanymi cukrami złożonymi są
celuloza
i
skrobia
. Cukier złożony z dwóch reszt cukrów prostych nazywany jest dicukrem
(disacharydem). Dicukrem jest
laktoza
,
maltoza
,
cukroza
i wiele innych.
Cukry mogą należeć do szeregu
D
lub
L
. Przynależność do odpowiedniego szeregu determinuje
konfiguracja ostatniego chiralnego atomu węgla. Do szeregu
D
należą te homologi aldehydu
D
-
glicerynowego
lub
dihydroksyacetonu
, które zawierają fragmenty HO-C-H pomiędzy grupą
karbonylową i kolejnym atomem węgla.
H
O
CH
2
OH
OH
H
CH
2
OH
CH
2
OH
O
H
O
CH
2
OH
OH
H
CH
2
OH
CH
2
OH
O
OH
H
dihydroksy-
aceton
C
C
C
aldehyd
D
-glicerynowy
C
C
C
(CHOH)
n
(CHOH)
n
C
D
-aldozy
D
-ketozy

2
Analogicznie wyglądają szeregi
L
-aldoz i
L
-ketoz. Cukry szeregu
D
są bardziej
rozpowszechnione w przyrodzie niż szeregu
L
.
Występowanie
Do popularnych cukrów zaliczają się
D
-ryboza
,
D
-galaktoza
,
D
-mannoza
i
D
-fruktoza
. Miód jest
mieszaną
D
-glukozy
i
D
-fruktozy
. Pośród nielicznych naturalnych cukrów prostych szeregu
L
znajduje się
L
-arabinoza
i
L
-galaktoza
. Wolne triozy nie zostały wykryte w przyrodzie, występują
jednak w żywych komórkach w postaci fosforanów. Również nie znaleziono wolnych tetroz.
Fosforylozowana
erytroza
bierze udział w procesach biochemicznych.
D
-Glukoza
i
D
-fruktoza
są produkowane przez rośliny zielone w procesie fotosyntezy z CO
2
i
wody. Inne cukry powstają w wyniku transformacji głównie
D
-glukozy
.
D
-Glukoza
występuje w
wielu owocach, we krwi, stanowi też wyłączne źródło energii dla mózgu.
Wolne cukry spotyka się w owocach lub innych częściach roślin, np. w łodygach (trzcina
cukrowa), korzeniu (buraki) czy w kwiatach (nektar). W mleku znajduje się
laktoza
(
cukier
mleczny
), który jest dimerem
D
-glukozy
i
D
-galaktozy
. W słodzie (w kiełkujących zbożach)
pojawia się inny dimer, złożony tylko
D
-glukozy
–
maltoza
(
cukier słodowy
). Powstaje on w
wyniku hydrolizy
skrobi
.
Skrobia
, podobnie jak i
celuloza
oraz
glikogen
są polimerami
D
-
glukozy
.
Celuloza
stanowi około 80% suchej masy roślin wyższych. Wiele innych produktów
roślinnych należy do cukrów złożonych, czyli polimerów cukrów prostych, w tym łupiny
orzechów, gumy roślinne, wyciągi typu agaru, dekstrany, pektyny i inne.
D
-Ryboza i
D
-dezoksyryboza
w postaci nukleotydów są składnikami kwasów nukleinowych:
RNA i DNA. Znajdują się więc we wszystkich komórkach organizmów żyjących i martwych.
Znane są także naturalne
analogi cukrów
, np. dezoksycukry (
D
-dezoksyryboza
), aminocukry (
D
-
glukozoamina
czy
D
-galaktozoamina
). Pośród
pochodnych cukrów
do najpopularniejszych
należą glikozydy (np.
amigdalina
czy
salicyna
), alditole (
D
-glucitol
, zwany też
sorbitolem
,
D
-
mannitol
) oraz
kwasy
(
D
-glukonowy
,
D
-glukuronowy
,
D
-galakturonowy
).
Cukry razem z innymi grupami związków tworzą substancje czynne, bardzo ważne dla życia, np.
glikoproteiny i glikolipidy. Na powierzchniach komórek, w tym erytrocytów, występują
oligocukry, pełniące rolę
determinantów antygenowych
. Skład tych oligocukrów decyduje o
grupach krwi.
Funkcja jaką pełnią cukry w procesach biochemicznych polega na tym, że stanowią one materiał
budulcowy, substancje zapasowe, przenośniki informacji, substancje znakujące (determinanty,
kwas sjalowy
), a także podstawowy, obok białek i tłuszczów składnik pożywienia.
Nomenklatura
Cukry są znane pod nazwami zwyczajowymi, ponieważ ich nazwy systematyczne są zbyt
skomplikowane. Często do nazwy cukru dodaje się końcówkę
-furanoza
lub
-piranoza
, które
informują o wielkości pierścienia hemiacetalowego cząsteczki cukru, np.
D-
glukopiranoza
.
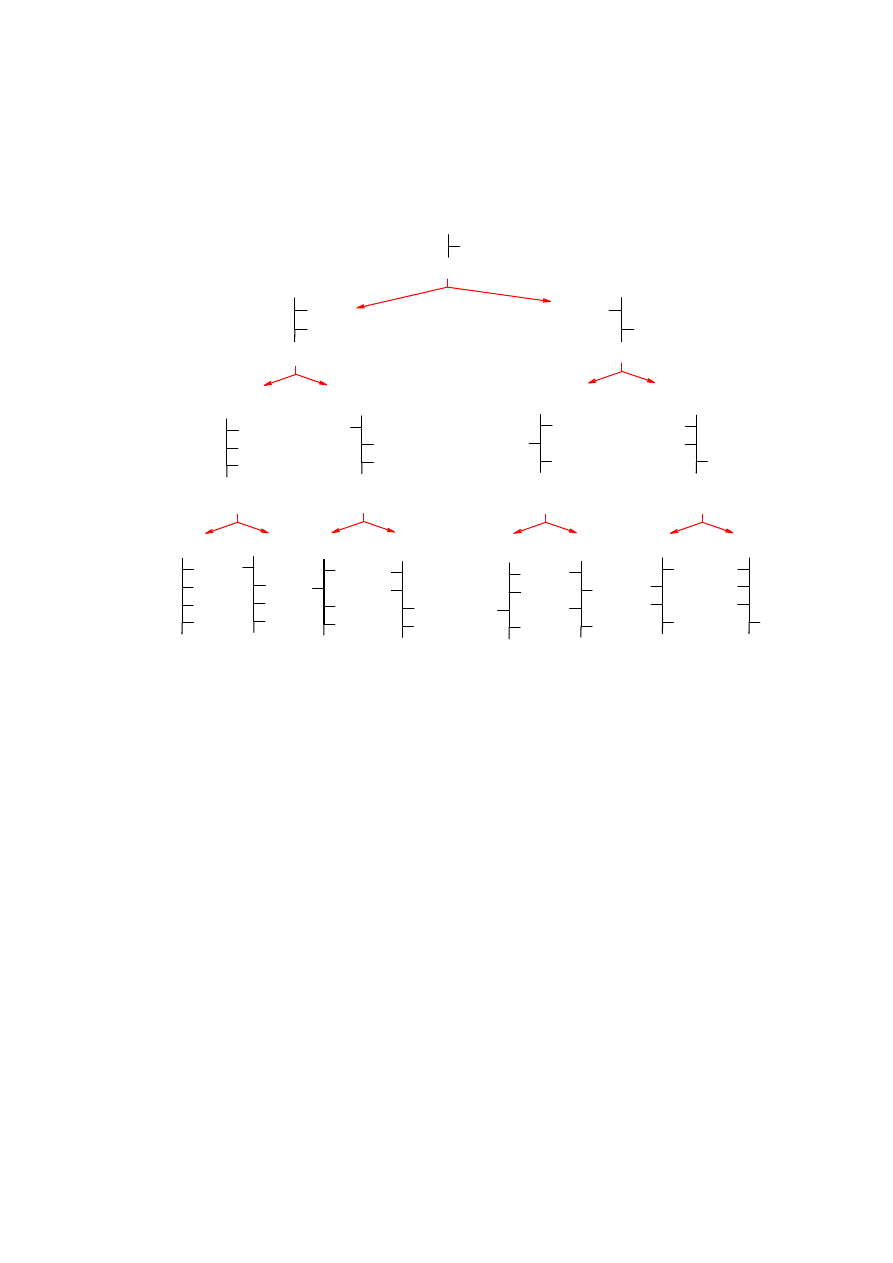
3
Przykłady cukrów prostych
szereg
D
-aldoz
OH
OH
CH
2
OH
CHO
O
H
OH
CH
2
OH
CHO
OH
OH
OH
CH
2
OH
CHO
OH
O
H
OH
CH
2
OH
CHO
O
H
OH
OH
CH
2
OH
CHO
O
H
CH
2
OH
O
H
OH
CHO
OH
OH
OH
OH
CH
2
OH
CHO
OH
O
H
O
H
OH
CH
2
OH
CHO
O
H
OH
OH
OH
CH
2
OH
CHO
OH
O
H
OH
OH
CH
2
OH
CHO
O
H
OH
O
H
OH
CH
2
OH
CHO
O
H
O
H
OH
OH
CH
2
OH
CHO
CHO
OH
CH
2
OH
O
H
O
H
OH
CH
2
OH
CHO
O
H
OH
O
H
OH
CH
2
OH
CHO
OH
aldehyd
D
-glicerynowy
jedna
D
-aldotrioza
cztery
D
-al-
dopentozy
osiem
D
-aldoheksoz
dwie
D
-aldotetrozy
(+)-erytroza (-)-treoza
(+)-alloza (+)-altroza (+)-glukoza (+)-mannoza (+)-guloza (+)-idoza
(+)-galaktoza (+)-taloza
(-)-ryboza (-)-arabinoza (+)-ksyloza (-)-liksoza
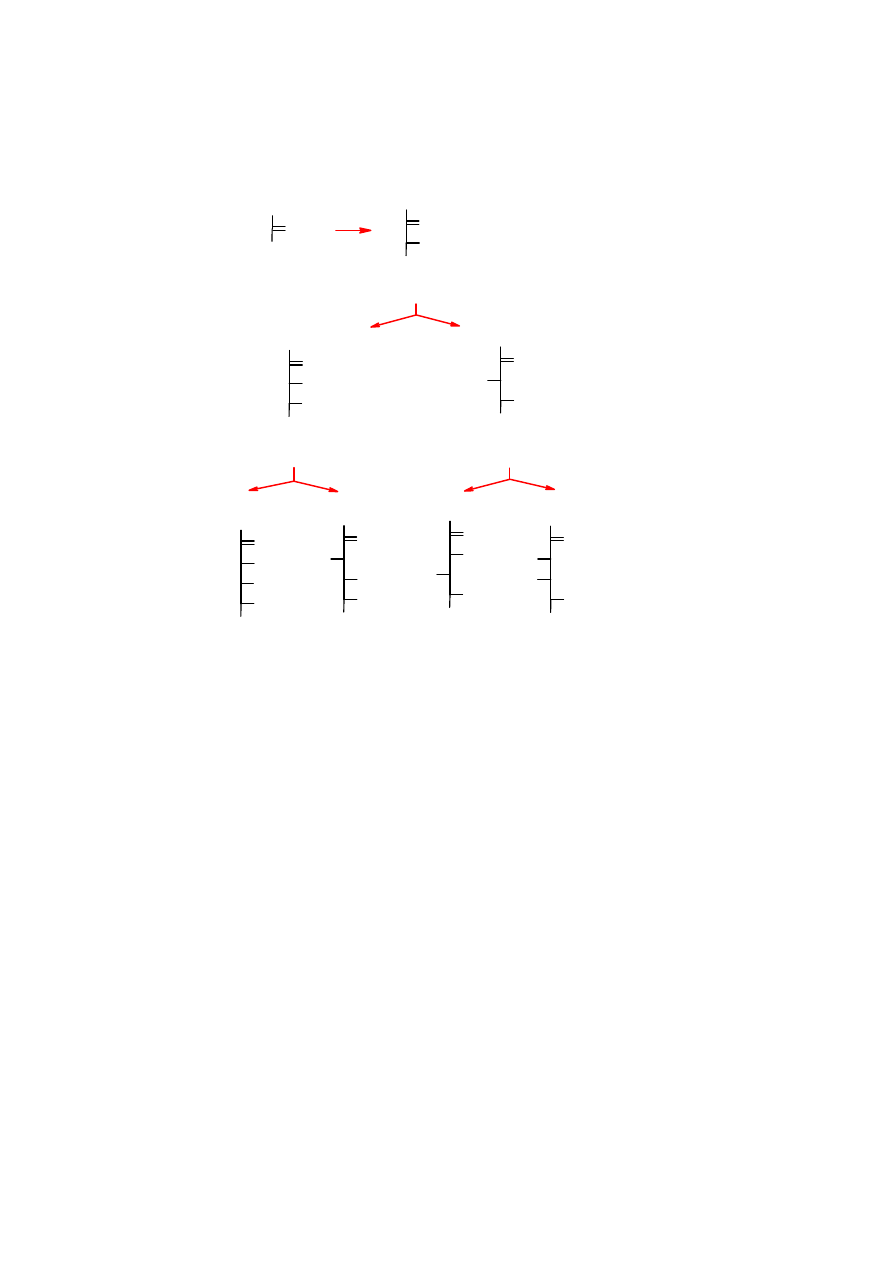
4
Szereg
D
-ketoz
CH
2
OH
CH
2
OH
O
CH
2
OH
O
OH
CH
2
OH
CH
2
OH
O
OH
OH
CH
2
OH
CH
2
OH
O
OH
CH
2
OH
O
H
CH
2
OH
O
OH
OH
CH
2
OH
OH
CH
2
OH
O
OH
CH
2
OH
OH
O
H
CH
2
OH
O
OH
CH
2
OH
OH
O
H
CH
2
OH
O
CH
2
OH
OH
O
H
O
H
1 ketotrioza
dihydroksyaceton
jedna
D
-ketotetroza
D
-erytruloza (tetruloza)
D
-rybuloza
D
-ksyluloza
dwie
D
-ketopentozy
cztery
D
-keto-
heksozy
D
-piskoza
D
-fruktoza
D
-sorboza
D
-tagatoza
Podobne szeregi można utworzyć dla
L
-aldoz i
L
-ketoz. Najpopularniejszym cukrem prostym jest
D
-glukoza
.
Właściwości fizyczne i fizjologiczne
Triozy są syropami, ale tworzą krystaliczne dimery. Dimer
aldehydu glicerynowego
jest trudno
rozpuszczalny w wodzie.
Erytroza
jest także syropem dobrze rozpuszczalnym w wodzie i w
etanolu. Wyższe cukry proste są substancjami krystalicznymi, chociaż krystalizacja niektórych z
nich może nastręczać trudności z uwagi na tendencję cukrów do tworzenia syropów. W
roztworze łatwo
izomeryzują
(tworzą anomery i epimery), co utrudnia ich krystalizację. Wyższe
cukry proste dobrze rozpuszczają się w wodzie, trudno w rozpuszczalnikach organicznych, w
tym w etanolu. Wiele cukrów ma właściwości hygroskopijne, tzn. chłoną wilgoć z powietrza, w
skutek czego zlepiają się, zbrylają, a nawet rozpływają się w postaci syropu.
Większość cukrów prostych ma słodki smak. Najbardziej słodka jest
D-fruktoza
, potem
D-
glukoza
, a następnie
cukroza
(
sacharoza
) – dicukier otrzymywany z trzciny cukrowej lub
buraków cukrowych, stosowany w codziennym użytku do słodzenia potraw.
D-Fruktoza
jest
ponad 5 razy słodsza od
cukrozy
. Stosując ją do słodzenia potraw można znacznie obniżyć ich
kaloryczność. Jeszcze większa redukcja kaloryczności, głównie napojów, jest możliwe poprzez
użycia do słodzenia tzw.
słodzików
. Najpopularniejszymi słodzikami są
sacharoza
(związek
aromatyczny) i
aspartam
(dipeptyd).
Aspartam
jest 200 razy słodszy od
cukrozy
. Znane są białka
tysiące razy słodsze niż
cukroza
, jednak słodki smak tej ostatniej jest dla większości ludzi
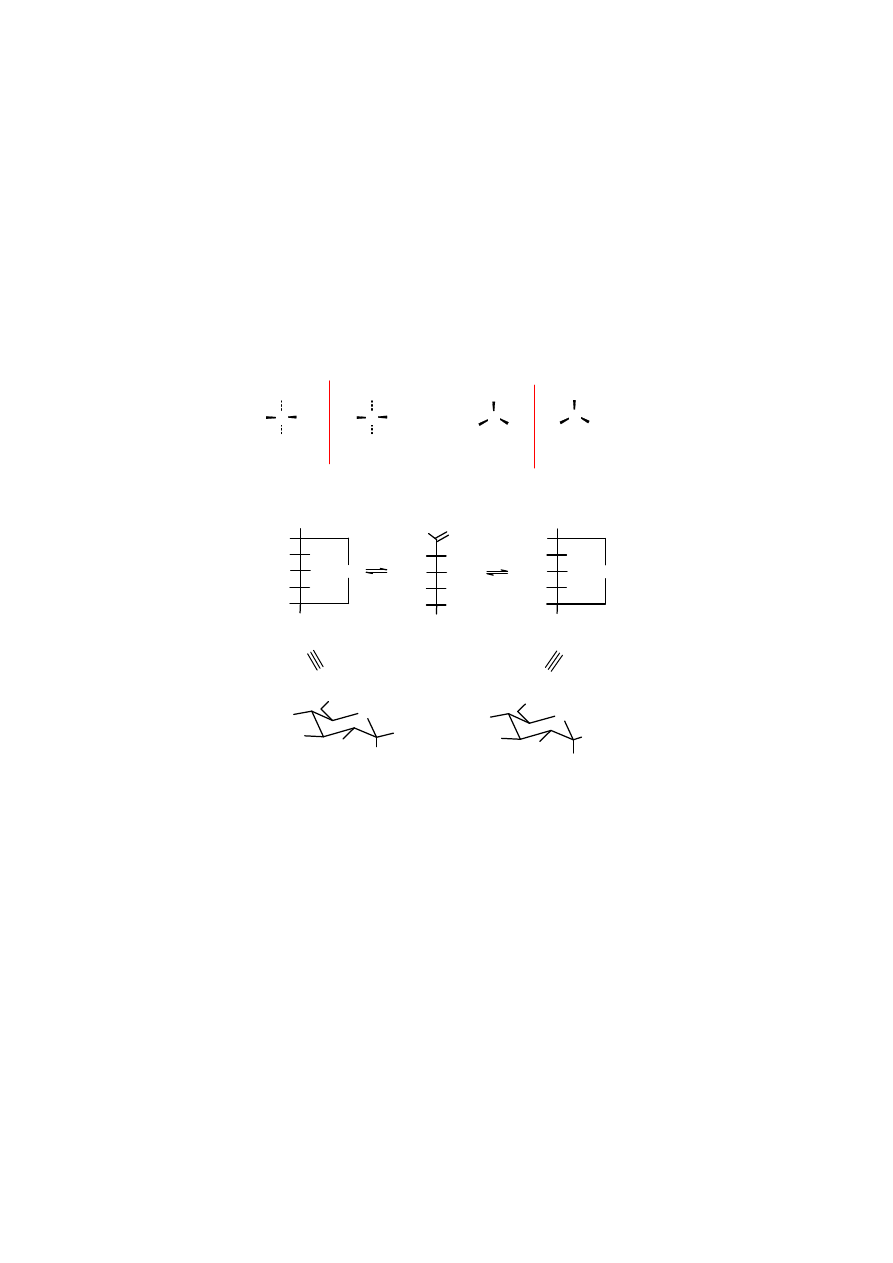
5
najprzyjemniejszy. Słodziki nie mogą zastąpić cukrów w wypiekach, ponieważ podczas
pieczenia dochodzi do reakcji cukrów z aminokwasami i powstają cenne związki aromatyczne i
smakowe, co jest niemożliwe przy udziale słodzików.
Pytanie: dlaczego miód jest znacznie słodszy od cukrozy?
Chiralność
Dihydroksyaceton
jest związkiem achiralnym.
Aldehyd glicerynowy
i ketotetroza zawierają po
jednym centrum chiralnym, wyższe cukry mają ich odpowiednio więcej.
aldehyd D-glicerynowy
(
gliceroza
)
CHO
CH
2
OH
OH
H
CHO
CH
2
OH
H
O
H
CHO
HOH
2
C
OH
CHO
O
H
CH
2
OH
C
C
C
C
w projekcji Fischera w projekcji Newmana
O
OH
H
OH
H
H
O
H
OH
H
CH
2
OH
H
O
H
O
H
OH
H
H
O
H
OH
H
CH
2
OH
H
O
H
OH
H
H
O
H
OH
H
CH
2
OH
H
OH
O
O
H
O
H
O
H
H
OH
OH
O
O
H
O
H
O
H
OH
H
OH
D
-glukoza
forma otwartołańcuchowa
anomer
ββββ
anomer
α
αα
α
hemiacetal
hemiacetal
+
H
+
H
Wyższe cukry mają tendencje do tworzenia cyklicznych układów
hemiacetalowych
, w wyniku
czego powstają nowe centrum chiralne. W trakcie zamykania pierścienia hemiacetalowego
pojawiają dwa nowe stereoizomery nazywane
anomerami
. Anomery są trwałe w stanie
krystalicznym, w roztworze zaś dochodzi do przemiany jednego w drugi i wytwarza się stan
równowagi. Przejście jednego anomeru w drugi, zwane
mutarotacją
jest katalizowane zarówno
kwasami, jak i zasadami i biegnie poprzez formę otwartą (karbonylową). W obojętnym wodnym
roztworze
glukozy
stężenie formy aldehydowej jest tak małe (0,02%), że pasmo adsorpcji grupy
aldehydowej w widmie UV jest niewidoczne. Po zakwaszeniu pojawia się pasmo adsorpcji w
zakresie 184 nm, typowe dla niesprzężonego karbonylu. Tak więc katalityczne działanie kwasów
w procesie anomeryzacji polega na ułatwieniu otwierania się pierścienia hemiacetalowego.
Reakcja tworzenia się hemiacetali jest katalizowane wyłącznie przez kwasy.
Przekształcanie wzorów otwartej formy cukrów w hemiacetalowe pierścienie
Na rysunku pokazane jest procedura przekształcania wzoru cukru z formy łańcuchowej w
pierścień hemiacetalowy. Postępujemy wg następującej kolejności. Zaczynamy od zagięcia końca
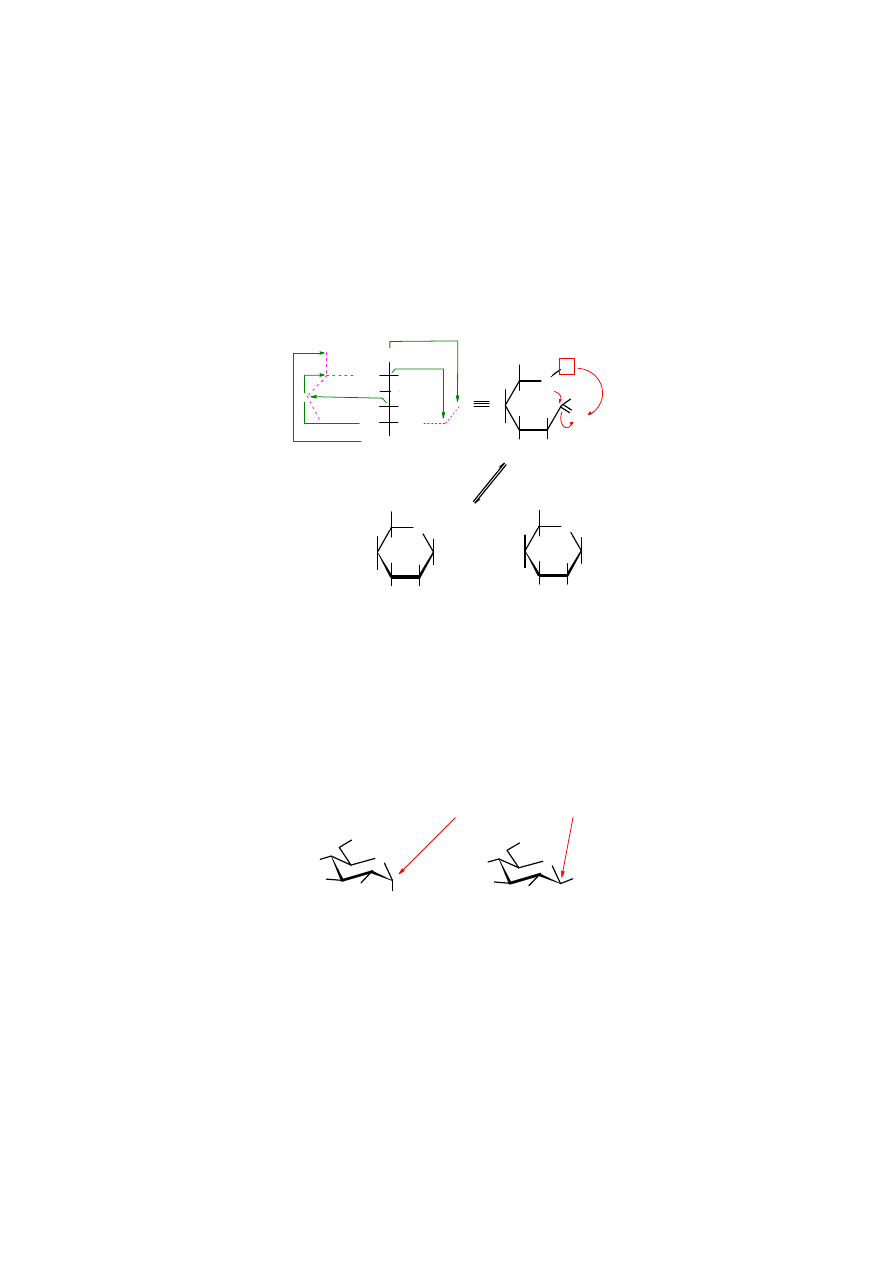
6
C
6
łańcucha węglowego w lewo do góry, tak żeby cząsteczka utworzyła otwarty pierścień
sześcioczłonowy. Zagięciu ulegają atomy C6, C5 i C4. Górna część łańcucha, obejmująca atomy
C1 i C2 zaginana jest w prawo w dół. W takim ułożeniu atom tlenu grupy hydroksylowej przy
C
5
tworzy wiązanie hemiacetalowe z karbonylowym atomem węgla przy C
1
, po czym atom
wodoru z grupy hydroksylowej przechodzi do karbonylowego atomu tlenu. W rezultacie
powstaje nowa grupa hydroksylowa, zwana
glikozydową
lub
anomeryczną
. W aldozach, grupy
glikozydowe znajdują się przy C1, a w ketozach przy C2. Również atomy węgla odpowiednio
C1 i C2 nazywane są glikozydowymi (anomerycznymi).
CHO
OH
H
H
O
H
OH
H
OH
H
O
CH
2
OH
H
H
OH
H
H
OH
O
H
H
CH
2
OH
H
H
OH
H
H
OH
O OH
H
CH
2
OH
H
H
OH
H
H
OH
O H
OH
D
-glukoza
..
..
1
2
3
4
5
6
1
2
3
4
5
6
HO
..
:
..
..
1
2
3
4
5
6
HO
CH
2
OH
..
..
1
2
3
4
5
6
HO
+
6
5
4
3
O
2
1
α
αα
α
-D-glukopiranoza
ββββ
-
D
-glukopiranoza
Powyższe wzory przedstawiające cząsteczkę cukru (w tym przypadku
D
-glukopiranozy
)
nazywane są
wzorami Haworth’a
. Są to wzory perspektywiczne, pogrubione z przodu.
Wyraźnie widoczne są na nich grupy znajdujące się pod i nad płaszczyzną pierścienia.
Częściej jednak cząsteczki cukrów przedstawiane są za pomocą wzorów pokazujących
krzesełkową konformację pierścienia sześcioczłonowego. Ułatwiają one identyfikację wiązań
aksjalnych i ekwatorialnych. Atomy wodoru związane z atomami węgla są zwykle pomijane.
Można również pogrubić frontową część pierścienia.
O
OH
O
H
O
H
O
H
OH
O
O
H
O
H
O
H
OH
OH
anomeryczne atomy
węgla
α
α
α
α
-D-glukopiranoza
ββββ
-
D
-glukopiranoza
Izomery
αααα
i
ββββ
, różniące się ułożeniem grupy OH przy C1 względem pierścienia narysowanego,
jak na powyższym wzorze, zwane są
anomerami
. W anomerze
αααα
grupa OH przyłączona jest do
C1 aksjalnie i znajduje się pod płaszczyzną pierścienia, a w anomerze
ββββ
jest przyłączona
ekwatorialnie nad płaszczyzną pierścienia. Warto zauważyć, że w cukrach szeregu D grupa
CH
2
OH zajmuje miejsce ponad płaszczyzną pierścienia. Z tego powodu glikozydowa grupa OH
i CH
2
OH w anomerze
αααα
są ułożone względem siebie w sposób trans, a w anomerze
ββββ
cis.
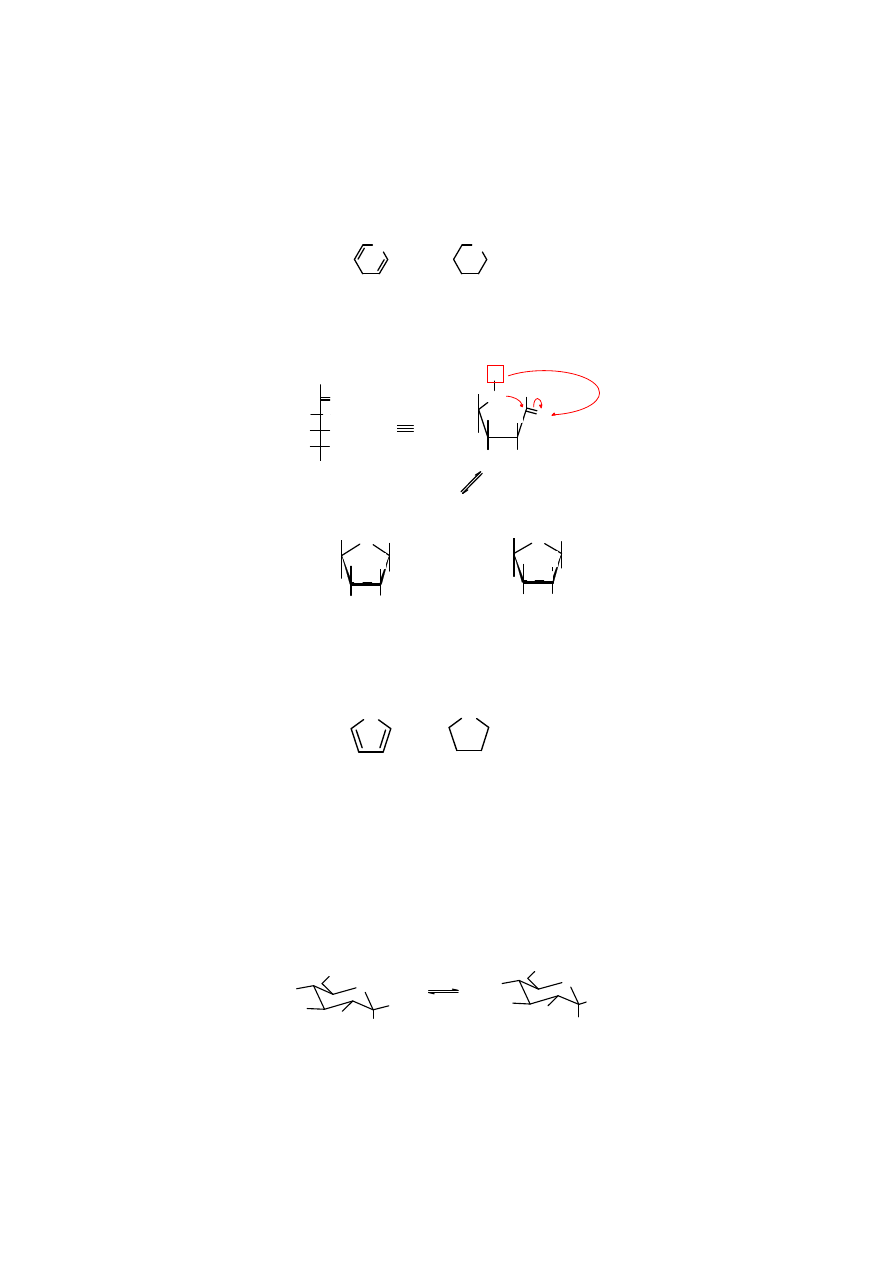
7
Przyrostek
-piranoza
wywodzi
się
od
piranu
,
heterocyklicznego,
nienasyconego,
sześcioczłonowego związku, który zawiera atom tlenu w pierścieniu, podobnie jak cukry w
formie sześcioczłonowego, pierścieniowego hemiacetalu,.
Piran
jest nietrwały, znane są jednak
jego pochodne, w tym –
tetrahydropiran
.
O
O
γγγγ
-piran
tetrahydropiran
Trochę inaczej zachodzi cyklizacja
D
-fruktozy
. W tym przypadku podczas tworzenia się
hemiacetalu powstaje pierścień pięcioczłonowy przypominający
furan
, dlatego cukry w tej
formie zawierają w nazwie przyrostek
-furonoza
, np.
D
-fruktofuranoza
.
CH
2
OH
O
H
O
H
OH
H
OH
H
O
CH
2
OH
O
H
H
OH H
H
..
O OH
CH
2
OH
H
H
OH H
O CH
2
OH
OH
H
H
OH H
:
D
-fruktoza
1
2
3
4
5
6
CH
2
OH
+
HOH
2
C
1
2
3
4
5
6
HO
HOH
2
C
1
2
3
4
5
6
HO
HOH
2
C
1
2
3
4
5
6
HO
α
αα
α
-
D
-fruktofuranoza
ββββ
-
D
-fruktofuranoza
Pierścienie pięcioczłonowe są płaskie, zatem nie są obrazowane wzorami przestrzennymi
(konformacyjnymi).
Furan
w przeciwieństwie do
piranu
jest trwały. Uwodorniony
furan
–
tetrahydrofuran
– znalazł szerokie jako popularny rozpuszczalnik.
O
O
furan
tetrahydrofuran
Właściwości chemiczne
1. Anomeryzacja
W stanie krystalicznym anomery cukrów są trwałe. Po rozpuszczeniu ustala się pomiędzy nimi
dynamiczna równowaga.
Anomeryzacja
jest katalizowana zarówno kwasami, jak zasadami.
Wystarczy CO
2
z powietrza, jako katalizator kwaśny i szkło, jako zasadowy do przyspieszenia
przemiany jednego anomeru w drugi. W roztworze przeważa izomer trwalszy. Dla
D-glukozy
jest to anomer
ββββ
, ponieważ wszystkie grupy OH w tym izomerze zajmują bardziej korzystne
wiązania ekwatorialne.
O
O
H
O
H
O
H
H
OH
OH
O
O
H
O
H
O
H
OH
H
OH
anomer
ββββ
anomer
α
αα
α
62%
38%
α
α
α
α
-
D
-glukopiranoza
ββββ
-
D
-glukopiranoza
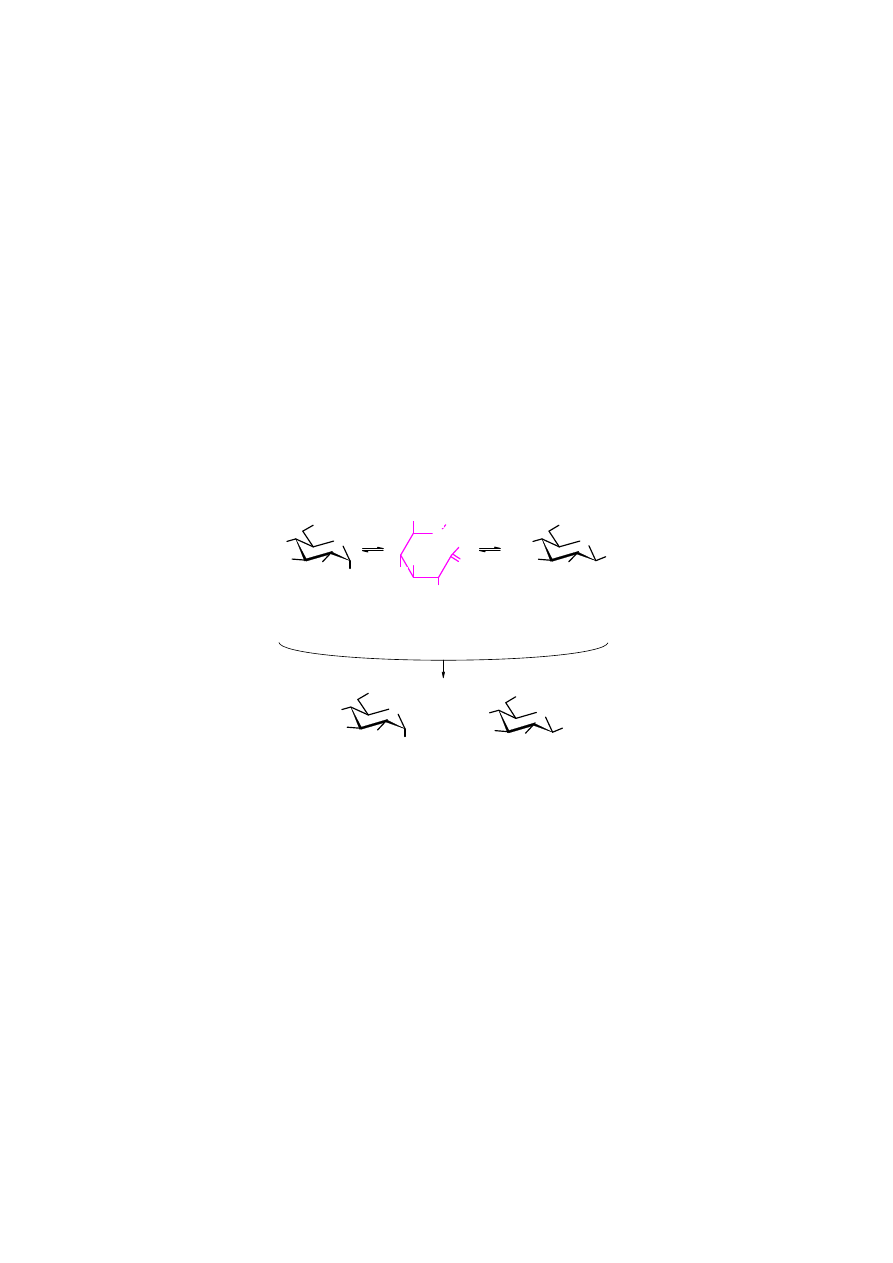
8
W wodzie
α
-
D
-glukopiranoza
jest trudniej rozpuszczalna niż anomer
ββββ
, dlatego jako pierwsza
krystalizuje z roztworu wodnego. Po wykrystalizowaniu części anomeru
αααα
zostaje zaburzona
równowaga, wobec czego odpowiednia ilość
ββββ
przechodzi w
αααα
, co umożliwia dalszą krystalizację
tej właśnie odmiany. Zatężając wolno wodny roztwór
glukozy
można ją prawie całkowicie
wykrystalizować w formie
αααα
. W
pirydynie
i w
kwasie octowym
trudniej rozpuszczalny jest
anomer
ββββ
i dzięki temu można go otrzymać w formie krystalicznej.
Po rozpuszczeniu określonego anomeru ustala się dynamiczna równowaga w roztworze. W
wodzie w stanie równowagi, jak już wspomniano znajduje się 38% izomeru
αααα
i 62% izomeru
ββββ
.
Wzajemnej przemianie anomerów towarzyszy
zmiany skręcalności właściwej roztwru. Stąd
nazwa tego zjawiska -
mutarotacja
, czyli zmieniająca się rotacja. Skręcalność właściwa
roztworu cukru ulegającego mutarotacji zmienia się do momentu ustalenia równowagi pomiędzy
anomerami. Skręcalność właściwa
α
-D-glukopiranozy
[
αααα
]
D
= +112
o
po jej rozpuszczeniu w
wodzie ulega zmniejszeniu aż do poziomu [
αααα
]
D
= +52,5
o
. Skręcalność właściwa
β
-D-
glukopiranozy
[
αααα
]
D
= +18,7
o
i po rozpuszczeniu w wodzie rośnie i po pewnym czasie osiąga tę
samą równowagową wartość +52,5
o
. Szybkość mutarotacji zależy od obecności katalizatorów,
jaki są kwasy lub zasady.
O
OH
OH
O
H
H
O
OH
O
H
O
H
O
H
OH
O
O
H
O
H
O
H
OH
OH
O
OH
O
H
O
H
O
H
OH
O
O
H
O
H
O
H
OH
OH
α
αα
α
-
D
-glukopiranoza
.
..
HO
.
+
HOCH
2
C
ββββ
-
D
-glukopiranoza
D
-glukoza
[
α
αα
α
]
D
= +112
o
[
α
αα
α
]
D
= +18,7
o
38%
62%
[
α
αα
α
]
D
= +52,5
o
α
αα
α
-
D
-glukopiranoza
ββββ
-
D
-glukopiranoza
W stanie równowagi [
αααα
]
D
roztworu
D
-glukozy
przyjmuje wartość +52,5
o
, taka samą jak dla
mieszaniny składającej się z 38% anomeru
αααα
i 62% anomeru
ββββ
.
Skład roztworu cukru jest jeszcze bardziej skomplikowany. W stanie równowagi znajdują się w
nim bowiem nie tylko dwa anomery, np. dla
D
-gluko
piranozy
(prawie 62%
ββββ
, prawie 38%
αααα
),
ale również, chociaż w mniejszych ilościach oba anomery
D
-gluko
furanozy
(0,14%
ββββ
, poniżej
0,1%
αααα
),
forma otwarta
(0,02%) oraz ślady
septanozy
(siedmioczłonowy pierścień) i
oksetanozy
(czteroczłonowy pierścień). Po dłuższym czasie pojawiają się dodatkowo
epimery
D
-glukozy
, czyli
D
-mannoza
i
D
-fruktoza
.
2. Epimeryzacja
Epimerami
nazywają się izomery cukrów różniące się budową chemiczną lub/i stereochemiczną
przy C1 lub/i C2. Epimerami
D
-glukozy
są więc
D
-mannoza
i
D
-fruktoza
. Niektórzy autorzy do
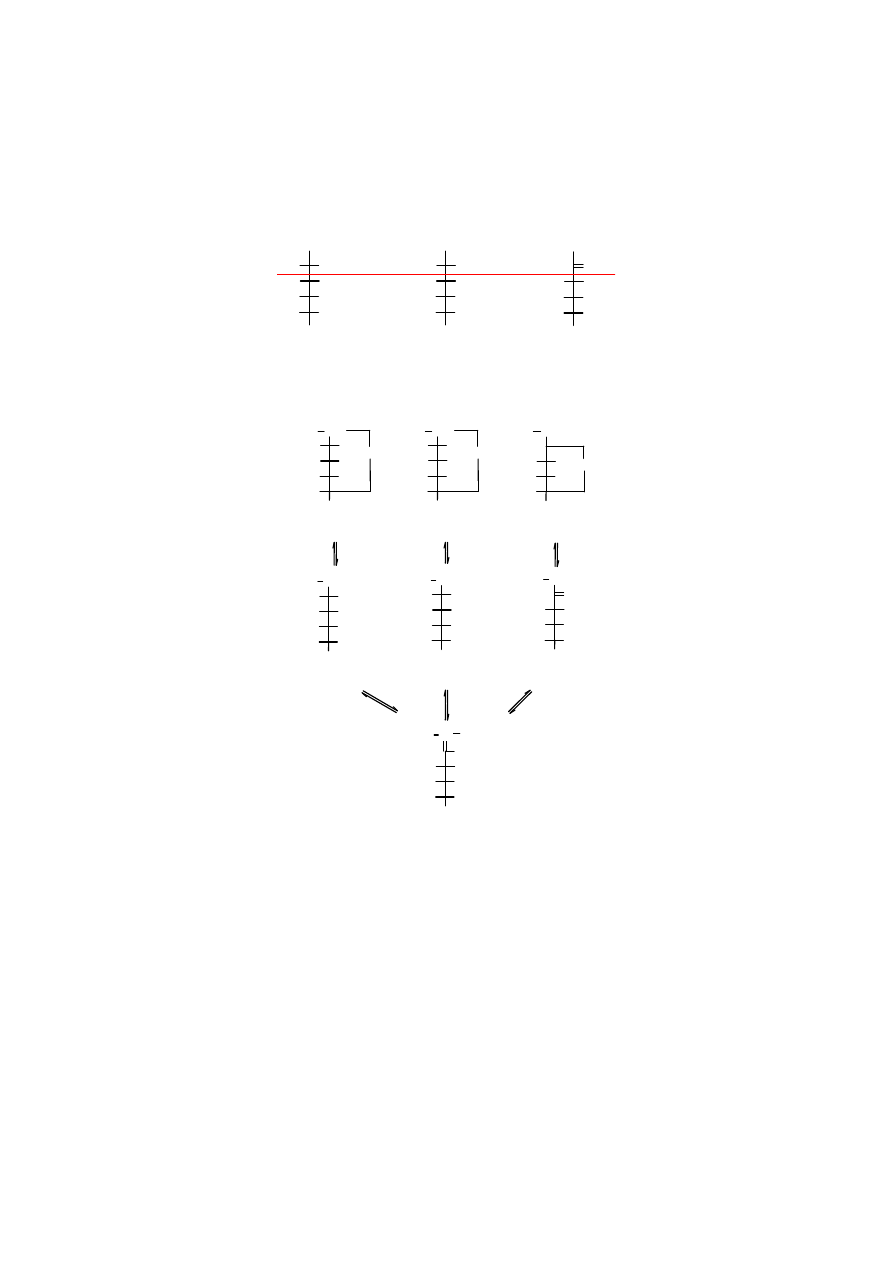
9
anomerów zaliczają jedynie te izomery, które różnią się układem sterycznym przy C2, a więc
byłaby to para
D
-glukozy
i
D
-mannozy
bez
D
-fruktozy
.
epimery
CH
2
OH
CHO
OH
H
H
O
H
OH
H
OH
H
CH
2
OH
CHO
H
O
H
H
O
H
OH
H
OH
H
CH
2
OH
CH
2
OH
O
H
O
H
OH
H
OH
H
1
2
1
2
1
2
D
-glukoza
D
-mannoza D-fruktoza
Epimery mogą przechodzić wzajemnie w siebie poprzez utworzenie wiązania podwójnego
pomiędzy C1 oraz C2 i
enolizację
.
CH
2
O
H
O
H
OH
H
CH
2
OH
OH
H
C=O
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
C=O
H
O
H
H
O
H
OH
H
CH
2
OH
OH
H
CH
OH
H
H
O
H
OH
H
CH
2
OH
H
O
O
H
O
H
O
H
O
CH
H
O
H
H
O
H
OH
H
CH
2
OH
H
O
CH
2
H
O
H
OH
H
CH
2
OH
H
H
H
O
H
OH
H
O
H
OH
H
CH
2
OH
OH
H
H
OH
D
-mannoza
D
-glukoza
D
-fruktoza
C
D
-fruktofuranoza
D
-glukopiranoza
D
-mannopiranoza
enolowa forma
(wspólna dla
epimerów):
D
-mannozy
D
-glukozy
D
-fruktozy
i
,
Zadanie
: zaproponuj mechanizm epimeryzacji.
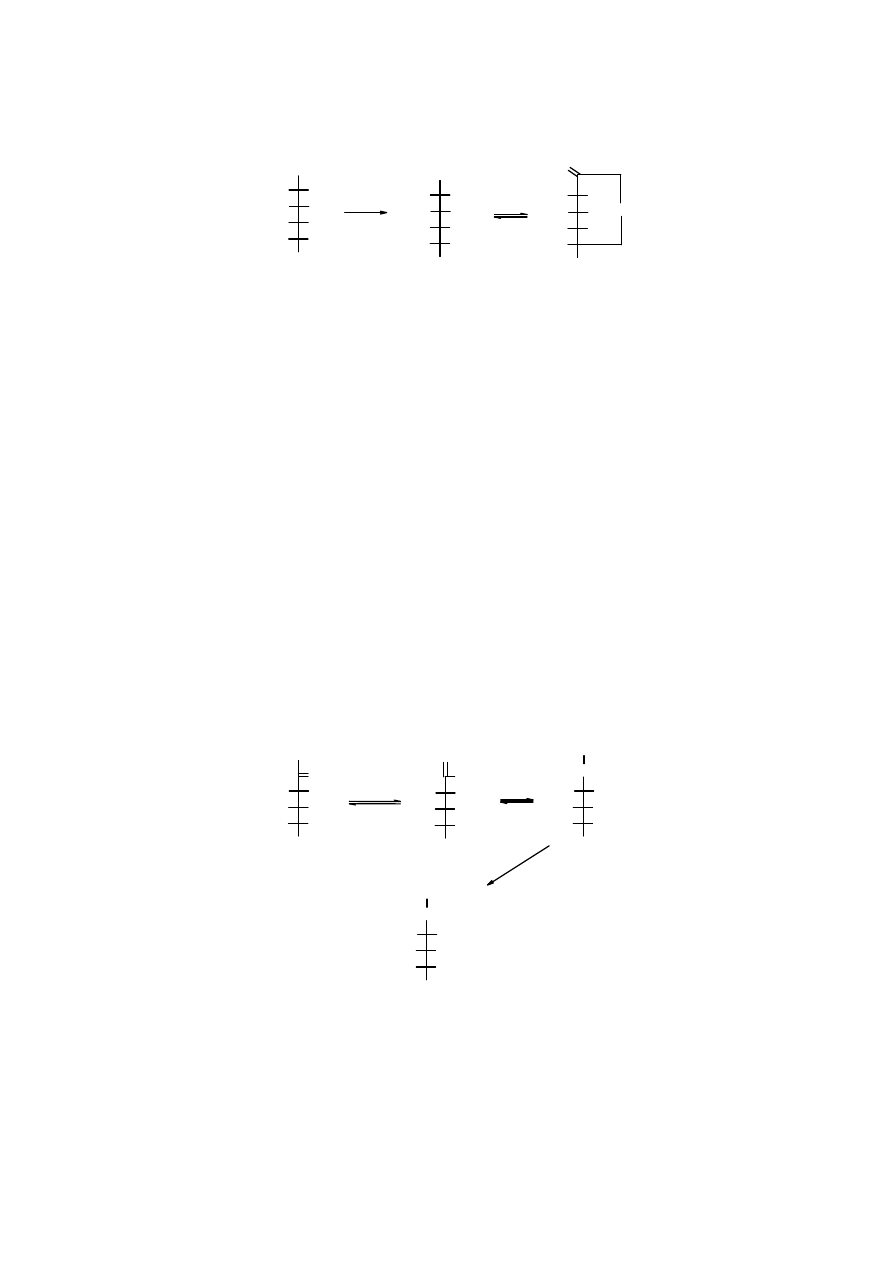
3. Utlenienie
3.1 Utlenienie do kwasów onowych
Karbonylowy atomi węgla aldoz łatwo ulega utlenieniu, powstają przy tym polihydroksykwasy,
zwane
kwasami onowymi
(dawniej kwasami aldonowymi). Najczęściej stosowanymi
utleniaczami są np. chlor lub brom w wodzie. Kwasy onowe tracąc wodę łatwo przechodzą w
lakotny.
10
CH
2
OH
CHO
OH
H
H
O
H
OH
H
OH
H
CH
2
OH
OH
H
H
O
H
OH
H
OH
H
COOH
CH
2
OH
OH
H
H
O
H
H
H
O
O
OH
Cl
2
/HOH
- HOH
D
-glukopiranoza kwas
D
-glukonowy lakton kwasu
D
-glukonowego
Sól wapniowa kwasu
D
-glukonowego
jest stosowana jak lek stanowiący źródło wapnia.
Stosowana jest, np. w chorobach alergicznych i w leczeniu osteoporozy.
Kwasy glukonowe powstają z aldoz również pod wpływem utleniającego działania soli srebra
Ag
+
lub soli miedzi Cu
+2
. Reakcje z tymi jonami zostały wykorzystane jako testy na obecność
aldoz. Warto pamiętać, że podobnie reagują aldehydy.
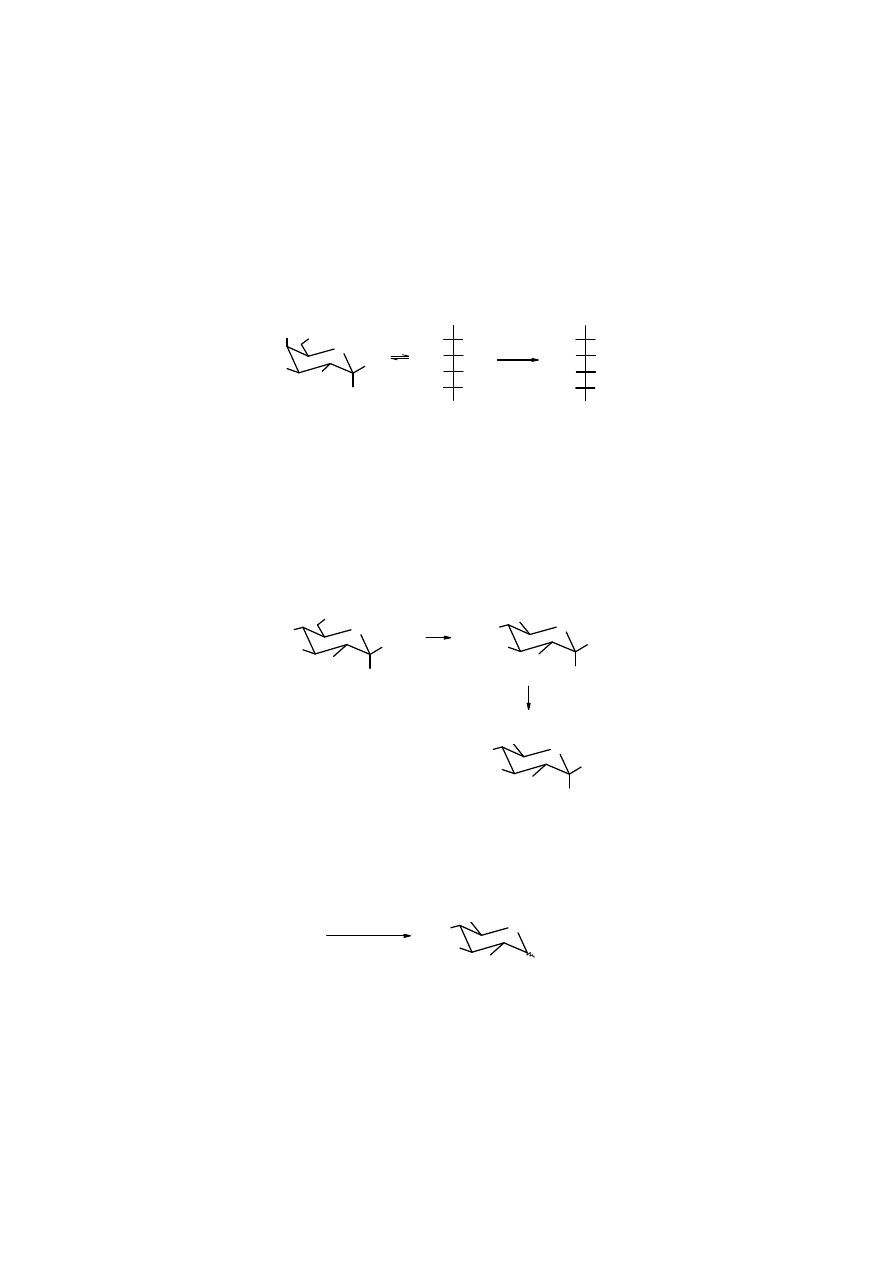
Test Tollensa
Odczynnikiem Tollensa
jest amoniakalny roztwór azotanu srebra. W reakcji z aldehydami, w
tym z aldozami kation srebrowy ulega redukcji do srebra metalicznego, które w postaci lustra
osadza się na powierzchni szklanego naczynia. Aldoza utlenia się przy tym do kwasu
glikonowego. Szybka reakcja tworzenia lustra srebrowego jest dowodem na obecność w
ś
rodowisku aldehydu (aldozy). Jeżeli tej reakcji poddamy ketozę, to również zaobserwujemy
wolne tworzenie się lustra srebrowego, ale dopiero po wielokrotnie dłuższym czasie, potrzebnym
do przekształcenia się ketozy w epimeryczną aldozę. Ketony zwykłe są niewrażliwe na test
Tollensa.
aldoza + Ag
+
→
Ag
↓
+ kwas glikonowy
lustro srebrowe
ketoza
→
aldoza + Ag
+
→
Ag
↓
+ kwas glikonowy
lustro srebrowe
CH
2
OH
CH
2
OH
O
H
O
H
OH
H
OH
H
CH
2
OH
CHOH
OH
H
O
H
OH
H
OH
H
CH
2
OH
CHOH
H
O
H
OH
H
OH
H
CHO
CH
2
OH
CHOH
H
O
H
OH
H
OH
H
COOH
-
OH/HOH
enolizacja
-
OH/HOH
Ag
+
/NH
4
OH
kwas glikonowy
D
-fruktoza
aldoza
enol
Reakcja redukcji soli srebra za pomocą aldehydów jest wykorzystywana do wytwarzania luster.
11
Test Fehlinga
Test Fehlinga
polega na
utlenianu
aldoz solą Cu(II) w zasadowym roztworze winianu sodowo-
potasowego. W wyniku reakcji aldoza utlenia się do kwasu glikonowego, a jonu Cu(II) redukują
się do Cu(I) i w środowisku zasadowym utleniacz wytrąca się w postaci pomarańczowego osadu
Cu
2
O. Ketozy reagują z odczynnikiem Fehlinga podobnie jak z odczynnikiem Tollensa, czyli
pomarańczowy osad zaczyna się wolno wytrącać po wielu minutach.
Z
D
-galaktozy
w wyniku delikatnego utleniania powstaje kwas
D
-galaktonowy
.
CH
2
OH
CHO
OH
H
H
O
H
H
O
H
OH
H
O
OH OH
O
H
O
H
CH
2
OH
OH
H
H
O
H
H
O
H
OH
H
COOH
H,OH
Br
2
/HOH
D
-galaktopiranoza
D
-galaktoza kwas
D
-galaktonowy
3.2 Utlenienie do kwasów uronowych
Kwasy uronowe są pochodnymi aldoz, których reszta CH
2
OH (ostatni atom węgla) jest
utleniona
do grupy karboksylowej.
Utlenienie
tej grupy można przeprowadzić po
zabezpieczeniu funkcji aldehydowej, która jak wiadomo utlenia się łatwiej niż pierwszorzędowy
alkohol.
Kwas
D
-glukuronowy
powstaje w
reakcji utlenienia
, np.
1,2,34-tetraacetylo-
D
-
glukopiranozy
.
O
OH
AcO
AcO
AcO
O
AcO
AcO
AcO
O
O
H
O
H
O
H
H, OAc
[O]
H, OAc
NaOH/HOH
COOH
H, OH
COOH
1,2,3,4-tetraacetylo-
-
D
-glukopiranoza
kwas
D
-glukuronowy
Selektywnie chroniona pochodna
D
-glukozy
, tak żeby była wolna jedynie grypa hydroksylowa
przy C6 (jak wyżej) jest trudna do otrzymania. Przy odpowiednio dobranym utleniaczu
wystarczy zablokować jedynie grupę aldehydową cukru. Warunek ten spełniają glikozydy, a
także tania i łatwo dostępna
skrobia
, polimer
D
-glukozy
, w którym poszczególne reszty
monomerów połączone są w sposób 1-4, tzn. mają chroniona grupę aldehydową.
O
O
H
O
H
O
H
OH
COOH
kwas
D
-gluku-
ronowy
skrobia
1. powietrze/kat.
2.
H
+
/HOH
Kwasy uronowe łatwo tworzą laktony. K
rystaliczny kwas D-glukuronowy
występuje głównie w
postaci
furanurono-6
→
3laktonu
, podczas gdy najtrwalszą formą
kwasu D-galakturowego
jest
piranurono-6
→
3-lakton
.
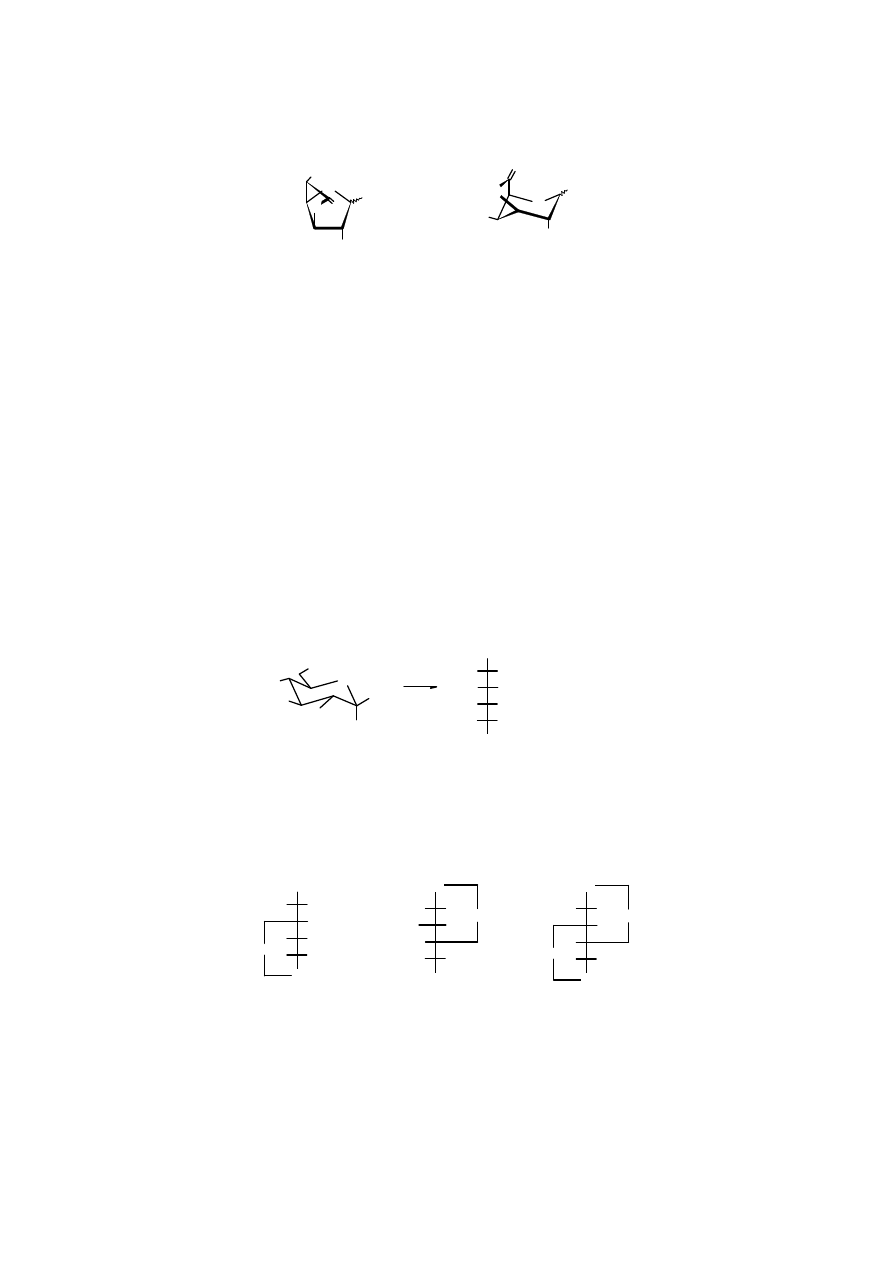
12
O
O
H
OH
OH
O
O
O
OH
OH
O
O
OH
lakton 6
→
→
→
→
3-
D
-glukofuranuronowy lakton 6
→
→
→
→
3-
D
-galaktopiranuronowy
Warto zwrócić uwagę na to, że powstawaniu laktonów towarzyszy wydzielenie cząsteczki wody,
podczas gdy hemiacetale tworzą się w reakcji addycji (nie wydziela się żadna cząsteczka).
Kwasy glikuronowe zachowują właściwości redukujące, zdolność do mutarotacji, mogą też
tworzyć glikozydy.
Kwas
D
-glukuronowy
został wykryty po raz pierwszy w moczu, stąd jego
nazwa (ang. urine – mocz). Występuje również we krwi. Pełni on ważną rolę w organizmie, służy
bowiem do usuwania wielu substancji toksycznych. Tworzy z nimi glikozydy, np. z
fenolem
, i w
tej postaci są one usuwane wraz z moczem.
Kwasy uronowe należą do popularnych związków organicznych.
Kwas
D
-glukuronowy
oprócz
roli wspomnianej powyżej jest składnikiem
gumy arabskiej
i ksantanów, kwas
D
-galakturonowy
nadaje właściwości żelujące tego typu produktom naturalnym jak agar czy peptyny, kwasy
L
-
guluronowy
i
D
-mannuronowy
występuje w alginianach wyodrębnianych z brunatnych glonów.
3.3 Utlenianie do kwasów arowych
Utlenianie
aldoz silnym utleniaczem, np. kwasem azotowym prowadzi do kwasów polihydroksy-
αααα
,
ω
ωω
ω
-dikarboksylowych, zwanych
kwasami arowymi
(dawniej kwasami cukrowymi). Utlenianie
D
-glukozy
kwasem azotowym daje
kwas
D
-glukarowy
.
O
O
H
O
H
O
H
OH
H
H
O
H
OH
H
OH
H
COOH
OH
H, OH
COOH
D
-glukopiranoza
kwas
D
-glukarowy
HNO
3
Kwasy arowe, podobnie jak kwasy uronowe łatwo tworzą laktony, jednak w przypadku kwasów
arowych, z uwagi na zawartość dwóch grup karboksylowych istnieje większa możliwość
wzajemnej wewnątrzcząsteczkowej reakcji, wobec czego tworzy się więcej laktonów.
Laktony
kwasu
D
-glukarowego
H
H
OH
H
OH
H
COOH
OH
O
H
H
H
OH
H
OH O
O
O
H
H
H
H
OH
OH
CO
COOH
CO
OC
OC
lakton 6
→
→
→
→
3 lakton 1
→
→
→
→
4 dilakton 1
→
→
→
→
4:6
→
→
→
→
3
Kwas arowy otrzymywany z
galaktozy
(lub
laktozy
) czyli
kwas galaktarowy
znany jest pod
zwyczajową nazwą
kwasu śluzowego
.
Zadanie
: napisz schemat reakcji otrzymywania
kwasu śluzowego
.

13
3.4 Utlenianie kwasem nadjodowym
Kwas nadjodowy, podobnie jak
tetraoctan ołowiu
utleniają
wicinalne glikole (1,2-glikole),
dochodzi przy tym do rozerwania wiązania C-C i utworzenia dwóch grup karbonylowych.
OH OH
CH
2
CH
2
HIO
4
2 H
2
C=O
glikol
etylenowy
metanal
W przypadku
utleniania
kwasem nadjodowym atomu węgla, który ma w sąsiedztwie dwa
ugrupowania -C-OH ulega on przekształceniu do grupy karboksylowej -COOH.
OH OH
CH
2
CH CH
2
OH
HIO
4
2 H
2
C=O + HCOOH
glicerol
metanal
kwas metanowy
Podobnie
utlenieniu
do grupy karboksylowej ulega aldehyd lub keton, który ma w sąsiedztwie
ugrupowania -C-OH lub karbonylowe.
OH OH
CH
2
CH C=O
H
HIO
4
H
2
C=O + 2 HCOOH
aldehyd
glicerynowy
metanal kwas metanowy
W cząsteczce wolnych cukru zwykle wszystkie atomy węgla są podatne na utleniające działanie
tego typu utleniaczy, dlatego z wolnych cukrów powstaje głównie
kwas metanowy
.
O
OH
OH
O
H
O
H
O
H
O
CH
2
OH
H
H
OH H
HOH
2
C
OH
5 HCOOH + CH
2
O
+ 5 HIO
4
aldoza
kwas
metanowy
metanal
HO
1
2
3
4
5
6
ketoza
Pytanie
: z którego atomu węgla cząsteczki cukru powstanie
kwas metanowy
?
Wiązanie hemiacetalowe nie stanowi przeszkody w
utlenieniu
wg powyższego schematu,
natomiast etery, w tym glikozydy są odporne na utleniające działanie kwasu nadjodowego.
Produkty utleniania glikozydów zależą od wielkości utlenianego pierścienia glikozydowego, tzn.
od tego czy
występuje on w formie piranozowej czy furanozowej
. Dawniej, utleniania cukrów
kwasem nadjodowym było głównym sposobem określania wielkości pierścienia cukrowego.
Obecnie, służą do tego metody spektralne.
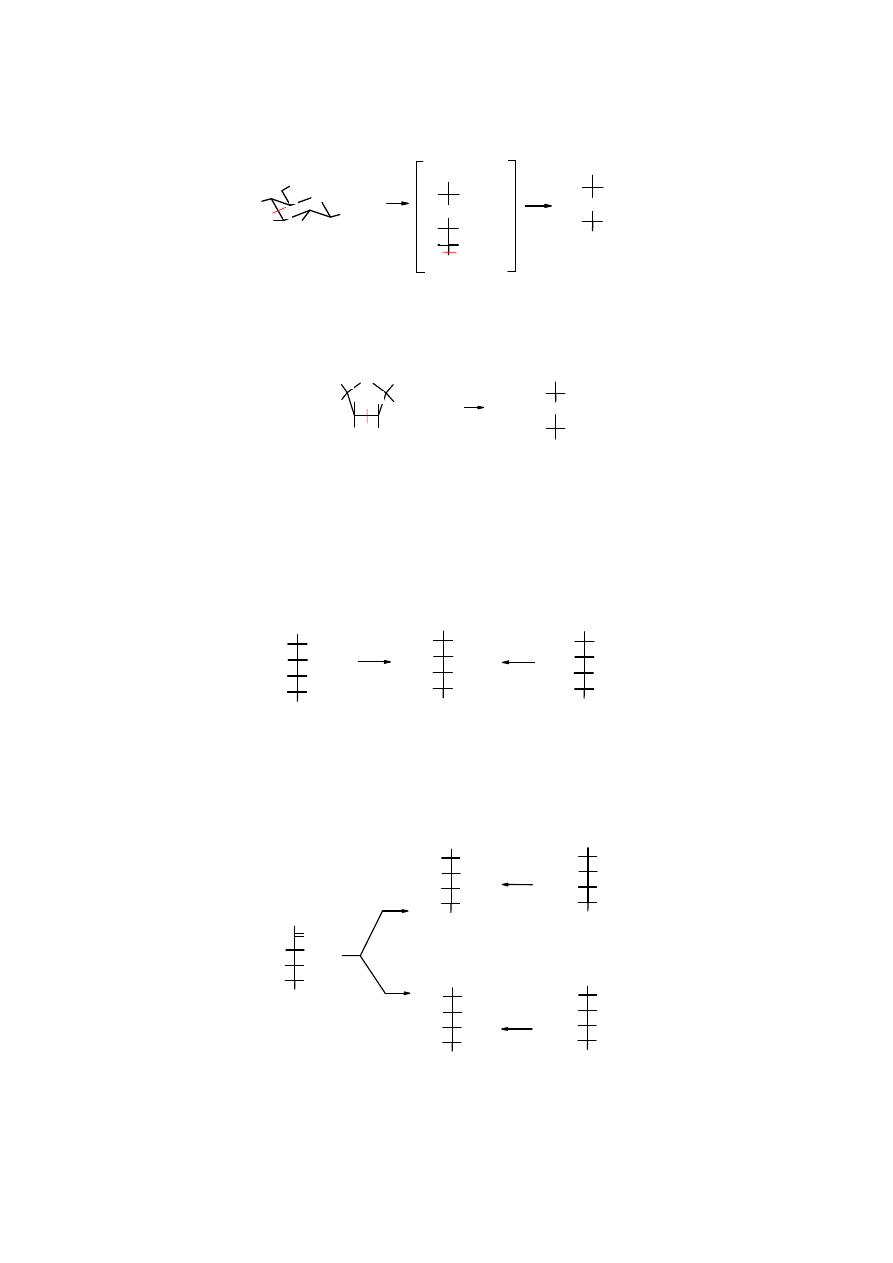
14
O
OH
O
H
O
H
O
H
OMe
H
O
H
OH
H
CH
2
OH
CHO
CHO
OMe
H
O
H
CH
2
OH
CHO
OMe
CHO
1
2
HIO
4
metylo-
ββββ
-
D
-glukopiranozyd
HIO
4
+ HCOOH
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
Zadanie
: nazwij produkt utlenienia, który powstaje obok
kwasu metanowego
.
Produkt utlenienia furanozydu różni się zasadniczo od produktu utlenienia piranozydu; na
podstawie tej różnicy poznaje się wielkość pierścienia.
O
CH
2
OH
H
H
OH H
HOH
2
C
OMe
CH
2
OH
O
CHO
H
CHO
CH
2
OH
HO
1
2
3
4
5
6
1
2
3
4
5
6
HIO
4
metylo-
ββββ
-
D
-fruktofuranozyd
MeO
Zadanie
: nazwij produkt utlenienia
metylo-
β
-D-fruktofuranozydu
kwasem nadjodowym.
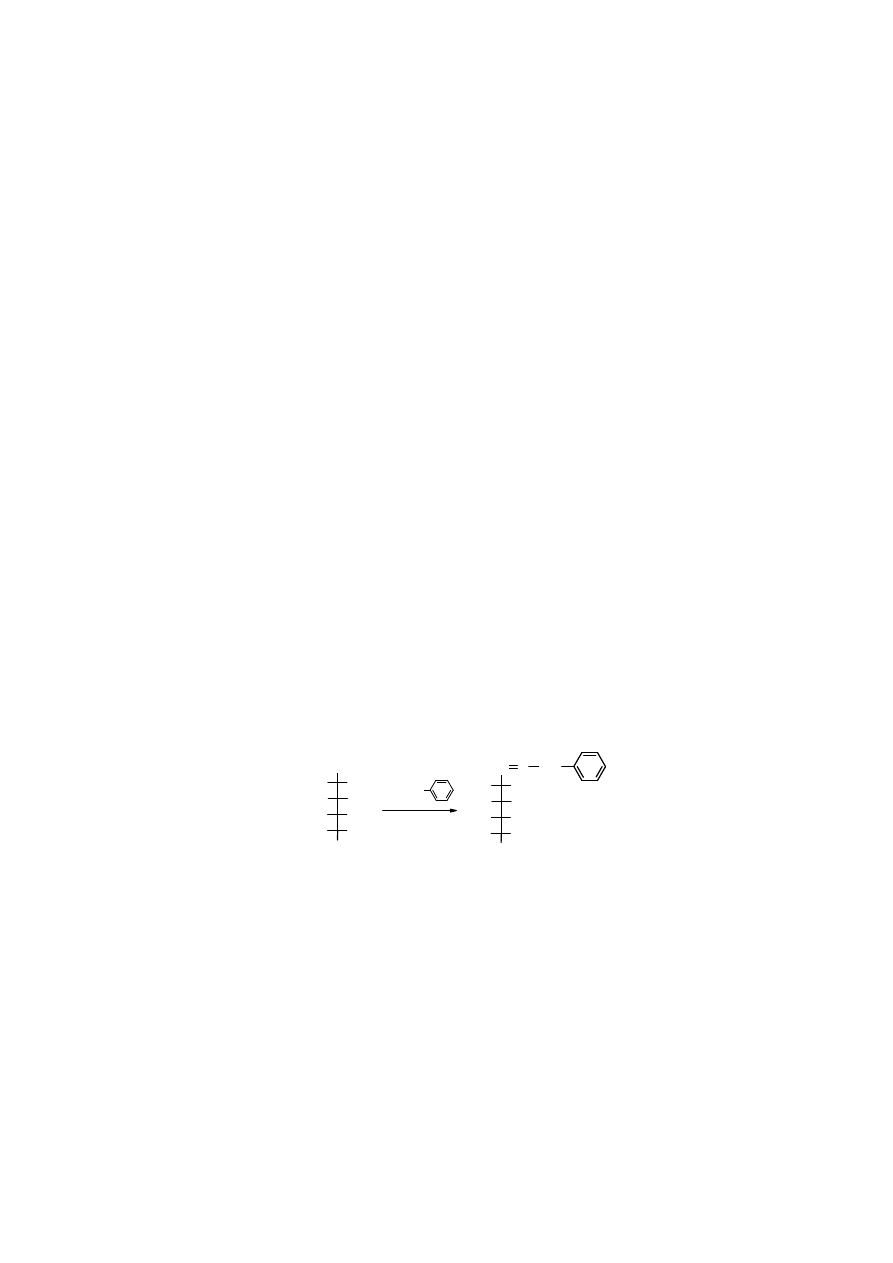
4. Redukcja
Redukcja
aldoz i ketoz prowadzi do polioli (polihydroksyalkanów), zwanych
alditolami
.
Ulegają one
redukcji
łatwiej niż zwykłe aldehydy czy ketony. Glikozydy są odporne na
redukcję
. Warto zwrócić uwagę na to, że ten sam alditol powstaje w wyniku
redukcji
dwóch
różnych aldoz, a z ketozy tworzą się dwa alditole, ponieważ pojawia się nowe centrum chiralne.
CHO
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
CH
2
OH
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
CHO
H
O
H
H
O
H
OH
H
CH
2
OH
H
O
H
[H]
[H]
D
-glukoza
D
-glucitol (sorbitol)
L
-guloza
Nazwę alditolu buduję się zamieniając w nazwie aldozy końcówkę -
oza
na –
itol
, np.
mann
oza
→
mann
itol
. Nazwę wyprowadza się od najpopularniejszej aldozy, z której może powstać; stąd
są znane
D
-glucitol
i
D
-mannitol
, chociaż oba te alditole powstaję również w
redukcji
D
-fruktozy
i odpowiednio innych aldoz. Niektóre alditole mają nazwy zwyczajowe, np.
sorbitol
(
D
-glucitol
).
CHO
H
O
H
H
O
H
OH
H
CH
2
OH
OH
H
CH
2
OH
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
CH
2
OH
O
H
O
H
OH
H
CH
2
OH
OH
H
CH
2
OH
H
O
H
H
O
H
OH
H
CH
2
OH
OH
H
CHO
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
[H]
[H]
[H]
D
-fruktoza
D
-glucitol
D
-glukoza
D
-mannitol
D
-mannoza
15
Dawniej alditole otrzymywało się z cukrów poprzez
redukcję
amalgamatem sodu lub glinu.
Obecnie w laboratorium stosuje się do tego celu tetrahydroboran sodu, a w przemyśle wodór pod
zwiększonym ciśnieniem, w obecności katalizatora niklowego.
Właściwości, występowanie i zastosowanie
Alditole są słodkie; słodkość
D
-glucitolu
odpowiada w 50% słodkości
cukrozy
(
sacharozy
), tzn.
stężenie wyczuwalnej słodkości
D
-glucitolu
jest dwa razy większe niż
cukrozy
.
Najbardziej znanym alditolem jest
glicerol
. Warto zwrócić uwagę, że on też jest słodki, co
przejawia się w jego nazwie. Do rozpowszechnionych w przyrodzie należy
D
-glucitol
. W
niektórych owocach stanowi aż 10% ich suchej masy (np. w jarzębinie górskiej, Sorbus
aucuparia), w małych ilościach występuje w jabłkach, morelach, gruszkach i innych. Nie stanowi
pożywki dla bakterii i nie ulega fermentacji. Mogą go spożywać diabetycy. Ma niską wartość
kaloryczną. Służy jako wypełniacz niektórych farmaceutyków, kosmetyków i wyrobów
papierniczych. Wykorzystywany jest w przemyśle do produkcji polieterów i detergentów
niejonowych.
D
-Ksylitol
dodawany jest jako słodzik do gum do żucia, ponieważ nie przyczynia
się do rozwoju próchnicy zębów.
D
-Mannitol
jest często spotykany w naturze, np. w oliwkach, glonach morskich czy cebuli. Warto
wiedzieć o tym, że
D
-galaktitol
jest szkodliwy. Schorzenie nazwane galaktozemią, wywołane
brakiem enzymu metabolizującego
galaktozę
prowadzi do nagromadzenia się
galaktitolu
u
niemowląt. Nie leczona galaktozemia powoduje niedorozwój umysłowy i w końcu śmierć.
Obecność
galaktitolu
w oku prowadzi do zaćmy.
5. Otrzymywanie azotowych pochodnych cukrów
W czasach, kiedy nie znano spektralnych metod badania związków organicznych oznaczanie
budowy i identyfikacja cukrów opierała się głównie na tworzeniu ich pochodnym i utlenianiu
kwasem najdjodowym. Duże znaczenie w identyfikacji cukrów, podobnie jak i innych związków
karbonylowych, miały pochodne azotowe, w tym np. fenylohydrazony. Powstają one jak
wiadomo w reakcji związku karbonylowego z
fenylohydrazyną
.
CHO
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
N NH
NH
2
NH
HC
fenylohydrazon
D
-glukozy
D
-glukoza
Fenylohydrazyna
użyta w nadmiarze w reakcji z cukrami daje specyficzne produkty – 1,2-
difenylohydrazony, zwane
osazonami
. W pierwszym etapie reakcji powstaje fenylohydrazon,
który zostaje na sąsiednim atomie węgla utleniony nadmiarem f
enylohydrazyny
do
oksyfenylohydrazonu. Ten z kolei z trzecią cząsteczką
fenylohydrazyny
tworzy 1,2-
difenylohydrazon, czyli osazon.
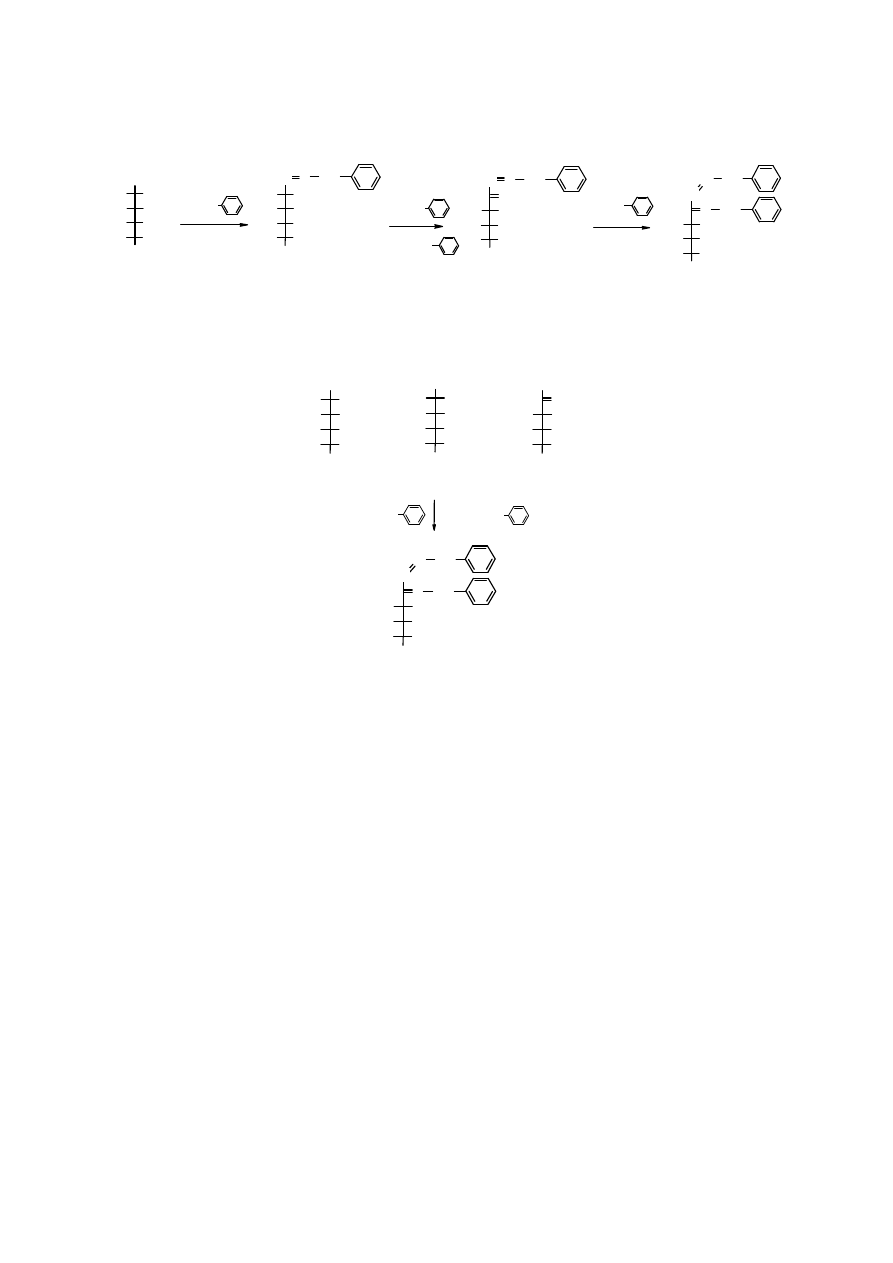
16
CHO
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
N NH
O
H
O
H
OH
H
CH
2
OH
OH
H
N NH
N
H
O
H
OH
H
CH
2
OH
OH
H
N NH
NH
NH
2
NH
HC
D
-glukoza
NH
2
NH
- H
2
N
HC
NH
2
NH
HC
- NH
3
,
fenylohydrazon
D
-glukozy fenylohydrazon 2-oksy
D
-glukozy osazon
D
-glukozy
Warto zwrócić uwagę, że z epimerów, np.
D
-glukozy
,
D
-mannozy
i
D
-fruktozy
powstaje
identyczny osazon.
N
H
O
H
OH
H
CH
2
OH
OH
H
N NH
NH
CH
2
OH
O
H
O
H
OH
H
CH
2
OH
OH
H
CHO
OH
H
H
O
H
OH
H
CH
2
OH
OH
H
CHO
H
O
H
H
O
H
OH
H
CH
2
OH
OH
H
HC
3 NH
2
NH
- NH
3
, - H
2
N
D
-glukoza
D
-mannoza
D
-fruktoza
lub
lub
osazon
ten sam dla wszystkich
epimerów
6. Skracanie i przedłużanie łańcucha węglowego cukrów
Cząsteczki cukrów można rozbudowywać, tak żeby np. z pentoz otrzymać heksozy, można je
degradować, np. heksozy do pentoz, a pentozy do tetroz, można również aldozy przekształcać w
ketozy i odwrotnie. Te reakcje zostały opracowane w celu umożliwienia otrzymywania cukrów
rzadko spotykanych w naturze z cukrów powszechnie dostępnych, lub na które jest większe
zapotrzebowanie. Najbardziej znaną transformacją jest
enzymatyczna izomeryzacja
D
-glukozy
do
D
-fruktozy
. Jest to proces prowadzony na dużą przemysłową skalę, ponieważ
D
-glukoza
otrzymywana poprzez hydrolizę
skrobi
(kukurydzianej lub ziemniaczanej) jest tania, a
D
-fruktoza
jest trzykrotnie słodsza od
cukrozy
. Zastąpienie
cukrozy
przez
D
-fruktozę
do słodzenia napojów
lub wyrobów cukierniczych pozwala na znaczne obniżenie kaloryczności tych produktów
spożywczych.
6. Acylowanie
Acylowanie
jest przykładem reakcji grup hydroksylowych (alkoholowych) cząsteczki cukrów. W
reakcji
acylowania
cukrów, najczęściej bezwodnikami, powstają estry. W zależności od
warunków acetylowania
D
-glukozy
bezwodnikiem octowym powstaje anomer
αααα
(w środowisku
lekko kwaśnym – ZnCl
2
) lub
ββββ
(w środowisku lekko zasadowym – AcONa).
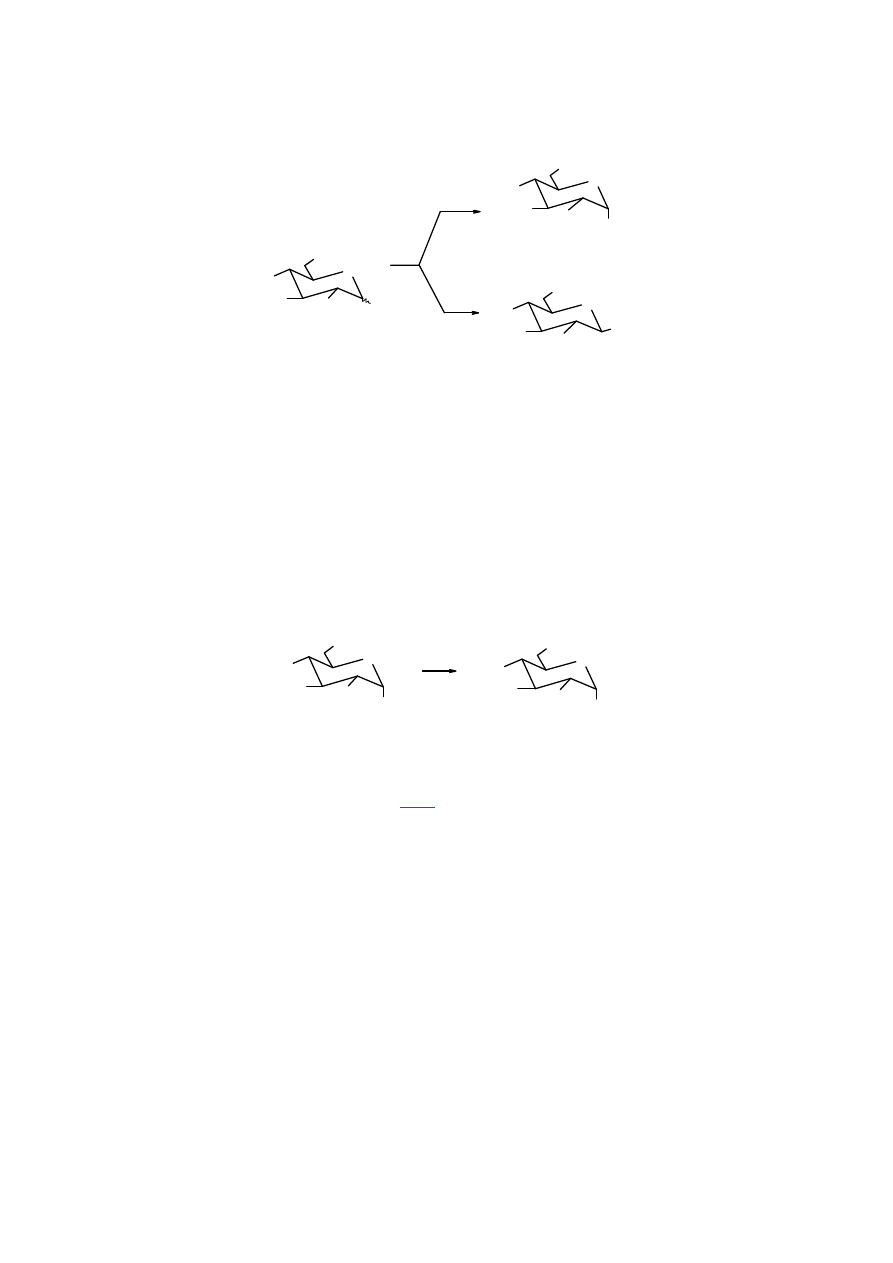
17
O
OH
O
H
O
H
O
H
OH
O
OAc
AcO
AcO
AcO
OAc
O
OAc
AcO
AcO
AcO
OAc
α
αα
α
-
-
D
-glukopiranoza
ββββ
-
(lub
)
Ac
2
O
ZnCl
2
AcONa
100
o
C
1 h
70%
80%
1,2,3,4,6-pentaacetylo-
α
αα
α
-
D
-glukopiranoza
1,2,3,4,6-pentaacetylo-
ββββ
-
D
-glukopiranoza
Reszty octanowe można traktować jako czasowe grupy ochronne. Usuwa się je najłatwiej w
wyniku
metanolizy
katalizowanej
metanolanem sodu
.
Zadanie
: napisz schemat reakcji usuwania grup octanowych z
1,2,3,4,6-pentaacetylo-
β
-D-glukopiranozy
.
Do czasowej osłony grup hydroksylowych cukrów stosuje się też inne reszty acylowe, np.
borany, fenyloborany, węglany. Cukry w stanie naturalnym występują często w postaci
fosforanów, np. w DNA czy RNA.
7. Alkilowanie
W wyniku reakcji cukrów z
jodkiem metylu
tworzą się etery metylowe.
Alkilowanie
cukrów
zachodzi łatwiej niż zwykłych alkoholi, ponieważ atomy wodorów grup hydroksylowych w
cukrach są bardziej kwaśne niż w alkoholach izolowanych.
O
OH
O
H
O
H
O
H
OH
O
OMe
OMe
OMe
OMe
OMe
MeI
BaO
α
αα
α
-D-glukopiranoza tetrametylo-
α
αα
α
-metylo-
D
-glukopiranozyd
Zazwyczaj powstaje mieszanina anomerów. W nazwie permetylowanego cukru często grupę
metylową przy glikozydowym atomie węgla wyodrębnia się i zmienia się końcówkę z
-oza
na
-
ozyd
, dla podkreślenia, że jest to glik
ozyd
, tzn. pochodna cukru będąca acetalem, a nie
hemiacetalem, jak wolne cukry.
Cukry można też
metylować
diazometanem
; dzięki podwyższonej kwasowości grup
hydroksylowych.
8. Otrzymywanie glikozydów
W określonych warunkach cukier można przekształcić w glikozyd (acetal) poprzez
alkilowanie
wyłącznie na glikozydowym atomie tlenu. Glikozydy powstają w reakcji cukru z alkoholem w
obecności mocnych, bezwodnych kwasów jako katalizatorów. Produkt jest zwykle mieszaniną
anomerów.
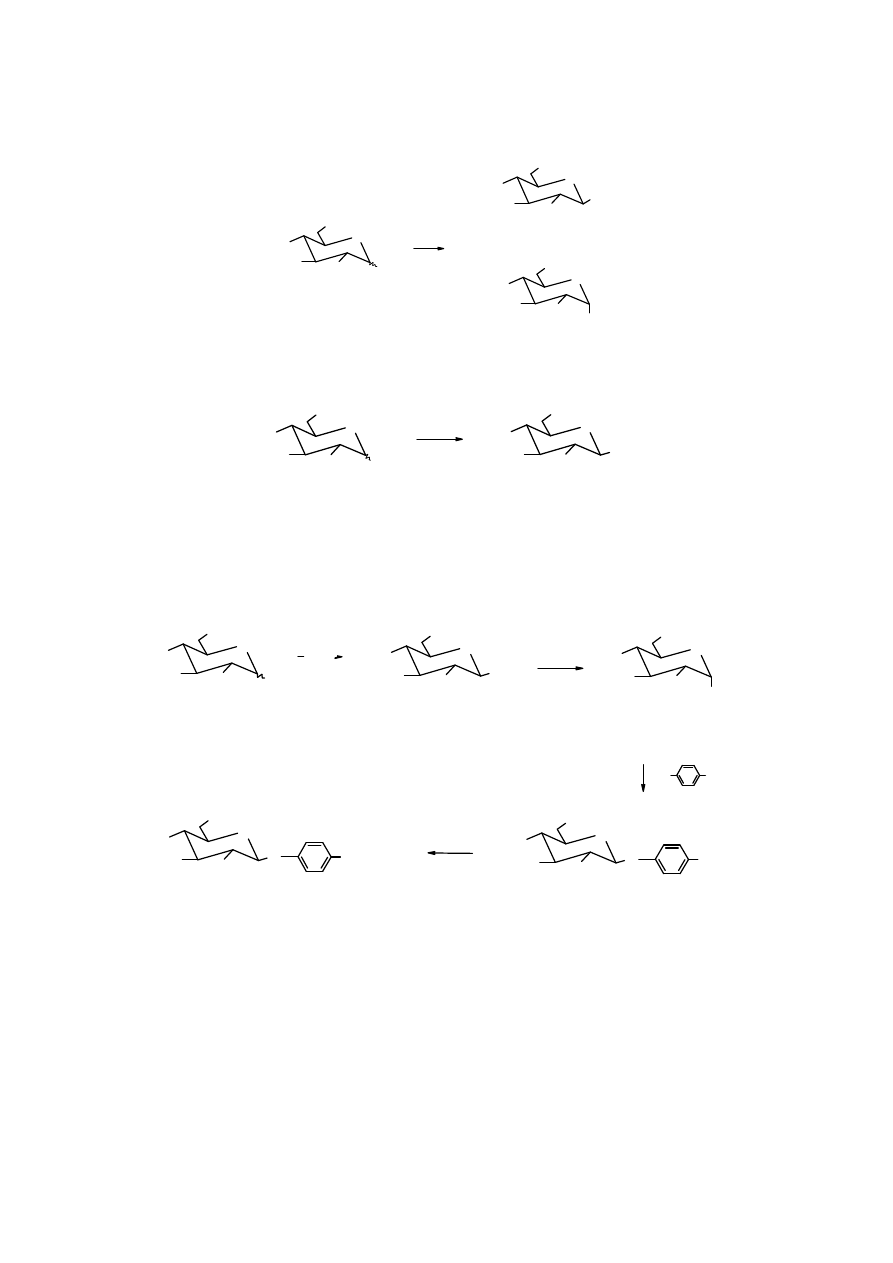
18
O
OH
O
H
O
H
O
H
OH
O
OH
O
H
O
H
O
H
OMe
O
OH
O
H
O
H
O
H
OMe
MeOH
HCl
α
αα
α
-(lub
ββββ
)-
D
-glukopiranozyd
ββββ
-metylo-
D
-glukopiranozyd
α
α
α
α
-metylo-
D
-glukopiranozyd
W podobny sposób powstaje glikozyd benzylowy. W podanych warunkach, niezależnie od
konfiguracji substratu, otrzymuje się głównie anomer
ββββ.
O
OH
O
H
O
H
O
H
OH
O
OH
O
H
O
H
O
H
OBz
BzOH, HCl
4 h, 100
o
C
D
-glukopiranoza
ββββ
-metylo-
D
-glukopiranozyd
Dogodnym substratami do syntezy glikozydów są chronione halogenki glikozylowe (chlorki bądź
bromki). Powstają one w reakcji, np. z pentaacetylopiranoz pod wpływem działania bezwodnego
halogenowodoru. Reakcja
alkoholizy
halogenku glikozylowego biegnie nie tylko łatwo, ale i
stereoselektynie (z inwersją konfiguracji), prowadzi więc do czystego anomeru.
O
OH
O
H
O
H
O
H
OH
O
OAc
AcO
AcO AcO
OAc
O
OAc
AcO
AcO AcO
Br
O
H
OMe
O
OAc
AcO
AcO AcO
O
OMe
O
OH
O
H
O
H
O
H
O
OMe
Ac
2
O
AcONa
HBr
bezwodny
Ag
2
O
D
-glukopiranoza
1,2,3,4,6-pentaacetylo-
-
ββββ
-
D
-glukopiranoza
bromek 2,3,4,6-tetraace-
tylo-
α
αα
α
-
D
-glukopiranozylu
92%
2,3,4,6-tetraacetylo-p-meto-
ksyfenylo-
ββββ
-
D
-glukopiranozyd
p-metoksyfenylo-
ββββ
-D-glukopiranozyd
95%
-
OH/HOH
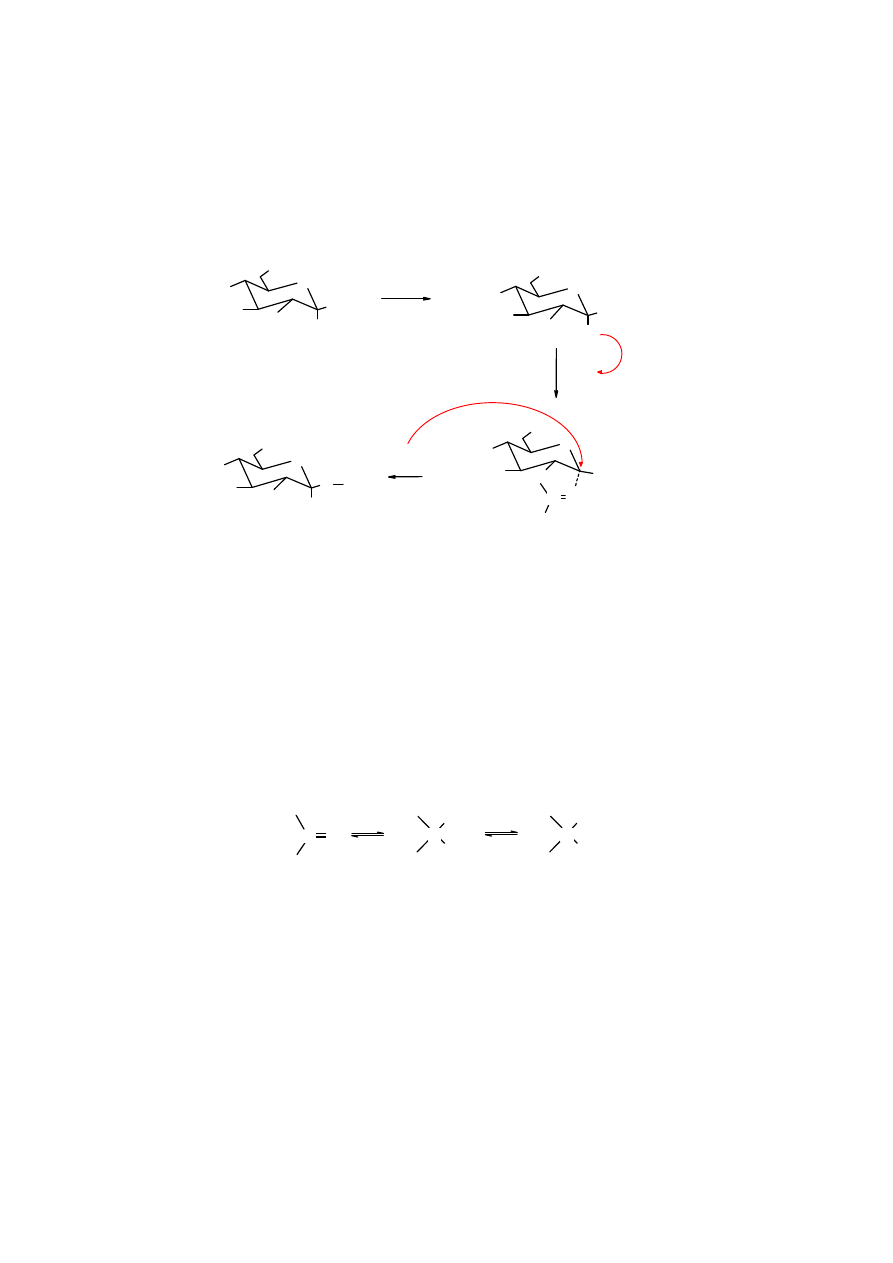
19
Inwersję konfiguracji podczas
alkoholizy
halogenku glikozylowego tłumaczy się oderwaniem
anionu halogenkowego pod wpływem Ag
2
O i utworzenia karbokationu stabilizowanego grupą
acetylową z sąsiedniego atomu węgla. Stabilizacja karbokationu następuje w wyniku
addycji
cząsteczki alkoholu.
Addycja
ta jest możliwa tylko od strony przeciwnej w stosunku do reszty
acetylowej.
O
OAc
AcO
AcO
AcO
OAc
H
O
OAc
AcO
AcO
AcO
Br
H
O
OAc
AcO
AcO
AcO
O
H
R
O
OAc
AcO
AcO
O
H
O
C
H
3
HBr
bezwodny
Ag
2
O
1,2,3,4,6-pentaacetylo-
-
ββββ
-D-glukopiranoza
bromek 2,3,4,6-tetraace-
tylo-
α
αα
α
-
D
-glukopiranozylu
2,3,4,6-tetraacetyloalkilo-
-
ββββ
-
D
-glukopiranozyd
S
N
2
inwersja
konfiguracji
- AgBr
C
..
:
+
karbokation
ROH
..
..
S
N
1
stabilizowany
resztą acetylową
Glikozydy są selektywnie
hydrolizowane
przez enzymy. Wydobywana z drożdży
α
-glikozydaza
hydrolizuje
glikozydy
αααα
, podobnie jak
maltaza
wytwarzana w kiełkujących ziarnach (w słodzie),
a anomery
ββββ
rozkłada
β
-glikozydaza
, zwana również
emulsyną
. Znajduje się ona w gorzkich
migdałach.
Lizozym
natomiast
hydrolizuje
oba izomery.
Glikozydy, jako acetale różnią się właściwościami chemicznymi w stosunku do wolnych cukrów,
które są hemiacetalami i zachowują się jak związki zawierające grupę karbonylową. Glikozydy
mają zablokowana grupę karbonylową, dlatego nie ulegają
mutarotacji
, nie
epimeryzują
, są
odporne na
utlenianie
i
redukcję
, nie tworzą pochodnych azotowych, np. osazonów. W
ś
rodowisku kwaśnym łatwo jednak
hydrolizują
i tym samym odzyskują właściwości typowe dla
cukrów.
O
OR
OH
OR
OR
C
ROH/
+
H
C
C
ROH/
+
H
związek karbonylowy hemiacetal acetal
Oprócz O-glikozydów znane są także N-glikozydy i S-glikozydy, tzn. związki, w których alkil lub
aryl połączone są z glikozydowym atomem węgla reszty cukrowej poprzez atom azotu lub siarki.
W tym sposób powstają glikoproteiny, cukrowe analogi białek. Część cukrowa jest w nich
przyłączona do łańcucha białkowego za pomocą wiązania O- lub S-glikozydowe. To wiązanie
tworzy się pomiędzy cząsteczką cukru, a znajdującymi się w łańcuchu białkowym resztami
seryny
lub
cysteiny
.
OLIGOCUKRY
20
Do najbardziej znanych oligocukrów należą dicukry:
maltoza
(
cukier słodowy
),
celobioza
(powtarzająca się jednostka
celulozy
),
laktoza
(
cukier mleczny
) i
cukroza
(
sacharoza
, czyli cukier
spożywczy).
Maltoza
i
celobioza
składają się z dwóch reszt
D-glukozy
, połączonych z sobą 1,4.
Różnią się konfiguracją wiązania glikozydowego: w
maltozie
jest
αααα
, a w
celobiozie
ββββ
.
O
OH
O
H
O
H
O
H
O
O
OH
O
H
O
H
OH
O
OH
O
H
O
H
O
H
O
O
OH
O
H
O
H
OH
wiązanie
ββββ
-glikozydowe
wiązanie
α
αα
α
-glikozydowe
1
4
1
4
4-O-(
ββββ
-
D
-glukopiranozylo)-
-
ββββ
-
D
-glukopiranoza
maltoza
4-O-(
α
αα
α
-
D
-glukopiranozylo)-
-
ββββ
-
D
-glukopiranoza
celobioza
Zadanie
: w jaki sposób
można stwierdzić konfigurację przy glikozydowym atomie węgla w
celobiozie
i
maltozie
?
Oba powyższe dicukry zachowują większość właściwości monocukrów (aldoz), np. ulegają
mutarotacji
i
utlenieniu
, tworzą glikozydy i osazony.
Maltoza
powstaje ze
skrobi
w kiełkujących ziarnach (w słodzie). Podczas kiełkowania uaktywnia
się enzym zwany
maltazą
, który
hydrolizuje
skrobię
.
Celobioza
nie występuje w stanie wolnym,
można ją otrzymać poprzez enzymatyczny rozkład
celulozy
lub jej ostrożną
hydrolizę
chemiczną.
Laktoza
jest złożona z reszt
D
-galaktozy
i
D
-glukozy
, które powiązane są z sobą w sposób
ββββ
-1,4,
przy czym wolna grupa glikozydowa należy do
D
-glukozy
. Zawartość
laktozy
w świeżym mleku
dochodzi do kilku procent. Kwaśnienie mleka polega na fermentacyjnym utlenieniu
laktozy
do
kwasu mlekowego
. Wytrąca się przy tym
kazeina
(białko mleka), ponieważ środowisku
kwaśnym jest ona nierozpuszczalna w wodzie. Proces kwaszenia mleka (również kapusty czy
ogórków) zachodzi pod wpływem bakterii. Zakwaszenie mleka kwasem, np.
cytrynowym
też
powoduje wytrącenie
kazeiny
, ale w mleku (serwatce) pozostaje niezmieniona
laktoza
.
O
OH
O
H
O
H
O
OH
O
OH
O
H
O
H
OH
wiązanie
ββββ
-glikozydowe
1
4
laktoza
4-O-(
ββββ
-
D
-galaktopiranozylo)-
ββββ
-
D
-glukopiranoza
Podobnie jak dwa poprzednio omówione dicukry
laktoza
jest cukrem redukującym, ulega
mutarotacji
i tworzy glikozydy oraz osazony.
Pytanie
: co to znaczy, że
laktoza
ulega
mutarotacji
? Jak poznać, która składowa
laktozy
ma wolną grupę
glikozydową?
Laktoza
jako składnik mleka ulega w przewodzie pokarmowym enzymatycznej
hydrolizie
do
wolnych cukrów:
D-galaktozy
i
D-glukozy
. U niektórych ludzie, częściej u dorosłych, zdarza się,
ż
e nie mają oni enzymu koniecznego do tej hydrolizy i dla nich mleko słodkie jest szkodliwe.
Mleko naturalnie skwaszone i wyroby z niego (np. twarożek) nie zawierają
laktozy
i mogą być
spożywane przez osoby uczulone na nią.
21
Cukrem, z którym najczęściej spotykamy się w życiu codziennym jest
cukroza
, zwana też
sacharozą
. Pozyskuje się ją w wielkości wielu milionów ton rocznie z trzciny cukrowej (w
krajach tropikalnych) i z buraków cukrowych (w strefie umiarkowanej). Cząsteczka
cukrozy
składa się
D-glukozy
i
D-fruktozy
, które są połączone z sobą w sposób
ββββ
-1-
αααα
-2. W tak
połączonych cząsteczkach cukrów obie grupy glikozydowe są zablokowane, uczestniczą bowiem
w tworzeniu wiązania glikozydowego, wobec czego
cukroza
jest cukrem nieredukującym, nie
ulega też
mutarotacji
i nie tworzy osazonów.
Cukrozę
można nazwać
2-O-(
α
-D-
glukopiranozylo)-
α
-D-fruktofuranozą
lub
1-O-(
α
-D-fruktofuranozylo)-
α
-D-glukopiranozą
.
O
OH
O
H
O
H
O
O
H
O
H
CH
2
OH
H
OH H
OH
reszta
D
-fruktozy
wiązanie
α
αα
α
-glikozydowe
1
2
HO
CH
2
wiązanie
ββββ
-glikozydowe
reszta
D
-glukozy
cukroza
(sacharoza)
1-O-(
ββββ
-D-fruktofuranozylo)-
α
αα
α
-D-glukopiranoza
lub
2-O-(
α
αα
α
-D-glukopiranozylo)-
ββββ
-D-fruktofuranoza
Cukroza
zhydrolizowana składem przypomina miód (zawiera w podobnych ilościach D-glukozę i
D-fruktozę. Taki hydrolizat nosi nazwę sztucznego miodu, lub cukru konwertowanego.
POLICUKRY
Policukry są bardzo rozpowszechnione w przyrodzie.
Celuloza
stanowi 50% suchej masy
drewna, a nawet 90% surowej bawełny. W suchych liściach jej zawartość dochodzi do 20%. Pod
względem chemicznym jest liniowym polimerem
D-glukozy
, przy czym stopień polimeryzacji
(n) w zależności od źródła waha się kilkuset do kilkanaście tysięcy. Powtarzającą się jednostkę w
łańcuchu
celulozy
jest dicukier –
celobioza
. Reszty
glukozy
powiązane są z sobą wiązaniem
glikozydowym
ββββ
-1,4.
Celuloza
stanowi materiał budulcowy szkieletu wielu roślin. Jest
powszechnie wykorzystywana przez ludzi, do wytwarzania naturalnych włókien (bawełnianych),
do przetwarzania na papier,
nitrocelulozę
,
acetylocelulozę
,
karboksycelulozę
i włókna
syntetyczne, tzw. wiskozowe.
Skrobia
jest także polimerem
glukozy
, z tym że monomery w niej powiązane są głównie
wiązaniami glikozydowymi
αααα
-1,4. Nie jest to substancja jednorodna, bowiem składa się
amylozy
i a
mylopektyny
.
Amyloza
jest polimerem liniowym tworzącym połączone w pęczki spiralne
łańcuchy.
Amylopeptyna
jest polimerem rozgałęzionym. Boczne łańcuchy oligomerowe są
dołączone do głównego łańcucha wiązaniami
αααα
-1,6.
Policukrami są także roślinne: pektyny, gumy, dekstrany oraz zwierzęce:
glikogen
czy
chityna
.
Glikogen
ma podobną strukturę jak
skrobia
i pełni rolę magazynu energii chemicznej zwierząt, a
chityna
, polimer
N-acetyloglukozoaminy
, tworzy mechaniczną osłonę miękkich części owadów i
skorupiaków.
Wyszukiwarka
Podobne podstrony:
11 Stereochemia i podstawowa nomenklatura sacharydów i polisacharydów
Oznaczenie zawartości sacharydów, Technologia żywnosci i Żywienie człowieka, 4 SEMESTR, Analiza żywn
sacharydy rola, podział, zawartośc w produktach spożywczych
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
sacharyd, chemia
8 sacharydy
Kinetyka reakcji inwersji sacharozy
''Wybrane zagadnienia z chemii sacharydów'' (''Chemia w szkole'' 5 2007 r )
Chemia 5 11 2010 Sacharydy
Analiza żywności Oznaczanie zawartości sacharydów
sprawozdanie sacharozapop
9 szybkość inwersji sacharozy
Bryjak, inżynieria bioreaktorów L, reakcja hydrolizy sacharozy katalizowana przez inwertazę
Biol cukrowce początek I kl, SACHARYDY ( CUKROWCE )
biochemia VI a, Temat: Reakcje charakterystyczne sacharydów
sprawozdanie oznaczanie sacharydów, TŻ UR, II rok, Analiza i ocena jakości żywności
więcej podobnych podstron