
WYKŁAD 8
• Rozpuszczalność ciał stałych w cieczach
• Kinetyka procesu rozpuszczania
• Badanie szybkości rozpuszczania leków
Zakład Farmakokinetyki i Farmacji Fizycznej CMUJ,
2004
Rozpuszczalno
Rozpuszczalno
ść ciał stałych w cieczach
ść ciał stałych w cieczach
Rozpuszczalno
Rozpuszczalno
ść
ść
wyra
wyra
ż
ż
amy poprzez ilo
amy poprzez ilo
ść
ść
gram
gram
ó
ó
w
w
substancji rozpuszczonej w 100 gramach
substancji rozpuszczonej w 100 gramach
rozpuszczalnika w stanie nasycenia roztworu w danej
rozpuszczalnika w stanie nasycenia roztworu w danej
temperaturze.
temperaturze.
Zale
Zale
ży od:
ży od:
•
rodzaju ciała stałego i rodzaju użytego
rodzaju ciała stałego i rodzaju użytego
rozpuszczalnika
rozpuszczalnika
(similia similibus solvuntur)
(similia similibus solvuntur)
•
temperatury
temperatury
S
S
2
2
i S
i S
1
1
– rozpuszczalność ciała stałego w temperaturze T
– rozpuszczalność ciała stałego w temperaturze T
2
2
i
i
T
T
1
1
H
H
rozp.
rozp.
– ciepło rozpuszczania w stanie nasycenia roztworu
– ciepło rozpuszczania w stanie nasycenia roztworu
2
1
1
2
rozp.
1
2
T
T
T
T
R
ΔH
S
S
ln

Właściwości rozpuszczalników polarnych
• duża stała dielektryczna
• zdolność do solwatacji jonów i innych polarnych cząstek substancji
rozpuszczonych (oddziaływania typu jon-dipol, dipol-dipol, tworze-
nie wiązań wodorowych
• charakter amfiprotyczny (tworzenie jonów z cząsteczki związku
o budowie atomowej np. rozpuszczanie HCL w wodzie)
W rozpuszczalnikach niepolarnych substancja rozpuszczona jest
związana z rozpuszczalnikiem za pomocą sił van der Waalsa
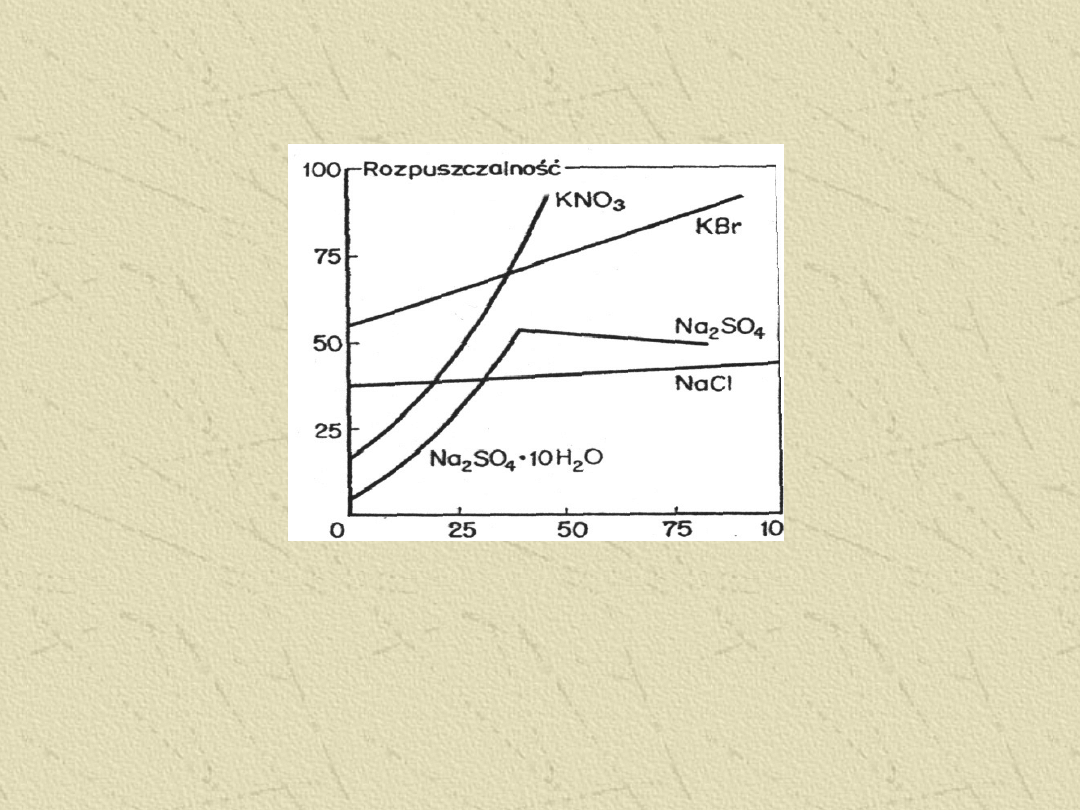
Rozpuszczalno
Rozpuszczalno
ść niektórych ciał stałych w zależności od temperatury
ść niektórych ciał stałych w zależności od temperatury
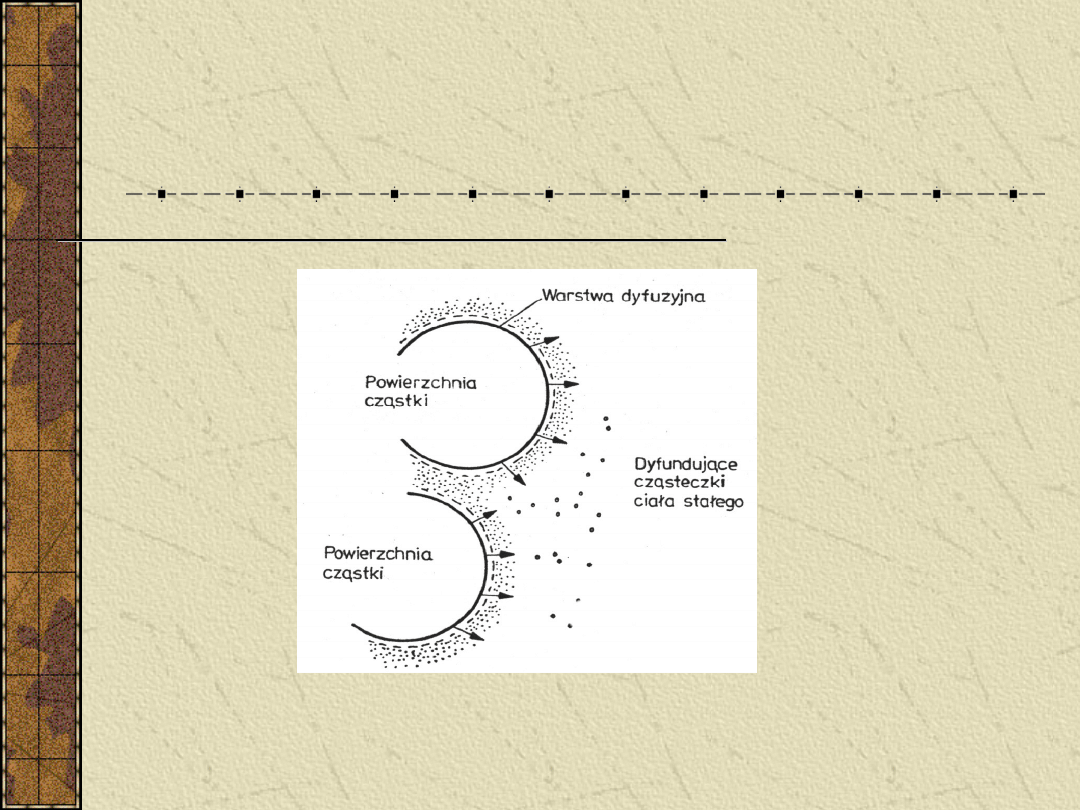
Kinetyka procesu rozpuszczania cia
Kinetyka procesu rozpuszczania cia
ł stałych w cieczy
ł stałych w cieczy
Model warstwy dyfuzyjnej (Higuchiego)
Model warstwy dyfuzyjnej (Higuchiego)
Schemat rozpuszczania ciała stałego

Szybko
Szybko
ść rozpuszczania ciała stałego w cieczy
ść rozpuszczania ciała stałego w cieczy
można opisać w oparciu o prawo dyfuzji Ficka
można opisać w oparciu o prawo dyfuzji Ficka
zmodyfikowane w następujący sposób (Noyes i
zmodyfikowane w następujący sposób (Noyes i
Whitney, 1897 r.):
Whitney, 1897 r.):
C)
(C
h
V
S
D
K
dt
dC
s
dC/dt – szybkość rozpuszczania ciała stałego
K – współczynnik proporcjonalności
D – współczynnik dyfuzji (zależy m. in. od rodzaju substancji rozpuszczonej
i rozpuszczalnika, jego lepkości i temperatury)
S – powierzchnia kontaktu fazy stałej i ciekłej
V – objętość roztworu
h – grubość warstwy dyfuzyjnej
C
s
– stężenie roztworu nasyconego (rozpuszczalność substancji w danym
rozpuszczalniku)
C - stężenie roztworu w chwili t
Zwiększenie dC/dt może nastąpić w wyniku zmiany D pod wpływem
wzrostu temperatury i zmniejszania h przez mieszanie układu.

dt
dc
DS
dt
dn
r
N
RT
D
6
1
Prawo Ficka
Prawo Ficka

R
R
ównanie słuszne gdy:
ównanie słuszne gdy:
•
szybko
szybkość rozpuszczania jest kontrolowana jedynie procesem dyfuzji cząsteczek
w warstwie dyfuzyjnej
• grubość tej warstwy jest jednakowa dla wszystkich cząsteczek fazy stałej
• kształt tych cząstek jest w przybliżeniu kulisty
• zmiany stężenia substancji rozpuszczonej w całym roztworze są niewielkie

W określonych warunkach rozpuszczania, w których D, V i h są stałe otrzymamy:
gdzie: k’ – współczynnik proporcjonalności równy K·D/V · h
C)
(C
S
k
dt
dC
s
,
s
,
C
S
k
dt
dC
Jeśli C
s
>>C to:
Wynika stąd, że zmianę szybkości rozpuszczania można uzyskać przez:
1)
zmianę stopnia rozdrobnienia ciała stałego
2)
dobór odpowiedniej formy fizycznej ciała rozpuszczonego
3)
buforowanie całego roztworu lub tylko warstwy dyfuzyjnej

Jeśli S
pH
=C
s
i S
0
=
C
0
to dla kwasów:
a dla zasad:
]
O
[H
C
K
C
C
3
0
a
0
s
a
0
3
0
s
K
C
]
O
[H
C
C
)
]
O
[H
K
(1
C
S
k
dt
dC
3
a
0
,
)
K
]
O
[H
(1
C
S
k
dt
dC
a
3
0
,
Podstawiając do równania na szybkość rozpuszczania te wyrażenia
otrzymamy:
dla kwasów
dla zasad

S
S
pH
pH
=S
=S
0
0
+S
+S
i
i
]
O
[H
]
HA
[
K
A
3
a
Zak
Zak
ładając, że S
ładając, że S
0
0
=[HA] i S
=[HA] i S
i
i
=[A
=[A
-
-
]
]
)
]
O
[H
K
(
S
S
3
a
0
pH
1
)
(
S
S
a
pK
pH
0
pH
10
1
)
(
S
S
pH
pK
0
pH
a
10
1
dla kwas
dla kwas
ó
ó
w
w
dla zasad
dla zasad
S
S
pH
pH
– rozpuszczalno
– rozpuszczalno
ść
ść
zwi
zwi
ą
ą
zku przy danym pH
zku przy danym pH
S
S
0
0
- rozpuszczalno
- rozpuszczalno
ść
ść
kwasu, gdy pH d
kwasu, gdy pH d
ą
ą
zy do zera lub zasad gdy pH d
zy do zera lub zasad gdy pH d
ą
ą
zy do 14
zy do 14
Stałe cząstki
leku
lek
we
krwi
rozpuszczanie
wchłanianie
lek
w
roztworze
Preparat Sta
Preparat Sta
ła szybkości Stężenie (mg/l) po czasie
ła szybkości Stężenie (mg/l) po czasie
rozpuszczania 0.5 h 1 h 2 h
rozpuszczania 0.5 h 1 h 2 h
(min
(min
-1
-1
)
)
A
A
0.144
0.144
0.43 1.09 1.80
0.43 1.09 1.80
B
B
0.021
0.021
0.27 0.78 1.28
0.27 0.78 1.28
C
C
0.006
0.006
0.19 0.57 1.14
0.19 0.57 1.14
D
D
0.003
0.003
0.08 0.29 0.76
0.08 0.29 0.76
Zale
Zale
żność między szbkością rozpuszczania
żność między szbkością rozpuszczania
tetracy- kliny
tetracy- kliny
in vitro
in vitro
a jej stężeniem we krwi
a jej stężeniem we krwi
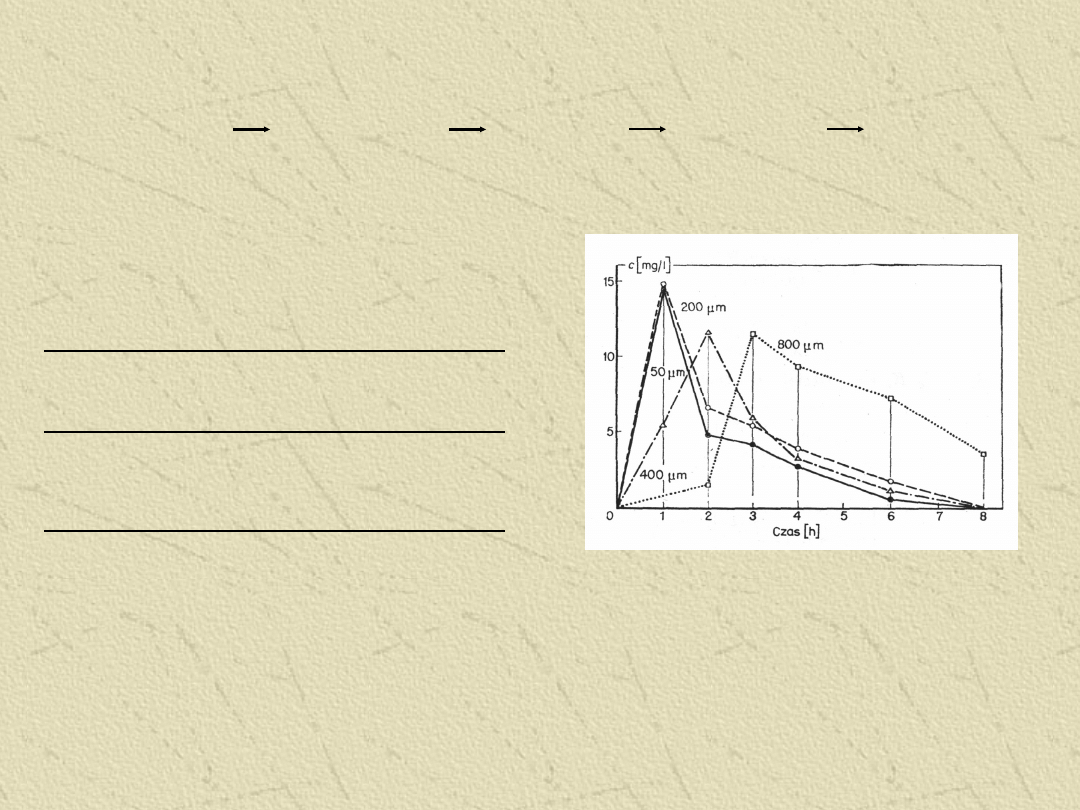
Wp
Wp
ływ rozdrobnienia cząstek
ływ rozdrobnienia cząstek
chloramfenikolu na jego stężenie we krwi
chloramfenikolu na jego stężenie we krwi
królików
królików
BADANIE SZYBKO
BADANIE SZYBKO
ŚCI ROZPUSZCZANIA LEKÓW
ŚCI ROZPUSZCZANIA LEKÓW
opiera się na oznaczaniu ilości substancji rozpuszczonej
w czasie
k’’ – współczynnik proporcjonalności
A
- całkowita ilość substancji rozpuszczonej
A - ilość rozpuszczona w czasie t
(A
-A) - ilość nierozpuszczonej substancji
w tym samym czasie
K=k’·C
s
·k’’
Po scałkowaniu w przedziale od 0 do t:
pozorna stała szybkości
rozpuszczania
A
1
, A
2
– ilości substancji rozpuszczonej odpowiednio
po czasie t
1
i t
2
S = k’’(A
- A)
A)
(A
,
,
k
C
,
k
dt
dA
s
A)
(A
K
dt
dA
Kt
lnA
A)
ln(A
1
2
2
1
t
t
)
A
ln(A
)
A
ln(A
K
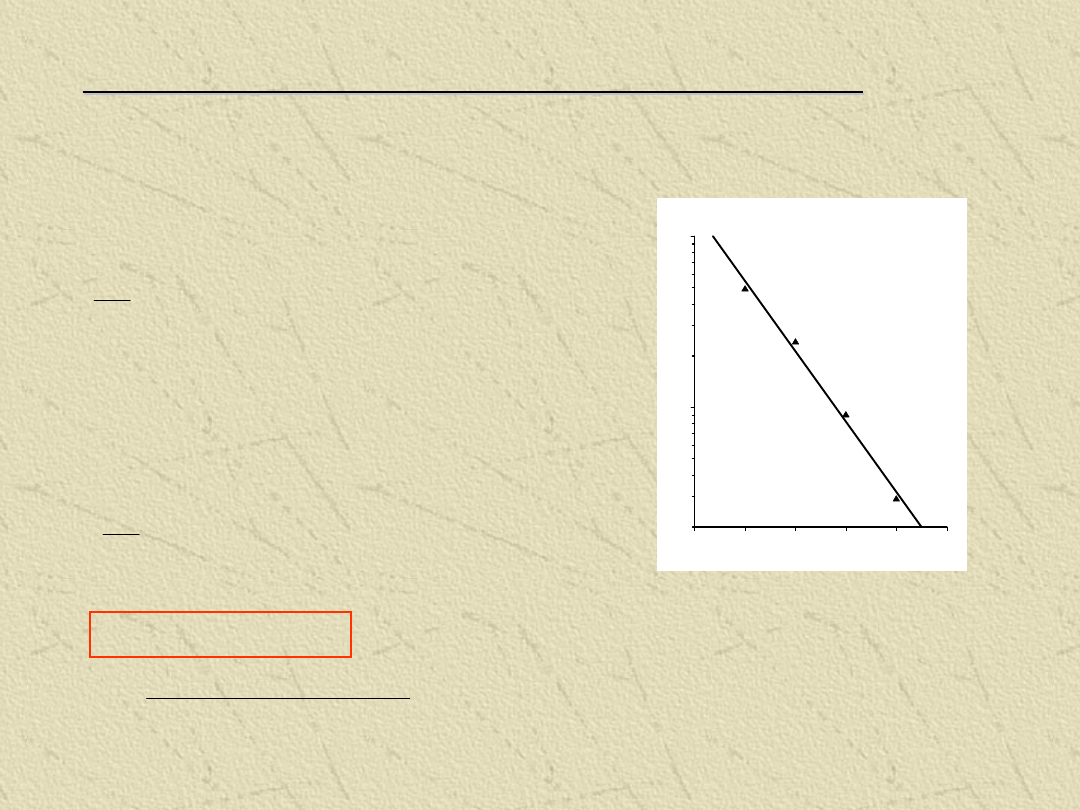
Wykres zmian ilo
Wykres zmian ilości nierozpuszczonego
kwasu acetylosalicylowego (mg) od czasu
Czas (min)
0
1
2
3
4
5
10
100
Il
o
Il
o
ść
(
A
ść
(
A
-A
-A
)
)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
chfwyklad 2
chfwyklad 4
chfwyklad 3
chfwyklad 7
chfwyklad 2
więcej podobnych podstron