1
Trzecia zasada
termodynamiki
Waldemar Ufnalski
Wprowadzenie do termodynamiki
chemicznej
Wykład 5
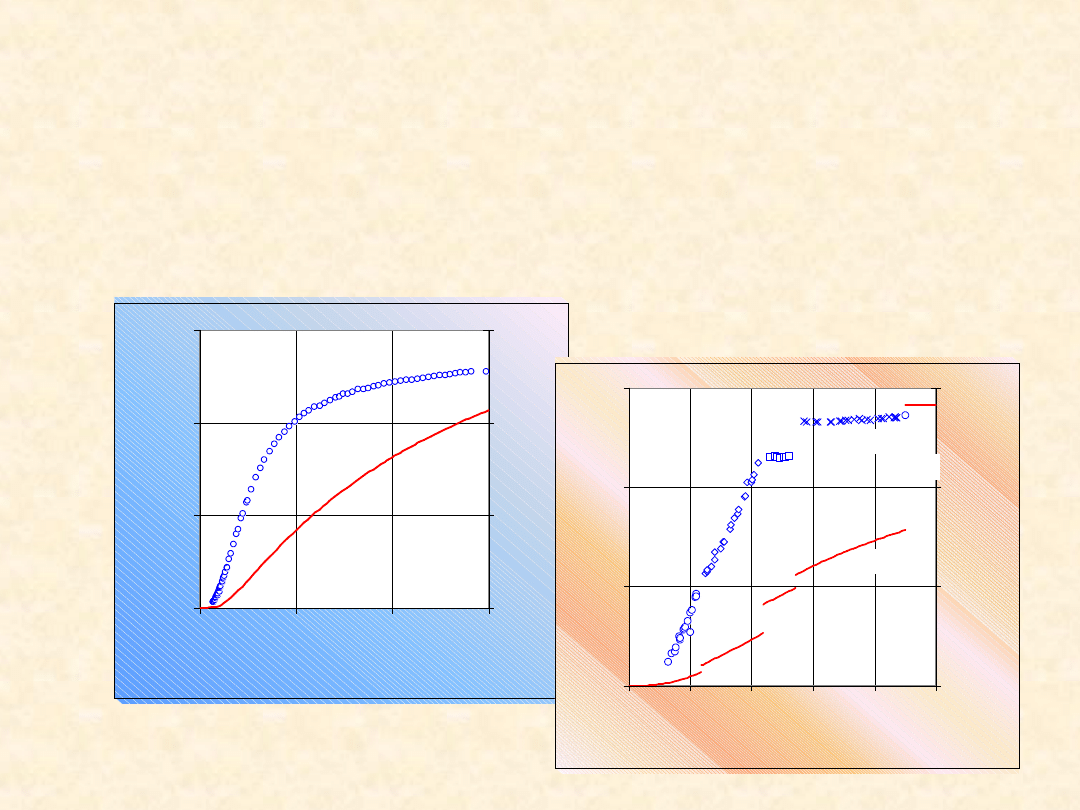
0
10
20
30
0
100
200
300
T/K
C
p
/(
J/
m
o
l
K
)
0
20
40
60
S
/(
J/
m
o
l
K
)
1
2
0
20
40
60
0
20
40
60
80
100
T/K
C
p
/(
J/
m
o
l
K
)
0
60
120
180
S
/(
J/
m
o
l
K
)
1
2
ciecz
gaz

2
5.1. Sformułowanie i
uzasadnienie trzeciej
zasady termodynamiki
Wykład 5

3
W. Nernst (1906) na podstawie badań
efektów ener- getycznych przemian w
niskich temperaturach...
W temperaturze zera bezwzględnego
entropia każ- dej substancji czystej w stanie
kryształu doskona- łego jest równa zeru.
Kryształ doskonały - kryształ nie zawierający
defek- tów sieciowych, zbudowanego z drobin
zorientowa- nych względem siebie w sposób
zapewniający mini- mum energii wewnętrznej.
0
0
T
T
S
lim

4
Uzasadnienie na podstawie postulatu
Boltzmanna...
Temperatura dostatecznie wysoka
(duży zasób
ener- gii)
gaz
swoboda translacji
(znikomy
odstęp między poziomami kwantowymi)
dostępna duża liczba poziomów kwantowych
bardzo duża róż- norodność podziału energii
duża entropia.
P - liczba różnych sposobów
podziału energii między drobiny.
P
k
S
B
ln
Temperatura maleje
zmniejsza się zasób
energii
maleje liczba sposobów jej podziału
między dro- biny
maleje entropia.

5
Uzasadnienie na podstawie postulatu
Boltzmanna...
Obniżanie temperatury
przemiany fazowe
(skro- plenie gazu, krzepnięcie cieczy)
procesy egzo- energetyczne
( U < 0)
maleje zasób energii
skokowo maleje
entropia.
Obniżanie temperatury kryształu
maleje
zasób energii oscylacyjnej
T 0K
U dąży
energii stanu podstawowego
jeden
sposób podziału
(wszystkie drobiny w
podstawowym stanie kwantowym)
entropia
S(T = 0 K) = 0 (!).

6
5.2. Zakres
stosowalności trzeciej
zasady termodynamiki
Wykład 5

7
W miarę obniżania temperatury stan
wielu (więk -szości !) substancji
czystych chemiczne nie zbliża się do
stanu kryształu doskonałego...
•Izotopia.
Pierwiastki stanowią
mieszaninę izoto- pów
substancja
prosta jest w sensie termody- namicznym
"roztworem”.
Naturalny chlor zawiera izotopy
35
Cl oraz
37
Cl,
„czysty” dichlor składa się z drobin
35
Cl
35
Cl,
37
Cl
37
Cl oraz
35
Cl
37
Cl
różne
masy, momenty bezwładności
i spiny
jądrowe
różne poziomy energetyczne
różny podział energii
różna entropia.

8
W miarę obniżania temperatury stan
wielu (więk -szości !) substancji
czystych chemiczne nie zbliża się do
stanu kryształu doskonałego...
• Spiny jąder atomów
różne wzajemne położenie
w drobinie
najprostszy przypadek H
2
.
E
para
< E
orto
. W T >> 0
współistnieją obie formy
„roztwór”. Przemiana
H
2(orto)
H
2(para)
ma zahamowania kinetyczne.
W T = 0 pozostaje „zamrożony”
krysz- tał zawierający obie formy
roztwór
S(T = 0 K) > 0 (!).
orto
-
para
-

9
W miarę obniżania temperatury stan
wielu (większości !) substancji czystych
chemiczne nie zbliża się do stanu
kryształu doskonałego...
•
Szkliwa.
Kryształ pod danym ciśnieniem, ma
ściśle określoną temperaturę topnienia, w
której ciecz powinna ulec krystalizacji.
Proces krystalizacji może mieć duże
zahamowania kinetyczne
ciecz można
ochłodzić do T < T
top
(stan cieczy
przechłodzonej).
W T << T
top
wzrasta lepkość
stan szklisty
(pozor- nie faza stała jednak
brak uporządkowanej sieci krystalicznej)
S
szkliwo
(T = 0 K) > 0 (!).

10
W miarę obniżania temperatury stan
wielu (większości !) substancji czystych
chemiczne nie zbliża się do stanu
kryształu doskonałego...
Inne przyczyny - ogólnie „zamrożenie
nieuprządkowania”...
•momentów magnetycznych drobin
•momentów dipolowych drobin
•defekty sieciowe...
Trzecia zasada termodynamiki odnosi się raczej
do fikcyjnego kryształu doskonałego niż do
rzeczywis- tych substancji
podważa to uznanie
postulatu Nernsta za zasadę termodynamiki.

11
Między duchem a materią
pośredniczy matematyka.
Hugo Steinhaus (1887 –1972)
wybitny matematyk polski
.
Document Outline
Wyszukiwarka
Podobne podstrony:
5 DRUGA I TRZECIA ZASADA TERMODYNAMIKI
TERMODYNAMIKA , 0 zasada termody: dwa cjała A i B są w ruwnowadze termicznej jeśli każde z nich jest
skaner zasada dzialania1
Erhard trzecia droga
Wykład Ch F I zasada
F 1 Zasada działania tranzystora bipolarnego
08 Zasada zachowania energii
Budowa pojazdów samochodowych -Zasada działania silnika dwusuwowego semestr 1, Motoryzacja
Z tajnych archiwów - Trzecia bomba atomowa, W ஜ DZIEJE ZIEMI I ŚWIATA, ●txt RZECZY DZIWNE
Zasada subsydiarności w Unii Europejskiej, instytucje i źródła prawa UE
komentarze do testów z przedsiębiorczości, podręczniki szkoła średnia liceum technikum klasa 3 trzec
Zasada PARETO
Weiderowska Zasada Treningu Cyklicznego, Sport
więcej podobnych podstron