
Wykład 8 – WIĄZANIA CHEMICZNE
WIĄZANIA CHEMICZNE
Elektrostatyczny charakter wiązań chemicznych. Rodzaje
wiązań:
jonowe,
kowalencyjne,
metaliczne
i
międzycząsteczkowe. Zarys Teorii Orbitali Molekularnych
(LCAO) – orbitale σ i π wiążące, antywiążące, ich względne
energie i kształty (wyprowadzenie graficzne). Struktura
elektronowa cząsteczek dwuatomowych, rząd wiązania.

Wykład 8 – WIĄZANIA CHEMICZNE
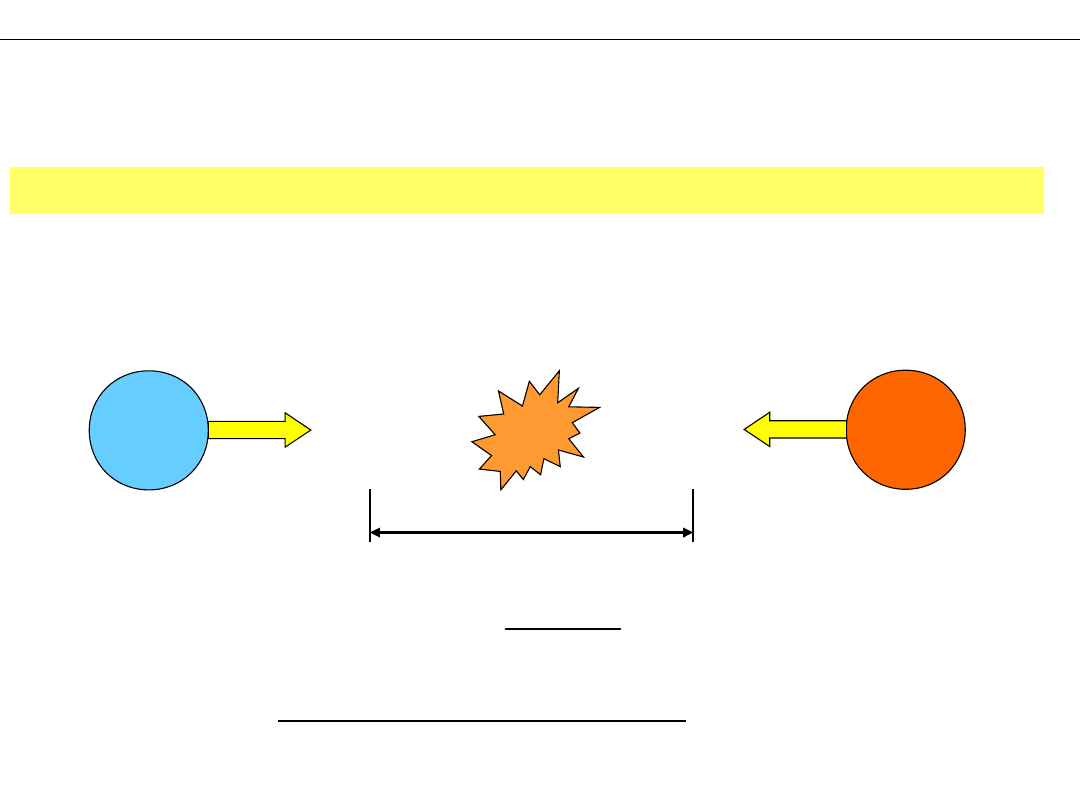
Wiązanie chemiczne:
Co to jest WIĄZANIE CHEMICZNE?
– połączenie pomiędzy atomami w cząsteczce
– mechanizm dzięki któremu atomy mogą łączyć się w cząsteczki
– zjawisko fizyczne odpowiedzialne za
przyciągające oddziaływanie pomiędzy
atomami, zapewniające stabilność związków
chemicznych
– wiązanie chemiczne występuje wtedy, gdy siły
działające pomiędzy atomami prowadzą do
utworzenia skupiska atomów o stabilności
wystarczającej do uznania go za odrębną formę
materii
– połączenie atomów w wyniku wymiany lub
uwspólnienia elektronów
Wykład 8 – WIĄZANIA CHEMICZNE
WIĄZANIE CHEMICZNE MA CHARAKTER ELEKTROSTATYCZNY
MECHANIZM
wiązania chemicznego
Siłą wiążącą atomy jest przyciąganie się różnoimiennych ładunków elektrycznych
r
Siła Coulomba
2
2
1
r
Q
Q
C
F
Istnieje kilka rodzajów wiązań chemicznych, różniących się
przestrzennym rozkładem ładunków odpowiedzialnych za
powstanie siły wiążącej.
–
Q
2
+
Q
1
F
2
C
r
e
Z
C
F
Wykład 8 – WIĄZANIA CHEMICZNE
WIĄZANIE JONOWE – przyciąganie się różnoimiennych
jonów, powstałych w wyniku
wymiany elektronów pomiędzy
atomami
RODZAJE WIĄZAŃ CHEMICZNYCH
9+
–
–
–
–
–
–
–
–
–
–
3+
–
Li
F
–
Bilans
ładunków:
0
0
–1
+1
JONY:
Li
+
F
–
Powstanie jonów
F
1
F
2
Wniosek:
Jądro fluoru (9+) mocniej
przyciąga elektron niż jądro litu
(3+); mniejsza odległość,
większy ładunek dodatni
Li
F
Porównanie sił F
1
i F
2
:
Wykład 8 – WIĄZANIA CHEMICZNE
WIĄZANIE
J
O
N
O
W
E
+
–
Schemat wiązania jonowego
Utworzenie wiązania
9+
–
–
–
–
–
–
–
–
–
–
3+
–
–
Li
+
F
–
KATION
ANION
NaCl
– związek jonowy
F
Cl
1
2
3
E
J
[kJ/mol]
liczba atomowa
O K R E S Y
Wykład 8 – WIĄZANIA CHEMICZNE
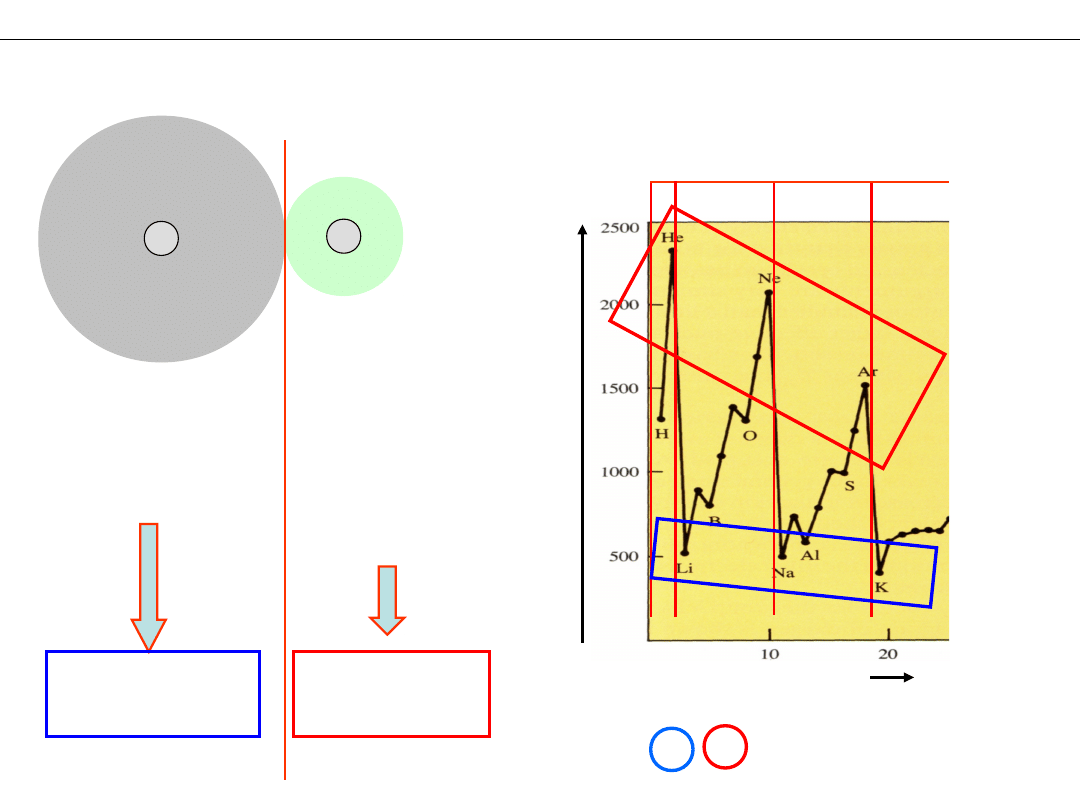
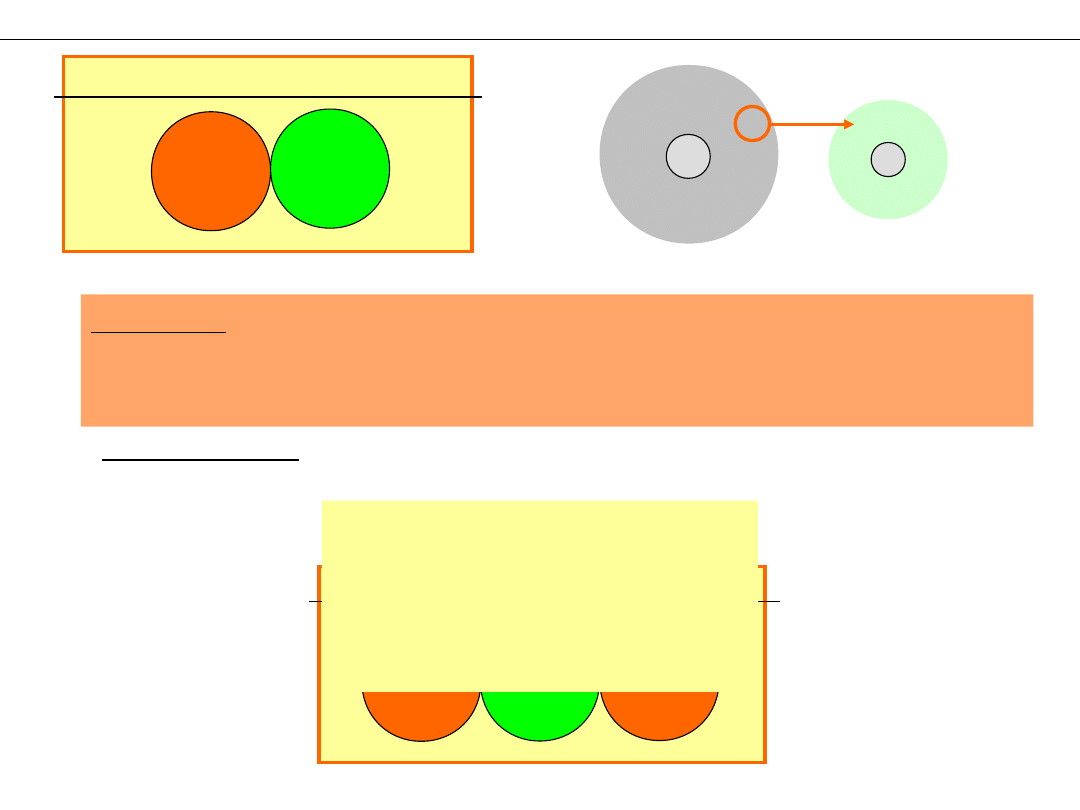
Jakie pierwiastki tworzą przeważnie wiązania jonowe?
9+
–
–
–
–
–
–
–
–
–
–
3+
–
–
Li
F
+
–
Li
- łatwe oddanie
elektronu
mała energia
jonizacji
F
– silne
przyciąganie
elektronu
duża energia
jonizacji
Wykład 8 – WIĄZANIA CHEMICZNE
9+
–
–
–
–
–
–
–
–
–
–
3+
–
–
Problem: Przeniesienie elektronu nie jest możliwe w
przypadku pary jednakowych atomów, a mimo to cząsteczki
H
2
, O
2
,
N
2
,
Cl
2
istnieją!
Rozwiązanie: Inny sposób elektrostatycznego związania
atomów
+
–
+
Schemat wiązania kowalencyjnego
+
–
Schemat wiązania jonowego
WIĄZANIE
KOW
ALE
NCYJ
NE
!
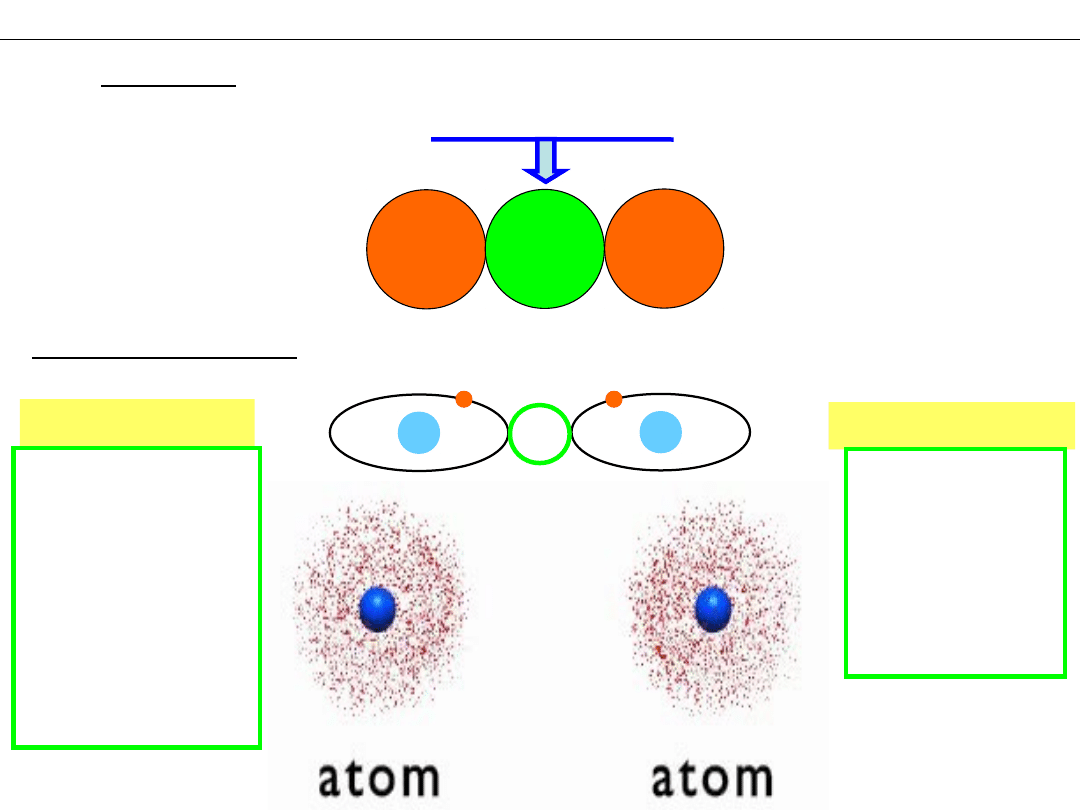
Wykład 8 – WIĄZANIA CHEMICZNE
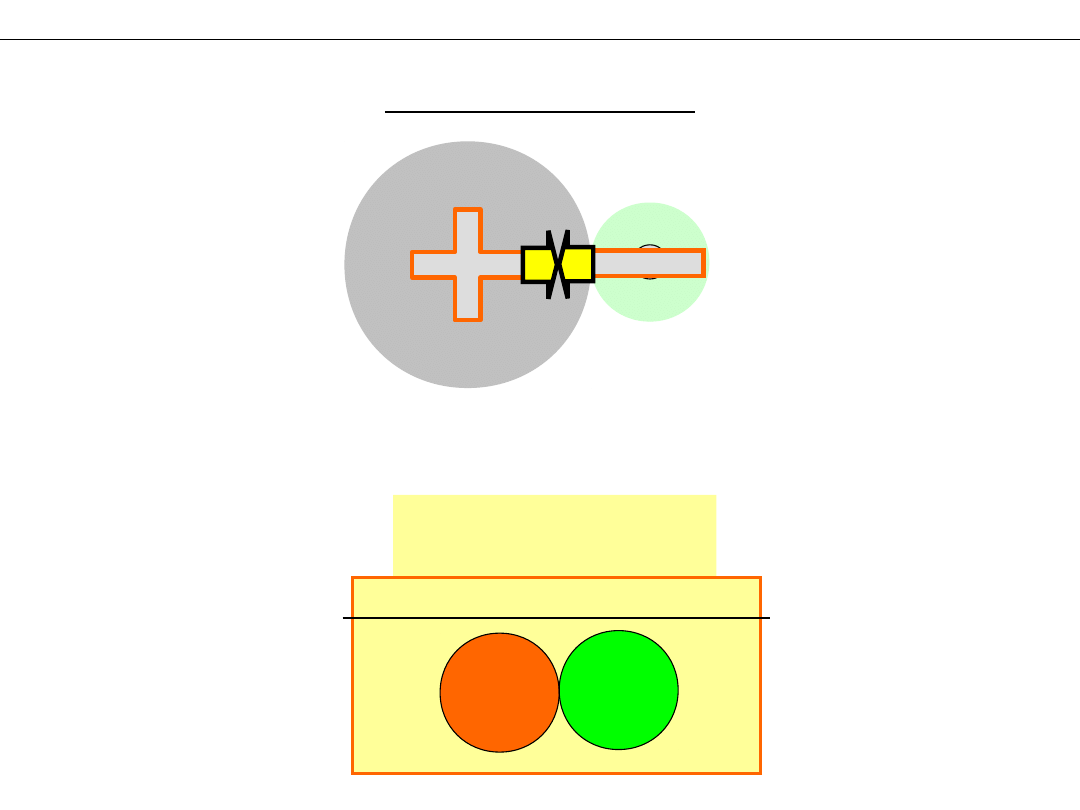
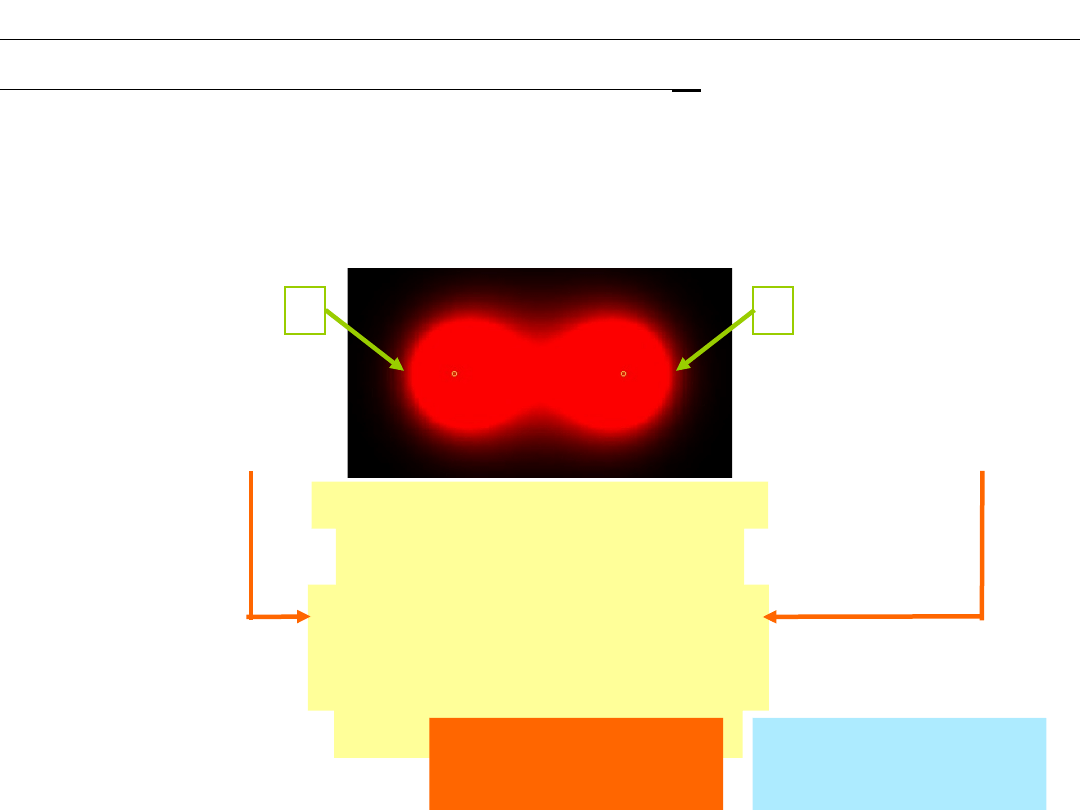
Skąd pochodzi centralny ładunek ujemny?
+
–
+
Cząsteczka
H
2
+
–
+
–
Rozwiązanie - np:
Problem:
Model Bohra
Model falowy
!
Podwyższon
a gęstość
prawdopo-
dobieństwa
znalezienia
elektronu
W tym
obszarze
elektrony
pojawiają się
częściej niż w
pozostałych
rejonach
cząsteczki
– przyciąganie jąder atomowych przez
lokalny ładunek ujemny , powstały w wyniku
częściowego uwspólnienia elektronów wiążących
się atomów.
Wykład 8 – WIĄZANIA CHEMICZNE
Kwantowy opis elektronów w cząsteczce –
Teoria Orbitali Molekularnych
H
A
Ψ
A
Ψ
B
H
B
Orbital cząsteczkowy
Ψ
AB
– jaka to funkcja?
WIĄZANIE KOWALENCYJNE
Wykład 8 – WIĄZANIA CHEMICZNE
Poszukiwanie funkcji falowej opisującej elektron w
cząsteczce.
H
2
Ψ
A
Ψ
B
Ψ
AB
Funkcja (orbital)
Ψ
AB
jako odpowiednie złożenie funkcji
Ψ
A
i
Ψ
B
fragment
podobny do
Ψ
A
Pomysł:
fragment
podobny do
Ψ
B
Linowa Kombinacja orbitali
Ψ
A
i
Ψ
B
Ψ
AB
= c
A
Ψ
A
+ c
B
Ψ
B
Zasada matematyczna:
Ψ
AB
= Ψ
A
+ λ
Ψ
B
lub
gdzie
λ = c
A
/ c
B
– trzeba znaleźć dwie wartości
λ
Wykład 8 – WIĄZANIA CHEMICZNE
– ang. Linear Combination of Atomic Orbitals
– pol. Linowa Kombinacja Orbitali Atomowych
Metoda
LCAO
H
2
Z 2 orbitali
Ψ
A
i
Ψ
B
muszą powstać
2 orbitale
Ψ
AB
Z łączenia n elementów musi powstać n różnych kombinacji
Gęstość prawdopodobieństwa znalezienia elektronu na orbitalu
Ψ
AB
ρ = |Ψ
AB
|
2
= |Ψ
A
+
λΨ
B
|
2
= |Ψ
A
|
2
+ 2λ|Ψ
A
|·|Ψ
B
| + λ
2
|Ψ
B
|
2
Wykład 8 – WIĄZANIA CHEMICZNE
Metoda LCAO – poszukiwanie dwóch wartości
λ
2
1
Ψ
B
= 0
~
Ψ
A
= 0
~
( a + b )
2
= a
2
+ 2ab + b
2
|Ψ
AB
(1)|
2
= |
Ψ
A
|
2
|Ψ
AB
(2)|
2
= λ
2
|
Ψ
B
|
2
|Ψ
AB
(1)|
2
= |
Ψ
AB
(2)|
2
Cząsteczka jest symetryczna
czyli
λ
2
= 1
a stąd
λ
= ±1
Dwa orbitale cząsteczkowe:
Ψ
AB
+
= Ψ
A
+
Ψ
B
Ψ
AB
–
= Ψ
A
–
Ψ
B
|Ψ
A
|
2
= λ
2
|Ψ
B
|
2
=
λ
2
|Ψ
A
|
2
σ
Wykład 8 – WIĄZANIA CHEMICZNE
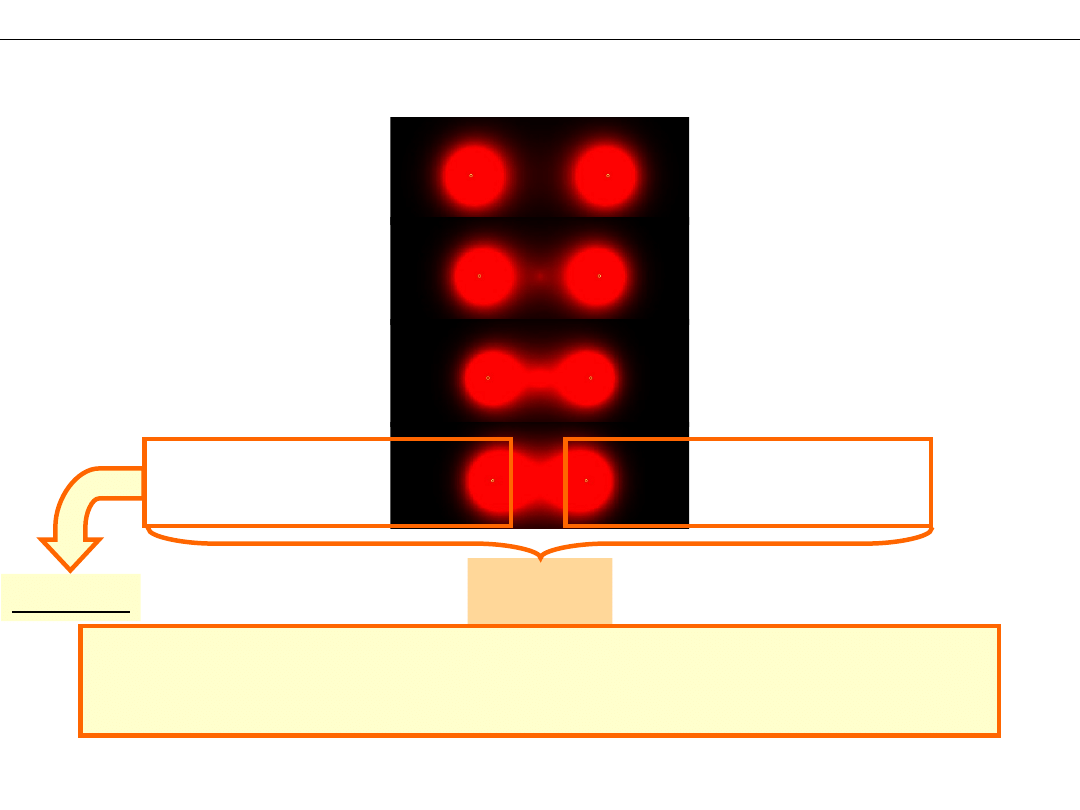
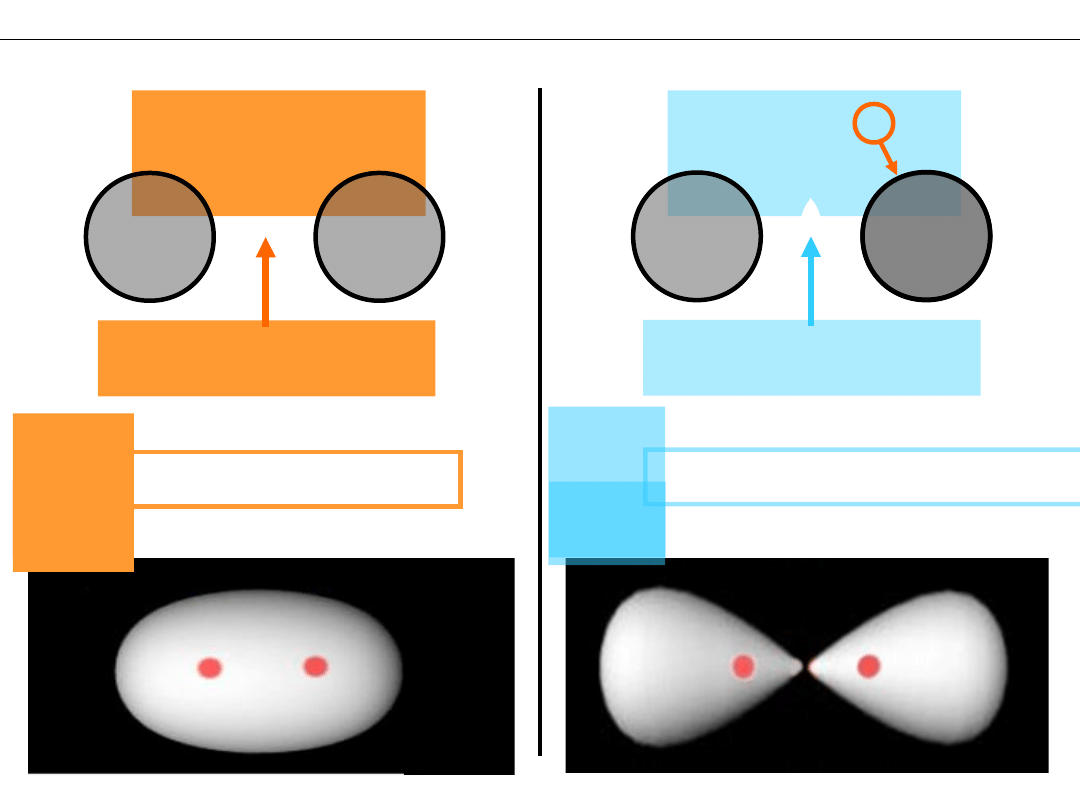
Kształt orbitali (rozkład gęstości elektronowej)
Ψ
AB
+
= Ψ
A
+
Ψ
B
Ψ
AB
–
= Ψ
A
–
Ψ
B
+
+
+
+
–
ZWIĘKSZONA
gęstość elektronowa
ZMNIEJSZONA
gęstość elektronowa
Ψ
A
B
Ψ
A
B
*
Orbital WIĄŻĄCY
Orbital ANTYWIĄŻĄCY
σ*
Wykład 8 – WIĄZANIA CHEMICZNE
ENERGIE orbitali cząsteczkowych
H
AB
Ψ
AB
= E
AB
Ψ
AB
Konkretną funkcję
Ψ
można wstawić do
równania Schrödingera
Ĥ Ψ = E Ψ
i
obliczyć energię
E
,
jaką będzie miał elektron opisany tą funkcją
Przypomnienie
Dla orbitali cząsteczkowych
H
2
H
AB
Ψ
AB
= E
AB
Ψ
AB
*
*
*
WIĄŻĄCY
ANTYWIĄŻĄCY
H
AB
σ
= E
AB
σ
*
H
AB
σ
= E
AB
σ
*
*
Wynik:
E
AB
< E
A
= E
B
Wynik:
E
AB
> E
A
= E
B
*
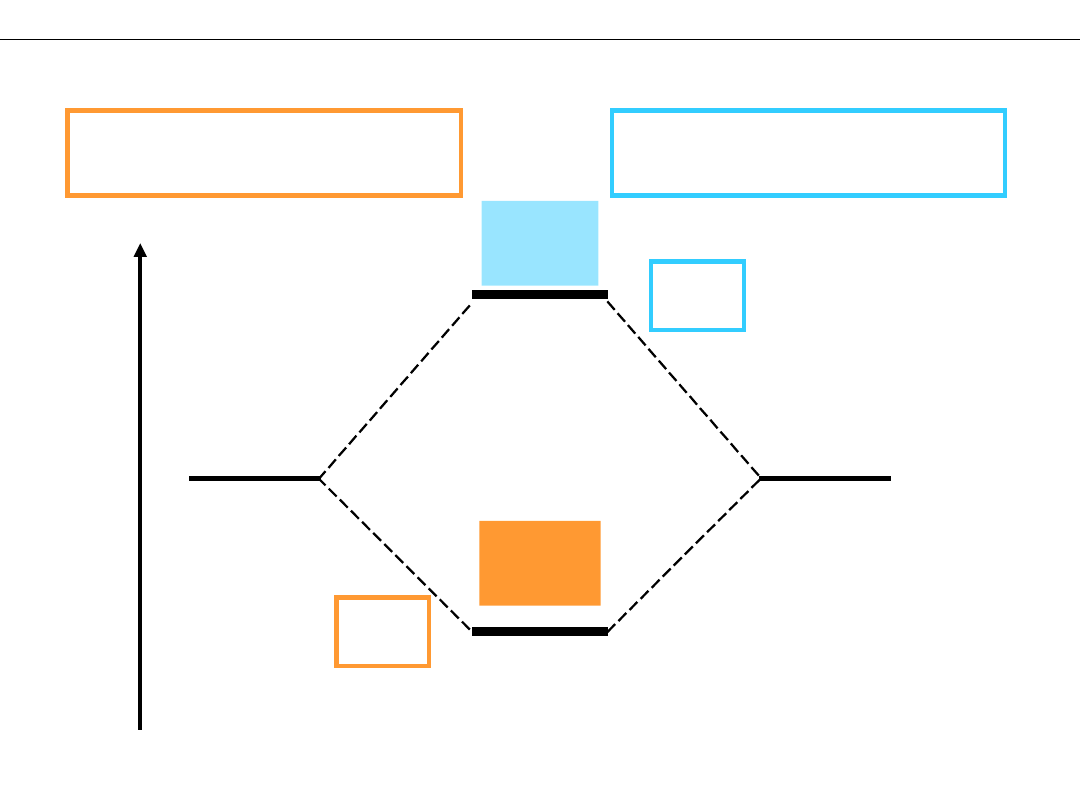
Wykład 8 – WIĄZANIA CHEMICZNE
DIAGRAM ENERGETYCZNY cząsteczki H
2
E
AB
< E
A
= E
B
E
AB
> E
A
= E
B
*
E
H
H
1s
1s
E
AB
E
AB
*
σ
1s
*
σ
1s
H
2
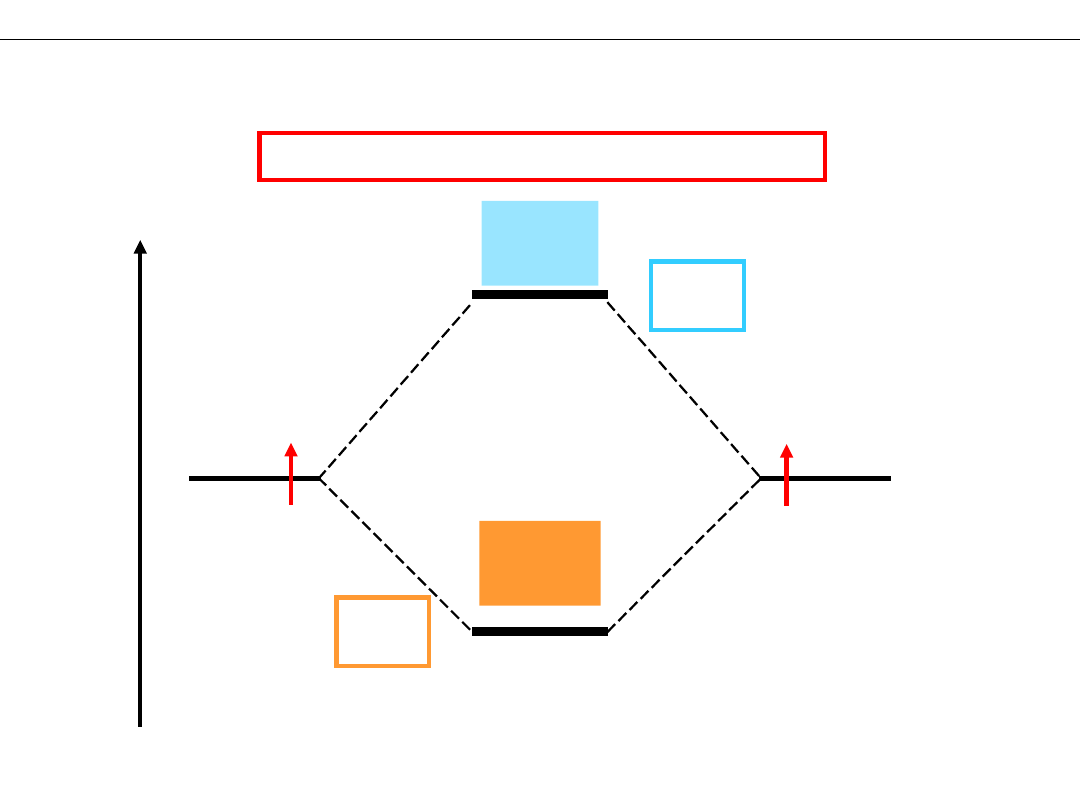
Wykład 8 – WIĄZANIA CHEMICZNE
DIAGRAM ENERGETYCZNY cząsteczki H
2
Obsadzenie orbitali elektronami
E
H
2
H
H
1s
1s
E
AB
E
AB
*
σ
1s
*
σ
1s
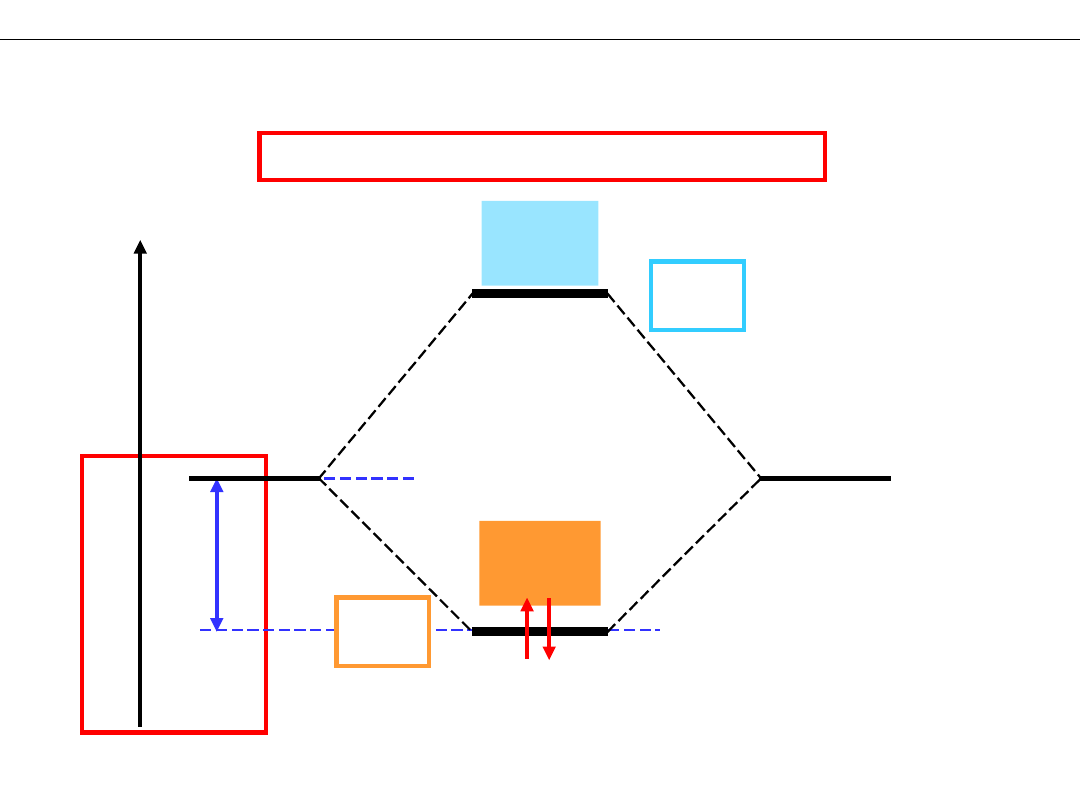
Wykład 8 – WIĄZANIA CHEMICZNE
DIAGRAM ENERGETYCZNY cząsteczki H
2
Obsadzenie orbitali elektronami
2ΔE
obniżenie
energii
układu.
Układ
H
2
jest
bardziej
trwały
od 2H
ΔE
E
1s
H
2
H
H
1s
E
AB
E
AB
*
σ
1s
*
σ
1s
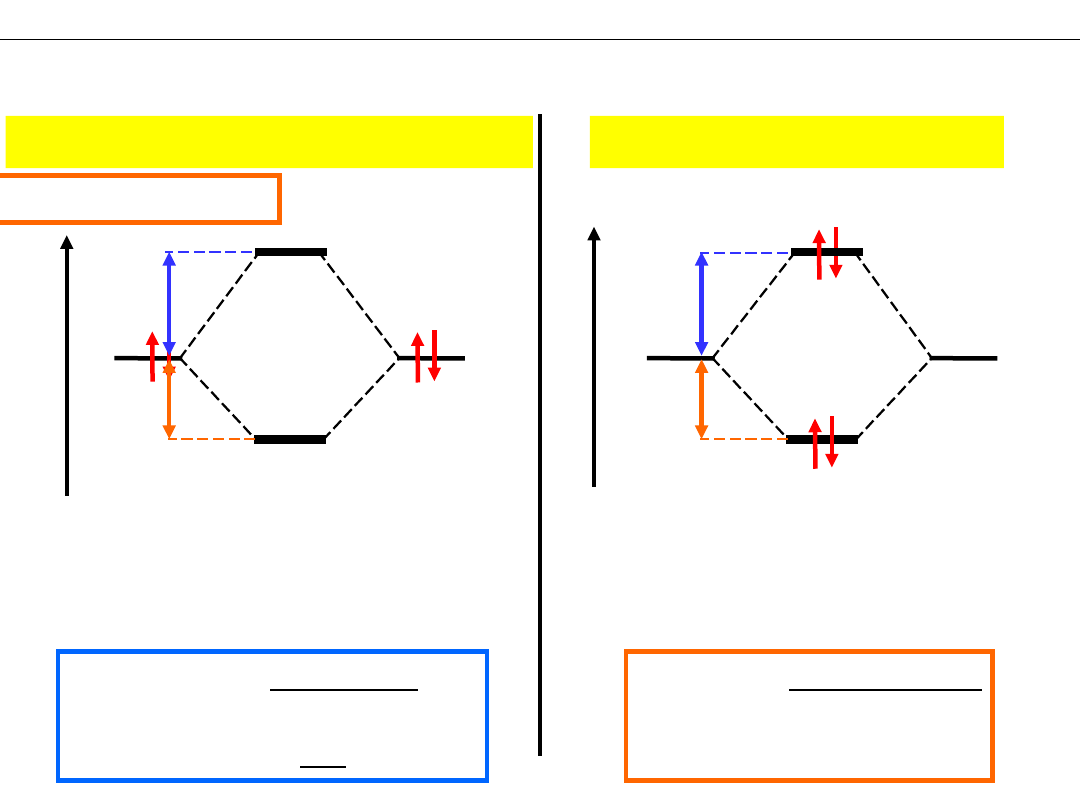
Wykład 8 – WIĄZANIA CHEMICZNE
Przewidywanie trwałości, istnienia cząsteczek dwuatomowych
He
2
He
He
E
1s
1s
σ
1
s
*
σ
1
s
Bilans energii elektronów
+ΔE
*
−2ΔE
+2ΔE
*
> 0
Układ He
2
jest mniej
trwały od 2He ;
cząsteczka He
2
nie istnieje!
Czy może istnieć cząsteczka He
2
?
Czy może istnieć jon He
2
?
+
Bilans energii elektronów
−2ΔE
+ΔE
*
≈ −ΔE
E
He
2
He
He
1s
1s
σ
1
s
*
σ
1
s
−ΔE
+ΔE
*
+
Układ He
2
jest bardziej
trwały od 2He ;
jon He
2
istnieje!
+
+
|
+ΔE
*
| > |
−ΔE
|
−ΔE
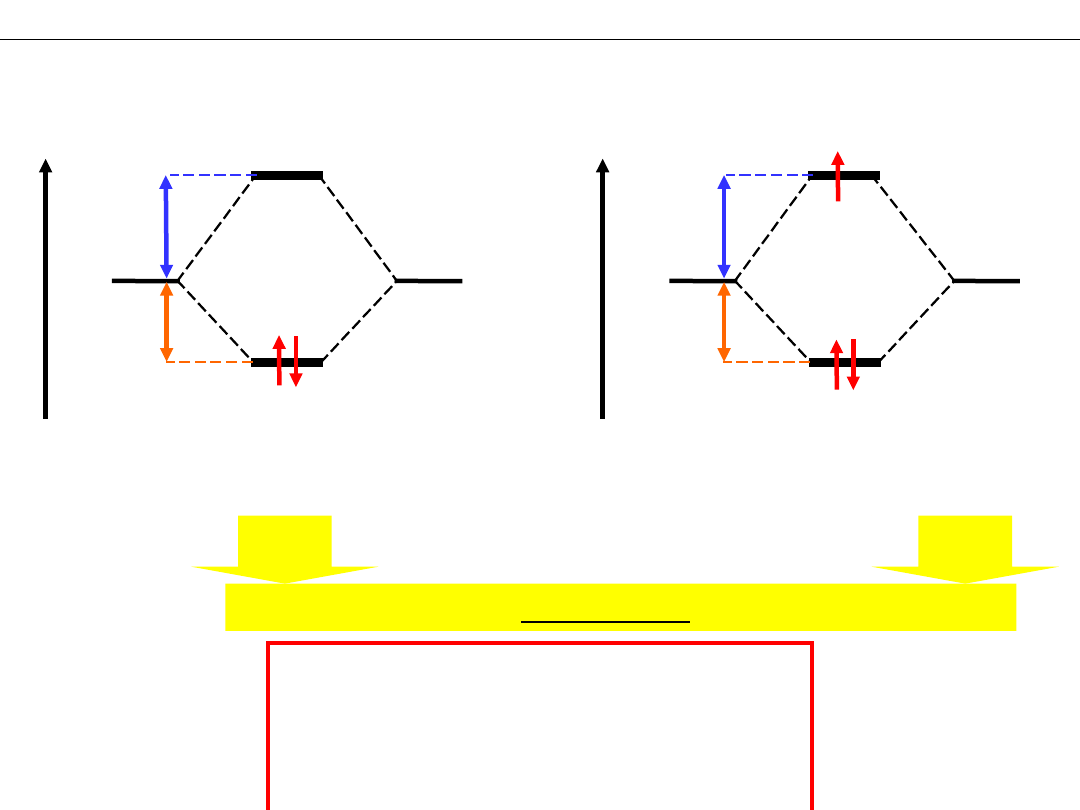
R
W
= ½(Σ
el. wiąż.
– Σ
el.
antywiąż.
)
Wykład 8 – WIĄZANIA CHEMICZNE
Względna moc wiązania chemicznego
Wiązanie H─H jest mocniejsze od wiązania He─He
+
E
H
2
H
H
1s
1s
σ
1
s
*
σ
1
s
Bilans energii elektronów
−ΔE
+ΔE
*
−2ΔE
E
He
2
He
He
1s
1s
σ
1
s
*
σ
1
s
−ΔE
+ΔE
*
Bilans energii elektronów
−2ΔE
+ΔE
≈ −ΔE
+
RZĄD WIĄZANIA
R
W
= ½(2–0)=1
H
2
He
2
R
W
= ½(2–1)=½
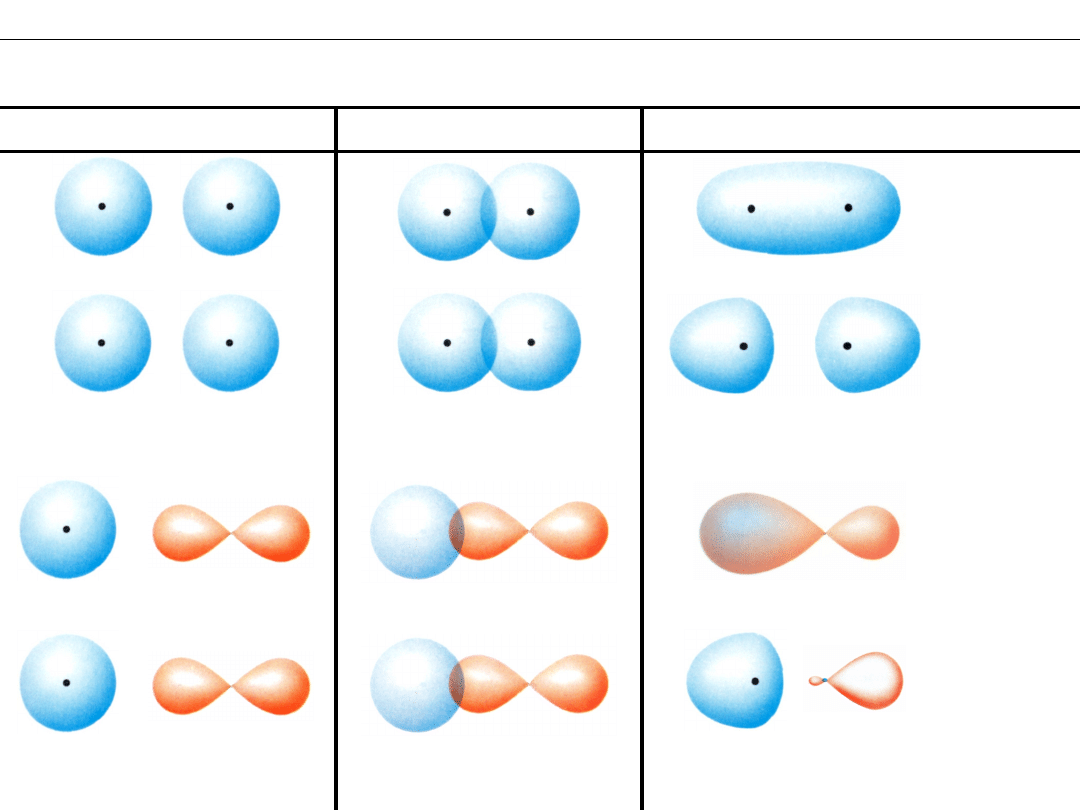
Wykład 8 – WIĄZANIA CHEMICZNE
Orbitale cząsteczkowe z udziałem orbitali
s
i
p
Orbitale CZĄSTECZKOWE
Orbitale ATOMOWE
NAKŁADANIE
+
+
s
+
+
σ
s
s
+
–
+
σ
s
s
*
+
s
–
+
s
s
+
+
–
+
+
s
.
.
–
+
+
σ
s
p
.
+
–
p
+
s
.
.
–
+
+
.
+
–
p
–
+
–
.
.
.
+
+
–
σ
s
p
*
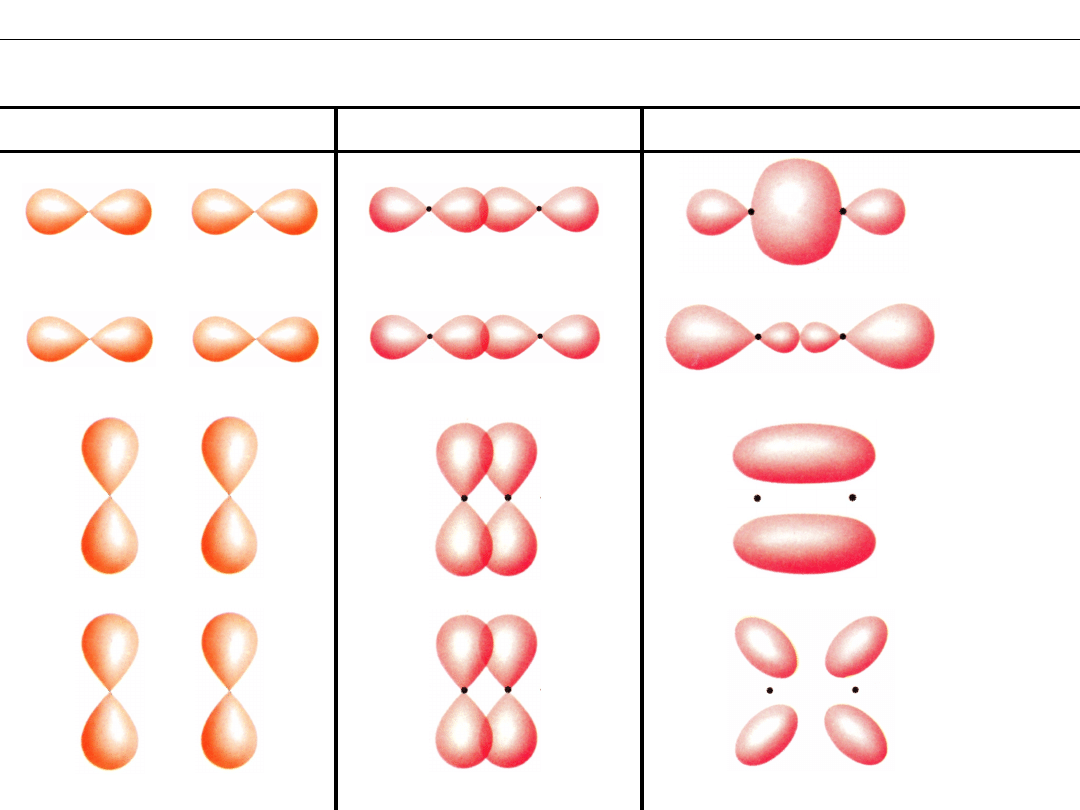
Wykład 8 – WIĄZANIA CHEMICZNE
Orbitale cząsteczkowe z udziałem orbitali
p
Orbitale CZĄSTECZKOWE
Orbitale ATOMOWE
NAKŁADANIE
σ
p
p
σ
p
p
*
+
p
.
+
–
.
+
–
p
+ +
–
–
+
p
.
+
–
.
+
–
p
+
+
–
–
–
+
–
+
–
+
–
–
p
.
+
–
.
+
–
p
p
.
+
–
.
+
–
p
–
+ +
– –
+
–
+ –
– +
+
+
–
–
π
p
p
π
p
p
*
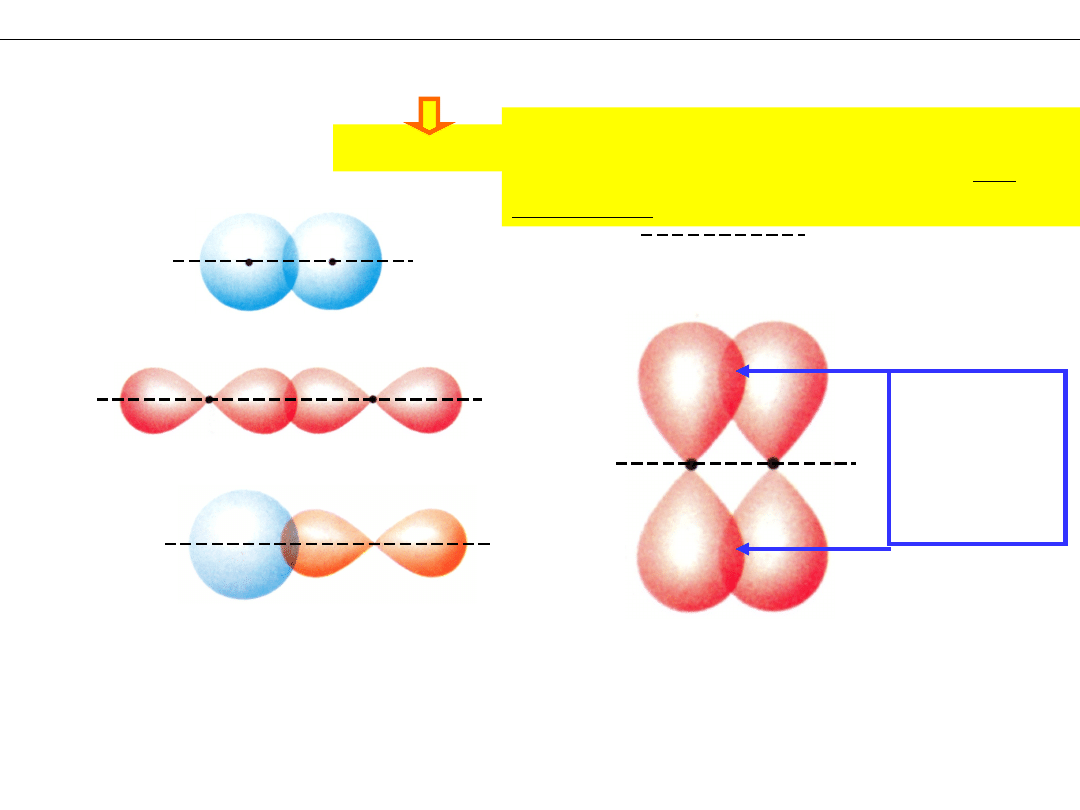
Wykład 8 – WIĄZANIA CHEMICZNE
Wiązania typu
σ
lub
π
σ
– orbitale
nakładają się NA
osi wiązania
π
– orbitale
nakładają się
POZA osią
wiązania
.
.
Kryterium: Położenie obszaru nakładania się
orbitali atomowych względem osi
wiązania.
oś wiązania – linia łącząca jądra
związanych
atomów
DWA
obszary
nakładania
, ale JEDNO
wiązanie
σ
p
p
π
p
p
σ
s
s
σ
s
p
Wykład 8 – WIĄZANIA CHEMICZNE
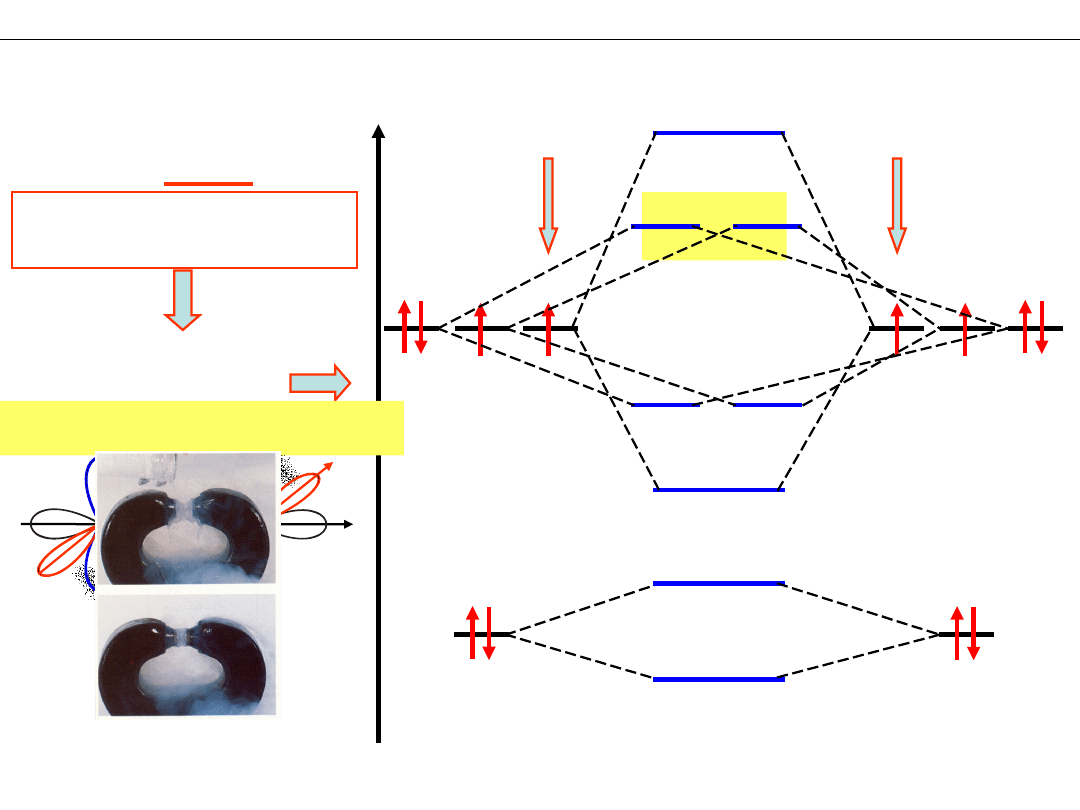
SCHEMAT POZIOMÓW ENERGETYCZNYCH cząsteczki O
2
E
O
2
O
Orbitale atomowe O:
1s
2
2s
2
2p
4
Diagram energetyczny
dla orbitali 2s i 2p
Elektrony zewnętrzne –
biorą udział w wiązaniu
p
x
p
y
p
z
s
p
x
p
y
p
z
s
O
π
x
π
y
σ
σ
*
σ
*
σ
z
p
x
p
y
p
z
p
x
p
y
p
z
π
y
*
π
x
*
S
=1 Paramagnetyzm tlenu
Ciekły tlen pomiędzy
biegunami magnesu
Wykład 8 – WIĄZANIA CHEMICZNE
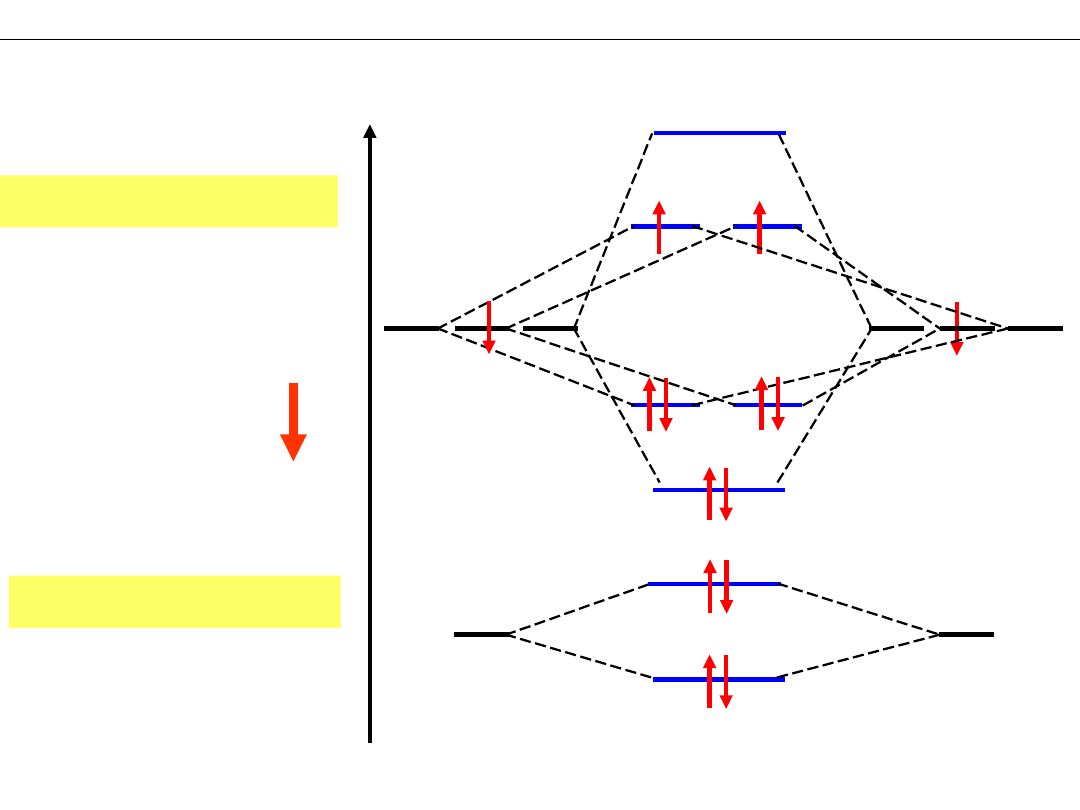
SCHEMATY POZIOMÓW ENERGETYCZNYCH cząsteczek O
2
i F
2
E
O
2
O
O
Orbitale atomowe:
p
x
p
y
p
z
s
p
x
p
y
p
z
s
π
x
π
y
π
x
π
y
σ
σ
*
σ
*
σ
O - 1s
2
2s
2
2p
4
RZĄD WIĄZANIA
R(O
2
) = 1/2(8-4) = 2
F - 1s
2
2s
2
2p
5
F
F
F
2
RZĄD WIĄZANIA
R(F
2
) = 1/2(8-6) = 1
Wykład 8 – WIĄZANIA CHEMICZNE
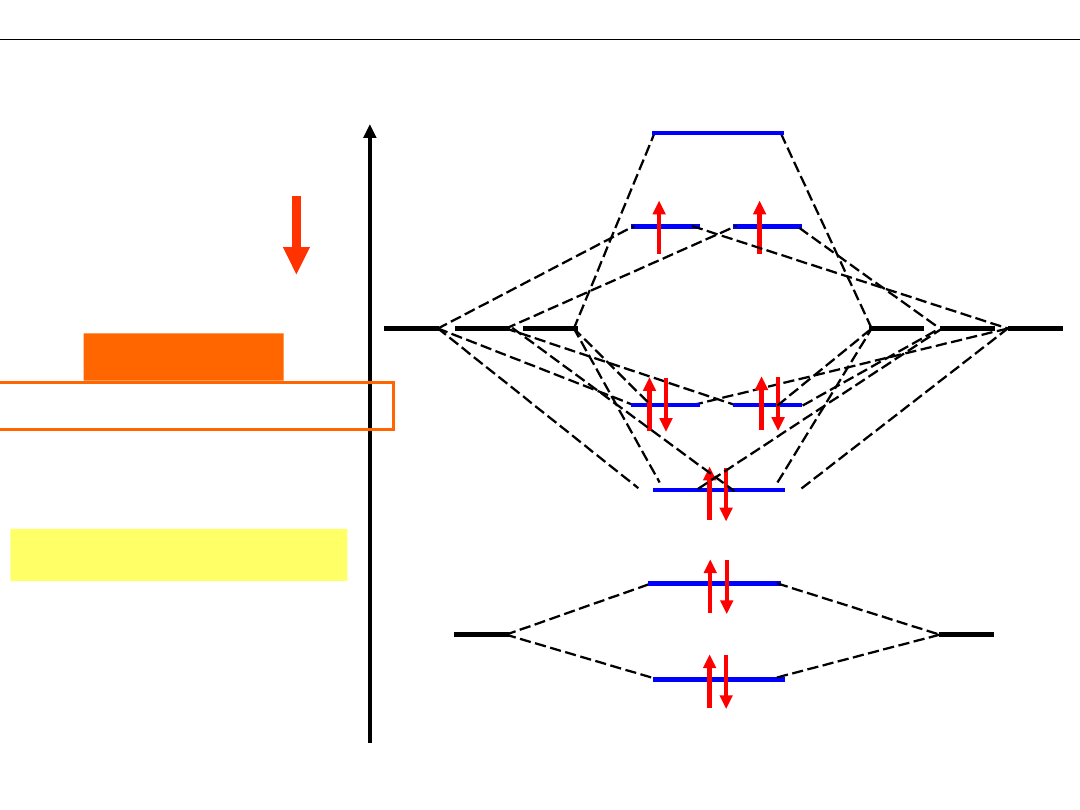
SCHEMATY POZIOMÓW ENERGETYCZNYCH cząsteczek O
2
i N
2
E
O
2
O
O
Orbitale atomowe:
p
x
p
y
p
z
s
p
x
p
y
p
z
s
π
x
π
y
σ
σ
*
σ
*
σ
O - 1s
2
2s
2
2p
4
π
x
π
y
N - 1s
2
2s
2
2p
3
N
N
N
2
RZĄD WIĄZANIA
R(N
2
) = 1/2(8-2) = 3
UWAGA !!!
Zmiana kolejności orbitali
N - 1s
2
2s
2
2p
3
Wykład 8 – WIĄZANIA CHEMICZNE
Konfiguracje elektronowe cząsteczek N
2
O
2
i F
2
N - 1s
2
2s
2
2p
3
Elektrony na orbitalach
zewnętrznych
N
2
1s
2
1s
2
(σ2s)
2
(σ
*
2s)
2
(π2p
x
)
2
(π2p
y
)
2
(σ2p
z
)
2
O - 1s
2
2s
2
2p
4
O - 1s
2
2s
2
2p
4
Elektrony na orbitalach
cząsteczkowych
O
2
1s
2
1s
2
(σ2s)
2
(σ
*
2s)
2
(σ2p
z
)
2
(π2p
x
)
2
(π2p
y
)
2
(π
*
2p
x
)
1
(π
*
2p
y
)
1
F - 1s
2
2s
2
2p
5
F - 1s
2
2s
2
2p
5
Elektrony na orbitalach
cząsteczkowych
F
2
1s
2
1s
2
(σ2s)
2
(σ
*
2s)
2
(σ2p
z
)
2
(π2p
x
)
2
(π2p
y
)
2
(π
*
2p
x
)
2
(π
*
2p
y
)
2
Elektrony na orbitalach
cząsteczkowych
Zmiana kolejności
energetycznej orbitali
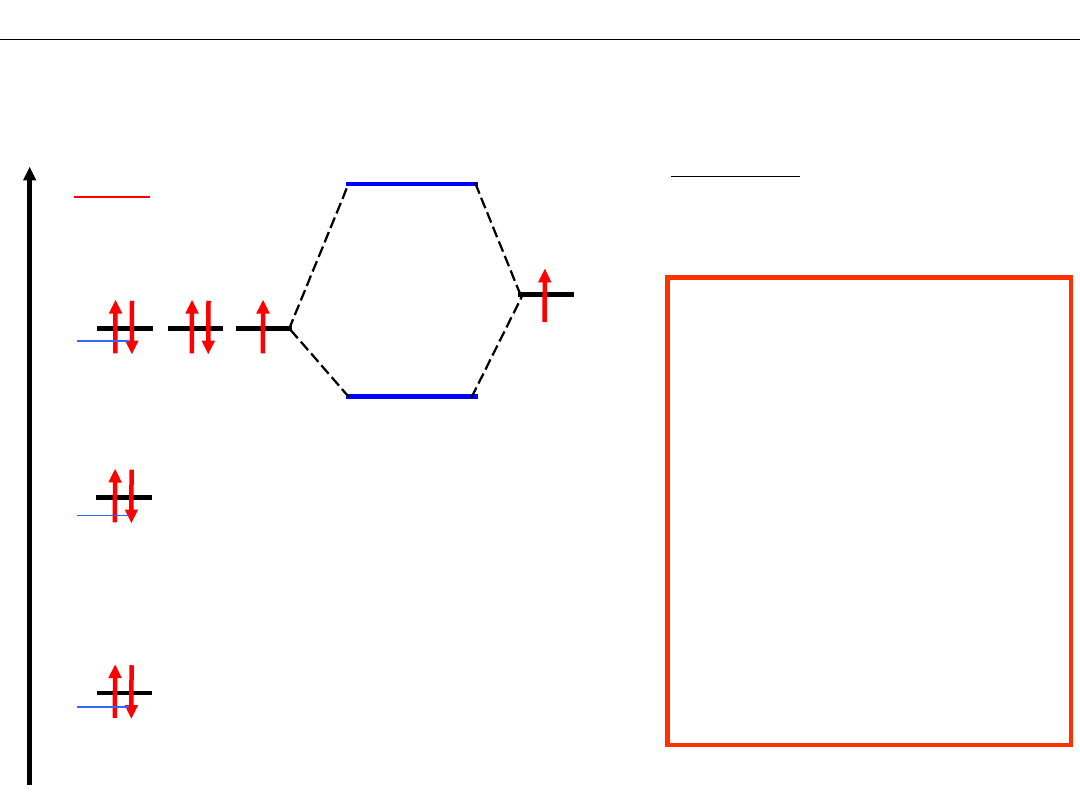
Wykład 8 – WIĄZANIA CHEMICZNE
SCHEMAT POZIOMÓW ENERGETYCZNYCH
cząsteczki heteroatomowej – HF
1
s
2
s
2
p
E
F
H
1
s
HF
Problem: Który orbital fluoru
utworzy orbital cząsteczkowy
z orbitalem 1s wodoru?
KRYTERIA TWORZENIA
ORBITALI
CZĄSTECZKOWYCH
1. Zbliżone energie orbitali
atomowych
2. Jak największe nakładanie
się fragmentów orbitali
atomowych
3. Jednakowa symetria
orbitali atomowych
względem osi wiązania
σ
σ
*
p
z
p
y
p
x
ORBITALE
wiążący
antywiążący
niewiążące
niewiążący
niewiążący
N
Wykład 8 – WIĄZANIA CHEMICZNE
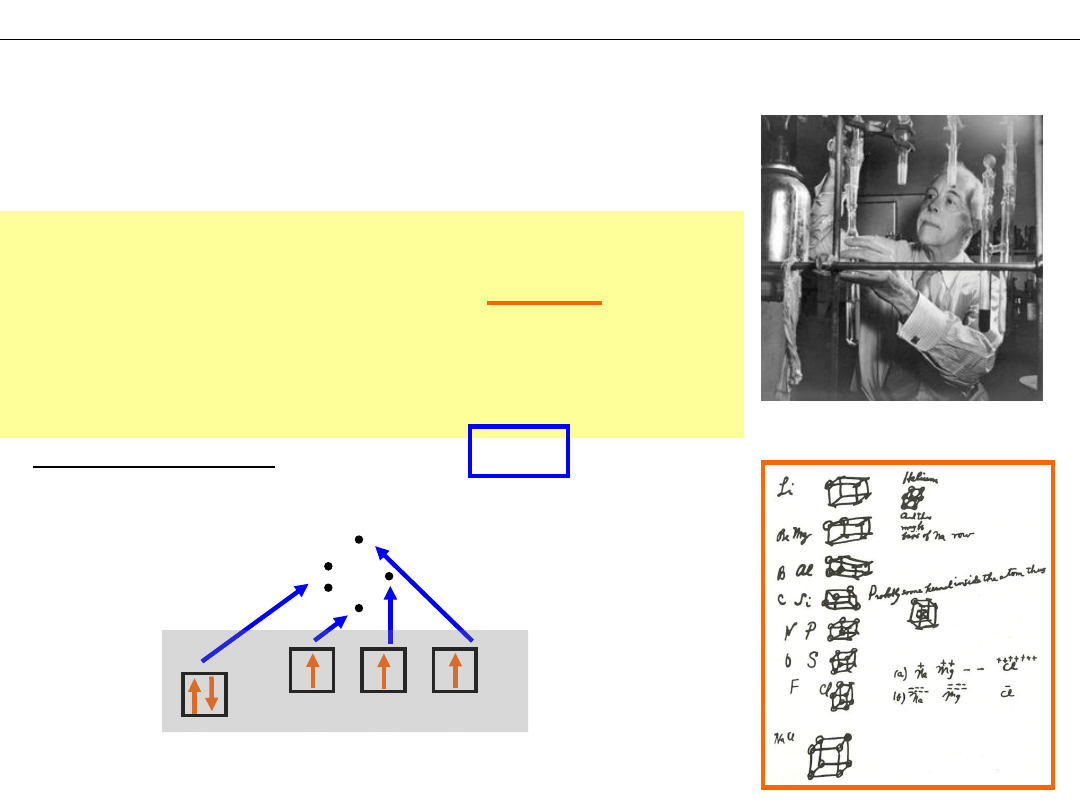
INNE TEORIE WIĄZAŃ CHEMICZNYCH
I. Reguła oktetu (Lewis – 1902)
Gilbert Newton Lewis
(1875-1946)
„Podczas tworzenia wiązania
kowalencyjnego atomy dążą do
skompletowania oktetów (ośmiu
elektronów) przez uwspólnienie par
elektronowych”
Symbole Lewisa
el. sparowane
el.
niesparowane
2s
2p
np: N
2
– 1s
2
2s
2
2p
3
Wykład 8 – WIĄZANIA CHEMICZNE
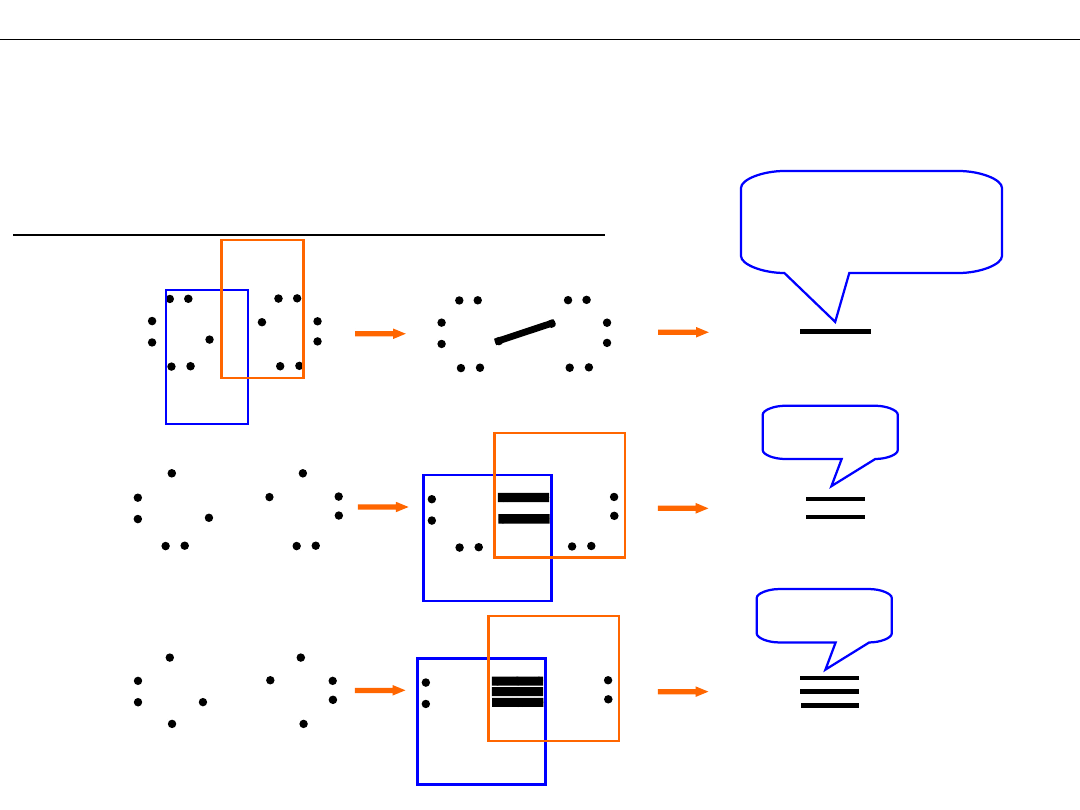
INNE TEORIE WIĄZAŃ CHEMICZNYCH
I. Reguła oktetu (Lewis – 1902)
Tworzenie wiązań – budowanie oktetów
F F
O
2
N
2
F
2
F F
8 el.
8 el.
F F
1 para wspólnych
elektronów
O O
O O
8 el.
8 el.
2 pary el.
O O
8 el.
8 el.
3 pary el.
N N
N N
N N
Wykład 8 – WIĄZANIA CHEMICZNE
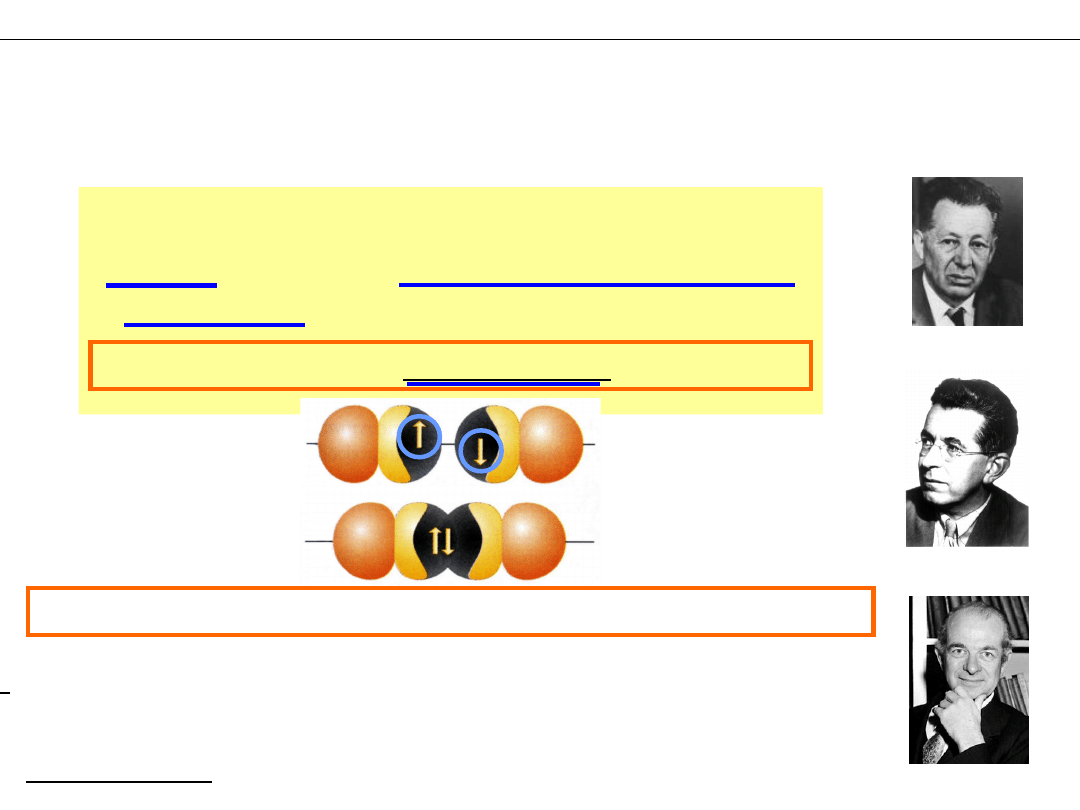
II. Teoria Wiązań Walencyjnych
(Heitler, London–1927, Pauling–1939)
VB – ang. Valence Bond „valens” – łac. być silnym, zdrowym
INNE TEORIE WIĄZAŃ CHEMICZNYCH
Walter Heitler
Linus Pauling
Fritz London
„Wiązanie powstaje w wyniku
nałożenia się orbitali atomowych
obsadzonych pojedynczymi
elektronami i utworzenia pary
elektronowej”
Orbitale obsadzone pojedynczymi elektronami
Para elektronowa pozostaje pomiędzy jądrami atomów
Problem
: Czy atom berylu o konfiguracji 1s
2
2s
2
nie może utworzyć żadnych wiązań ???
Rozwiązanie –
... na następnym wykładzie
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Wykład 1, budowa atomu, wiązania chemiczne
2 Atom i cząstka Wiązania chemiczne klucz
2 Atom i cząstka Wiązania chemiczne
7 układ okresowy pierwiastków, wiązania chemiczne
Budowa atomu i wiązania chemiczne test odpowiedzi
wypisać i wymienić rodzaje wiązań chemicznych
WIĄZANIA CHEMICZNE
Atom, cząsteczka, wiązanie chemiczne
ściąga rodzaje wiązań chemicznych
Wiązania chemiczne
Chemia wiązania chemiczne
wiązania chemiczne wstęp(1)
Wiązania chemiczne
więcej podobnych podstron