
Liczby kwantowe
Dr inż. Katarzyna Kozłowska

Główna liczba kwantowa
Główną liczbę kwantową - n
Wartości całkowitych liczb dodatnich: 1, 2, 3,…
Określa powłokę elektronową do której należy elektron
Główna liczba kwantowa n określa energię powłoki
elektronowej
Wartość n
Symbol literowy
1
K
2
L
3
M
4
N
5
O
6
P

Poboczna (dodatkowa, orbitalna,
azymutalna) liczba kwantowa
Oznacza się literą – l
Przyjmuje wartości: od 0, 1, 2, .......do ( n-1)
Jest to liczba kwantowa opisująca niewielkie różnice energii
elektronów danego poziomu energetycznego związane z
różnicami ich orbitalnego momentu pędu
Dla atomów zawierających więcej niż jeden elektron - trzeba
znać równocześnie liczbę n oraz l -by określić poziom
energetyczny odpowiadający orbicie elektronowej
Poboczna liczba kwantowa l - uściśla wartość energii elektronu
Charakteryzuje kształt orbitali atomowych
Przykład obliczenia wartości
kwantowej liczby pobocznej - l
Dla pierwszej powłoki n = 1
Liczba poboczna l przyjmie wartość:
l = n - 1 = 1 -1 = 0
Dla drugiej powłoki gdzie n = 2
Liczba poboczna l ma wartości:
0 oraz n - 1 = 2 - 1 =1
czyli - dwie wartości liczby pobocznej:
l = 0,1
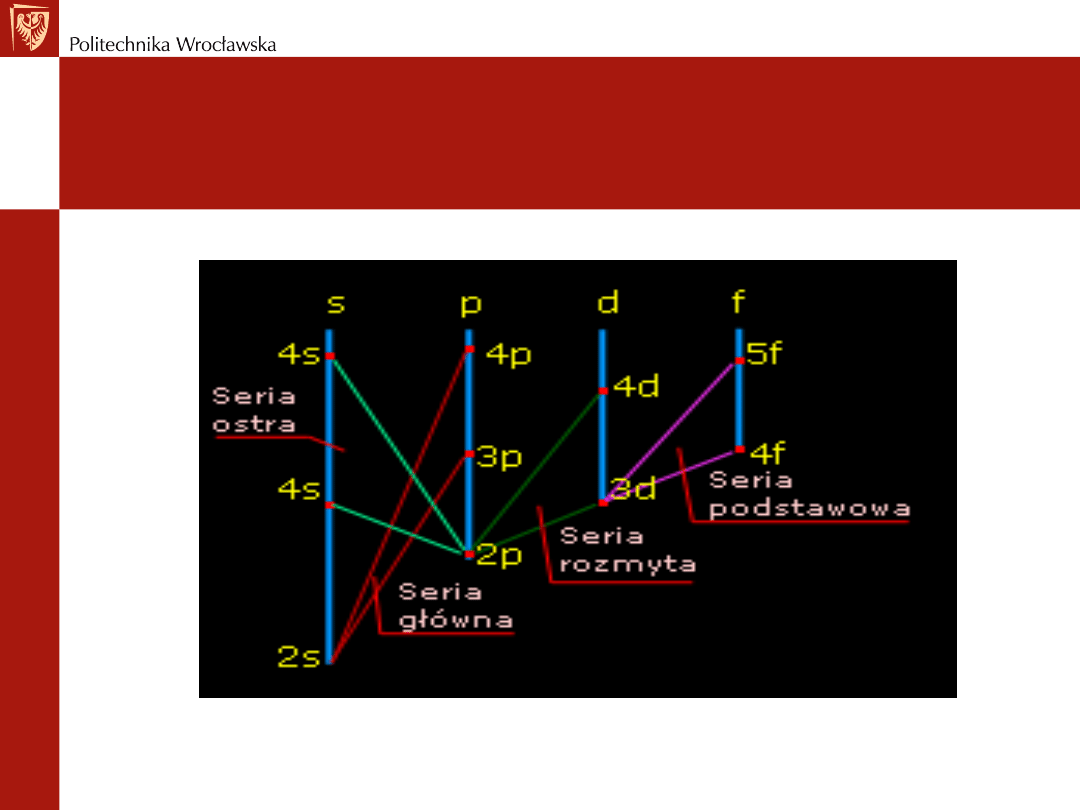
Schemat poziomów energetycznych
w atomie litu

Oznaczenia
s dla serii ostrej /sharp/,
p dla serii głównej /principle/,
d dla serii rozmytej /difusel/
f dla serii podstawowej /fundamental/
dalej - porządek alfabetyczny
Stan s, dla którego l = 0 – stan - któremu odpowiada
moment pędu równy zeru
Gdy l przyjmuje wartości różne od zera - całkowita funkcja
falowa odbiega od symetrii sferycznej i w układzie pojawia
się moment pędu
Magnetyczna liczba kwantowa
W teorii Schrodingera - magnetyczna liczba kwantowa m -
reprezentuje składową momentu pędu w kierunku dowolnej osi
współrzędnych - na przykład w kierunku osi z
Co to oznacza?
Że wektor orbitalnego momentu pędu nie może ustawić się pod
dowolnym kątem do linii sił przyłożonego pola magnetycznego
Może ustawić się tylko w dozwolonych wybranych kierunkach
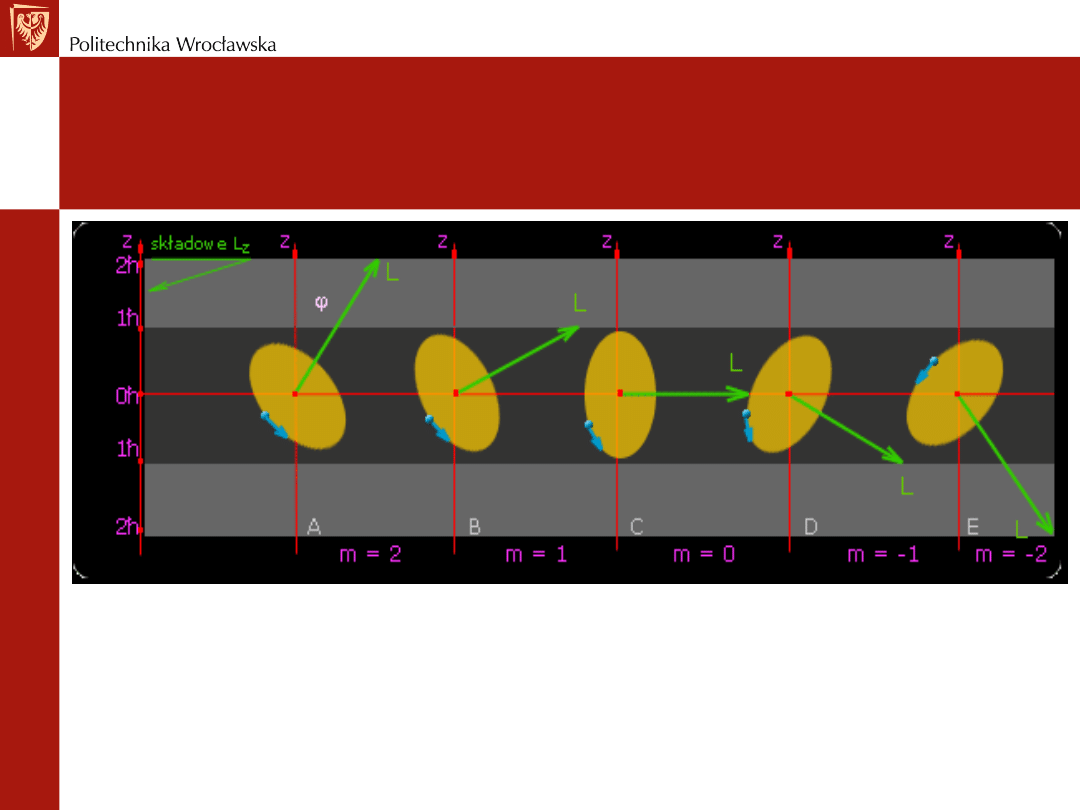
Wektor orbitalnego momentu L
Wektor orbitalnego momentu L jest skwantowany w przestrzeni
Względem danego kierunku z dozwolone są jedynie pewne
ustawienia wektora L
Gdy l = 2 - kwantyzacja przestrzenna wektora orbitalnego
momentu pędu daje składowe Lz = 0h, +/-1h, +/-2h.

Magnetyczna liczba kwantowa
W znaczeniu fizycznym -magnetyczna liczba kwantowa m
- określa niewielkie różnice energetyczne pomiędzy
elektronami o tej samej liczbie kwantowej n i l oraz
wzajemne ustawienie się orbitali w przestrzeni pod
wpływem zewnętrznego pola magnetycznego

Magnetyczna liczba kwantowa
o Przy braku zewnętrznego pola magnetycznego orbitale nie
mają określonego kierunku w przestrzeni i nie różnią się
energią - są
zdegenerowane
o Degeneracja
- oznacza istnienie dwóch lub więcej różnych
stanów o tej samej energii
o Stany p są trzykrotne, stany d - pięciokrotne, a stany f -
siedmiokrotnie zdegenerowane
o Liczba m może przyjmować (2l + 1) wartości
o m = - l, -(l - 1), ......-1, 0, +1, .......,+(l -1) +l
Przykład:
dla l = 2 liczba magnetyczna m przyjmie wartości:
- 2, - (2 -1), 0, +(2 -1) , +2
m = -2, -1, 0, +1, +2

Zjawisko Zeemana
Magnetyczna liczba kwantowa m pozwoliła na wyjaśnienie
tzw.
Zjawiska Zeemana
- polegającego na dalszym
rozszczepieniu składników subtelnej budowy prążków
widmowych w polu magnetycznym
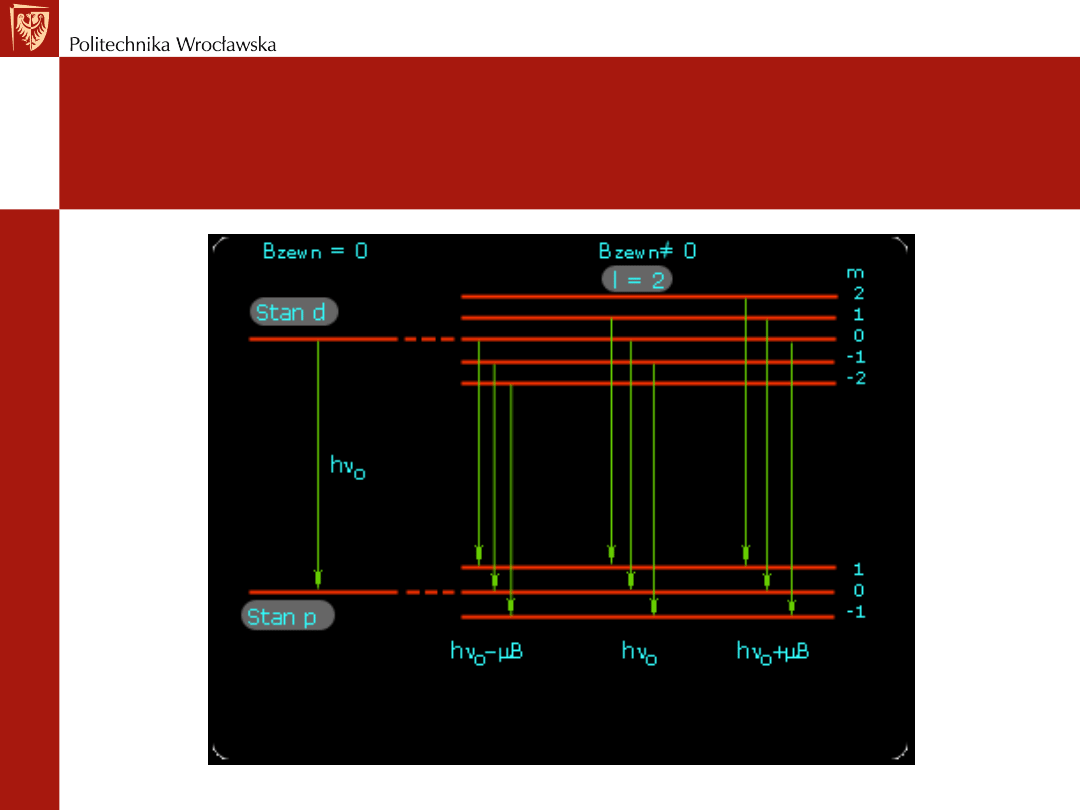
Zjawisko Zeemana

Zjawisko Zeemana
W nieobecności zewnętrznego pola magnetycznego w
wyniku przejścia ze stanu d do stanu p powstaje tylko jedna
linia widmowa. Gdy przyłożone zostanie zewnętrzne pole
magnetyczne, wtedy możliwych jest sześć przejść, chociaż
będą występować jedynie trzy rozróżnialne energie
Zjawisko Zeemana jest jednym z najbardziej bezpośrednich
potwierdzeń koncepcji kwantyzacji momentu pędu

Spinowa liczba kwantowa
o Linie widmowe rozszczepiają się w bardziej skomplikowany
sposób, niż wynika to z efektu Zeemana - zjawisko to
nazwano
anormalnym zjawiskiem Zeemana
o Niekiedy następuje rozdwojenie linii - co wskazuje na
rozdwojenie poziomów energetycznych
o Wskazywało to na istnienie liczby kwantowej która może
przybierać tylko dwie wartości

Spinowa liczba kwantowa
Rozdwojenie linii widmowych - wyjaśnił Goudsmit i
Uhlenbeck
Elektron oprócz takich właściwości jak ładunek i masa ma
jeszcze inną, immanentną własność, a mianowicie spinowy
moment pędu – spin, który jest wynikiem ruchu
obrotowego elektronu wokół własnej osi - ruch ten opisuje
spinowa liczba kwantowa s
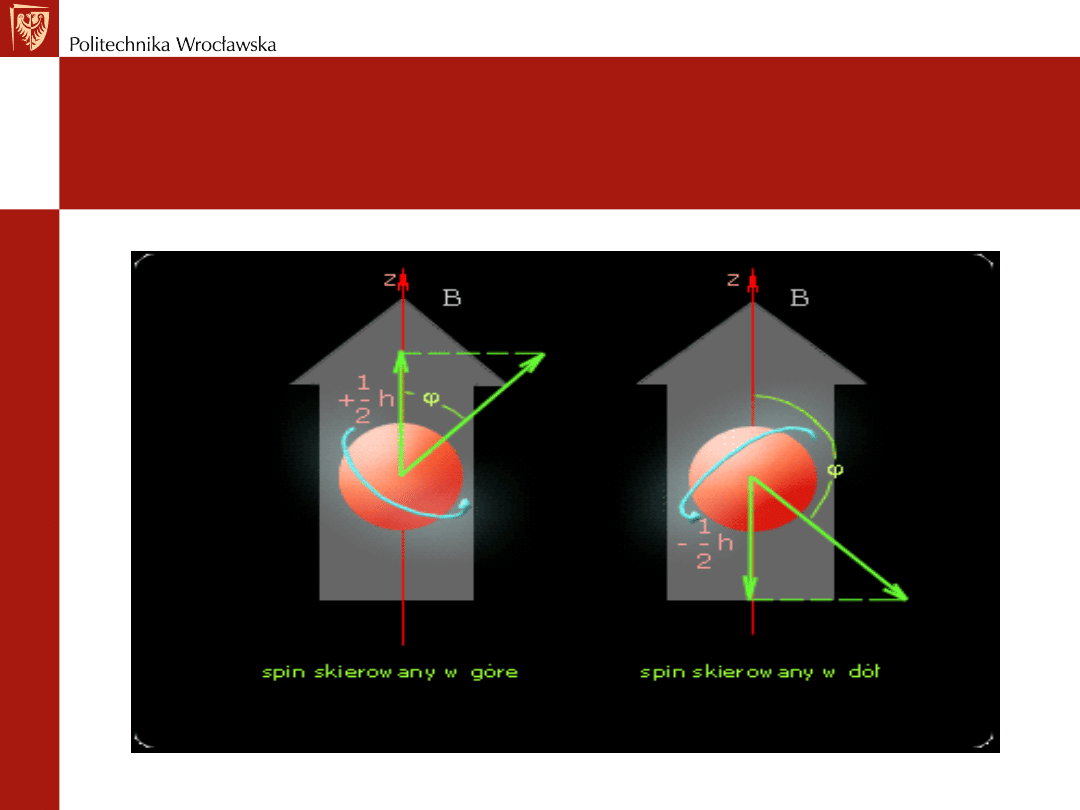
Spinowy moment pędu elektronu
Spinowa liczba kwantowa
Spinowa liczba kwantowa – s
Ma wyłącznie wartość 1/2 dlatego nie wprowadza
dodatkowego rozróżnienia stanów energetycznych
Gdy przyłoży się zewnętrzne pole magnetyczne (B) -
składowa momentu pędu Ls w kierunku z jest skwantowana:
L
sz
= m
s
h / 2
gdzie; m
s
= +/-1/2 magnetyczna spinowa liczba kwantowa
Gdy ms = +1/2 - spin skierowany w górę
ms = -1/2 - spin skierowany w dół

Liczby kwantowe
Liczby kwantowe
Wartości
Liczba możliwych
wartości
Główna, n
Orbitalna, l
Magnetyczna, m
Spinowa, s
Magnetyczna spinowa,
ms
1, 2, 3, ....
0, 1, 2,...,(n - 1)
0, +/-1, +/-2,...,+/-l
1/2
+/-1/2
dowolna
n
2l + 1
1
2s + 1 = 2

Orbitale atomowe
Dla opisu stanu jednego elektronu w atomie ma
zastosowanie tylko jedna funkcja falowa nazywana
orbitalem.
Jest to najmniejszy obszar przestrzeni
wokółjądrowej, w którym prawdopodobieństwo
znalezienia elektronu o określonym zasobie
energii wynosi 90%. Każdemu orbitalowi można
przyporządkować maksymalnie dwa elektrony.
Orbital
jest określony za pomocą trzech liczb
kwantowych n, l, m
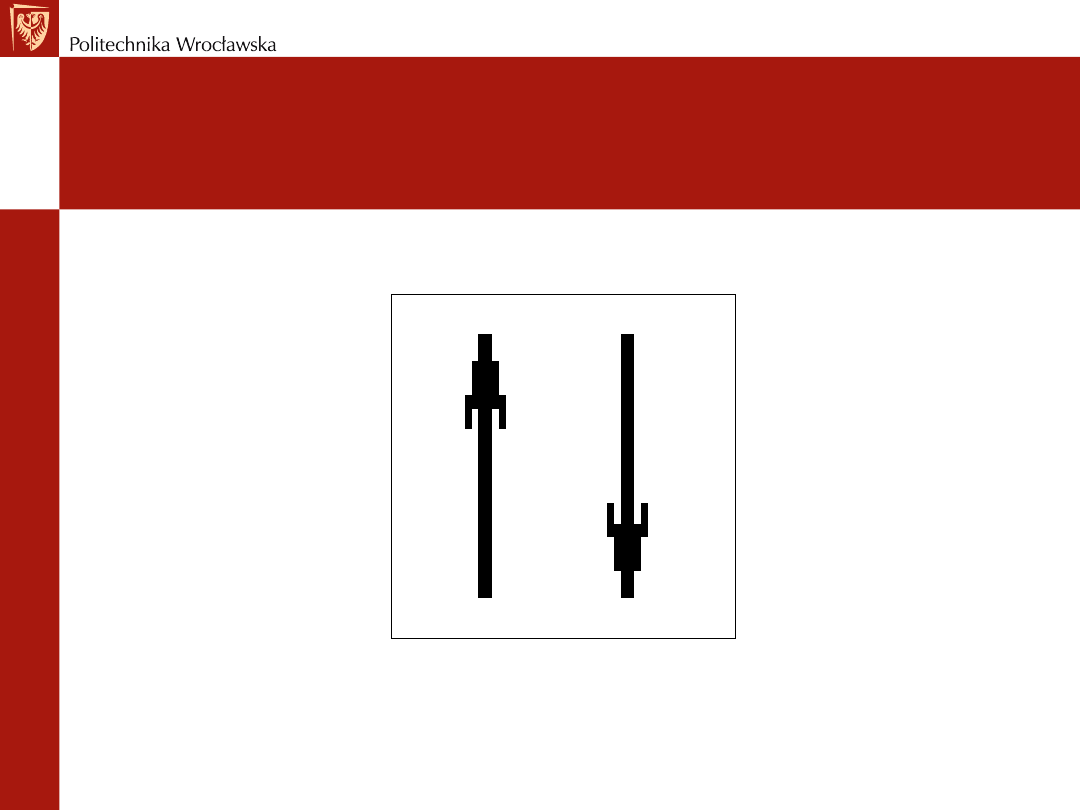
Symboliczne przedstawianie
orbitali atomowych
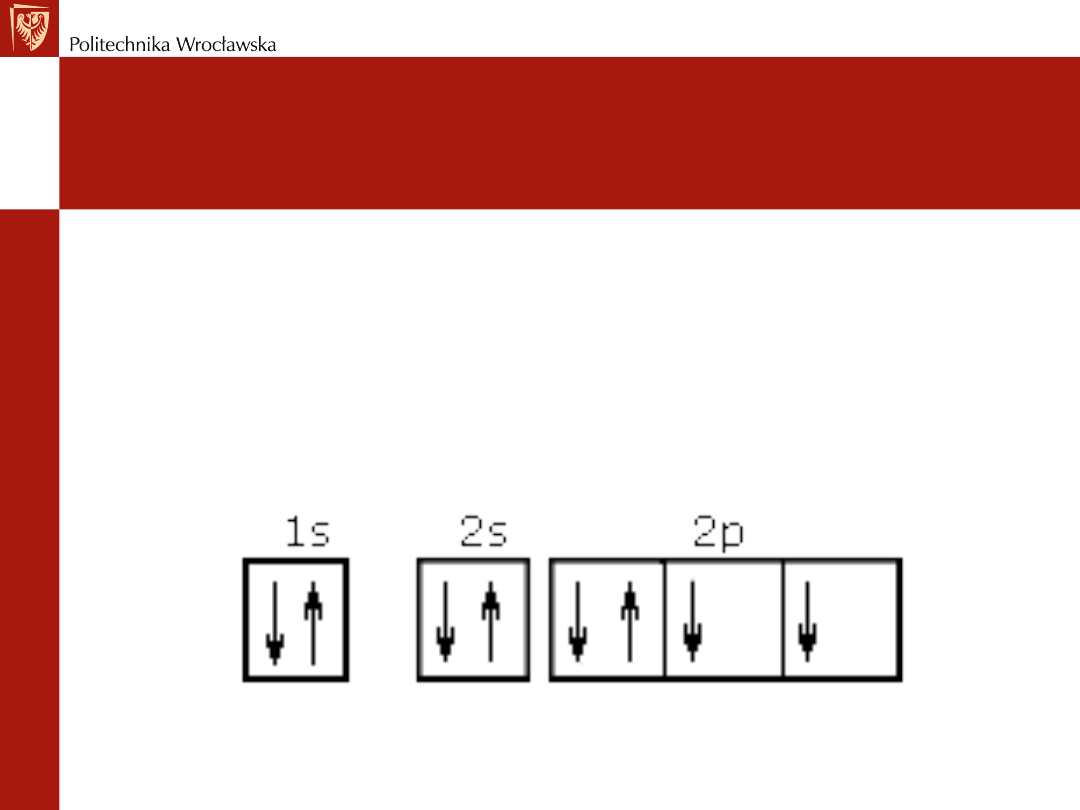
Sposób wypełniania orbitali
Jeżeli l = 0, m = 0 i występuje tylko jeden orbital
Jeżeli l = 1 to m przyjmuje wartości -1, 0, +1 – trzy wartości
m to trzy orbitale
l jest niezależna od n - lecz musi spełniać warunek 0 < l < n

Trzy zasady
Przy przedstawianiu budowy powłok mają zastosowanie trzy
zasady:
o zasada rozbudowy
o zakaz Pauliego
o reguła Hunda
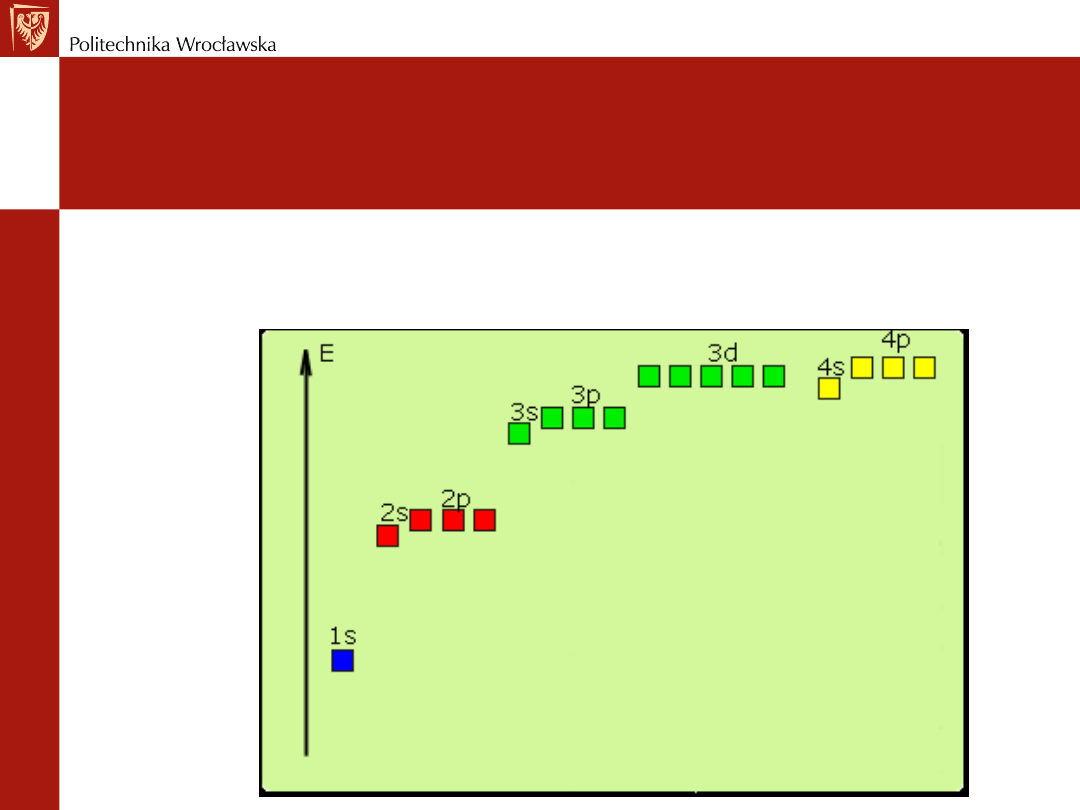
Zasada rozbudowy
Zasada ta mówi, że kolejne orbitale są zajmowane w
porządku wzrastającej energii

Zakaz Pauliego
Dwa elektrony mogą zajmować ten sam orbital tylko wówczas -
gdy ich spiny są przeciwne
tj. zorientowane w przeciwnych kierunkach
Nie mogą istnieć dwa elektrony w identycznym stanie
kwantowym -
tzn. mające identyczne wartości pięciu liczb kwantowych (n, l,
m, s, m
s
)

Zakaz Pauliego
Wolfgang Pauli /1950 - 1959 / - zauważył, że obecność
jednego elektronu na orbitalu wyklucza możliwość
znalezienia się na nim innego elektronu o tej samej
orientacji spinu
Jest on słuszny także dla wiązań chemicznych elektronów w
ciałach stałych i budowy jądra atomowego
Na podstawie zakazu Pauliego - można wyliczyć
maksymalną liczbę elektronów jaka może pomieścić się na
poszczególnych powłokach i podpowłokach atomu

Maksymalna pojemność powłok
wynosi:
Numer
powłoki
Maksymalna
ilość
elektronów
1
2
2
8
3
18
4
32
5
50
Maksymalna liczba elektronów
dla podpowłok wynosi:
s – 2
p – 6
d – 10
f - 14
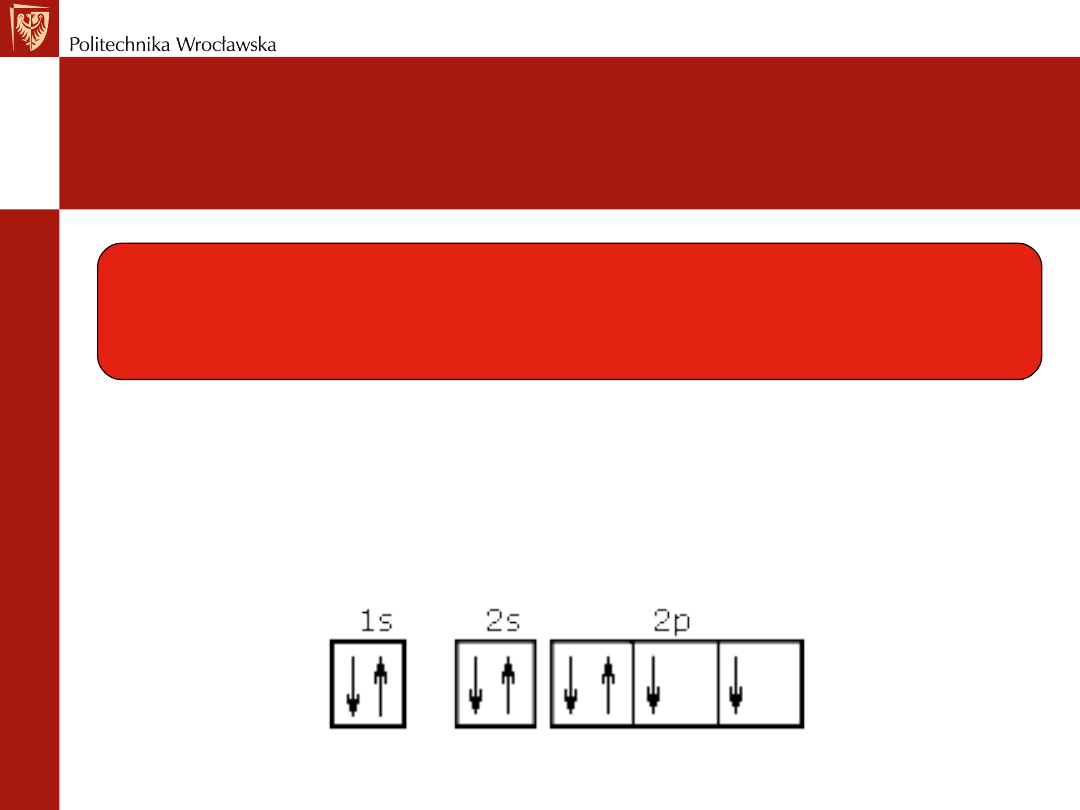
Reguła Hunda
Elektrony obsadzają orbitale w taki sposób,
aby liczba niesparowanych elektronów w danej podpowłoce
była możliwie największa
Oznacza to, że przy zapełnianiu kolejnych orbitali elektronami
wszystkie orbitale odpowiadające (orbitale o tych samych
liczbach kwantowych n i l) zostaną zapełnione najpierw po
jednym elektronie o spinie równoległym, a dopiero potem
drugim elektronem o spinie przeciwstawnym

Orbital typu s
" Kształt orbitalu"
-powierzchnia graniczną
obejmującą większą część
gęstości
prawdopodobieństwa
Ruch elektronu w obrębie
orbitali s prawdopodobnie
odbywa się wzdłuż
promienia w kierunku od i
dośrodkowym

Orbital typu p
Elektrony w powłoce n = 2 mogą mieć wartość liczby pobocznej
l = 0 i 1 tzn. oprócz orbitalu s pojawiają się orbitale p
Trzy zdegenerowane / tzn. o jednakowej energii/ orbitale p mają
w przybliżeniu kształt figur powstałych przez obrót ósemki
dookoła podłużnej osi i są ustawione względem siebie w
przestrzeni pod kątem prostym
Prawdopodobieństwo znalezienia się elektronu w środkowej
części jest równe zeru

Orbital typu d i f
• Poziom n = 3 obejmuje podpoziomy s, p, d
• Orbitale typu f mają symetryczny rozkład w przestrzeni
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
Liczby kwantowe, chemia(2)
Liczby kwantowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Liczby kwantowe, chemia dla liceum
LICZBY KWANTOWE I PRAWA ZACHOWANIA
Liczby kwantowe chemia dla liceum
liczby kwantowe
06 Orbitale i liczby kwantowe
19 Liczby kwantowe
5) Liczby kwantowe
liczby kwantowe
więcej podobnych podstron