
Enzymologia

B
A
D
C
RT
G
G
o
ln
o
G
A + B = C + D
Gdzie:
- standardowa zmiana energii swobodnej
R – stała gazowa
T – temperatura
[A], [B], [C], [D] – molowe stężenia składników
reakcji

B
A
D
C
K
W stanie równowagi
B
A
D
C
RT
G
o
ln
0
B
A
D
C
RT
G
o
ln
K
RT
G
o
ln
0
G
Stała równowagi K

G
RT
G
e
v
k
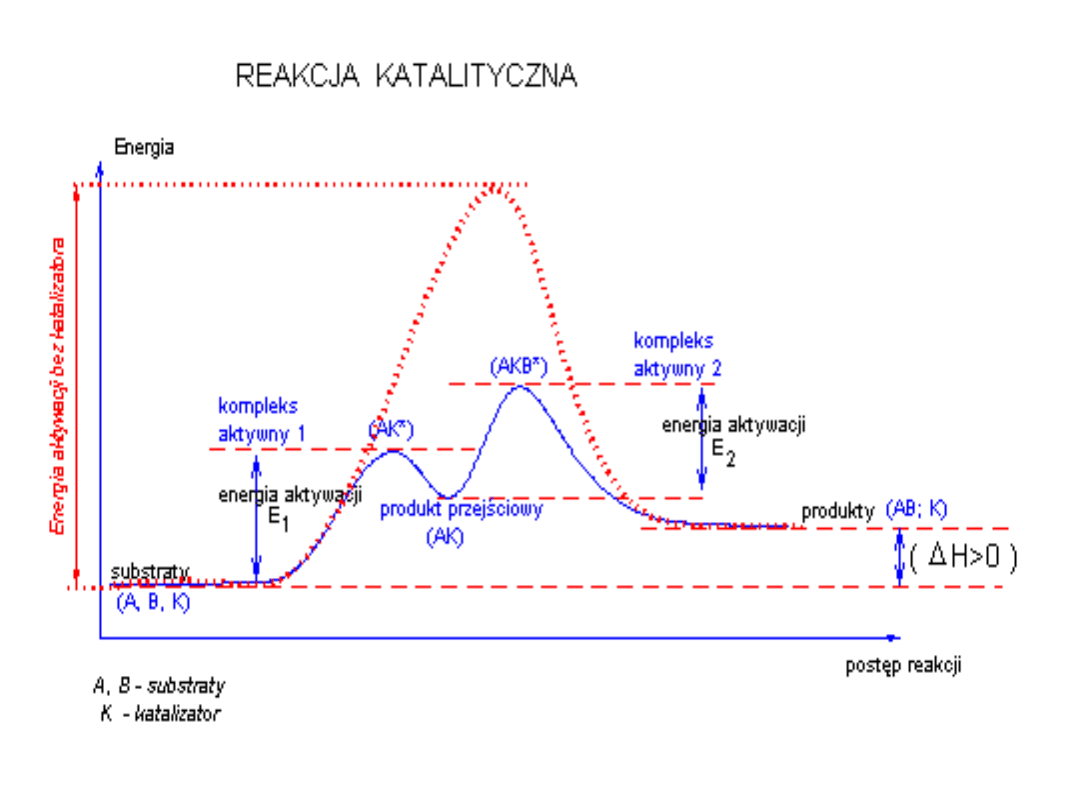
Energia aktywacji
- to różnica energii swobodnej
między stanem przejściowym a substratem. Minimalna
energia jaką musi posiadać substrat, aby mógł przereagować.
Stan przejściowy – stan o maksymalnej energii na wykresie
postępu reakcji. Dla reakcji enzymatycznych stanem
przejściowym jest kompleks enzym-substrat ES.
Stałą szybkości opisujemy wówczas równaniem:

Oddziaływania Enzym-
Substrat
H
2
N
CH
C
CH
2
OH
O
CH
2
CH
2
NH
C
NH
2
NH
Arg
H
2
N
CH
C
CH
2
OH
O
CH
2
CH
2
CH
2
NH
2
Lys
H
2
N
CH
C
CH
2
OH
O
N
NH
His
H
2
N
CH
C
CH
2
OH
O
CH
2
CH
2
CH
2
NH
2
H
2
N
CH
C
CH
2
OH
O
CH
2
CH
2
CH
2
NH
3
pH 7,4
Aminokwasy zasadowe
Aminokwasy zasadowe
H
2
N
CH
C
CH
2
OH
O
CH
2
C
OH
O
Glu
H
2
N
CH
C
CH
2
OH
O
CH
2
C
O
O
pH 7,4
Aminokwasy kwasowe
C
O
O
NMe3
H
2
C
H
2
C
O
C
H
3
C
O
Wiązanie jonowe
10-15 kcal/mol
R
C
O
–
O
CH3
O
R
C-X
(X= O,N, S, Cl, Br...)
C=O
+
NH
3
-R ( np. zasadowy aminokwas)
Oddziaływania dipol-dipol ( -1 kcal/mol)
Oddziaływania dipol-dipol

Oddziaływania jon-dipol
Oddziaływania jon-dipol ( -4kcal/mol do -7
kcal/mol)
C-X
(X= O,N, S, Cl, Br...)
C=O
+
NH
3
-R ( np. zasadowy
aminokwas
)
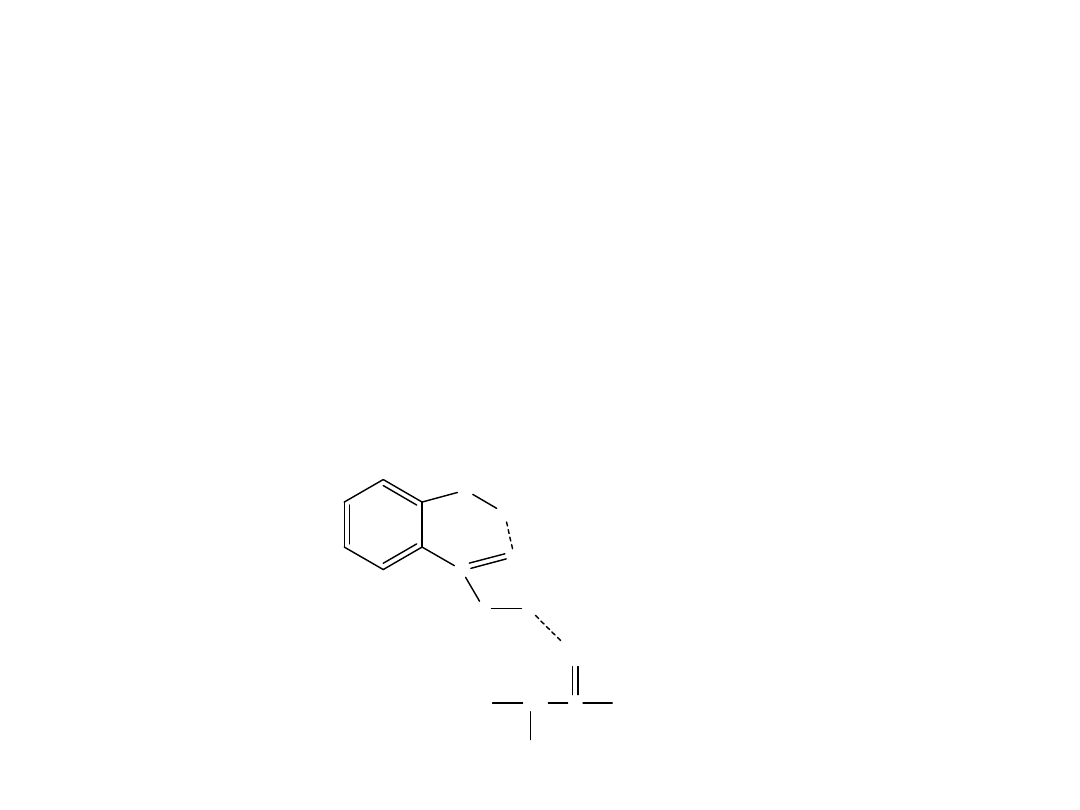
Wiązania wodorowe
Wiązania wodorowe ( -3 kcal/mol
do –7kcal/mol)
X-H .....Y
X: O, S, N, P,
Y: C=O; S=O; NO
2
O
C
H
O
O
H
H
2
N
CH
C
CH
3
OH
O

Oddziaływania hydrofobowe
Natura efektu:
Orientacja wody wokół niepolarnego łańcucha
oznacza wyższą energię układu
Zbliżenie niepolarnych podstawników
wymusza asocjację cząsteczek wody Oznacza
wzrost entropii układu
Następuje zmniejszenie energii swobodnej
takiego układu
Oznacza to stabilizację układu
Oddziaływanie CH2..... CH2 to około 0,7
kcal/mol

R
R
10x (-0,7)= -7 kcal
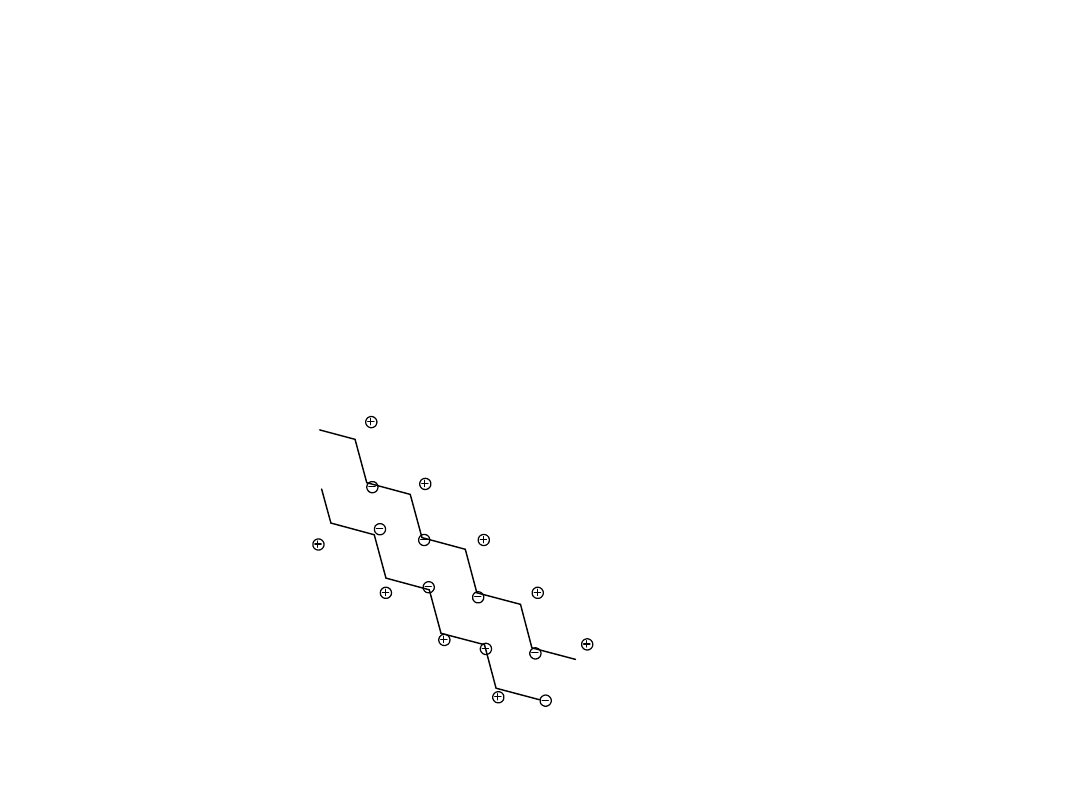
Oddziaływania dyspersyjne
Oddziaływania międzycząsteczkowe dipol....dipol indukowany
( G0 około – 0,5 kcal/mol
R
R
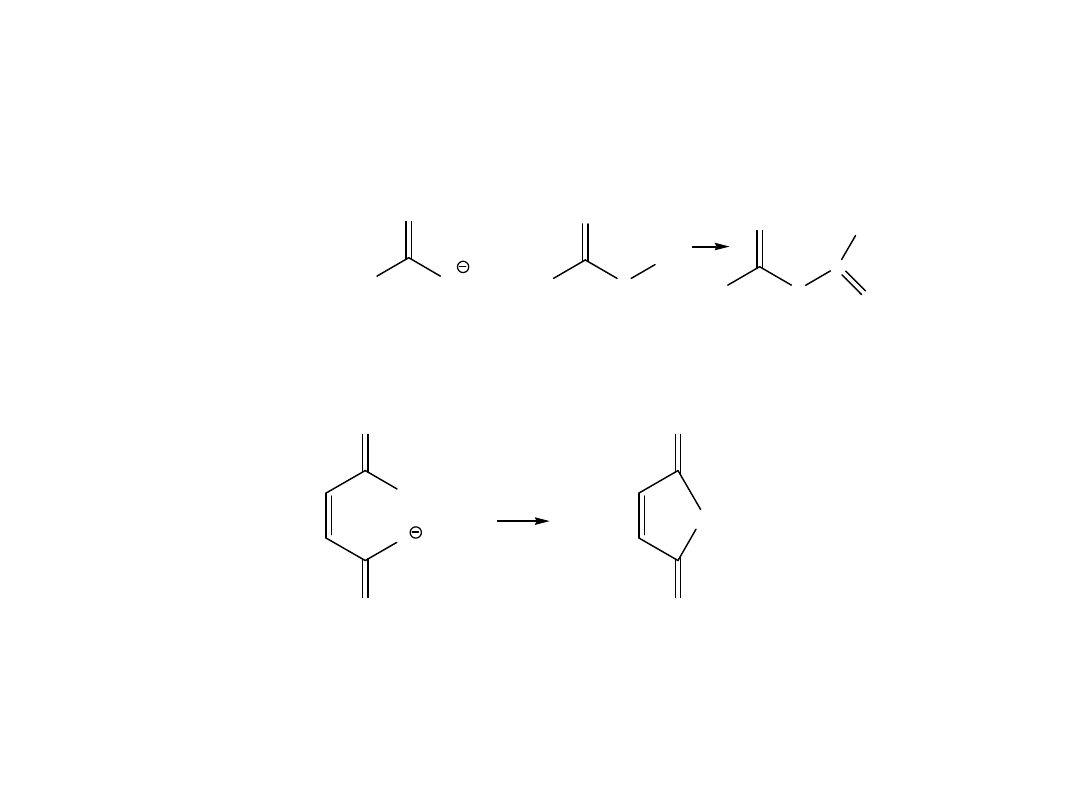
H
3
C
O
O
H
3
C
O
Ph
O
H
3
C
O
C
O
O
CH
3
V1
O
OPh
O
O
O
O
O
V2
V2/V1= 2,3 x10
6

Zawartość aminokwasów w centrum aktywnym enzymu
Ser
OH
7,8% (zawartość)
4% (centrum aktywne)
Lys
NH2
7
9
Thr
OH
6.5
3
Asp
COOH 4,8
15
Glu
COOH 4,8
11
Arg
NH2
3.8
11
Tyr
OH
3,4
5
Cys
SH
3,4
6
His
-N-
2,2
18
Met
SMe
1,6
1
Trp
1,2
-N-
1

3. EFEKTY WPŁYWAJĄCE NA
3. EFEKTY WPŁYWAJĄCE NA
SZYKOŚĆ REAKCJI
SZYKOŚĆ REAKCJI
ENZYMATYCZNEJ
ENZYMATYCZNEJ
Kataliza wewnątrzcząsteczkowa
Efekty konformacyjne
Kataliza wielosubstratowa
Kataliza kowalencyjna
Kataliza kwasowo – zasadowa
Wpływ rozpuszczalnika
Działanie sił elektrostatycznych
Wiązania wodorowe
Wpływ sił hydrofobowych
Efekt koordynacyjny
a
) Przykłady katalizy dwucząsteczkowej
Kataliza przez zbliżenie reagujących
Kataliza przez zbliżenie reagujących
cząsteczek – kataliza
cząsteczek – kataliza
wewnątrzcząsteczkowa
wewnątrzcząsteczkowa
O
2
N
O
O
N
H
N
N
N
O
H
2
O
N
H
N
OH
O
OH
O
2
N

Wnioski:
Wnioski:
Wzrost szybkości reakcji
wewnątrzcząsteczkowych w
porównaniu do reakcji, do
których zainicjowania wymagane
jest zderzenie dwóch lub więcej
cząsteczek.
Efekt katalizy
wewnątrzcząsteczkowej zależy od
długości i budowy fragmentu
łączącego dwie grupy; największy
efekt katalityczny w przypadku
produktu z sześcioczłonowym
pierścieniem.
Maksymalne przyspieszenie
reakcji: 103.
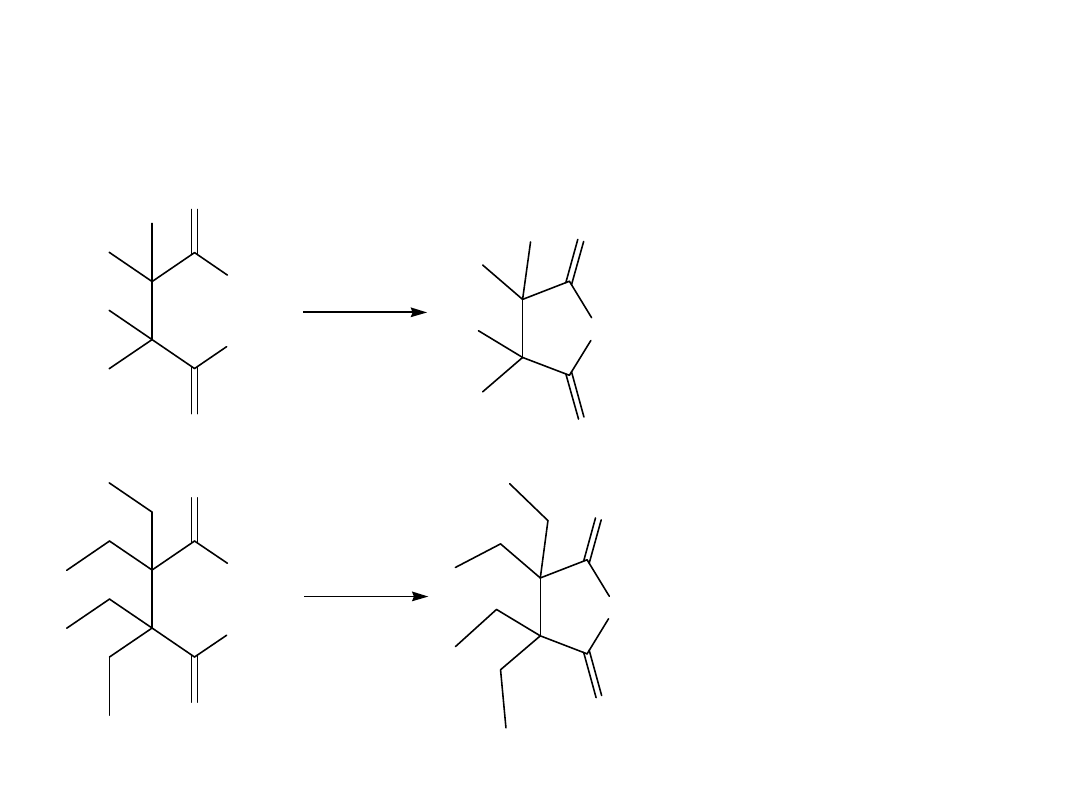
Konformacja i zbliżenie grup
OH
OH
O
O
OH
OH
O
O
O
O
O
O
O
O
2,0*10
3
1,8*10
4

Wnioski:
Wnioski:
•
Wzrost szybkości reakcji uzyskuje się przez
optymalne ułożenie w przestrzeni reagujących
ze sobą grup – efekt sferyczny (orientacyjny).
• Wzrost szybkości reakcji uzyskuje się na
skutek zmniejszenia naprężenia w obrębie
reagującej cząsteczki podczas przejścia od
stanu podstawowego do przejściowego.
• Maksymalne przyspieszenie reakcji: 10
10
.
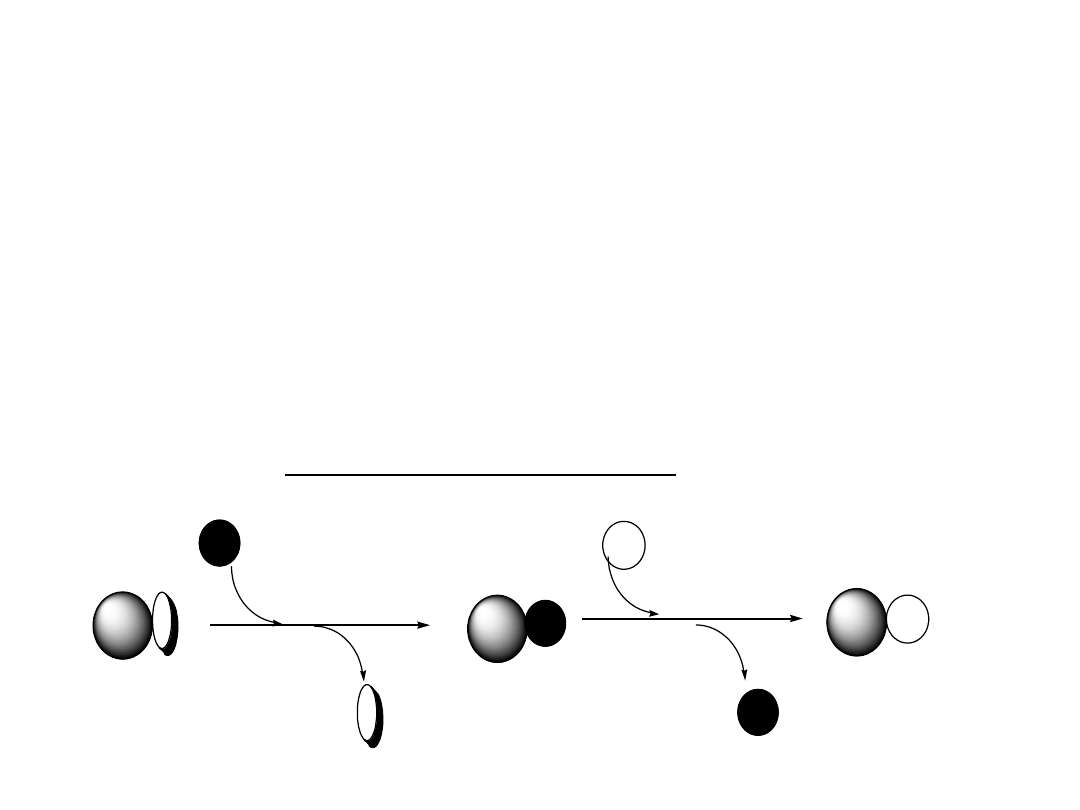
Kataliza kowalencyjna
Kataliza kowalencyjna
k
1
k
2
R X
W
X
R
R
W
Y
Y
W
Kataliza kowalencyjna polega na reakcji katalizatora
z substratem, a następnie na rozpadzie powstałego w
ten sposób produktu pośredniego pod wpływem
drugiego substratu, co w wyniku daje produkt reakcji i
uwalanie katalizator.
Wyróżniamy dwa typy katalizy:
katalizę pierwszego typu
Reakcja katalizowana
Reakcja niekatalizowana
R X
k
R
Y
Y
X
a) Przykład reakcji katalizowanej
O
2
N
N
H
N
N
N
O
H
2
O
N
H
N
OH
O
2
N
O
O
OH
O
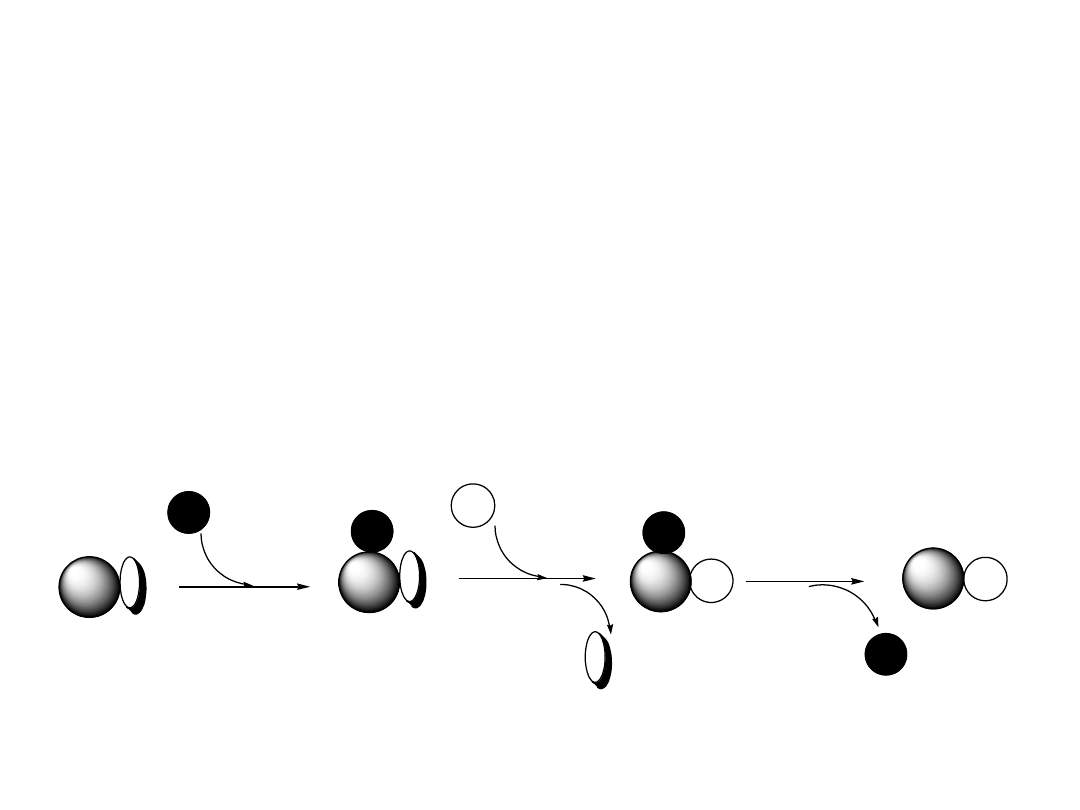
k
1
k
2
R X
W
R
R
W
Y
Y
W
X
X
R
W
Y
k
3
Kataliza 2-go rodzaju
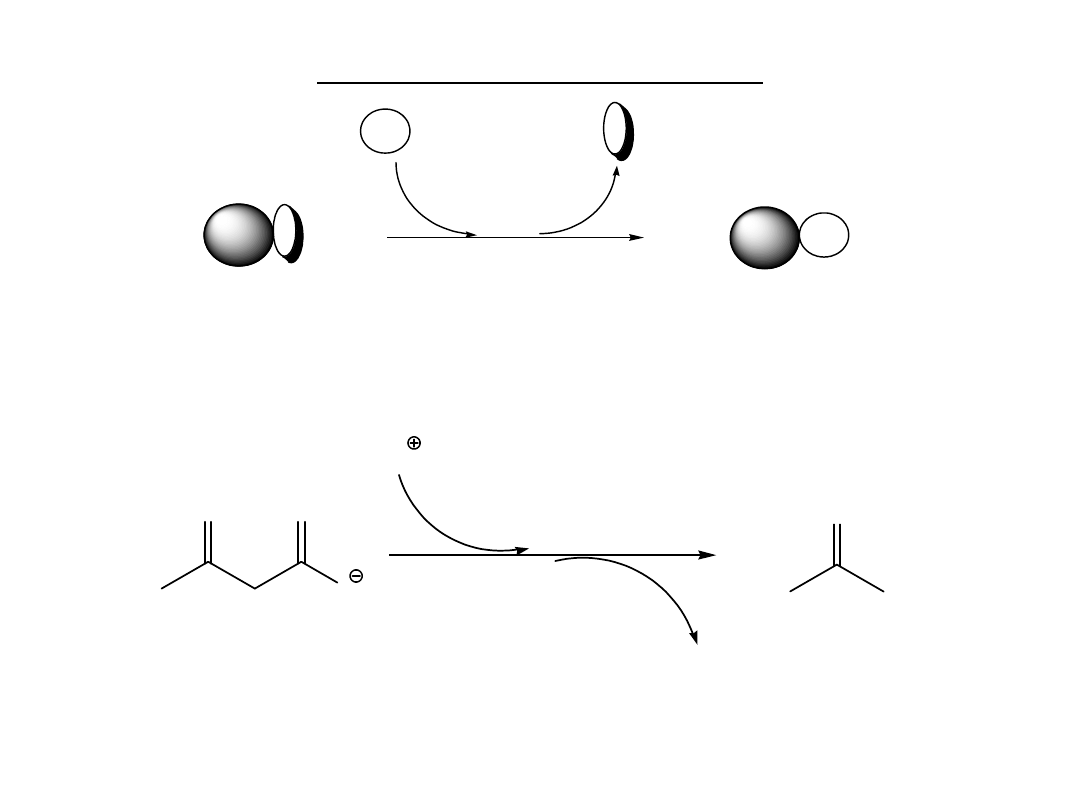
Reakcja niekatalizowana
R X
k
R
Y
Y
X
b)Przykład reakcji katalizowanej
O
O
O
H
O
k
CO
2

WNIOSKI:
WNIOSKI:
• Im mocniej związany jest substrat z enzymem,
tym wolniej może zachodzić sama reakcja.
• Stosunek ładunków elektrycznych jonów
wchodzących w skład pary jonowej wpływa na
wartość pK.
• Siły jonowe biorą udział w stabilizacji lub
destabilizacji stanu przejściowego reakcji.
• Siły elektrostatyczne mogą powodować
przyspieszenie reakcji nawet rzędu 10
3
.
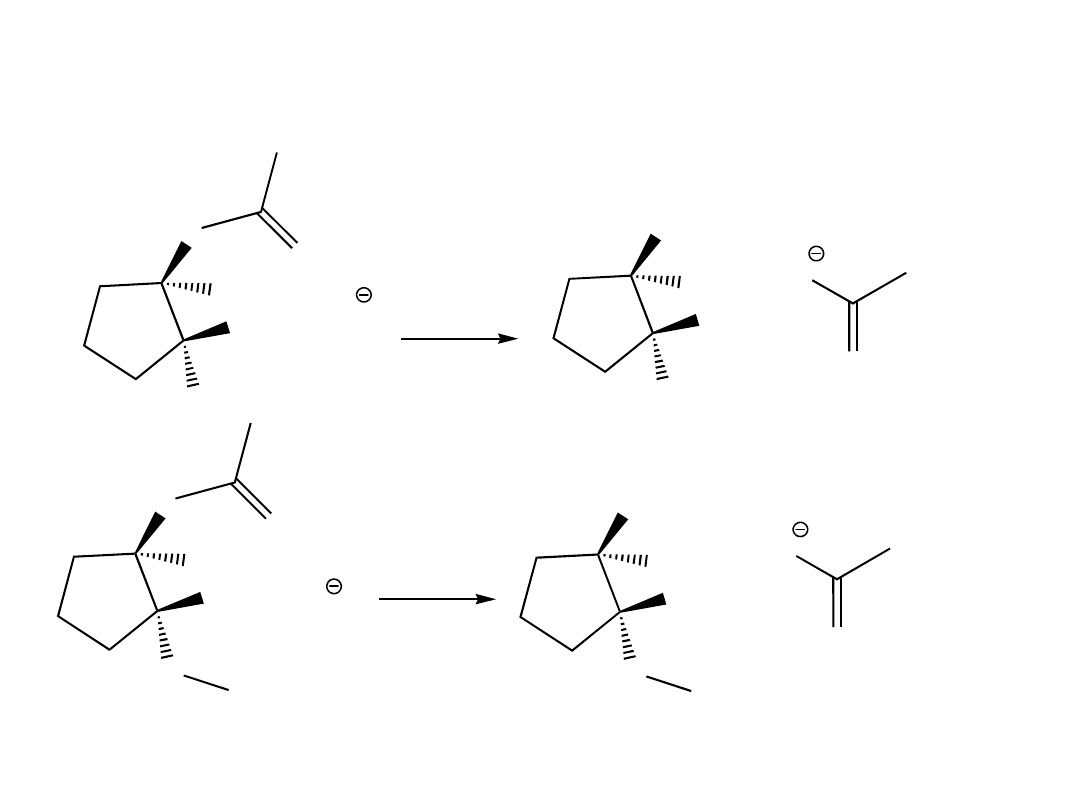
WIĄZANIE WODOROWE
WIĄZANIE WODOROWE
O
H
H
H
O
+ OH
OH
H
H
H +
O
O
O
H
O
H
O
+ OH
OH
H
O
H
+
O
O
1
31,6

WNIOSKI
WNIOSKI
• Nie mają dużego wpływu na siłę wiązania
cząsteczki substratu z enzymem.
• Odpowiedni układ przestrzenny wiązań
wodorowych warunkuje specyficzność wiązania i
pozwala na odpowiednie usytuowanie cząsteczki w
centrum aktywnym enzymu.
• W większość przypadków oprócz efektu wiązań
wodorowych może występować efekt katalizy
kwasowo – zasadowej.
• Efektywność wiązań wodorowych wzrasta w
rozpuszczalnikach nie solwatujących substratu.
• Występowanie wiązań wodorowych może
powodować przyspieszenie reakcji nawet rzędu
10
4
.
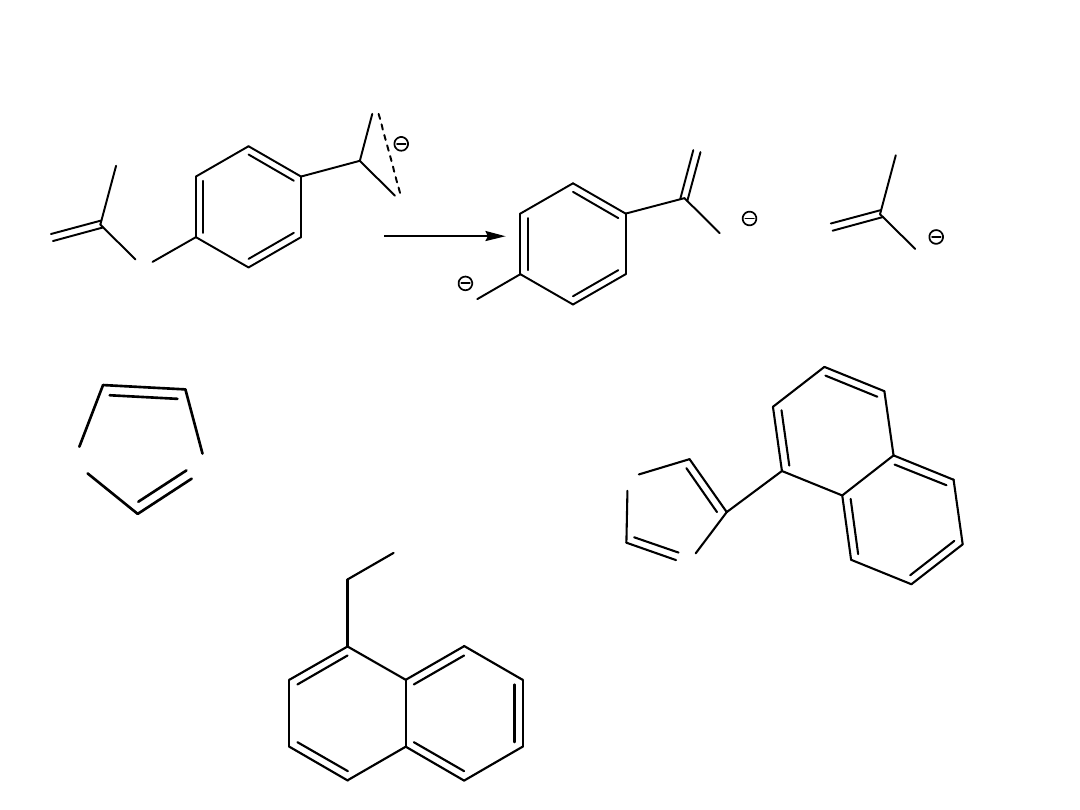
SIŁY HYDROFOBOWE
SIŁY HYDROFOBOWE
O
O
O
O
O
O
O
O
O
N
HN
1
N
HN
128
NH
2
4200

WNIOSKI
WNIOSKI
• Hydrofobowość zależy od powierzchnie kontaktu
oddziałujących ze sobą cząsteczek
• Siły hydrofobowe pełnią istotną rolę w wiązaniu
substratu z enzymem.
• Siły hydrofobowe powodują przyspieszenie reakcji
od 10 do 20 razy.

Kataliza kowalencyjna
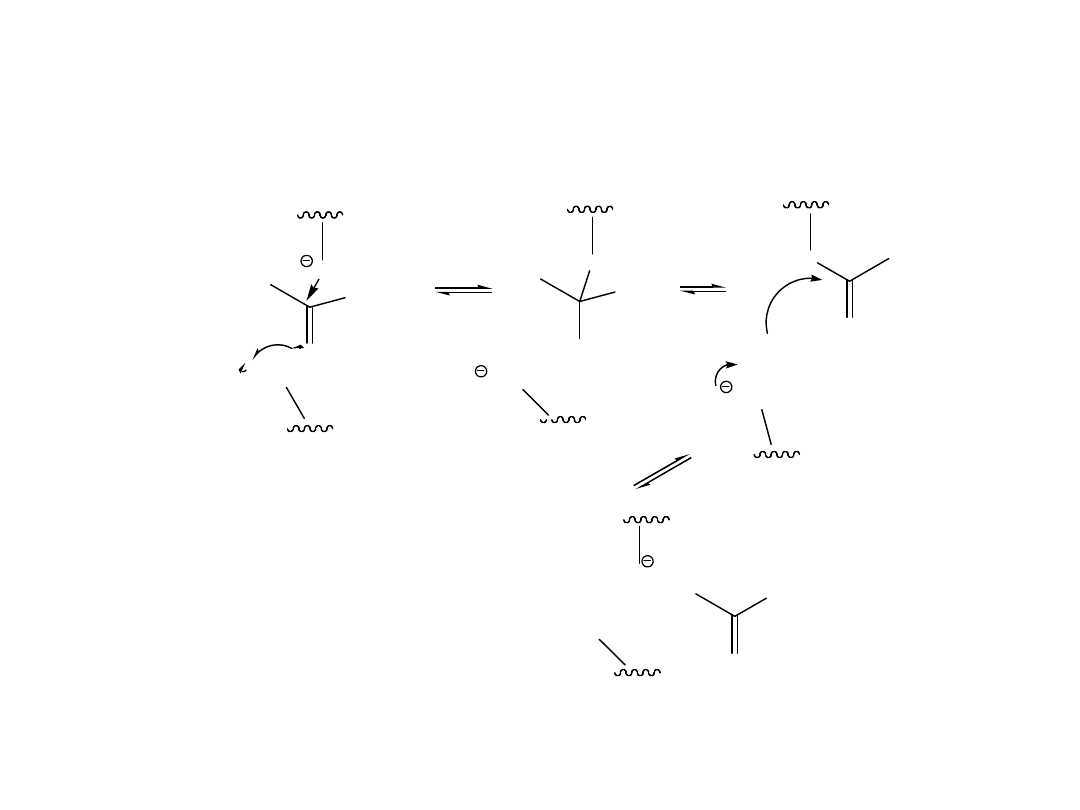
Kataliza nukleofilowa:
Reakcja centrum nukleofilowego enzymu z centrum
elektrofilowym substratu ( Tetraedryczny stan przejściowy)
Odejście grupy dobrze odchodzącej i utworzenie produktu
pośredniego
Atak nukleofila ( np. jon OH- ) i utworzenie produktu reakcji
Grupy nukleofilowe enzymów:
OH Seryna
Imidazol
Histydyna
Aminowa
Lizyna
CO2-
Asparaginian, glutaminian
Przykłady: reakcje hydrolizy estrów, amidów
Zalety reakcji katalizowanej przez enzymy:
Reakcja jednocząsteczkowa, wewnątrzcząsteczkowa
Korzystna entropowo
Grupy nukleofilowe enzymu ( SH, OH) są bardzo reaktywnymi
nukleofilami
Związek pośredni jest bardziej reaktywny od substratu
O
O
OR
O
OH
OR
O
O
-ROH
OOC
H-OH
HOOC
OOC
O
HOOC
O
OH
Reakcja hydrolizy estrów działaniem
lipazy

Zalety reakcji katalizowanej przez enzymy:
Reakcja jednocząsteczkowa, wewnątrzcząsteczkowa
Korzystna entropowo
Grupy nukleofilowe enzymu ( SH, OH) są bardzo reaktywnymi
nukleofilami
Związek pośredni jest bardziej reaktywny od substratu
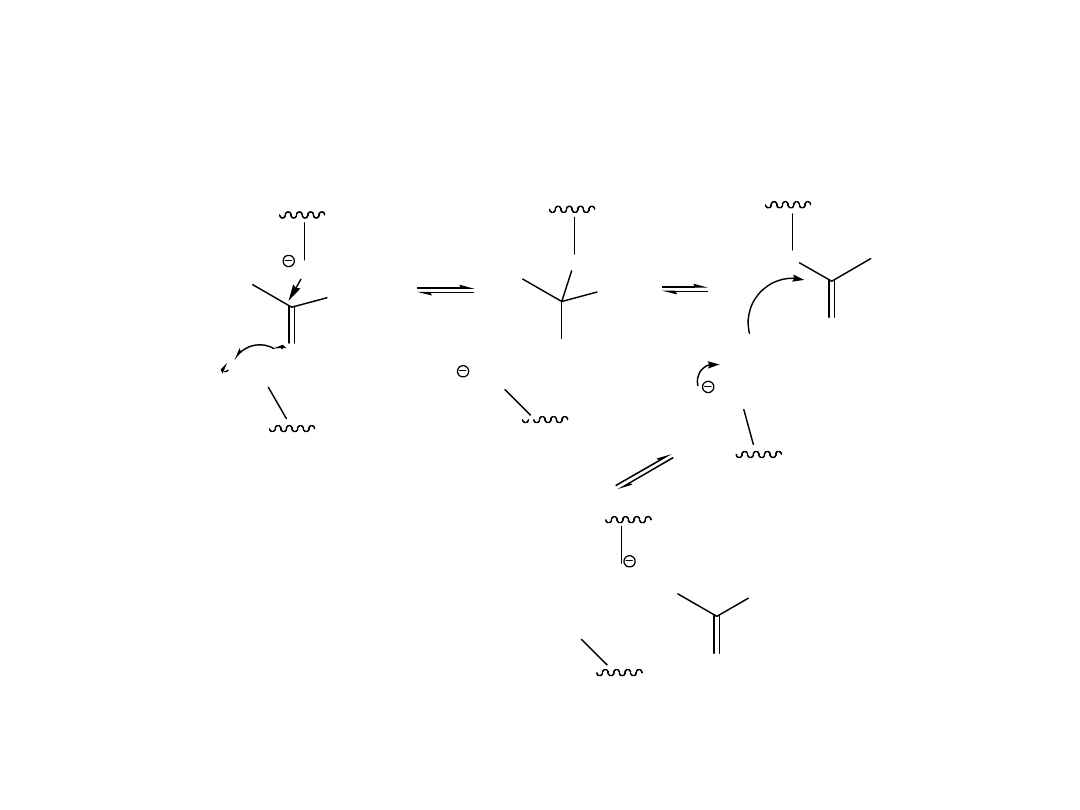
O
O
OR
O
OH
OR
O
O
-ROH
OOC
H-OH
HOOC
OOC
O
HOOC
O
OH
Reakcja hydrolizy estrów
działaniem lipazy

Ogólna kataliza kwasowo-zasadowa
Hydroliza estru
CH3-COOEt + HOH = CH3-COOH + EtOH
Kat: zasady, kwasy np. OH- , H+
Jednoczesna enzymatyczna kataliza kwasowa i zasadowa
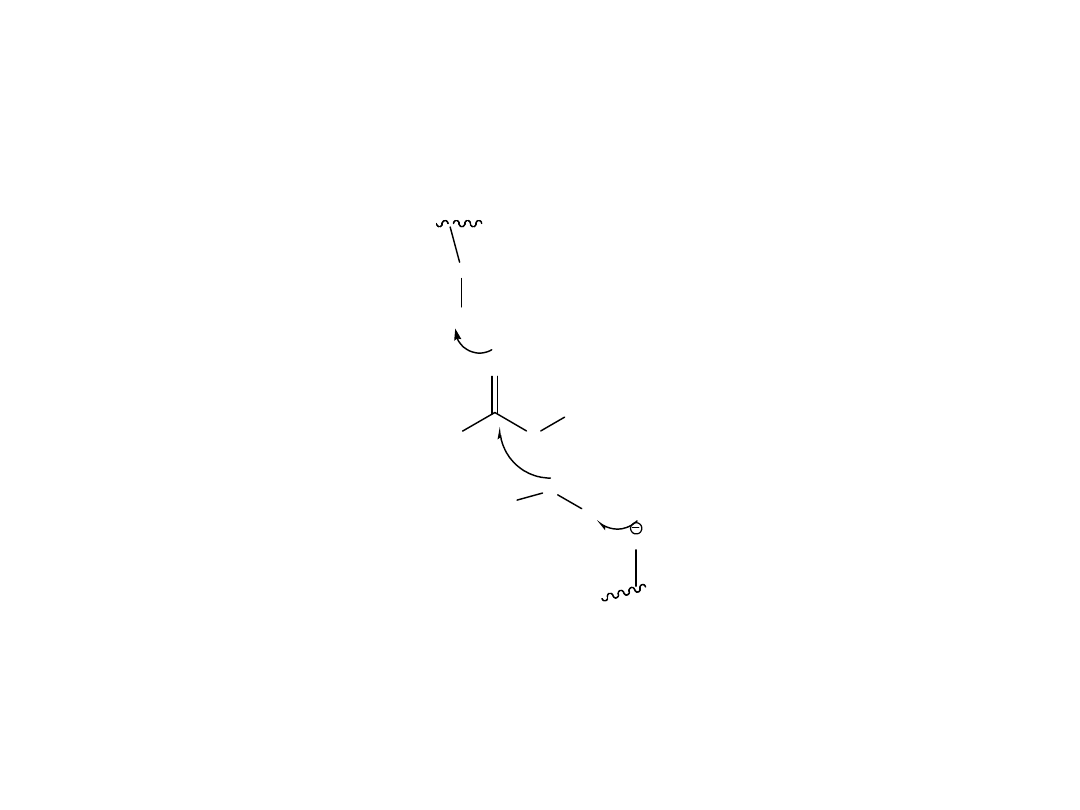
R
O
H
O
H
O
H
B
BH
H
Jednoczesna enzymatyczna kataliza kwasowa i
zasadowa
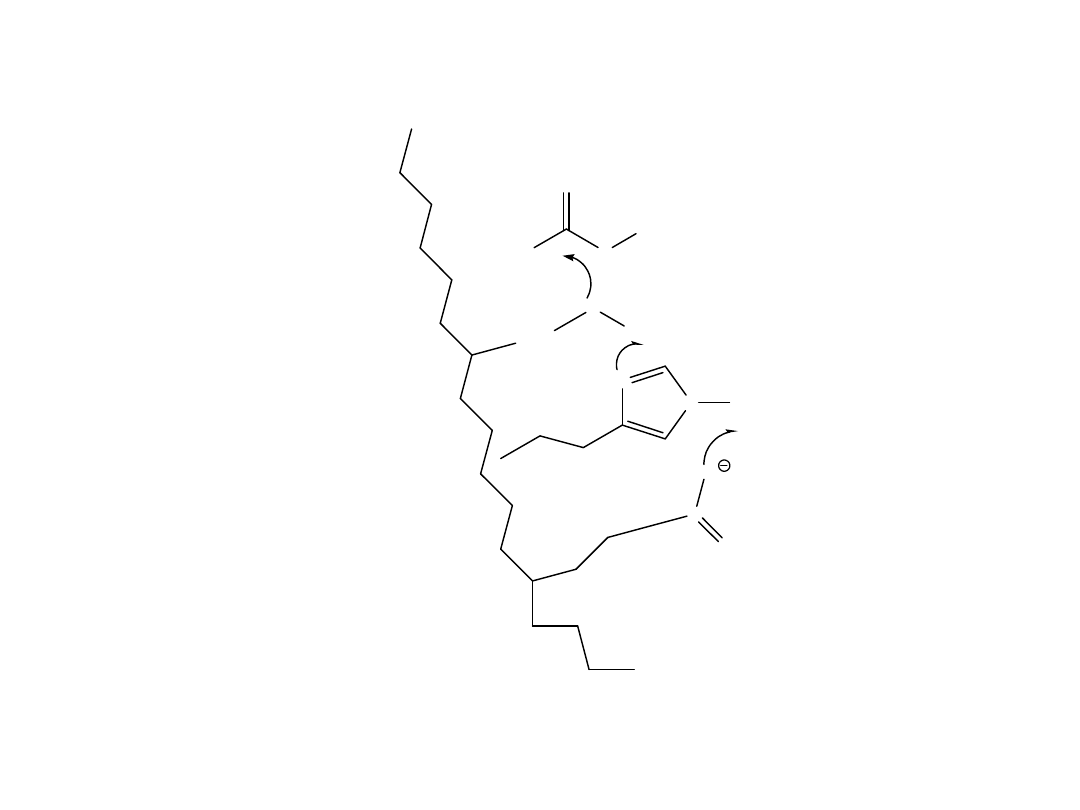
R
O
H
O
Ser
O
H
N
N
H
C
O
O
Asp
His
Przekazywanie ładunku w czasie aktywacji seryny (charge-relay
system)

Deprotonizacja histydyny przez grupę karboksylową kwasu
asparaginowego
Usunięcie protonu z grupy hydroksylowej seryny
Atak utworzonego jonu alkoksylowego ( reaktywny
nukleofil) na centrum elektrofilowe
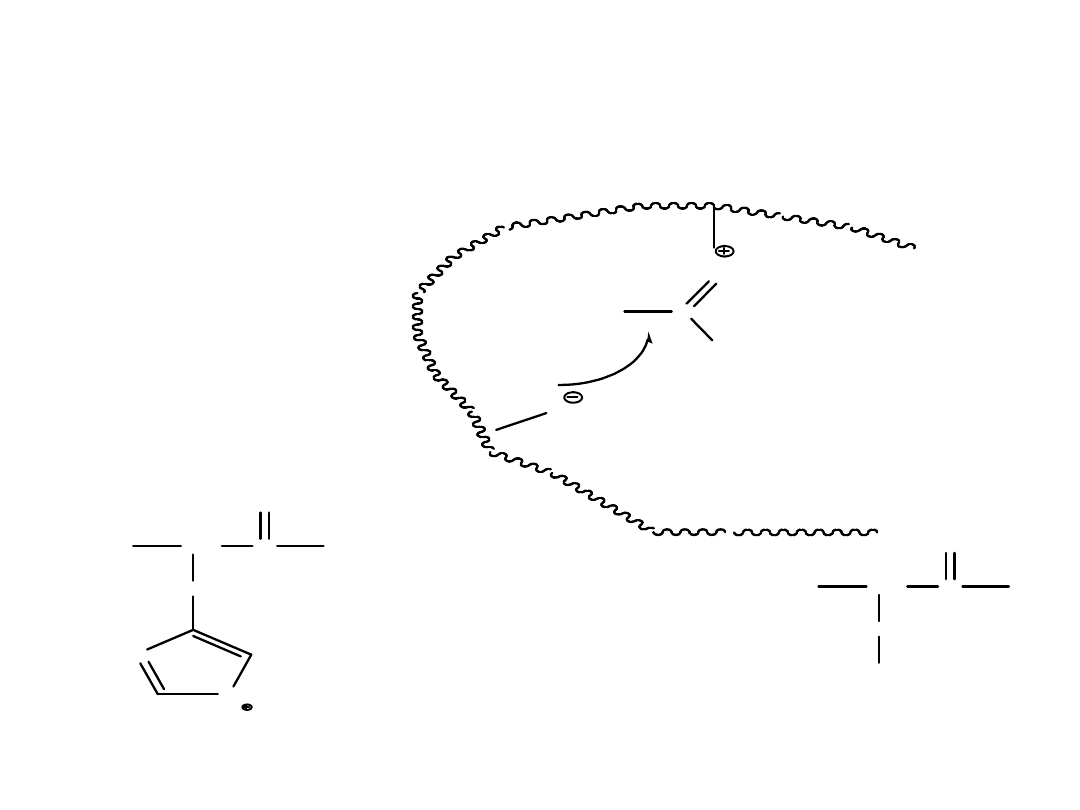
Kataliza
elektrostatyczna
R
C
NHR
O
O
His
Ser
H
2
N
CH
C
CH
2
OH
O
OH
H
2
N
CH
C
CH
2
OH
O
N
NH
2
His
Ser

Naprężenie i odkształcenie
Wiązanie substratu indukuje zmianę konformacji (E i S)
Grupy funkcyjne substratu przyjmują właściwą orientację wobec
aktywnych grup funkcyjnych enzymu
Pojawia się naprężenie w substracie ( destabilizacja substratu)
Wartość G# obniża się z uwagi na uwolnienie naprężenia

Leki

Leki. Inaktywacja i hamowanie działania enzymu.
Inhibitor- spowalnia lub blokuje reakcję katalizowana prze enzym
Inaktywator- nieodwracalnie wiąże się z enzymem
Enzym........Lek
E
Związek (i) Związek (k)
a) zmniejszone stężenie (i) .... choroba
np. Kwas 4-aminomasłowy (i).......Padaczka
Terapia:
zwiększenie koncentracji kwasu w płynie mózgowym
hamowanie działania enzymu (aminotransferaza 4-aminobutanowa)
b) nadmiar (k).......choroba
np. kwas moczowy......skaza moczanowa
Terapia: hamowanie działania enzymu katalizującego tworzenie kwasu
( oksydaza ksantynowa katalizuje konwersję ksantyny do
Kwasu moczowego)
c) Związek (k)... metabolit niezbędny w procesie rozwoju komórki bakterii, wirusa
Chemioterapia: blokowanie enzymu hamuje wzrost i replikację komórek
Np. hamowanie działania racemazy alaninowej...blokowanie syntezy
Peptydoglikanów....utrudniona synteza ściany bakteryjnej
Kompetencyjne inhibitory
odwracalne
Sulfonamidy
NH
2
H
2
N
N
N
SO
2
NH
2
prontosil
SO
2
NH
2
H
2
N
sulfanilamid
Mechanizm
działania
N
N
N
H
N
H
2
N
OH
O
P
2
E
H
2
N
COO
N
N
N
H
N
H
2
N
OH
H
N
COO
Kwas
dihydrofoliowy
E- syntetaza dihydropteranowa
Kwas dihydrofoliowy Tetrahydrofolian synteza puryn
DNA
Mechanizm
działania
H
2
N
C
O
–
O
H
2
N
S
O
–
O
NR
H
2
N
S
O
O
NH
R
H
2
N
S
O
-
N
R
O
var
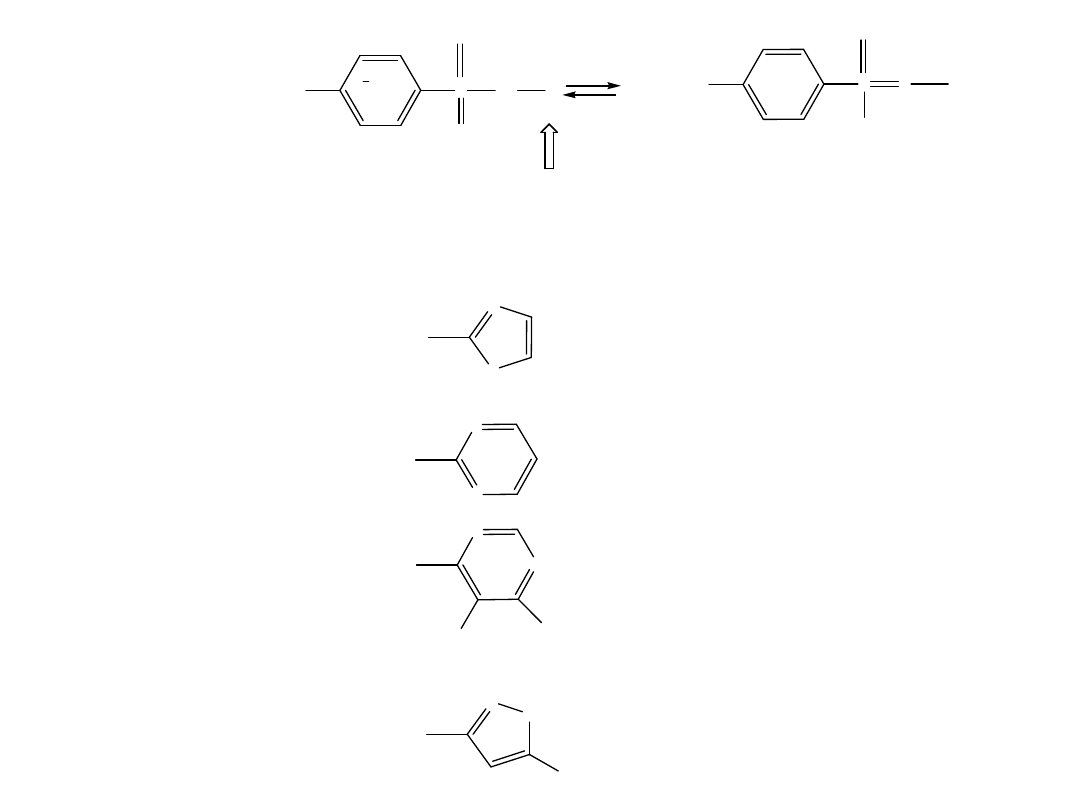
H
2
N
S
O
O
NH
R
H
2
N
S
O
-
N
R
O
var
R:
N
S
SULFATIAZOL
N
N
SULFADIAZYNA
N
N
OCH
3
H
3
CO
SULFAMETOKSYNA
1 tydzien
O
N
CH
3
SULFAMETOKSAZOL
Kwas foliowy
Tetrahydrofolian
Kwas 4-Amino-
benzoesowy
Puryny
DNA
SULFAMETOKSAZOL
TRIMETOPRIM
N
N
H
2
N
CH
2
OCH
3
OCH
3
OCH
3
NH
2
TRIMETOPRIM

Białka transportujące
komórki ssaków
bakterie
Kwas foliowy
+
-
Enzymy syntezujące
-
+
Kwas foliowy
Proleki
PRONTOSIL
SUKCYNYLOSULFOTIAZOL
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
Wyszukiwarka
Podobne podstrony:
02-03-2009 zestawienie skladnikow
Była minister Blaira o kulisach ataku na Irak (02 03 2009)
02 03 2009 zestawienie skladnikowid 3886
W0 Biotechnologia (02 03 2009)
wykład 23.02 i 8.03.08(1), Ekonomia
wykład 23.02 i 8.03.08, notatka
07 gestalt - kognitywizm 23.02.2007 - 02.03.2007, JĘZYKOZNAWSTWO, Notatki
Były więzień Guantanamo oskarża USA o tortury (23 02 2009)
Ćw 1 23.02.2009 Ośrodkowy i obwodowy neuron ruchowy, studia, Neurologia
Ćw 1 23.02.2009 - organizacyjne, studia, Neurologia
23 02 2009
Otwarcie unikatowego Muzeum Narodowego (23 02 2009)
MPLP 306;307 23.02;07.03.2011(1)
1 Skały osadowe (23 02 2010; 2 03; 9 03)
więcej podobnych podstron