
Fermentacyjne technologie
wytwarzania enzymów i białek
terapeutycznych wysokiej wartości

Porównanie cech preparatów enzymatycznych o niskiej czystości,
produkowanych w dużych ilościach i preparatów o wysokim stopniu
oczyszczenia
Enzymy do celów technologicznych,
wytwarzane w dużych ilościach (bulk)
Enzymy wysokiej czystości
Niewielki koszt jednostkowy, cena
kalkulowana na jednostki masy
Surowe preparaty, często poniżej 10%
białka
Obecność innych enzymów
Preparaty otrzymane w wyniku suszenia
rozpyłowego lub stężone roztwory
Brak stabilizatorów
Niewiele etapów oczyszczania
Próbki dostępne nieodpłatnie
Minimalne zamówienie 1-2 kg
Wysoki
koszt
jednostkowy,
cena
kalkulowana na jednostki aktywności
enzymu
Wysoka czystość, często powyżej 90%
Inne enzymy nieobecne, lub ich obecność
określona ilościowo
Liofilizaty lub zawiesiny w roztworze
siarczanu amonu
Obecne stabilizatory
Wiele etapów oczyszczania, w tym
techniki chromatograficzne
Brak takich próbek
Szeroki
zakres
dostępnych
ilości
(poczynając od bardzo niewielkich)
Produkcja enzymów

Warunki wytwarzania enzymu rekombinowanego
1. Producent bakteryjny– zwykle szczep E. coli zawierający plazmid
kodujący enzym w wektorze z markerem oporności na antybiotyk
i obszar induktorowy.
Fermentacja okresowa z zasilaniem. Wzrost początkowy w pożywce
minimalnej (glukoza + ekstrakt drożdżowy + sole + antybiotyk).
W fazie początkowej wzrostu dodawanie składników odżywczych
w kontrolowany sposób. Źródło azotu – sole amonowe, mocznik.
Po osiągnięciu fazy intensywnego wzrostu – dodanie induktora.
Proces trwający 24 – 48 h w temperaturze 24 – 28 C.
Osiąga się do 50% ogólnej puli białek, z wydajnością 10 – 15 g/L
2. Alternatywni producenci – drożdże (S. cerevisiae, Pichia pastoris),
grzyby – Aspergillus, Fusarium. Gen zintegrowany z chromosomalnym
DNA + efektywny promotor. Pożywki z tanimi źródłami węgla i azotu.
Fermentacja 4 – 8 dni. Enzymy często wydzielane poza komórkę,
co obniża koszty izolacji.
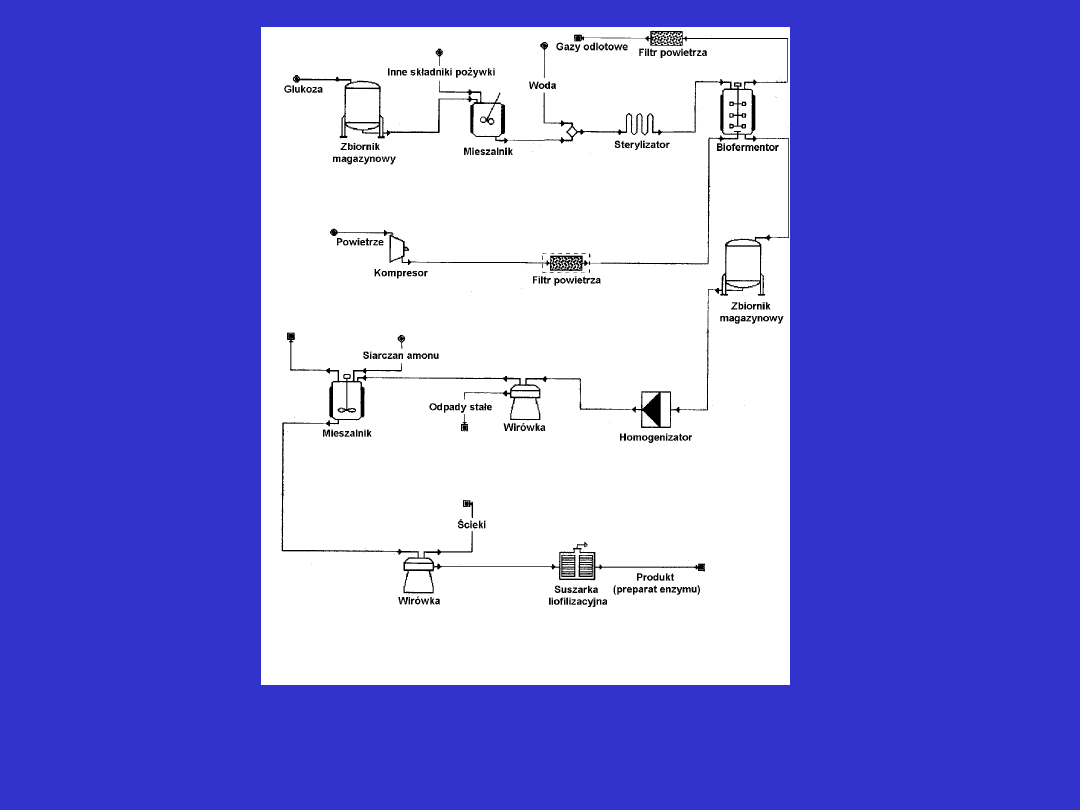
Schemat technologiczny wytwarzania enzymu

Przykłady enzymów stosowanych w diagnostyce
Enzym
Źródło (oryginalne)
Stosowany do oznaczania
----------------------------------------------------------------------------------------------------------------
Oksydaza cholesterolowa Nocardia erythropolis
Cholesterol
lub Brevibacterium spp.
Kreatynaza
Pseudomonas spp.
Kreatyna
Kreatyninaza
j.w.
Kreatynina
-galaktozydaza
E. coli
jony Na
+
, ELISA
Oksydaza glukozowa Aspergillus niger
Glukoza
Dehydrogenaza Glc-6-P
Leuconostoc mesenteroides
Glukoza
-glukozydaza
S. cerevisiae
aktywność -amylazy
Oksydaza glicerolo-3-P
Aerococcus viridians
Triacyloglicerole
Heksokinaza
S. cerevisiae
Glukoza
Peroksydaza
Chrzan
Enzym wskaźnikowy,
testy ELISA
Oksydaza pirogronianowa Pediococcus spp.
Pirogronian, transami-
nazy
Oksydaza kwasu
moczowego
Arthrobacter protopharmiae
Kwas moczowy
Ureaza
Klebsiella aerogenes
Mocznik

Białka rekombinowane terapeutyczne
Białko
Leczona choroba
Rok zaakceptowania
------------------------------------------------------------------------------------------------------------------
Insulina
Cukrzyca
1982
Ludzki hormon wzrostu
Karzełkowatość
1985
Interferon alfa
Wirusowe zapalenie wątroby
niektóre nowotwory
1986
Szczepionka przeciwko wiru-
sowemu zap. wątroby typu B
Zapobieganie WZW typu B 1986
Aktywator plazminogenu
Zawał serca, zator naczyniowy
1987
Erytropoetyna
Anemia związana z niewydolnoś-
cią nerek
1989
Interferon gamma
Chroniczna granulomatoza 1990
Czynnik stymulujący granulocyty Neutropenia, stany po przesz-
czepach szpiku
1991
Czynnik krzepliwości VIII
Hemofilia A
1992
Interferon beta
Stwardnienie rozsiane
1993
DNaza
Zwłóknienie torbielowate
1994
Glukocerebrozydaza
Choroba Gauchera
1994
Czynnik krzepliwości IX
Choroba Christmasa
1997
Interleukina-10
Zapobieganie trombocytopenii
1997
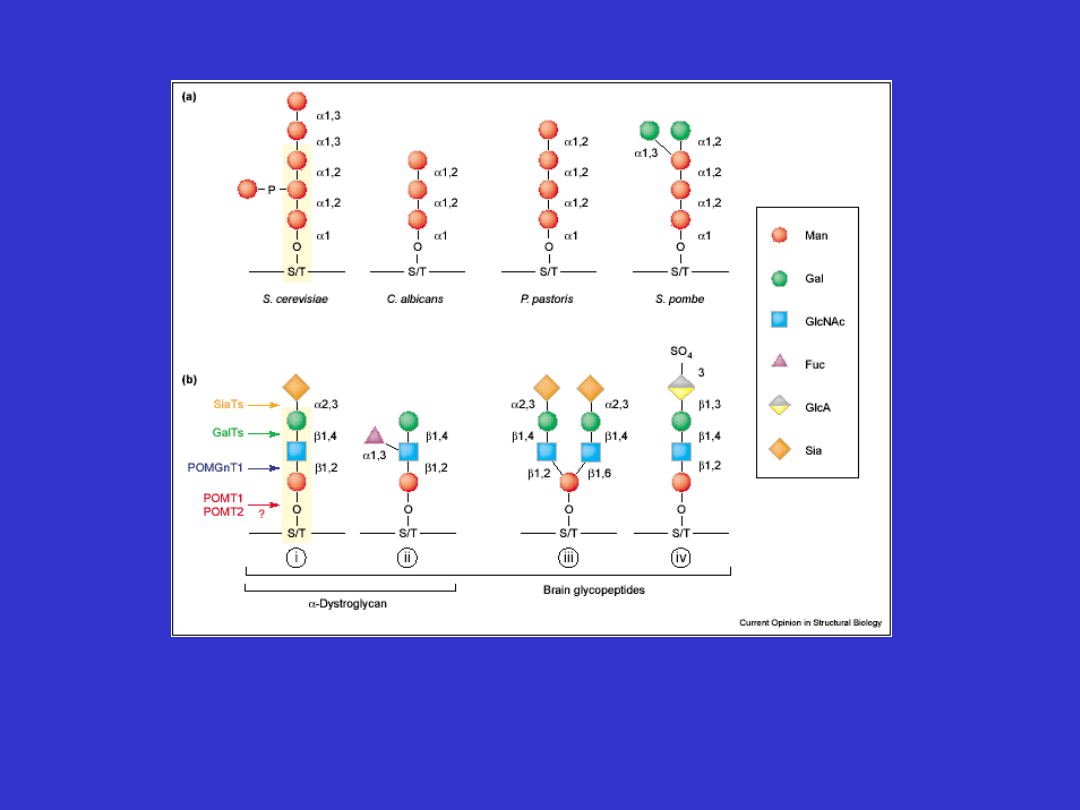
Białka, które są glikoproteinami nie mogą być wytwarzane
w komórkach bakteryjnych. Komórki grzybów wytwarzają
glikoproteiny o innej budowie niż komórki ssacze.

Pierwsze białko terapeutyczne wytwarzane
przez zwierzę transgeniczne
Atryn, pierwszy lek pochodzący od zmodyfikowanego
genetycznie zwierzęcia został dopuszczony do użytku
w Europie przez Europejską Agencję do spraw Leków
(EMEA) w roku 2006.
Atryn jest uzyskiwany z mleka genetycznie
zmodyfikowanych kóz, które mają gen kodujący
antyrombinę – białko hamujące patologiczne
krzepnięcie krwi.
Niedobór antytrombiny – choroba o podłożu
genetycznym (1 raz na 5 tys. osób).
Jedna koza może zastąpić 90 000 ludzkich dawców krwi.
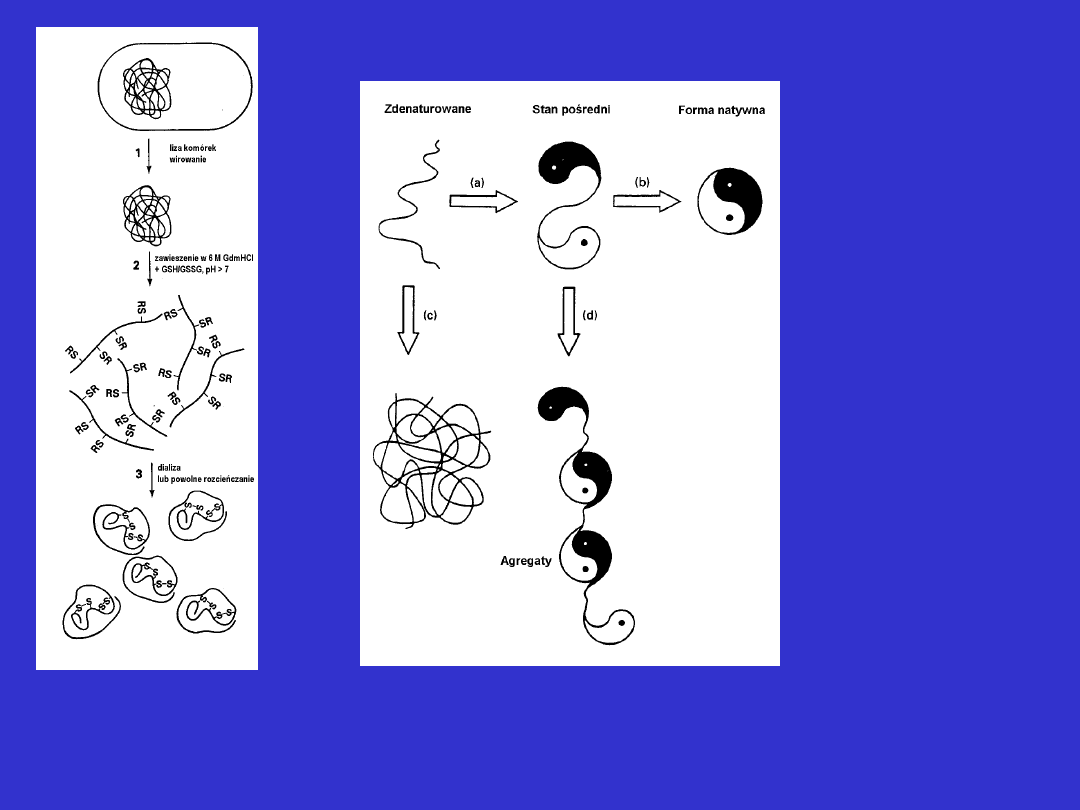
Naturacja białek z ciał inkluzyjnych
1. Liza komórek; 2. Wydzielenie ciał inkluzyjnych poprzez wirowanie; 3. Rozpuszczenie w
roztworze 6-8 M mocznika (+ mieszania zredukowanego i utlenionego glutationu, w razie
potrzeby); 4. Powolne usuwanie czynnika denaturującego – rozcieńczanie, dializa
Problem tworzenia
agregatów podczas
fałdowania białek

Białka terapeutyczne rekombinowane I generacji
Insulina
Genentech, Eli Lilly
1. Osobna ekspresja łańcuchów A i B w E. coli jako białek fuzyjnych
z syntazą tryptofanową i -galaktozydazą;
2. Rozszczepienie bromocyjanem;
3. Połączenie łańcuchów przez chemiczną reoksydację
Novonordisk
Ekspresja proinsuliny w E. coli, potem usunięcie enzymatyczne

Gensulin (BIOTON)
Konstrukcja genu:
sekwencja kodująca Peptyd B-dipeptyd-Peptyd A-peptyd nośnikowy
Ekspresja w Escherichia coli
Produkt:
białko fuzyjne w ciałach inkluzyjnych
Etapy izolacji wstępnej:
rozbicie komórek, izolacja ciał inkluzyjnych, naturacja
Półprodukt:
prekursor z mostkami disiarczkowymi
Obróbka:
rozcięcie hydrolityczne – oddzielenie peptydu nośnikowego oraz
przecięcie wiązania peptydowego pomiędzy dipeptydem a peptydem A
Oczyszczanie:
chromatografia kolumnowa
Dalsza obróbka:
usunięcie dipeptydu przy użyciu karboksypeptydazy
Produkt:
insulina identyczna z ludzką, o czystości około 95%
Dalsze oczyszczanie:
HPLC, ekstrakcja, krystalizacja
Produkt:
insulina identyczna z ludzką, o czystości ponad 99,9%
Białka terapeutyczne rekombinowane I generacji
Document Outline
Wyszukiwarka
Podobne podstrony:
Fermentacyjne technologie zagospodarowanie odpadów
Korbutowicz,optoelektronika,Technologia wytwarzania półprzewodnikowych struktur optoelektronicznych
pytania-enzymy, Technologia żywności UWM, enzymologia
cw 3 lab, Imir imim, Semestr 3, Technologie wytwarzania
Wykonywanie otworow, Technologie wytwarzania, Obróbka skrawaniem, Wiercenie
lab2(v2), Semestr III, Technologie wytwarzania
Dobór technologii wytwarzania zadanie
Nowoczesne technologie wytwarzania biopaliw Prof Koltuniewicz
kiossdobry, PW Transport, Gadżety i pomoce PW CD2, płytki, Technologia wytwarzania
Spawanie, PW Transport, Gadżety i pomoce PW CD2, płytki, Technologia wytwarzania
Technologie wytwarzania, Technologie wytwarzania
TECHNOLOGIA WYTWARZANIA, Szlifowanie i ostrzenie - gotowa sciaga, Szlifowanie - jest obróbką ze skra
dokłądność geometryczna tokarki, UTP-ATR, Technologia wytwarzania dr. Matuszewski
pyt i odp, POLITECHNIKA POZNAŃSKA, LOGISTYKA, semestr III, technologia wytwarzania, odlewnictwo pyta
cw 2 lab, Imir imim, Semestr 3, Technologie wytwarzania
Technoligie wytwarzania II sprawozdania, OBróbka elektroerozyjna, POLITECHNIKA KRAKOWSKA
Labolatorium podstaw techniki światłowodowej, Technologia wytwarzania światłowodów, POLITECHNIKA LUB
Labolatorium podstaw techniki światłowodowej, Technologia wytwarzania światłowodów, POLITECHNIKA LUB
NOWE TECHNOLOGIE WYTWARZANIA BIOKOMPONENTÓW I BIOPALIW
więcej podobnych podstron