
kwasy karboksylowe
estry
tłuszcze
hydroksykwasy

Budowa kwasów
karboksylowych
Kwasy karboksylowe
– związki organiczne, których
cząsteczki zwierają
jedną
lub
kilka
grup
karboksylowych: - COOH
Grupa karboksylowa – grupa funkcyjna złożona z dwóch
grup
funkcyjnych karbonylowej C = O
, z którą
związana jest
grupa hydroksylowa OH
O
//
-
C
–
OH
Atom węgla w grupie karboksylowej jest w
hybrydyzacji
sp
2
, tworzy
trzy wiązania σ
: jedno z drugim atomem
węgla (lub wodoru w przypadku kwasu mrówkowego),
drugie z atomem tlenu z grupy hydroksylowej, trzecie z
karbonylowym atomem tlenu
oraz jedno wiązanie π
z
karbonylowym atomem tlenu.
Obecność tlenu karbonylowego
zwiększa
polaryzację
wiązania tlen – wodór grupy hydroksylowej
i ułatwia
rozpad heterolityczny tego wiązania,
czyli dysocjację
elektrolityczną
- z uwolnieniem H
+

Budowa i klasyfikacja
kwasów
Podział ze względu na liczbę grup karboksylowych:
Mono
karboksylowe
nasycone
R
-
COOH
H
–
COOH
kwas mrówkowy
(
metan
owy
)
CH
3
–
COOH
kwas octowy (
etan
owy
)
CH
3
– CH
2
–
COOH
kwas propionowy
(
propan
owy
)
H
3
18
C
–
(CH
2
)
16
–
1
COOH
kwas stearynowy
(
oktadekan
owy
)
Di
karboksylowe nasycone
HOOC
– R –
COOH
HOOC
–
COOH
kwas szczawiowy
(
etano
diowy
)
HOOC
–
CH
2
–
COOH
kwas malonowy
(
propano
di
owy
)
Mono
karboksylowe nienasycone
H
2
3
C
=
2
CH
–
1
COOH
kwas akrylowy (prop-
2
-
enowy)
H
3
18
C
–
(CH
2
)
7
–
10
CH
=
9
CH
–
(CH
2
)
7
–
1
COOH
kwas oleinowy
(
oktadec
-
9
-
en
owy
)
Budowa i klasyfikacja
kwasów
Kwasy
aromatyczne
mono
karboksylowe
Ar
–
COOH
-
COOH
kwas benzoesowy
(
benzeno
karboksylowy)
Kwasy
aromatyczne
poli
karboksylowe
HOOC
- -
COOH
HOOC
- -
COOH
kwas
benzeno
-
1,2,4,5
–
tetra
karboksylowy
1
2
4
5
Nazewnictwo systematyczne
kwasów karboksylowych
Kwasy alifatyczne nasycone monokarboksylowe
Węgiel z grupy karboksylowej należy do głównego łańcucha
węglowego
, stąd w nazwie po
słowie kwas
do
nazwy alkanu
należy dodać końcówkę
owy
, nie ma potrzeby podawania
lokantu
, ponieważ węgiel z grupy karboksylowej zawsze ma
lokant 1.
4
CH
3
–
3
CH
2
–
2
CH
2
–
1
COOH
kwas
butan
owy
Kwasy alifatyczne nienasycone monokarboksylowe
Do nazwy odpowiednio
alkenu
lub
alkinu
z
podanym
lokantem wiązania wielokrotnego
należy dodać końcówkę
-
owy
4
CH
3
–
3
CH
=
2
CH
–
1
COOH
kwas
but
-
2
-
en
owy
4
CH
2
=
3
CH
–
2
CH
2
–
1
COOH
kwas
but
-
3
-
en
owy
4
CH
3
–
3
C
≡
2
C
–
1
COOH
kwas
but
-
2
-
yn
owy
4
CH
≡
3
C
–
2
CH
2
–
1
COOH
kwas
but
-
3
-
yn
owy
Nazewnictwo systematyczne
kwasów karboksylowych
Kwasy
alifatyczne
di
karboksylowe
G
rupy karboksylowe
mogą być związane tylko
z
końcowymi
(pierwszy i ostatni)
atomami węgla grupy
alkilowej
,
atomy węgla w grupach karboksylowych
należą do
głównego łańcucha węglowego,
w nazwie po
słowie kwas
podaje się nazwę alkanu
i po łączniku
o
podaję liczbę grup karboksylowych
(di) i dodaje się
końcówkę –
owy
HOOC
–
CH
2
– CH
2
–
COOH
kwas
butan
o
di
owy
HOOC
–
CH
2
–CH
2
– CH
2
–
COOH
kwas
pentan
o
di
owy
Kwasy
aromatyczne
Po słowie kwas
należy podać nazwę arenu
(np.
benzen) oraz łącznik
o
i słowo
karboksylowy
C
6
H
5
–
COOH
kwas
benzen
o
karboksylowy
Otrzymywanie kwasów
karboksylowych
Metoda laboratoryjna
sól kwasu karboksylowego + H
2
SO
4
w podwyższonej
temp.
CH
3
–
COO
Na
+ H
2
SO
4
2
CH
3
–
COOH
+
Na
2
SO
4
etanian
sodu
kwas
etan
owy
(octowy)
Metody przemysłowe
• Katalityczne utlenianie
(KMnO
4
lub K
2
Cr
2
O
7
)
alkoholi
I-rz.
do
aldehydów,
a następnie do kwasów
karboksylowych
CH
3
- CH
2
-
OH
+ [O]
CH
3
-
CHO
+ H
2
O
etan
ol
etan
al
CH
3
–
CHO
+ [O]
CH
3
-
COOH
etan
al
kwas
etan
owy
(octowy)
• Katalityczne utlenianie ketonów
(reakcja z
rozerwaniem wiązania C- C)
powstaje mieszanina
kwasów karboksylowych
CH
3
–
CO
–
CH
3
+ 3[O]
H
-
COOH
+
CH
3
–
COOH
propan
on
kwas
metan
owy
+
etan
owy

Otrzymywanie kwasów
karboksylowych cd
Utlenianie alkanów
w obecności katalizatora (sole
kobaltu i magnezu) w podwyższonej temp.
2CH
3
– CH
2
– CH
2
– CH
3
+ 5O
2
4
CH
3
-
COOH
+
2H
2
O
butan
kwas
etan
owy
Reakcja alkenów z CO i H
2
O
(g)
,
w podwyższonej
temp.
i w obecności katalizatora
CH
3
– CH = CH
2
+ CO + H
2
O
CH
3
-CH
2
-CH
2
-
COOH
propen
kwas
butan
owy
Hydroliza trihalogenopochodnych węglowodorów
(podstawniki halogenowe muszą być przy tym
samym at. C)
CH
3
–
C
Cl
3
+2H
2
O
CH
3
–
COOH
+ 3HCl
1,1,1-tri
chloro
etan
kwas
etan
owy

Właściwości kwasów karboksylowych
• Kwas metanowy (mrówkowy)
– bezbarwna ciecz o
ostrym i duszącym zapachu oraz właściwościach
parzących, stężony powoduje poparzenia skóry, opary
podrażniają błony śluzowe, związek palny, dobrze
rozpuszczalny w wodzie
• Kwas etanowy (octowy)
– bezbarwna ciecz o
przenikliwym zapachu, związek palny, dobrze
rozpuszczalny w wodzie (6% lub 10% roztwór wodny
to ocet), stężony w temp. 16,6
o
C krzepnie w kryształy
podobne do lodu (lodowaty kwas octowy)
W roztworach wodnych ulegają
dysocjacji
elektrolitycznej
:
• H – COOH + H
2
O ↔ HCOO
-
+ H
3
O
+
• CH
3
– COOH + H
2
O ↔ CH
3
- COO
-
+ H
3
O
+
Właściwości kwasów
karboksylowych cd.
• Rozpuszczalność kwasów karboksylowych
w wodzie
maleje
wraz ze wzrostem liczby atomów C w cząsteczce kwasu:
kwasy metanowy, etanowy, propanowy i butanowy
rozpuszczają się bez ograniczeń
od 5 do 8 at. C rozpuszczają się bardzo słabo
od 9 at. C są praktycznie nierozpuszczalne w wodzie.
• Kwasy mają wysokie temp. topnienia i wrzenia
(wyższe niż
woda),
jest to skutek powstających wiązań wodorowych
(efekt polarności wiązania w grupie karbonylowej = C = O i
hydroksylowej – OH
) i asocjacji cząsteczek:
O
….
H – O Tworzą się dimery kwasu
metanowego lub etanowego
// \
CH
3
– C
C – CH
3
…. wiązanie wodorowe
\ //
O – H
….
O
Właściwości kwasów
karboksylowych cd
• Kwas butanowy – masłowy
CH
3
– CH
2
– CH
2
–COOH
bezbarwna, oleista ciecz o nieprzyjemnym zapachu
i gorzkim smaku, rozpuszczalna w wodzie, etanolu
i eterze,
reszta tego kwasu występuje
w estrze gliceryny
(glicerolu)
– tłuszczu krowim (maśle), tłuszczach
roślinnych
i zwierzęcych,
W stanie wolnym występuje w zjełczałym maśle
–
powstaje w wyniku fermentacji masłowej laktozy
(cukru mlekowego – dwucukier zawierający reszty
:
β-D-galaktopiranozy
i
D- glukopiranozy
połączonych wiązaniem β – glikozydowym
)
prowadzonej przez drobnoustroje:
C
6
H
12
O
6
C
3
H
7
-COOH + H
2
↑ + 2CO
2
↑
Właściwości kwasów
karboksylowych cd
• Kolejne - do 9 atomów C w cząsteczce
kwasy karboksylowe
są oleistymi, lepkimi cieczami nierozpuszczalnymi w
wodzie.
• Powyżej 9 atomów C w cząsteczce są ciałami stałymi,
bezwonnymi i nierozpuszczalnymi w wodzie.
• Wraz ze wzrostem liczby atomów C w cząsteczce
oddziaływanie
polarnej grupy karboksylowej
–
tworzącej
wiązania wodorowe
z cząsteczkami wody
-
maleje
,
a wzrasta oddziaływanie
grupy węglowodorowej o niskiej polarności
–
nie mającej
zdolności tworzenia wiązań wodorowych.
• Cząsteczka kwasu składa się z dwóch części
:
hydrofilowej
(lubiącej wodę) – grupa karboksylowa
i grupy hydrofobowej
– nielubiącej wody – grupy węglowodorowej (R - , Ar -).
CH
3
– CH
2
– CH
2
– CH
2
– CH
2
–
COOH
grupa hydrofobowa
grupa hydrofilowa
• O zdolności rozpuszczalności związków organicznych w
wodzie
decyduje stosunek wielkości gr.
hydrofobowej
do gr.
hydrofilowej.
Właściwości chemiczne kwasów
karboksylowych
Dysocjacja elektrolityczna (jonowa)
• kwasy karboksylowe rozpuszczalne w wodzie
ulegają
dysocjacji z odszczepieniem kationu wodorowego
,
• moc kwasów karboksylowych
maleje wraz ze wzrostem
liczby at. C w cząsteczce,
• najmocniejszy jest kwas metanowy, kolejny kwas
etanowy (kwasy te są mocniejsze o kwasu
węglowego(IV):
H – COOH ↔ H
+
+ H-COO
-
lub H-COOH + H
2
O ↔ H
3
O
+
+ H-COO
-
CH
3
– COOH ↔ H
+
+ CH
3
– COO
-
lub CH
3
– COOH + H
2
O ↔ H
3
O
+
+ CH
3
-COO
-

Właściwości chemiczne kwasów
karboksylowych
Reakcje z metalami sól + wodór
2H – COOH + 2Na
2H-COONa + H
2
metanian (mrówczan) sodu
Reakcje z tlenkami zasadowymi i amfoterycznymi sól + woda
2CH
3
– COOH + CuO
(CH
3
–CH
2
– COO)
2
Cu + H
2
O
etanian (octan) miedzi(II)
2CH
3
-CH
2
-COOH + K
2
O
2CH
3
-CH
2
-COOK + H
2
O
propanian potasu
Reakcje z wodorotlenkami zasadowymi i amfoterycznymi sól
+ woda
2CH
3
–COOH + Pb(OH)
2
(CH
3
-COO)
2
Pb + 2H
2
O
etanian (octan)
ołowiu(II)
Reakcje z solami słabych kwasów słabych nieorganicznych
sól + słaby kwas nieorganiczny
Na
2
CO
3
+ 2CH
3
-COOH
2CH
3
-COONa + H
2
O + CO
2
etanian (octan) sodu

Właściwości chemiczne kwasów
karboksylowych
Reakcja z alkoholami (reakcje estryfikacji) w obecności
kationów H
+
ester + woda
O O
// //
CH
3
–
C – OH
+
H O
–
CH
3
CH
3
–
C
–
O
–
CH
3
+ H
2
O
kwas etanowy + metanol
etanian (octan) metylu
Odwodnienie (dehydratacja)
w obecności stężonego H
2
SO
4
bezwodnik kwasu organicznego + woda
CH
3
CH
3
CH
3
CH
3
| |
H
2
SO
4
| |
C C
C C +
H
2
O
// \ / \\
// \ / \\
O
OH H
O
O
O
O
O

Właściwości chemiczne kwasów
karboksylowych
Dekarboksylacja
- reakcja polegająca na usunięciu z
cząsteczki związku
cząsteczki tlenku węgla(IV) CO
2
produktem jest alkan
O
//
CH
3
– CH
2
– CH
2
-
C – O
– H
CH
3
– CH
2
- CH
3
+
CO
2
kwas butanowy propan
Dekarboksylacja w reakcji Kolbego
- elektroliza
wodnych roztworów soli kwasów karboksylowych:
A(+):
2R
–
COO
-
R – R
+
2CO
2
+ 2e
-
A(+):
2CH
3
–
COO
-
CH
3
– CH
3
+
2CO
2
+ 2e
-
anion octanowy etan

Budowa hydroksykwasów
Hydroksykwasy
– (dwufunkcyjne) pochodne węglowodorów
zawierających
w cząsteczkach dwie grupy funkcyjne:
karboksylową (–
COOH
)
i
hydroksylową
(– OH)
Hydroksykwasy
mono
karboksylowe
HO
- CH
2
–
COOH kwas
hydroksy
etanowy
(hydroksyoctowy)
3
CH
3
–
2
CH –
1
COOH kwas
2
-
hydroksy
propano
wy
|
(mlekowy)
OH
HO
-
3
CH
2
–
2
CH
2
–
1
COOH kwas
3-
hydroksy
propan
owy
4
CH
3
–
3
CH
2
–
2
CH –
1
COOH kwas
2
-
hydroksy
butan
owy
|
OH
4
CH
3
–
3
CH –
2
CH
2
–
1
COOH kwas
3-
hydroksy
butan
owy
|
OH
HO
–
4
CH
2
–
3
CH
2
–
2
CH
2
–
1
COOH kwas
4
-
hydroksy
butan
owy

Budowa hydroksykwasów
Hydroksykwasy
di
karboksylowe
HOOC
– CH
2
– CH –
COOH kwas
hydroksy
butano
di
owy
| (jabłkowy)
OH
HOO
1
C
–
2
CH –
3
CH
–
4
COOH kwas
3,4-
di
hydroksy
butano
di
owy
| | (winowy)
OH
OH
Hydroksykwasy
tri
karboksylowe
OH
|
HOO
5
C
–
4
CH
2
–
3
C –
2
CH
2
–
1
COOH kwas
3
-
hydroksy
-
3
-
karboksy
pentano
di
owy
|
(cytrynowy)
COOH

Rodzaje izomerii hydroksykwasów
–
izomery kwasu
hydroksybutanowego
Izomeria położenia podstawnika (pozycyjna)
CH
3
–
3
CH
2
–
2
CH –
1
COOH kwas
2
-
hydroksy
butan
owy
|
OH
HO
–
4
CH
2
–
3
CH
2
–
2
CH
2
–
1
COOH kwas
4
-
hydroksy
butan
owy
Izomeria szkieletowa (łańcuchowa)
HO
–
3
CH
2
–
2
CH–
1
COOH kwas
3
-
hydroksy-
2
-
metylo
propan
owy
|
CH
3
Izomeria optyczna
jest rodzajem izomerii geometrycznej
(przestrzennej) – związki posiadające
asymetryczny
(chiralny [*] – cztery różne podstawniki) atom węgla
mają zdolność skręcania światła spolaryzowanego – są
substancjami optycznie czynnymi .
Cząsteczka kwasu mlekowego
posiada dwa izomery
optyczne ( parę
enancjomerów
) będące lustrzanymi
odbiciami.

Izomeria optyczna
Kwas L-(+)-mlekowy
jest prawoskrętny,
powstaje w
mięśniach z glikogenu w wyniku fermentacji
mlekowej na skutek niedotlenia w trakcie dużego
wysiłku fizycznego. Powoduje uczucie zmęczenia
i bóle mięśni – kłucie.
Kwas D-(-)-mlekowy
jest lewoskrętny,
powstaje w
procesie fermentacji katalizowanej przez
bakterie –
Bacillus acidi laevolactici
– w trakcie kwaśnienia
mleka, kwaszenia kapusty, ogórków.
Otrzymywany syntetycznie
kwas mlekowy
jest
mieszaniną racemiczną – racematem
(
racemat
zawiera obie formy w
stężeniach równomolowych,
przez co jest optycznie nieczynny).
COOH
HOOC
| |
*C ….. OH HO …..*C
H
3
C CH
3
H
H
kwas
D
-(-) -mlekowy
L
-(+)-mlekowy
Otrzymywanie hydroksykwasów
Częściowe utlenienie dioli
(alkoholi dihydroksylowych)
CH
3
–CH–CH
2
–OH
+ 2[O]
CH
3
–CH–
COOH
+ H
2
O
| |
OH OH
propano-
1,2
-di
ol
kwas
2
-
hydroksy
propan
owy
Utlenienie kwasów aromatycznych
COOH COOH
OH
+
H
2
O
2
+
H
2
O
kwas benzoesowy
kwas salicylowy
Hydroliza halogenopochodnych kwasów karboksylowych w
środowisku zasadowym
CH
2
Cl
–
COOH
+
Na
OH
HO
– CH
2
-
COOH
+
Na
Cl
kwas
chloro
etan
owy
kwas
hydroksy
etan
owy
Hydratacja (uwodnienie) nienasyconych kwasów karboksylowych
CH
2
= CH –
COOH
+ H-
OH
OH-
CH
2
– CH
2
–
COOH
kwas prop
en
owy
kwas
3
-
hydroksy
prop
an
owy
Uwaga:
jeżeli
atom węgla z wiązaniem podwójnym
jest
połączony z
grupą COOH,
to reakcja addycji wody przebiega
niezgodnie z
regułą Markownikowa
.

Właściwości hydroksykwasów
Hydroksykwasy monokarboksylowe
są bezbarwnymi lepkimi
cieczami
lub
ciałami stałymi
,
natomiast dikarboksylowe
to
ciała stałe, krystaliczne
lepiej rozpuszczalne w wodzie niż
odpowiednie kwasy karboksylowe.
Obecność grup hydroksylowych powoduje
powstawanie wiązań
wodorowych między
cząsteczkami
i powstawanie asocjatów,
a
tym samym podwyższenie temp. topnienia i wrzenia.
Zdolność tworzenia wiązań wodorowych z cząsteczkami wody
wpływa na ich dobrą rozpuszczalność w wodzie.
Kwas mlekowy
– stosowany w przemyśle spożywczym,
farmaceutycznym, skórzanym.
Kwas cytrynowy
– stosowany w przemyśle spożywczym,
skórzanym i tekstylnym.
Kwas salicylowy
– substancja stała, krystaliczna, w zimnej
wodzie słabo rozpuszczalna, dobrze rozpuszcza się w wodzie
gorącej i etanolu,
reaguje (tak jak fenol) z jonami Fe
3+
dając
filetowo-granatowy związek kompleksowy,
stosuje się do
produkcji barwników, farmaceutyków ( leki
przeciwgorączkowe
i przeciwzapalne, przeciwreumatyczne, przeciwgruźlicze,
dezynfekujących) oraz środków zapachowych i
konserwacyjnych .

Właściwości chemiczne
hydroksykwasów
Hydroksykwasy
wykazują silniejsze właściwości kwasowe
niż
odpowiednie kwasy karboksylowe
,
wchodzą w
typowe reakcje dla kwasów hydroksylowych – tworzą
sole, alkoholany, estry amidy.
Reakcja z zasadami:
CH
3
–CH(
OH
)–
COOH
+
Na
OH
CH
3
-CH(
OH
)-
COO
Na
+
H
2
O
kwas mlekowy mleczan
sodu
Reakcja z aktywnymi metalami :
CH
3
– CH –
COOH
+ 2
Na
CH
3
– CH –
COO
Na
+
H
2
| |
OH O
Na
kwas mlekowy
(sól będąca jednocześnie
alkoholanem
i
solą
kwasu karboksylowego)
Reakcja z alkoholami (reakcje estryfikacji w obecności
H
+
)
CH
3
–CH(
OH
) –
CO
OH
+
H
O
-
CH
3
CH
3
-CH(
OH
)-
CO
-
O
-
CH
3
+
H
2
O
kwas mlekowy
metan
ol
mleczan
metylu
Właściwości chemiczne
hydroksykwasów cd
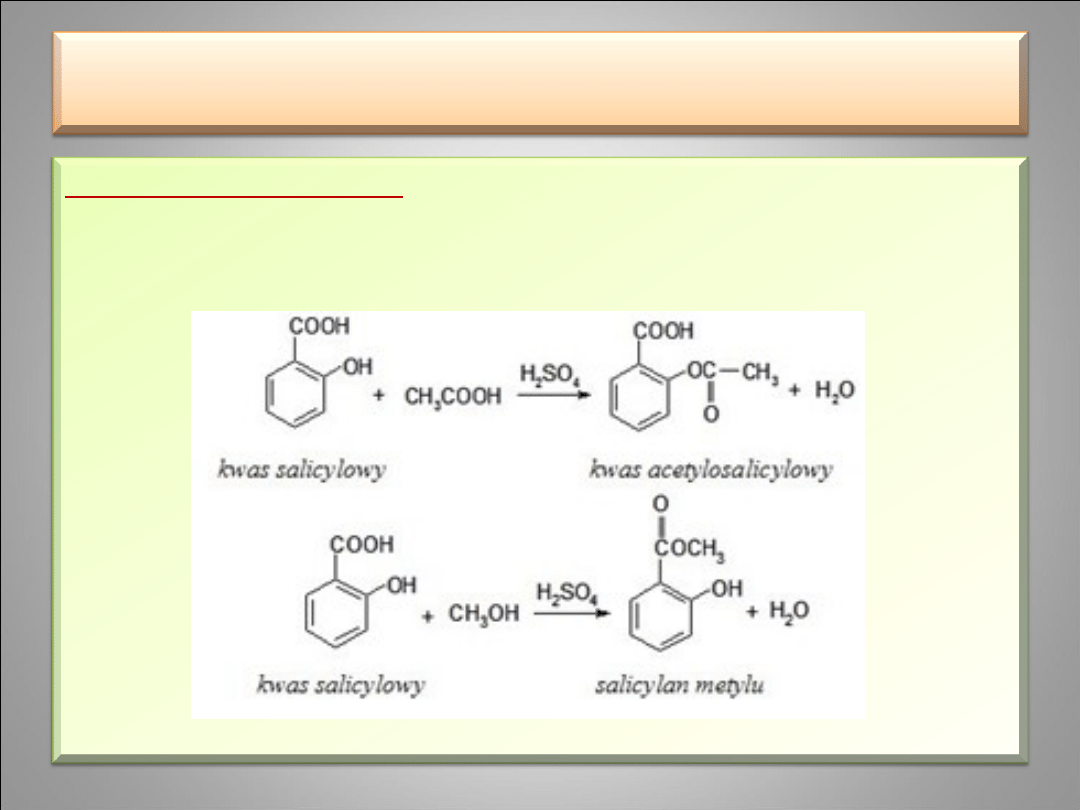
Reakcje estryfikacji -
prowadzą do utworzenia estrów,
przy czym stosując odpowiednie warunki można
zestryfikować grupę karboksylową lub hydroksylową.
Właściwości chemiczne
hydroksykwasów cd
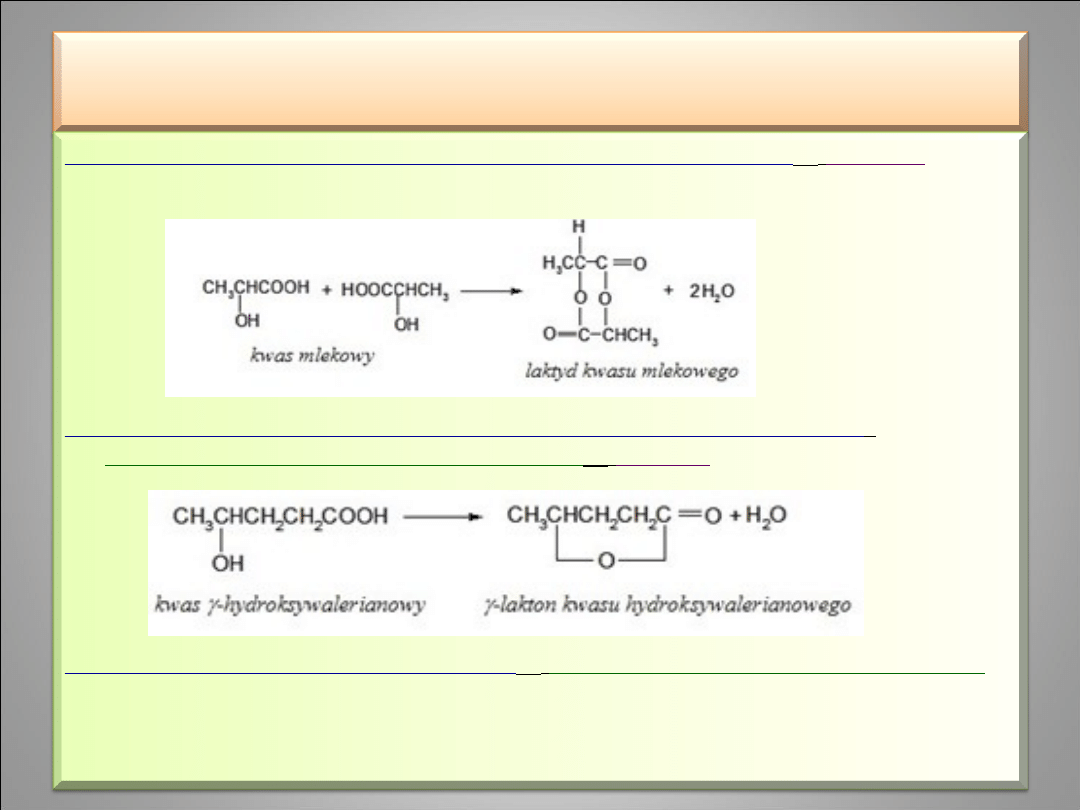
Dehydratacja międzycząsteczkowa α-hydroksykwasów
laktyd (
kwas
mlekowy
+ kwas mlekowy
laktyd kwasu mlekowego)
Dehydratacja wewnątrzcząsteczkowa γ i δ-hydroksykwasów
–
estryfikacja wewnątrzcząsteczkowa
lakton
Dehydratacja β-hydroksykwasów
nienasycony kwas karboksylowy
H
2
C – CH –
COOH
H
2
C = CH
–
COOH
+ H
2
O
| |
OH H
kwas
2
-hydroksy
propan
o
wy
kwas
propeno
wy
Hydroliza estrów
Hydroliza w środowisku kwasowym
(odwracalna – ustala
się stan równowagi z przesunięciem w kierunku
produktów):
ester + woda ↔ kwas karboksylowy + alkohol
(zanik zapach estru, wyczuwalny zapach kwasu
karboksylowego)
H
+
CH
3
– CO
–
O – CH
2
- CH
3
+ H
2
O ↔
CH
3
-COOH
+
CH
3
-
CH
2
– OH
etanian
(octan)
etylu
kwas etanowy
+
etanol
Hydroliza w środowisku zasadowym
(nieodwracalna):
ester + zasada sól kwasu karboksylowego
+ alkohol
(zanik zapachu estru, wyczuwalny zapach alkoholu)
CH
3
– CO
–
O – CH
2
- CH
3
+
NaOH
CH
3
-COO
Na
+
CH
3
- CH
2
– OH
etanian
(octan)
etylu
etanian
sodu
+
etanol
W środowisku obojętnym (po ogrzaniu z wodą) nie
dostrzega się istotnych zamian w zapachu , chociaż
hydroliza również zachodzi, ustala się stan
równowagi między substratami i produktami
hydrolizy.

Pozostałe właściwości
chemiczne estrów
Substytucja nukleofilowa
przy karbonylowym atomie
węgla (np. z NH
3
).
Redukcja wodorem
powstają odpowiednie alkohole
(2).
Alkoholiza (transestryfikacja)
– przekształcenie jednego
estru w inny w reakcji z odpowiednim alkoholem,
reakcja zachodzi w środowisku kwasowym lub
zasadowym i polega na wymianie grupy np.:
- O – CH
2
– CH
3
na
– O – CH
2
– CH
2
–CH
2
– CH
3
CH
3
– CO
–
O – CH
2
– CH
3
+
OH – CH
2
– CH
2
–CH
2
– CH
3
↔
etanian
(octan)
etylu
butan-1-ol
CH
3
– CO
–
O – CH
2
– CH
2
– CH
2
– CH
3
+
CH
3
– CH
2
– OH
etanian
(octan)
butylu
etanol
Właściwości estrów organicznych
Niższe estry
są lotnymi cieczami o gęstości mniejszej od
gęstości wody i niższych temp. wrzenia niż alkohole i kwasy
karboksylowe (
miedzy cząsteczkami estrów nie powstają
wiązania wodorowe
), ale
niższe estry mogą tworzyć
wiązania wodorowe z cząsteczkami wody
, stąd
ich
rozpuszczalność w wodzie
, dobrze rozpuszczają się w
rozpuszczalnikach organicznych, są dobrymi
rozpuszczalnikami zw. organicznych, farb i lakierów, np.
octan etylu stosowany jest jako zmywacz do paznokci.
W miarę wzrostu liczby atomów C
w cząsteczce estru ich
gęstość wzrasta – przechodzą w oleiste ciecze i ciała stałe,
ich lotność maleje, wzrastają temp. wrzenia, są trudno
rozpuszczalne w wodzie, dobrze rozpuszczają się w
rozpuszczalnikach organicznych .
Większość estrów ma przyjemny zapach (kwiatów, owoców)
wyczuwalny w małych stężeniach, stąd ich zastosowanie w
przemyśle kosmetycznym, perfumeryjnym, w przemyśle
spożywczym.
Jako rozpuszczalniki zw. organicznych stosowane są do
produkcji farb, lakierów, są dobrymi rozpuszczalnikami
wosków, tłuszczów (mrówczan etylu jest rozpuszczalnikiem
azotanu i octanu celulozy, natomiast octan etylu jako
rozpuszczalnik estrów celulozy) .
Woski
Estry wyższych kwasów karboksylowych
(np. kwas
palmitynowy – C
15
H
31
COOH) i
wyższych
monohydroksylowych alkoholi
(np. mirycylowy –
C
31
H
63
OH) - palmitynian mirycylowy jest
głównym składnikiem wosku pszczelego.
Woski przypominają tłuszcze, ich właściwości są
też podobne, ich gęstość jest mniejsza od
gęstości wody, mają niską lepkość i niskie temp.
topnienia, stopione w odróżnieniu od tłuszczów
mają przyjemny zapach, są odporne na działanie
czynników chemicznych.
Stosowane są do produkcji świec zapachowych,
past, w przemyśle farbiarskim,
farmaceutycznym, skórzanym, kosmetycznym,
spożywczym, zbrojeniowym.
Estry nieorganiczne
Estry kwasu siarkowego(VI)
CH
3
– OH
+
HO-SO
2
-OH
CH
3
– O
–
SO
2
– OH
+
H
2
O
wodorosiarczan(VI)
metylu
,
CH
3
– CH
2
– OH
+
HO – SO
2
– OH
CH
3
–CH
2
– O
–
SO
2
– OH
+
H
2
O
wodorosiarczan(VI)
etylu
Dwupodstawnikowe estry kwasu siarkowego(VI) -w reakcji
rozpuszczonego SO
3
w H
2
SO
4
(H
2
S
2
O
7
) i w
nadmiarze
alkoholu
2
CH
3
– CH
2
- OH
+
SO
3
CH
3
- CH
2
– O
– SO
2
–
O – CH
2
– CH
3
+
H
2
O
siarczan(VI)
di
etylu
W/w estry są związkami silnie trującymi.
Dwupodstawnikowe estry kwasu węglowego
są związkami
o zapachu owoców, otrzymuje się je w reakcji fosgenu i
alkoholanów:
O=CCl
2
+ 2NaO-CH
3
(CH
3
- O)
2
C=O + 2NaCl
Estry nieorganiczne cd
Estry kwasu azotowego(V)
– triazotan(V) glicerolu
(nitrogliceryna)
H
2
C – O
H
H
2
C – O
– NO
2
| |
HC – O
H
+ 3
HO
– NO
2
HC – O
–
NO
2
+ 3
H
2
O
| |
H
2
C – O
H
H
2
C – O
– NO
2
propano
-1,2,3-tri
ol
triazotan(V)
propano
tri
olu
Żółtawa, lepka ciecz, wybuchająca pod wpływem
wstrząsu, nasączona ziemia okrzemkowa w/w
związkiem jest dynamitem - (A. Nobel), 1% roztwór
stosowany jest w medycynie jako lek nasercowy i
układu krążenia.
Azotan(III) pentylu (amylu)
jest lekiem rozkurczowym,
Wodoroortofosforan(V) dimetylu
jest składnikiem
pestycydów,
estrami kwasu ortofosforowego(V) są
kwasy nukleinowe
.

Budowa tłuszczów
Tłuszcze to szczególny przypadek estrów glicerolu
(propano-1,2,3-triolu)
i wyższych kwasów tłuszczowych
– reszty wyższych
kwasów tłuszczowych – podstawniki
acylowe
zawierają
od 12 do 18 atomów węgla w cząsteczce
O O
//
//
H
2
C – O
H HO
– C – R
1
H
2
C – O
– C – R
1
O O
// //
HC – O
H
+
HO
– C – R
2
HC - O
– C – R
2
+
3
H
2
O
O O
// //
H
2
C – O
H
HO
–
C – R
2
H
2
C – O
– C – R
2
glicerol
wyższe kwasy
tłuszcz (gliceryd
)
karboksylowe
R
1
= R
2
= R
3
lub R
1
= R
2
≠ R
3
lub R
1
≠ R
2
= R
3
lub R
1
≠ R
2
≠
R
3
lub R
1
= R
3
≠ R
2

Procentowy udział
podstawników acylowych w
tłuszczach
Tłuszc
z
C
3
H
7
COO
H
Kwas
masłowy
C
13
H
27
COOH
kwas
butadekano
wy
C
15
H
31
COO
H
Kwas
palmityno
wy
C
17
H
35
COO
H Kwas
stearynow
y
C
17
H
33
COO
H
Kwas
oleinowy
C
17
H
31
COO
HKwas
linolowy
C
17
H
29
COO
H Kwas
linolenowy
Kwasy nasycone
Kwasy nienasycone
Masło
10%
10%
25%
11%
34%
5%
5%
Olej
słoneczniko
wy
-
-
11%
4%
39%
46%
-
Olej
lniany
-
-
5%
3%
5%
62%
25%
Oliwa
-
-
10%
2%
83%
5%
-
Łój
wołow
y
-
2%
29%
25%
40%
2%
2%
Słonin
a
(smale
c)
-
1%
29%
15%
45%
5%
5%
Tłuszcz
człowie
ka
8%
3%
25%
8%
46%
10%
-

Podział tłuszczów
• Tłuszcze proste
– zawierają
jeden rodzaj grup acylowych
(reszty acylowe tego samego kwasu)
• Tłuszcze złożone
– zawierają
dwa lub trzy rodzaje grup
acylowych
(reszty acylowe różnych kwasów)
• Tłuszcze nasycone
– zwierają
reszty acylowe nasyconych
kwasów tłuszczowych
(palmitynowego i stearynowego)
• Tłuszcze nienasycone
– zwierają
reszty acylowe
nienasyconych kwasów tłuszczowych
(oleinowego,
linolowego, linolenowego)
• Tłuszcze stałe (twarde)
– glicerydy
głównie nasyconych
kwasów
tłuszczowych (palmitynowego i stearynowego) –
głównie tłuszcze zwierzęce, ale są
wyjątki: tłuszcz rybi –
tran
• Tłuszcze ciekłe (oleje)
– glicerydy
nienasyconych kwasów
tłuszczowych
(oleinowego, linolowego, linolenowego) –
głównie tłuszcze roślinne, ale są
wyjątki – masło
kakaowe, kokosowe.

Hydroliza tłuszczów
Hydroliza kwasowa tłuszczów glicerol + kwasy tłuszczowe
Hydroliza zasadowa – zmydlanie tłuszczów glicerol + sole
wyższych kwasów tłuszczowych (mydła)
CH
2
– O – CO – C
17
H
35
CH
2
-
OH
| |
CH – O – CO – C
17
H
35
+ 3NaOH
3C
17
H
35
COONa + CH - OH
| |
CH
2
– O – CO – C
17
H
35
CH
2
–
OH
tristearynian glicerolu stearynian sodu
glicerol
W trakcie trawienia tłuszczów zachodzi hydroliza kwasowa,
produkty hydrolizy pod wpływem lipaz są ponownie
syntetyzowane w swoiste tłuszcze dla każdego organizmu
zwierzęcego
Hydroliza kwasowa tłuszczów glicerol + kwasy tłuszczowe
Hydroliza zasadowa – zmydlanie tłuszczów glicerol + sole
wyższych
kwasów tłuszczowych (mydła)
CH
2
– O – CO – C
17
H
35
CH
2
-
OH
| |
CH – O – CO – C
17
H
35
+ 3NaOH
3C
17
H
35
COONa + CH - OH
| |
CH
2
– O – CO – C
17
H
35
CH
2
–
OH
tristearynian
glicerolu
stearynian
sodu
glicerol
W trakcie trawienia tłuszczów zachodzi hydroliza kwasowa,
produkty hydrolizy pod wpływem lipaz są ponownie
syntetyzowane w swoiste tłuszcze dla każdego organizmu
zwierzęcego

Liczba zmydlania
Liczba zmydlania – liczba mg KOH potrzebna do
zobojętnienia kwasów tłuszczowych powstałych po
zmydleniu 1g tłuszczu.
Przykładowe zadanie – wyznacz liczby zmydlenia dla
tripalmitynianu glicerolu (M
1
)i trioleinianu glicerolu (M
2
) .
• Rozwiązanie:
Do zmydlenia 1 mola tłuszczu należy użyć 3 mole KOH
(M
KOH
= 56g/mol = 56000mg/mol)
Obliczenie mas molowych w/w tłuszczów:
M
1
= 806g/mol M
2
= 884g/mol
806g ---- 3 · 56000mg KOH 884g ----- 3 ·
56000mg KOH
1g ---- x 1g ---- x
--------------------------------
-----------------------------------
x = 208,44mg x = 190,04mg
Liczba zmydlania – liczba mg KOH potrzebna do
zobojętnienia kwasów tłuszczowych powstałych po
zmydleniu 1g tłuszczu.
Przykładowe zadanie – wyznacz liczby zmydlenia dla
tripalmitynianu glicerolu (M
1
)i trioleinianu glicerolu (M
2
) .
• Rozwiązanie:
Do zmydlenia 1 mola tłuszczu należy użyć 3 mole KOH
(M
KOH
= 56g/mol = 56000mg/mol)
Obliczenie mas molowych w/w tłuszczów:
M
1
= 806g/mol M
2
= 884g/mol
806g ---- 3 · 56000mg KOH 884g ----- 3 ·
56000mg KOH
1g ---- x 1g ---- x
--------------------------------
-----------------------------------
x = 208,44mg x = 190,04mg

Liczba jodowa
Liczba jodowa
–
liczba gramów jodu
przyłączonego przez
reszty acylowe nienasyconych kwasów tłuszczowych
zawartych w
100g określonego tłuszczu.
Przykładowe zadanie: wyznacz liczbę jodową dla
glicerydu o nazwie systematycznej: 2-linolonian-1,3-
dioleinian glicerolu.
Rozwiązanie:
W 1 molu tłuszczu znajdują się 2 reszty acylowe
kwasu linolowego
a w nich po 2 mole wiązań podwójnych (łącznie 4
mole), natomiast reszcie acylowej kwasu oleinowego
znajduje się 1mol wiązań podwójnych.
Łącznie w 1 molu tłuszczu znajduje się 5 moli wiązań
podwójnych, stąd dla całkowitego wysycenia wiązań
podwójnych należy użyć 5 moli
jodu (I
2
)
Obliczenie masy molowej tłuszczu: M = 880g/mol,
M
I2
= 254g/mol
880g ------ 5 · 254g I
2
100g ------ x
---------------------------
x = 144,32g
Utwardzanie tłuszczów
Tłuszcze zawierające reszty acylowe nienasyconych
kwasów karboksylowych
(olienowego, linolowego,
linolenowego) tak jak węglowodory nienasycone
ulegają
reakcji addycji – przyłączenia
(patrz liczba
jodowa) wodoru. Reakcja przebiega w
obecności
katalizatora Ni,w podwyższonej temp. i w
podwyższonym ciśnieniu.
Tłuszcze zawierające reszty acylowe kwasów
nienasyconych
odbarwiają wodę bromową
– reakcja
addycja bromu.
Proces ten wykorzystuje się w produkcji maseł
roślinnych i margaryn
z olejów roślinnych:
po częściowym uwodornieniu
(utwardzeniu) oleju roślinnego dodaje się mleko,
masło, witaminy, sól, emulgatory – lecytynę, barwniki.

Właściwości fizyczne tłuszczów
oraz próba akroleinowa
Tłuszcze są nierozpuszczalne w wodzie,
ich gęstość
jest mniejsza od gęstości wody, dobrze
rozpuszczają się w rozpuszczalnikach
organicznych – benzen, alkohol etylowy,
dichloroetanie, itd.
Temp. topnienia i wrzenia są stosunkowo niskie,
zależą od składu tłuszczu (reszt acylowych).
Próba akroleinowa – długotrwałe ogrzewanie
prowadzi do rozkładu tłuszczów z wydzielaniem
akroleiny (aldehydu nienasyconego – propenalu
CH
2
= CH – CHO) o nieprzyjemnym zapachu,
co
pozwala odróżnić woski od tłuszczów
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Sprawdzian z chemii kwasy karboksylowe, estry, tłuszcze
Test Chemia kwasy karboksylowe alkohole estry wersja 1, Klasa III
Chemia 3 Kwasy karboksylowe
Chemia, Chemia - Kwasy karboksylowe (2)
kwasy karboksylowe estry
ściągi chemia Kwasy karboksylowe
Chemia Kwasy Karboksylowe
Chemia 3 Kwasy karboksylowe
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
Estry i tłuszcze, ESTRY KWASÓW KARBOKSYLOWYCH
Kwasy karboksylowe, chemia, GIMNAZJUM
Chemia Kartkówka Kwasy karboksylowe
Kwasy karboksylowe, Chemia(1)
chemia - kwasy tłuszcze, Liceum Matura, Chemia, Chemia(1)
więcej podobnych podstron