
3. Jednofunkcyjne pochodne w´glowodorów
128
2. Reakcje
– redukcja ketonów do alkoholi II-rz´dowych:
gdzie R i R' sà podstawnikami alifatycznymi lub aromatycznymi, na
przyk∏ad:
3.6. Kwasy karboksylowe
3.6.1. Otrzymywanie i nazewnictwo kwasów karboksylowych
Kwasy karboksylowe sà zwiàzkami, w których grupà funkcyjnà jest
grupa karboksylowa:
Grupa karboksylowa w porównaniu do grupy karbonylowej jest bo-
gatsza o atom tlenu. Ogólny wzór kwasów karboksylowych zapisuje si´
w nast´pujàcej postaci:
gdzie R to atom wodoru, podstawnik alifatyczny lub aromatyczny.
Kwasy karboksylowe sà doÊç rozpowszechnionà grupà zwiàzków, dla-
tego wiele z nich okreÊla si´ wcià˝ nazwami zwyczajowymi, pochodzàcy-
mi cz´sto od surowców, z jakich je wyodr´bniono. Kwas octowy, majàcy
du˝e zastosowanie w gospodarstwie domowym, wyodr´bniano przez
stulecia z octu winnego, a kwas mrówkowy, stosowany w medycynie
ludowej jako sk∏adnik Êrodków przeciwreumatycznych, wydzielajà
mrówki. Obecnie stosuje si´ dwa systemy nazewnictwa kwasów karbok-
sylowych – system zalecany przez IUPAC oraz starszy, ale doÊç rozpo-
wszechniony system oparty na nazwach zwyczajowych.
Nazw´ systematycznà kwasu tworzy si´, podajàc po nazwie „kwas”
nazw´ w´glowodoru, od którego dany kwas pochodzi, z koƒcówkà -owy
(tab. 3.4).
—
R—C
OH
O
R—COOH
lub
—
—C
OH
O
—
—C
O
grupa karboksylowa
grupa karbonylowa
CH
3
CH
2
—C—CH
3
O
Ni
CH
3
CH
2
—C—CH
3
+ H
2
OH
H
—
—
$
R—C—R'
O
[H]
R—C—R'
OH
H
——
$
Wzór ogólny
kwasów, które
majà nasycony
∏aƒcuch w´glo-
wodorowy,
mo˝na napisaç
w postaci
C
n
H
2n + 1
COOH.
3.6. Kwasy karboksylowe
Je˝eli kwas ma podstawniki zwiàzane z ∏aƒcuchem g∏ównym, to ∏aƒ-
cuch zawierajàcy grup´ karboksylowà numeruje si´, poczàwszy od grupy
karboksylowej:
Dalsze zasady tworzenia nazwy sà takie same jak przy poprzednich
grupach zwiàzków: przed nazwà podaje si´ nazwy podstawników w ko-
lejnoÊci alfabetycznej oraz numery atomów w´gla, przy których te pod-
stawniki wyst´pujà. Powy˝szy kwas nazywa si´ wi´c kwasem 2-metylo-
propanowym. JeÊli wyst´puje nazwa zwyczajowa tego kwasu, to
zamiast numerów przy kolejnych atomach w´gla pojawià si´ oznacze-
nia literowe alfabetu greckiego, przy czym numeracj´ takà rozpoczyna
si´ nie od grupy karboksylowej, lecz od atomu w´gla po∏o˝onego bez-
poÊrednio za nià:
Nazwa zwyczajowa powy˝szego kwasu brzmi – kwas
α-metylopropio-
nowy. Nale˝y jednak przestrzegaç zasady niemieszania obu systemów
nazywania kwasów.
Grupa karboksylowa jest grupà o wy˝szej randze od grup wczeÊniej
poznanych, dlatego podczas nazywania zwiàzku o bardziej rozbudowa-
nej strukturze numerowanie rozpoczynamy od grupy karboksylowej,
traktujàc pozosta∏e grupy funkcyjne jak podstawniki:
CH
2
—CH
2
—CH
2
—COOH
OH
—
4
3
2
1
kwas-4-hydroksybutanowy
(lub kwas
c-hydroksymas∏owy)
CH
3
—CH—COOH
CH
3
—
β
α
CH
3
—CH—COOH
CH
3
—
3
2
1
129
Wzór kwasu
Nazwa zwyczajowa
Nazwa systematyczna
kwas mrówkowy
kwas metanowy
kwas octowy
kwas etanowy
HCOOH
CH
3
COOH
kwas propionowy
kwas propanowy
kwas mas∏owy
kwas butanowy
CH
3
CH
2
COOH
CH
3
CH
2
CH
2
COOH
kwas palmitynowy
kwas heksadekanowy
C
15
H
31
COOH
kwas stearynowy
kwas benzoesowy
kwas oktadekanowy
kwas benzenokarboksylowy
C
17
H
35
COOH
C
6
H
5
COOH
Tab. 3.4. Nazwy zwyczajowe i systematyczne kwasów karboksylowych
3. Jednofunkcyjne pochodne w´glowodorów
130
Kwasy karboksylowe otrzymuje si´ w wyniku utleniania aldehydów lub
alkoholi I-rz´dowych. W przypadku alkilowych pochodnych zwiàzków
aromatycznych, takich jak toluen czy etylobenzen, utlenieniu ulega ∏aƒ-
cuch w´glowodorowy. Jako utleniaczy u˝ywa si´ manganianu(VII) pota-
su i kwasu azotowego(V). Tlenek srebra i wodorotlenek miedzi(II) stosu-
je si´ tylko do utleniania aldehydów (w próbach Tollensa i Trommera).
Utlenianie toluenu prowadzi wi´c bezpoÊrednio do otrzymania kwasu
benzenokarboksylowego:
Utlenianie etanolu prowadzi natomiast do otrzymania kwasu etano-
wego (octowego):
W wyniku utleniania propanalu powstaje kwas propanowy:
Mo˝na zauwa˝yç, ˝e aldehyd stanowi poÊrednie stadium podczas
utleniania alkoholi I-rz´dowych:
3.6.2. W∏aÊciwoÊci fizyczne i chemiczne kwasów karboksylowych
ObecnoÊç silnie polarnej grupy karboksylowej wp∏ywa na wi´kszoÊç
w∏aÊciwoÊci kwasów. Du˝y ∏adunek ujemny zgromadzony na atomie tlenu
grupy karboksylowej i silnie dodatni atom wodoru po∏àczony z atomem
tlenu umo˝liwiajà wytwarzanie wiàzaƒ wodorowych zarówno mi´dzy czà-
steczkami kwasu, jak i z czàsteczkami innych zwiàzków, na przyk∏ad wody:
$
$
CH
3
—CH
2
OH
CH
3
—COOH
[O]
etanol
kwas etanowy
(kwas octowy)
[O]
O
H
—
CH
3
—C
etanal
(aldehyd octowy)
O
H
—
CH
3
—CH
2
—C
CH
3
—CH
2
—COOH
propanal
kwas propanowy
(propionowy)
$
utlenianie
$
CH
3
—CH
2
OH
CH
3
—COOH
utlenianie
etanol
kwas etanowy
(octowy)
$
utlenianie
CH
3
COOH
COOH
NO
2
kwas o-nitrobenzenokarboksylowy (lub kwas o-nitrobenzoesowy)
Utlenianie etylo-
benzenu prowa-
dzi do powsta-
nia kwasu
benzoesowego
i tlenku
w´gla(IV)
oraz wody.
3.6. Kwasy karboksylowe
131
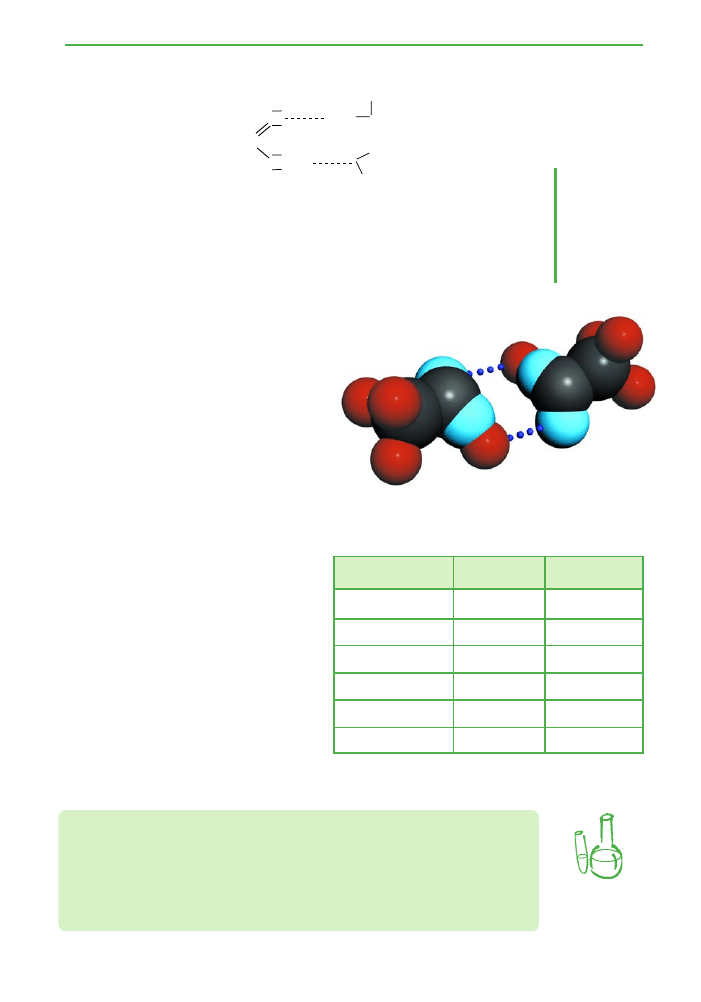
Symetryczne roz∏o˝enie ∏adunków dodatnich i ujemnych w grupie
karbonylowej pozwala na dimeryzacj´ czàsteczek, czyli ∏àczenie si´
dwóch czàsteczek w jeden wi´kszy uk∏ad (ryc. 3.17). W przypadku kwa-
sów karboksylowych dimeryzacja polega na wytworzeniu mi´dzy dwie-
ma czàsteczkami kwasu dwóch wiàzaƒ
wodorowych.
Ma∏a lotnoÊç kwasów wynika ze
zdolnoÊci do tworzenia wiàzaƒ wodo-
rowych mi´dzy czàsteczkami kwasu.
Porównawszy temperatury wrzenia
metanolu, metanalu i kwasu mrówko-
wego, przekonujemy si´, ˝e najbar-
dziej lotny jest HCHO, niemogàcy
wytworzyç mi´dzy swoimi czàsteczka-
mi wiàzaƒ wodorowych, a najmniej
lotny jest kwas mrówkowy, wytwarza-
jàcy du˝à liczb´ silnych wiàzaƒ wodo-
rowych.
W podobny sposób zmieniajà si´
temperatury wrzenia etanolu, etanalu
i kwasu octowego. Zwiàzki te, jak wy-
nika z tabeli 3.5, sà nieco mniej lotne
od omawianych czàsteczek jednow´-
glowych, gdy˝ majà od nich nieco
wi´kszà mas´. WÊród tych zwiàzków
najbardziej lotny etanal jest w tempe-
raturze pokojowej ∏atwo parujàcà cie-
czà, podczas gdy kwas octowy to ciecz
o temperaturze wrzenia wy˝szej od
wody.
DoÊwiadczenie
Porównanie lotnoÊci etanolu i kwasu mrówkowego
Na pasek bibu∏y nanieÊ za pomocà bagietki kropl´ etanolu i kropl´
kwasu mrówkowego. Odczekaj chwil´ i porównaj, która z plamek szyb-
ciej wyparowa∏a.
O
H
O
H
H
—
—
CH
3
—C
—
O
H
H
—
—
O
Ryc. 3.17. Model dimeru tworzonego przez czàsteczki
kwasu octowego
Kwasy karbok-
sylowe majà
ma∏à lotnoÊç
dzi´ki powstajà-
cym silnym
wiàzaniom
wodorowym.
Tab. 3.5. Temperatury wrzenia alkoholi, aldehydów i kwa-
sów karboksylowych
Nazwa
zwiàzku
Wzór
zwiàzku
Temperatura
wrzenia [°C]
CH
3
OH
64,6
HCHO
–20
metanol
metanal
HCOOH
101
CH
3
CH
2
OH
78,3
kwas mrówkowy
etanol
CH
3
CHO
20,7
etanal
CH
3
COOH
118
kwas octowy

3. Jednofunkcyjne pochodne w´glowodorów
132
DoÊwiadczenie
Porównanie rozpuszczalnoÊci kwasu octowego i kwasu stearynowego
w wodzie
Nalej do dwóch probówek po oko∏o 5 cm
3
wody. Nast´pnie do jednej
dodaj 1 cm
3
kwasu octowego, a do drugiej – odrobin´ kwasu stearynowe-
go. Porównaj rozpuszczalnoÊç obu zwiàzków.
ZdolnoÊç do tworzenia wiàzaƒ wodorowych z wodà wyjaÊnia dobrà roz-
puszczalnoÊç kwasów karboksylowych w wodzie. Jednak w miar´ wzrostu
d∏ugoÊci ∏aƒcucha w´glowodorowego zdolnoÊç ta zanika. Kwasy o tak du-
˝ej czàsteczce, jak kwas stearynowy, sà nierozpuszczalne w wodzie, gdy˝ na
ich w∏aÊciwoÊci silnie wp∏ywa d∏ugi niepolarny ∏aƒcuch w´glowodorowy.
Kwasy karboksylowe, podobnie jak kwasy nieorganiczne, majà zdol-
noÊç do zmieniania odczynu roztworu na kwasowy. Papierek uniwersalny
barwi si´ w roztworach kwasów na czerwono, a oran˝ metylowy wkroplo-
ny do roztworu kwasu zmienia zabarwienie z pomaraƒczowego na czer-
wone. ZdolnoÊç do zmiany odczynu roztworów kwasów wynika z obecno-
Êci silnie spolaryzowanego wiàzania O—H w czàsteczce kwasu. Wiàzanie
to ∏atwo ulega rozerwaniu, w roztworze pojawiajà si´ wtedy jony wodoro-
we, które sà przyczynà zmiany zabarwienia wskaêników.
Kwasy organiczne – w porównaniu z wi´kszoÊcià kwasów nieorganicz-
nych – sà kwasami s∏abymi, ale ich moc jest wystarczajàca do przeprowa-
dzenia reakcji z metalami, tlenkami metali i wodorotlenkami.
DoÊwiadczenie
Badanie kwasowych w∏aÊciwoÊci kwasu octowego
Nalej do trzech probówek po oko∏o 5 cm
3
20% roztworu kwasu octo-
wego. W jednej z probówek zanurz na moment papierek uniwersalny
i zanotuj odczyn roztworu. Nast´pnie do jednej probówki wrzuç odrobi-
n´ wiórków magnezowych, do drugiej dodaj 2 cm
3
5% roztworu zasady
sodowej, zabarwionej fenoloftaleinà na malinowo, a do trzeciej dodaj
szczypt´ tlenku miedzi(II). Probówk´ z tlenkiem miedzi(II) lekko
ogrzej. Zapisz wyniki obserwacji.
Papierek uniwersalny zabarwi∏ si´ w roztworze kwasu octowego na
czerwono. Wiórki magnezowe przereagowa∏y burzliwie z kwasem, zgod-
nie z równaniem:
2 CH
3
COO
H
+ Mg
$ (CH
3
COO)
2
Mg +
H
2
kwas octowy
sól – octan magnezu
Zabarwienie fenoloftaleiny w roztworze NaOH zanik∏o po dodaniu
roztworu do kwasu, gdy˝ wodorotlenek zosta∏ zoboj´tniony zgodnie
z równaniem:
CH
3
COO
H
+ Na
OH
$ CH
3
COONa +
H
2
O
kwas octowy
sól – octan sodu
Rozpuszczalne
kwasy karbok-
sylowe powo-
dujà powstawa-
nie kwaÊnego
odczynu wod-
nych roztwo-
rów.

3.6. Kwasy karboksylowe
133
Kwas octowy reaguje tak˝e z tlenkami metali. Czarny tlenek miedzi
reaguje po ogrzaniu z kwasem octowym, tworzàc niebieski roztwór soli
zgodnie z równaniem:
2 CH
3
COO
H
+ Cu
O
$ (CH
3
COO)
2
Cu +
H
2
O
kwas octowy
sól – octan miedzi(II)
Kwas octowy i jego wy˝sze homologi, czyli czàsteczki o d∏u˝szych od
niego ∏aƒcuchach, sà odporne na dzia∏anie Êrodków utleniajàcych. Pró-
ba utlenienia kwasu octowego lub mas∏owego za pomocà roztworu man-
ganianu(VII) potasu koƒczy si´ niepowodzeniem (roztwór KMnO
4
po-
zostaje nieodbarwiony).
3.6.3. Wa˝niejsze kwasy monokarboksylowe
Kwas metanowy (mrówkowy) HCOOH
Kwas ten ró˝ni si´ nieco od pozosta∏ych kwasów karboksylowych,
gdy˝ w strukturze jego czàsteczki nie wyst´pujà wiàzania w´giel–w´giel:
Czàsteczka kwasu mrówkowego ma tylko wiàzanie w´giel–wodór,
które jest ∏atwe do rozerwania. Z tego powodu:
a) czàsteczk´ kwasu mrówkowego ∏atwo utleniç do CO
2
:
[O]
HCOOH
$ CO
2
+ H
2
O
b) silne Êrodki odwadniajàce powodujà rozpad czàsteczki na wod´ i CO:
Kwas mrówkowy znajduje si´ w przyrodzie w stanie
wolnym, na przyk∏ad w organizmach mrówek (3.18)
lub we w∏oskach parzàcych pokrzyw.
Kwas mrówkowy jest bezbarwnà cieczà, która
krzepnie w temperaturze 8,4°C, a wrze w temperatu-
rze nieco powy˝ej 100°C. Ma ostry zapach i bardzo do-
brze rozpuszcza si´ w wodzie. Reaguje tak jak pozosta-
∏e kwasy karboksylowe – z metalami aktywnymi,
tlenkami metali i zasadami, tworzàc sole nazywane
mrówczanami. Na przyk∏ad:
HCOOH + KOH
$ HCOOK + H
2
O
kwas mrówkowy
mrówczan potasu
—
O
O
H
CO +
H
2
O
H—
C
—
H
2
SO
4
st´˝.
grupa aldehydowa
—
O
O
H
H—C
—
grupa karboksylowa
—
O
O
H
H—
C
—
Kwasy mono-
karboksylowe
majà jednà gru-
p´ COOH.
Istniejà takie
kwasy, które
majà wi´cej ni˝
jednà grup´
karboksylowà,
na przyk∏ad
kwas szczawio-
wy o wzorze
COOH
COOH
—
Ryc. 3.18. Kwas mrówkowy wyst´pu-
je w przyrodzie w stanie wolnym; wy-
kryto go tak˝e w organizmach mró-
wek (stàd nazwa).

3. Jednofunkcyjne pochodne w´glowodorów
134
Kwas etanowy (octowy) CH
3
COOH
Kwas octowy znany by∏ ju˝ w staro˝ytnoÊci. Ma on du˝e zastosowanie
zarówno w przemyÊle, jak i w gospodarstwie domowym jako przyprawa
do potraw. Kwas octowy bezwodny jest bezbarwnà cieczà, krzepnàcà
w temperaturze 16,6°C i wrzàcà w temperaturze 118°C. W wodzie roz-
puszcza si´ bardzo dobrze z wydzieleniem ciep∏a. Rozpuszczaniu kwasu
w wodzie towarzyszy kontrakcja (zmniejszanie si´) obj´toÊci. Kwas ten
tworzy liczne sole i jest odporny na utlenianie.
Kwas butanowy (mas∏owy) CH
3
CH
2
CH
2
COOH
Wolny kwas mas∏owy znajduje si´ w pocie, natomiast w maÊle wyst´-
puje w postaci po∏àczeƒ z glicerolem. Je∏czenie mas∏a polega w∏aÊnie na
wydzielaniu si´ z mas∏a wolnego kwasu mas∏owego na skutek dzia∏ania
wilgoci i enzymów. Kwas mas∏owy jest cieczà o nieprzyjemnym zapachu,
dobrze rozpuszczalnà w wodzie.
Kwas heksadekanowy (palmitynowy) C
15
H
31
COOH i kwas oktadekanowy
(stearynowy) C
17
H
35
COOH
WÊród kwasów o wi´kszej d∏ugoÊci ∏aƒcucha w´glowodorowego naj-
wa˝niejsze sà kwasy powszechnie wchodzàce w sk∏ad t∏uszczy – przede
wszystkim kwas palmitynowy i stearynowy. Oba te kwasy sà bezbarwny-
mi cia∏ami sta∏ymi o temperaturach topnienia tak niskich, ˝e umieszczo-
ne w goràcej wodzie si´ topià. Oba nie rozpuszczajà si´ w wodzie, ale
d∏ugo ogrzewane z zasadà sodowà reagujà z nià, tworzàc odpowiednie
sole nazywane myd∏ami:
C
17
H
35
COOH + NaOH
$ C
17
H
35
COONa + H
2
O
kwas stearynowy
stearynian sodu
(czyli myd∏o sodowe)
Zazwyczaj wykorzystuje si´ mieszanin´ obu kwasów do wyrobu Êwiec
i myde∏. Mieszanina kwasu stearynowego i palmitynowego nosi nazw´
stearyny.
Kwas benzenokarboksylowy (benzoesowy) C
6
H
5
COOH
Kwas benzoesowy jest bia∏ym cia∏em sta∏ym, topiàcym si´ w tempera-
turze 121°C. ¸atwo sublimuje, s∏abo rozpuszcza si´ w zimnej wodzie, na-
tomiast doÊç dobrze w goràcej.
Sól kwasu benzoesowego – benzoesan sodu – jest popularnym Êrod-
kiem konserwujàcym ˝ywnoÊç.
Polecenia kontrolne
1. WyjaÊnij, dlaczego niektóre w∏aÊciwoÊci kwasu mrówkowego ró˝nià
si´ od w∏aÊciwoÊci innych kwasów.
2. Zaproponuj syntez´ kwasu propionowego z propanu.
Kwas benzo-
esowy reaguje
w sposób cha-
rakterystyczny
dla arenów, to
znaczy ulega na
przyk∏ad reakcji
nitrowania, pod-
czas którego
powstaje kwas
m-nitrobenzo-
esowy.

3.6. Kwasy karboksylowe
135
3. Zaproponuj doÊwiadczenia umo˝liwiajàce odró˝nienie propanalu od
kwasu octowego.
4. Zapisz równania reakcji:
a) kwasu mas∏owego z wodorotlenkiem wapnia,
b) kwasu octowego z tlenkiem magnezu,
c) kwasu mrówkowego z ˝elazem.
5. Zapisz równanie reakcji kwasu benzoesowego z wodorotlenkiem
sodowym.
Najwa˝niejsze reakcje kwasów karboksylowych
1. Otrzymywanie
a) utlenianie alkoholi I-rz´dowych:
[O]
RCH
2
OH
$ RCOOH
gdzie R to podstawnik alifatyczny lub aromatyczny, na przyk∏ad:
b) utlenianie aldehydów:
[O]
R—CHO
$ R—COOH
gdzie R to podstawnik alifatyczny lub aromatyczny, na przyk∏ad:
2. Reakcje
a) reakcje z metalami aktywnymi, na przyk∏ad z magnezem, cynkiem,
˝elazem:
2 HCOOH + Zn
$ (HCOO)
2
Zn + H
2
b) reakcje z zasadami, na przyk∏ad:
C
6
H
5
COOH + NaOH
$ C
6
H
5
COONa + H
2
O
c) reakcje z tlenkami metali, na przyk∏ad:
CaO +2 CH
3
COOH
$ (CH
3
COO)
2
Ca + H
2
O
O
H
—
CH
3
—CH
2
—C
CH
3
—CH
2
—COOH
propanal
kwas propanowy (propionowy)
$
utlenianie
CH
3
—CH
2
OH
CH
3
—COOH
etanol
kwas etanowy (octowy)
$
utlenianie
3. Jednofunkcyjne pochodne w´glowodorów
136
3.7. Estry kwasów karboksylowych
Estry sà bardzo wa˝nà grupà zwiàzków powstajàcych w reakcji kwa-
sów z alkoholami. Najbardziej powszechne sà estry kwasów monokar-
boksylowych, zaliczane do szerszej grupy pochodnych kwasów karboksy-
lowych. Ich wzór ogólny to RCOOR', a zapisany strukturalnie:
gdzie R jest podstawnikiem alkilowym, aromatycznym lub atomem wo-
doru. R' jest podstawnikiem alkilowym lub aromatycznym.
O
O—CH
3
—
CH
3
—CH
2
—C
podstawnik alifatyczny R
podstawnik alifatyczny R'
O
O—R'
—
R—C
Estry to zwiàzki bardzo rozpowszechnione w przyrodzie. Ich najpow-
szechniejszà grupà sà t∏uszcze, b´dàce estrami glicerolu i kwasów kar-
boksylowych o d∏ugich nierozga∏´zionych ∏aƒcuchach. Niektóre estry sà
pochodnymi kwasów nieorganicznych, na przyk∏ad nitrogliceryna. Ten
znany materia∏ wybuchowy jest estrem kwasu azotowego(V) i glicerolu,
a mylàca nazwa „nitrogliceryna” si´ga poczàtków produkowania tego
estru. Reakcj´ z kwasem azotowym(V) uto˝samiano wtedy z reakcjà ni-
trowania.
Ogromne znaczenie w przyrodzie majà estry kwasu fosforowego(V)
– ich budow´ i rol´ omówimy w póêniejszych rozdzia∏ach.
3.7.1. Otrzymywanie i nazewnictwo estrów kwasów karboksylowych
Nazwy estrów tworzy si´ w podobny sposób jak nazwy soli kwasów
karboksylowych. Pierwszym cz∏onem nazwy jest nazwa kwasu, z którego
powsta∏ ester, z koƒcówkà -an, drugim natomiast – nazwa alkoholu,
z którego powsta∏ ester, z koƒcówkà -ylu. Na przyk∏ad:
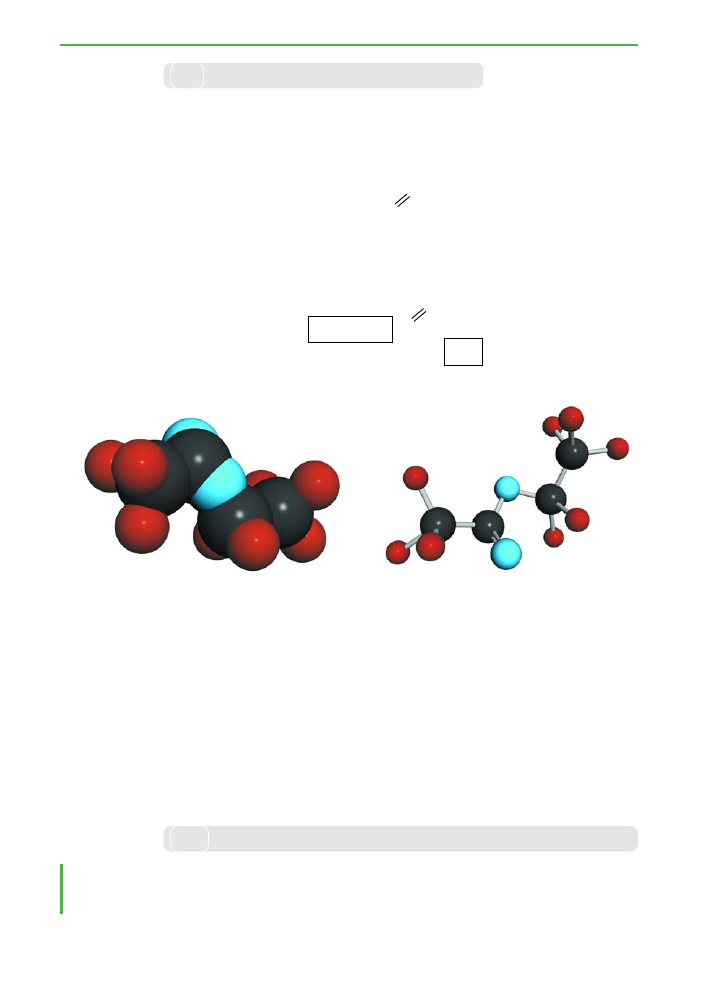
Ryc. 3.19. Modele czàsteczki octanu etylu
Estry sà po-
chodnymi kwa-
sów i alkoholi.

3.7. Estry kwasów karboksylowych
CH
3
COOH
C
2
H
5
OH
CH
3
COOC
2
H
5
kwas etanowy
etanol
etani
an
ety
lu
(kwas octowy)
(etanol)
(oct
an
ety
lu
)
HCOOH
CH
3
CH
2
CH
2
OH
HCOOCH
2
CH
2
CH
3
kwas metanowy
propan-1-ol
metani
an
propy
lu
(kwas mrówkowy)
(n-propanol)
(mrówcz
an
propy
lu
)
W przypadku kwasów i estrów powszechnie stosowane sà nazwy zwy-
czajowe, dlatego b´dziemy si´ nimi pos∏ugiwaç.
Estry kwasów karboksylowych otrzymuje si´ w wyniku reakcji odpo-
wiednich kwasów z alkoholami. W celu u∏atwienia procesu estryfikacji
dodaje si´ do mieszaniny reakcyjnej katalizator, czyli kwas siarko-
wy(VI). Estryfikacja nie jest procesem zachodzàcym szybko, a ponadto
nie przebiega nigdy do koƒca. W mieszaninie otrzymanej po reakcji b´-
dzie si´ wi´c znajdowaç pewna iloÊç substratów.
DoÊwiadczenie
Otrzymywanie octanu etylu
Do probówki przystosowanej do ogrzewania lotnych cieczy wlej 1 cm
3
kwasu octowego i 1 cm
3
etanolu. Do tak przygotowanej mieszaniny do-
daj 0,5 cm
3
st´˝onego kwasu siarkowego(VI). Probówk´ zatkaj korkiem
zaopatrzonym w szklanà rurk´ i wstaw na kilka minut do ∏aêni wodnej.
Sygna∏em przebiegu reakcji jest zmiana zapachu mieszaniny reakcyjnej.
Zapach estru mo˝na najlepiej oceniç, wylewajàc p∏yn z probówki do
zlewki zawierajàcej 20 cm
3
10% roztworu wodorotlenku sodu, gdy˝ uzy-
skujemy wtedy du˝à powierzchni´ parowania estru.
W wyniku reakcji estryfikacji, zachodzàcej mi´dzy kwasem octowym
a etanolem, powstaje lotny bezbarwny produkt – octan etylu o zapachu
podobnym do zapachu zmywacza do paznokci:
Reakcje tworzenia estrów nie zachodzà, jak mog∏oby si´ wydawaç,
w sposób podobny do reakcji tworzenia soli. Podczas otrzymywania soli
kwasów karboksylowych w czàsteczce kwasu p´ka wiàzanie wodór–tlen,
natomiast w czasie reakcji estryfikacji p´ka wiàzanie w´giel–tlen.
podczas tworzenia soli
p´ka wiàzanie w´giel–wodór
O
O—H
CH
3
—C—
w reakcji tworzenia estru
p´ka wiàzanie w´giel–tlen
O
O—H
CH
3
—C—
137
$
O
O—H
CH
3
—C
H
2
O
+
+
CH
3
—CH
2
CH
3
—C
OH
H
2
SO
4
kwas octowy
etanol
octan etylu
woda
—
O
O—CH
2
—CH
3
—
—
Reakcj´ otrzy-
mywania es-
trów nazywa si´
reakcjà estryfi-
kacji.

3. Jednofunkcyjne pochodne w´glowodorów
Czàsteczk´ wody tworzy grupa —OH pochodzàca z kwasu i atom wo-
doru pochodzàcy z czàsteczki alkoholu:
3.7.2. W∏aÊciwoÊci estrów kwasów karboksylowych
DoÊwiadczenie
Badanie w∏aÊciwoÊci octanu etylu
Wlej do probówki oko∏o 1 cm
3
octanu etylu. Opisz jego stan skupie-
nia, barw´ i zapach. Za pomocà bagietki nanieÊ na bibu∏´ kropl´ estru
i kropl´ etanolu. Porównaj lotnoÊç obu cieczy. Nast´pnie dodaj do pro-
bówki 2 cm
3
wody i oceƒ rozpuszczalnoÊç estru w wodzie. ZawartoÊç
probówki przelej do probówki przystosowanej do ogrzewania lotnych
cieczy i dodaj 0,5 cm
3
kwasu siarkowego(VI). Potem zatkaj probówk´
korkiem zaopatrzonym w rurk´ i wstaw jà na kilka minut do ∏aêni wod-
nej. Podczas ogrzewania wstrzàsaj cz´sto probówkà z mieszaninà reak-
cyjnà. OkreÊl zapach mieszaniny po wyj´ciu z ∏aêni wodnej.
Estry o mniejszej liczbie atomów w´gla w czàsteczce sà cieczami,
o wi´kszej zaÊ cia∏ami sta∏ymi. Wszystkie estry, nawet te o ma∏ych
czàsteczkach, êle rozpuszczajà si´ w wodzie. Estry sà substancjami doÊç
lotnymi. Octan etylu ma prawie takà samà lotnoÊç jak etanol, mimo
wi´kszej masy czàsteczki. Taka du˝a lotnoÊç, podobnie jak ma∏a roz-
puszczalnoÊç w wodzie, jest spowodowana budowà czàsteczki. Struktura
octanu etylu nie pozwala na wytwarzanie wiàzaƒ wodorowych mi´dzy
czàsteczkami estru, a liczba wiàzaƒ wodorowych wytwarzanych z czà-
steczkami wody te˝ jest ograniczona.
Najwa˝niejszà reakcjà estrów jest reakcja rozpadu na kwas i alkohol
pod wp∏ywem wody, nazywana hydrolizà estru. Dlatego podczas ogrze-
wania octanu etylu z wodà pojawia si´ zapach octu.
Estry doÊç ∏atwo ulegajà hydrolizie, zw∏aszcza gdy przeprowadza si´
jà w roztworze zakwaszonym. Reakcje hydrolizy estrów sà bowiem kata-
lizowane przez kwasy, podobnie jak reakcje estryfikacji:
O
O—H
H—C
H
2
O
+
+
CH
3
—CH
2
H—C
O
H
kwas mrówkowy
etanol
mrówczan etylu
woda
—
O
O—CH
2
—CH
3
—
—
$
H
2
SO
4
138
O
O
H
O
—
CH
3
—CH
2
—C
O
OH
—
—
CH
3
—CH
2
—C
H
—OH
+
+
propionian fenylu
kwas propionowy
fenol
—
$
H
2
SO
4
Estry sà zwiàz-
kami doÊç lot-
nymi i s∏abo
rozpuszczalny-
mi w wodzie.

3.7. Estry kwasów karboksylowych
Estry hydrolizuje si´ jednak najcz´Êciej w Êrodowisku zasadowym,
poniewa˝ dodanie roztworu zasady pozwala uzyskaç du˝à wydajnoÊç re-
akcji rozpadu. Powstaje wtedy nie kwas i alkohol, lecz sól kwasu karbo-
ksylowego i alkohol:
139
O
O—CH
2
—CH
3
—
CH
3
—C
CH
3
—CH
2
OH
O
O—Na
—
CH
3
—C
NaOH
+
+
ester
sól kwasu karboksylowego
temp.
$
H
2
O
$
O
O—H
—
CH
3
—CH
2
—CH
2
—C
H
2
O
CH
3
—CH
2
O
O—CH
2
—CH
3
—
CH
3
—CH
2
—CH
2
—C
H
2
SO
4
+
+
kwas mas∏owy
etanol
maÊlan etylu
O
H
—
DoÊwiadczenie
Otrzymywanie maÊlanu etylu
Do probówki przystosowanej do ogrzewania lotnych cieczy wlej 1 cm
3
kwasu mas∏owego i 1 cm
3
etanolu. Do tak przygotowanej mieszaniny do-
daj 0,5 cm
3
st´˝onego kwasu siarkowego(VI). Probówk´ zatkaj korkiem
zaopatrzonym w szklanà rurk´ i wstaw na kilka minut do ∏aêni wodnej.
Sygna∏em przebiegu reakcji b´dzie zmiana zapachu mieszaniny reakcyj-
nej. Zapach estru mo˝na okreÊliç naj∏atwiej, wylewajàc p∏yn z probówki
do zlewki zawierajàcej 20 cm
3
10% roztworu wodorotlenku sodu.
MaÊlan etylu powstaje w wyniku nast´pujàcej reakcji:
Jest to substancja o zapachu ananasa, co mo˝na
by∏o stwierdziç podczas przeprowadzania doÊwiad-
czenia. Wiele estrów charakteryzuje si´ przyjem-
nym zapachem, z tego powodu wykorzystuje si´ je
w przemyÊle perfumeryjnym i spo˝ywczym jako
substancje zapachowe (ryc. 3.20).
Czy wiesz, ˝e...
Substancje zapachowe wyst´pujàce w przyrodzie sà mieszaninami bardzo
wielu zwiàzków. Na przyk∏ad w lotnych sk∏adnikach gruszki stwierdzono
obecnoÊç a˝ 53 estrów. Cz´sto sà one tak˝e sk∏adnikiem substancji zapacho-
wych wydzielanych przez zwierz´ta i owady w celu przyciàgania partnera.
Ryc. 3.20. Estry wchodzà w sk∏ad wielu produktów codzienne-
go u˝ytku, na przyk∏ad zmywacza do paznokci, olejków do
ciast, sà te˝ stosowane jako substancje zapachowe na przyk∏ad
w szamponie.
Estry w wodzie
ulegajà powol-
nej reakcji
z wodà, czyli
hydrolizie.
3. Jednofunkcyjne pochodne w´glowodorów
3.7.3. T∏uszcze
T∏uszcze, zwiàzki bardzo rozpowszechnione w przyrodzie, sà estrami
glicerolu i kwasów t∏uszczowych. Kwasami t∏uszczowymi nazywano kie-
dyÊ tylko te kwasy, które by∏y wydzielane z t∏uszczów. Obecnie okreÊla
si´ tak ca∏à grup´ zwiàzków majàcych nierozga∏´ziony ∏aƒcuch w´glowo-
dorowy i jednà grup´ karboksylowà w czàsteczce. Najcz´Êciej w czà-
steczkach t∏uszczów spotyka si´ reszty kwasowe, które liczà od 12 do 18
atomów w´gla w czàsteczce.
140
Tab. 3.6. Kwasy najcz´Êciej tworzàce naturalne t∏uszcze
Nazwa kwasu
Wzór kwasu
C
15
H
31
COOH
C
17
H
35
COOH
palmitynowy
stearynowy
C
17
H
33
COOH
C
14
H
27
COOH
oleinowy
mirystynowy
C
17
H
31
COOH
linolowy
C
3
H
7
COOH
mas∏owy
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
CHCH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
COOH
kwas oleinowy
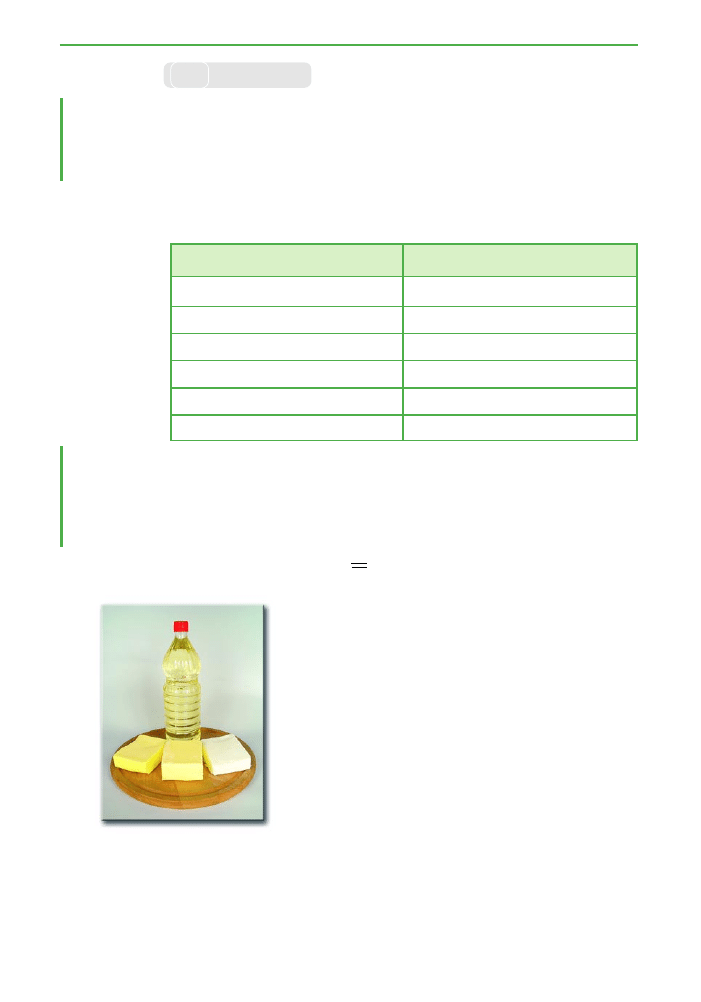
Ze wzgl´du na stan skupienia t∏uszcze dzielimy na
sta∏e i ciek∏e (oleje) (ryc. 3.21). T∏uszcze sta∏e zawierajà
w swoich czàsteczkach nasycone reszty kwasowe o d∏u˝-
szych ∏aƒcuchach. T∏uszcze ciek∏e natomiast majà
w swoich czàsteczkach reszty kwasowe o ∏aƒcuchach
sk∏adajàcych si´ z niewielu atomów w´gla lub nienasy-
conych reszt kwasowych.
T∏uszcze zwierz´ce to najcz´Êciej cia∏a sta∏e, choç sà
wyjàtki, na przyk∏ad tran b´dàcy t∏uszczem ciek∏ym.
T∏uszcze roÊlinne zazwyczaj sà cieczami. Do wyjàtków
nale˝y na przyk∏ad t∏uszcz kokosowy, który jest cia∏em
sta∏ym.
T∏uszcz wydzielany z produktu naturalnego nie jest
nigdy substancjà jednorodnà, lecz mieszaninà ró˝nych
estrów glicerolu. Do takich estrów zaliczamy mi´dzy
innymi tristearynian glicerolu, zawierajàcy trzy takie
same reszty kwasowe:
Z analizy tabeli 3.6 wynika, ˝e w sk∏ad t∏uszczów – oprócz kwasów
nasyconych – wchodzà tak˝e kwasy nienasycone. Na przyk∏ad kwas ole-
inowy ma jedno wiàzanie podwójne w czàsteczce znajdujàce si´ mi´dzy
9 a 10 atomem w´gla:
T∏uszcze sà es-
trami glicerolu
i ∏aƒcuchowych
kwasów kar-
boksylowych.
Kwas oleinowy
ma jedno,
a linolowy dwa
podwójne
wiàzania
w czàsteczce.
Ryc. 3.21. T∏uszcze sta∏e i cie-
k∏e znajdujà si´ w naszym co-
dziennym po˝ywieniu, na
przyk∏ad olej, mas∏o lub
smalec

3.7. Estry kwasów karboksylowych
Innym przedstawicielem tej grupy zwiàzków jest na przyk∏ad triole-
inian glicerolu, tak˝e zawierajàcy w swojej czàsteczce trzy takie same
reszty kwasowe:
Trioleinian glicerolu jest t∏uszczem nienasyconym.
Wi´kszoÊç t∏uszczów nale˝y do estrów mieszanych, zawierajàcych
w czàsteczce ró˝ne reszty kwasowe. Sà estry, w których ka˝da reszta
kwasowa pochodzi od innego kwasu, na przyk∏ad:
Stan skupienia danego glicerydu zale˝y od rodzaju kwasów tworzà-
cych jego czàsteczk´. Na przyk∏ad tristearynian glicerolu jest cia∏em sta-
∏ym, a trioleinian glicerolu – cieczà, gdy˝ zawiera w swojej strukturze wy-
∏àcznie nienasycone reszty kwasowe.
O
(CH
2
)
14
—CH
3
—
CH
2
—O—C
O
(CH
2
)
16
—CH
3
—
CH—O—C
—
O
(CH
2
)
2
—CH
3
—
CH
2
—O—C
—
O
(CH
2
)
14
—CH
3
—
CH
2
—O—C
O
(CH
2
)
14
—CH
3
—
CH—O—C
—
O
(CH
2
)
14
—CH
3
—
CH
2
—O—C
—
O
(CH
2
)
16
—CH
3
—
CH
2
—O—C
O
(CH
2
)
16
—CH
3
—
CH—O—C
—
O
(CH
2
)
16
—CH
3
—
CH
2
—O—C
—
141
Tristearynian
glicerolu jest
t∏uszczem sta-
∏ym, gdy˝ za-
wiera w czà-
steczce d∏ugie
nasycone ∏aƒ-
cuchy w´glo-
wodorowe.
Trioleinian glice-
rolu jest t∏usz-
czem ciek∏ym,
gdy˝ zawiera
w czàsteczce
nienasycone
∏aƒcuchy w´-
glowodorowe.
Kwasy nienasy-
cone wyst´pu-
jàce w t∏usz-
czach sà
izomerami cis.
3. Jednofunkcyjne pochodne w´glowodorów
DoÊwiadczenie
Badanie w∏aÊciwoÊci oleju rzepakowego
Wlej do probówki oko∏o 1 cm
3
oleju. Opisz jego barw´, zapach oraz
sprawdê, czy rozpuszcza si´ w wodzie. Porównaj jego g´stoÊç z g´stoÊcià
wody. Nast´pnie dodaj 0,5 cm
3
oleju do 5 cm
3
benzyny ekstrakcyjnej
i okreÊl, jaka jest rozpuszczalnoÊç tego t∏uszczu w rozpuszczalniku nie-
polarnym. Do trzeciej probówki wlej 1 cm
3
oleju, dodaj 0,5 cm
3
0,01-mo-
lowego roztworu manganianu(VII) potasu i mieszaj roztwory przez
kilka minut. Zanotuj obserwacje.
Wszystkie t∏uszcze sà l˝ejsze od wody, najcz´Êciej nie majà zapachu,
sà nierozpuszczalne w wodzie i dobrze rozpuszczalne w rozpuszczalni-
kach niepolarnych. T∏uszcze zawierajàce w czàsteczce nienasycone resz-
ty kwasowe odbarwiajà manganian(VII) potasu i wod´ bromowà.
W∏aÊciwoÊci chemiczne t∏uszczów sà takie same jak estrów o mniej-
szych czàsteczkach. Najwa˝niejszà reakcjà t∏uszczów jest wi´c hydroliza
pod wp∏ywem wody lub roztworów zasad, podczas której powstaje glice-
ryna i kwas lub jego sól.
Hydroliz´ t∏uszczów z udzia∏em zasad nazywamy zmydlaniem t∏uszczu,
a powstajàcà w tej reakcji sól kwasu t∏uszczowego nazywamy myd∏em:
142
Ryc. 3.22. Model czàsteczki t∏uszczu
O
(CH
2
)
16
—CH
3
—
CH
2
—O—C
O
ONa
—
O
(CH
2
)
16
—CH
3
+ 3 NaOH
+
3 CH
3
—(CH
2
)
16
—C
—
CH—O—C
—
O
(CH
2
)
16
—CH
3
—
CH
2
—O—C
—
CH
2
—OH
CH—OH
CH
2
—OH
—
—
t∏uszcz
myd∏o
temp.
Zasadowà hy-
droliz´ t∏uszczu
nazywamy
zmydlaniem
t∏uszczu.
Âwie˝e t∏uszcze sà oboj´tne, jednak poddane dzia∏aniu wilgoci i mi-
kroorganizmów ulegajà powolnemu psuciu si´, co nazywamy je∏czeniem.
Zje∏cza∏e mas∏o ma odczyn kwaÊny i zapach pochodzàcy mi´dzy innymi
od kwasu mas∏owego, który powoli si´ z niego uwalnia. W t∏uszczach nie-
3.7. Estry kwasów karboksylowych
nasyconych wystawionych na dzia∏anie powietrza nast´puje z kolei utle-
nianie wiàzaƒ podwójnych, co obserwujemy jako zestalanie si´ oleju.
Margaryna, czyli t∏uszcz utwardzony, jest otrzymywana z ciek∏ych
t∏uszczów roÊlinnych, które poddano przetworzeniu. Proces ten, zwany
utwardzaniem, polega na uwodornieniu t∏uszczu, czyli reakcji z wodo-
rem przy udziale katalizatorów. Podczas takiej reakcji nast´puje addycja
wodoru do wiàzaƒ podwójnych t∏uszczu, w wyniku czego t∏uszcz ciek∏y
staje si´ t∏uszczem sta∏ym.
3.7.4. Myd∏a
Myd∏a sà to sole sodowe lub potasowe wy˝szych kwasów t∏uszczowych,
najcz´Êciej palmitynowego, stearynowego i oleinowego. Sole sodowe
wchodzà w sk∏ad myde∏ twardych, myd∏a mi´kkie natomiast zawierajà
sole potasowe wymienionych kwasów.
Myd∏a otrzymuje si´ w wyniku d∏ugiego gotowania t∏uszczów z NaOH
lub KOH. Powstaje wtedy p∏ynna masa b´dàca mieszaninà glicerolu, my-
d∏a i wody. Do tak otrzymanej mieszaniny dodaje si´ NaCl w celu przepro-
wadzenia jej w postaç ˝elu. Surowe myd∏o poddaje si´ przeróbce uszlachet-
niajàcej – usuwa si´ z niego resztki NaOH, dodaje substancje barwiàce
i zapachowe, a ostatnio tak˝e substancje obni˝ajàce zasadowoÊç. Myd∏a
przezroczyste uzyskuje si´ przez dodanie pewnej iloÊci glicerolu.
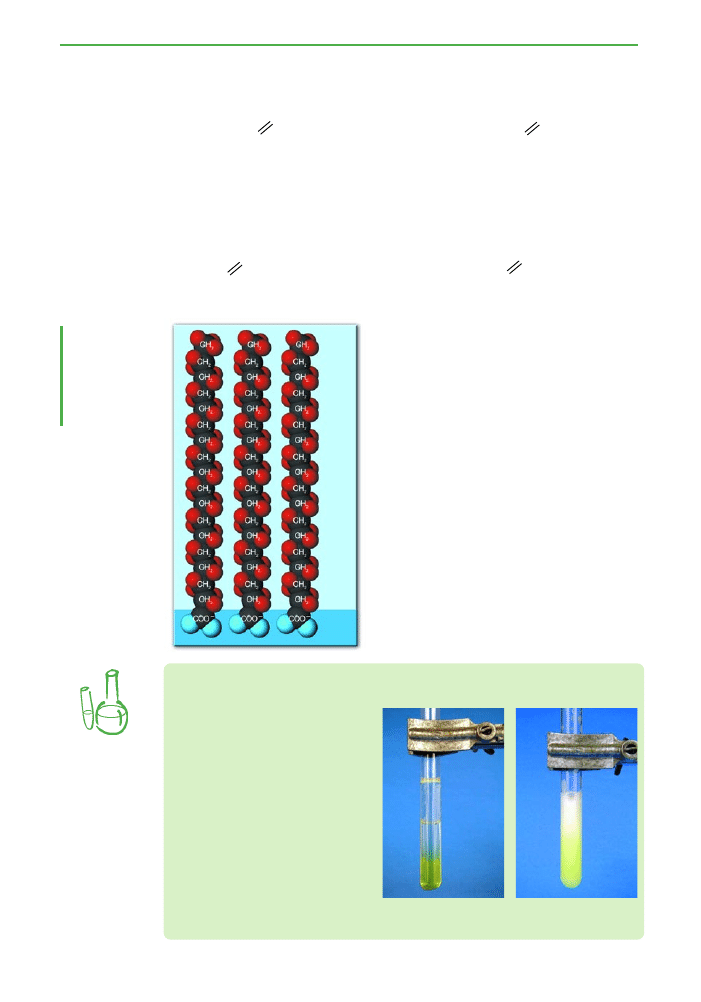
DoÊwiadczenie
Zmydlanie t∏uszczu
Do probówki zawierajàcej nieco rozdrobnionej porcelany (mo˝e to
byç np. stary, pot∏uczony na drobne kawa∏ki kubek) wlej 2 cm
3
oleju rze-
pakowego, dodaj 1 cm
3
etanolu i 3 cm
3
20% wodorotlenku sodu. Etanol
dodaje si´, by umo˝liwiç mieszanie si´ oleju z wodà. Ca∏oÊç ogrzewaj
przez par´ minut, intensywnie mieszajàc. Uwaga! W czasie wykonywa-
nia doÊwiadczenia nale˝y szczególnie uwa˝aç, ˝eby nie przegrzaç cieczy,
co przejawia si´ intensywnym wypryskiwaniem zawartoÊci na zewnàtrz.
Zaobserwuj wyglàd mieszaniny pod koniec ogrzewania. Nast´pnie za-
wartoÊç probówki wylej do zlewki zawierajàcej st´˝ony roztwór chlorku
sodu i intensywnie wymieszaj. Poczekaj, a˝ mieszanina ostygnie i obej-
rzyj zbierajàce si´ na powierzchni grudki myd∏a.
DoÊwiadczenie
Badanie w∏aÊciwoÊci myd∏a
Przygotuj kilka ró˝nych gatunków myd∏a. Porównaj ich twardoÊç. Na-
st´pnie sporzàdê wodne roztwory tych myde∏ i zbadaj ich odczyn. Do
ka˝dego z tych roztworów dodaj wodny roztwór chlorku wapnia i do-
k∏adnie je wymieszaj. Oceƒ, czy roztwory myde∏ po dodaniu chlorku
wapnia pienià si´ równie dobrze jak przed dodaniem tej substancji.
143
Wy˝sze kwasy
t∏uszczowe to
kwasy t∏uszczo-
we o d∏ugich
czàsteczkach.
Utwardzanie
t∏uszczu polega
na addycji wo-
doru do wiàzaƒ
podwójnych
t∏uszczu niena-
syconego.
3. Jednofunkcyjne pochodne w´glowodorów
Myd∏a ulegajà w pewnym stopniu reakcji z wodà, podczas której po-
wstaje kwas karboksylowy i wodorotlenek sodu:
144
O
ONa
—
2 CH
3
—(CH
2
)
16
—C
O
O
—
CH
3
—(CH
2
)
16
—C
+ CaCl
2
+ 2 NaCl
Ca
(
(
2
.
$
$
O
ONa
—
CH
3
—(CH
2
)
16
—C
O
OH
—
CH
3
—(CH
2
)
16
—C
+ H
2
O
+ NaOH
Ryc. 3.24. Myd∏o zmiejsza napi´cie powierzch-
niowe, u∏atwiajàc tworzenie si´ piany.
DoÊwiadczenie
Badanie emulgujàcych w∏a-
ÊciwoÊci myd∏a
Wlej do probówki 0,5 cm
3
oleju i dodaj do niego przygo-
towany wczeÊniej roztwór
myd∏a. Do drugiej probówki
wlej 0,5 cm
3
oleju i dodaj tro-
ch´ czystej wody. Wymieszaj
dok∏adnie sk∏adniki w obu
probówkach (ryc. 3.24).
W której z nich wytworzy∏a
si´ piana?
Z tego powodu roztwory wodne myde∏ majà odczyn zasadowy. Po do-
daniu do wodnego roztworu myde∏ soli wapniowych lub magnezowych
nast´puje wytràcenie nierozpuszczalnych soli kwasów t∏uszczowych:
Myd∏o zmniej-
sza napi´cie
powierzchnio-
we i u∏atwia
emulgacj´
t∏uszczu.
W wyniku tego procesu roztwór myd∏a
przestaje si´ pieniç. Mo˝na to zaobser-
wowaç, u˝ywajàc do mycia tak zwanej
twardej wody, czyli wody zawierajàcej
du˝e iloÊci soli wapniowych i magnezo-
wych.
Czyszczàce dzia∏anie myd∏a polega na
du˝ej zdolnoÊci do obni˝ania napi´cia
powierzchniowego roztworów oraz ∏a-
twoÊci tworzenia z t∏ustymi zabrudzenia-
mi ∏atwej do usuni´cia emulsji (ryc. 3.23).
Ryc. 3.23. Czàsteczki myd∏a przy powierzchni
wody ustawiajà si´ w ten sposób, ˝e dziurawià
b∏onk´ na granicy woda–powietrze, zmniejszajàc
w ten sposób napi´cie powierzchniowe wody.
WODA POWIETRZE
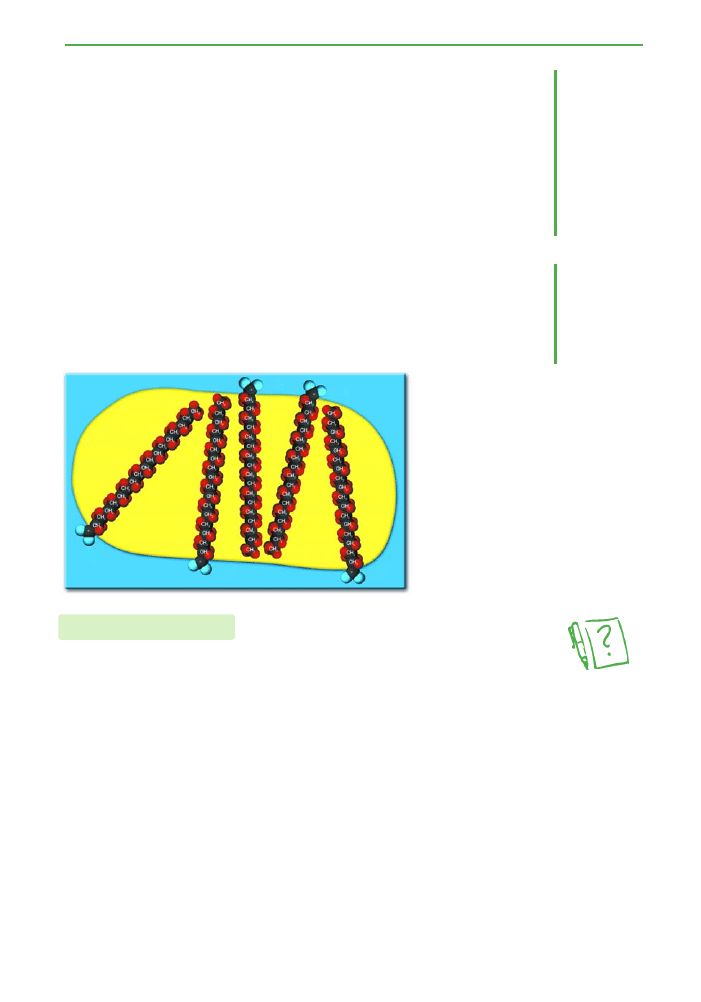
3.7. Estry kwasów karboksylowych
Czàsteczki myd∏a rozpuszczone w roztworze zawierajàcym t∏uszcz
grupujà si´ w ten sposób, ˝e ich niepolarne fragmenty (hydrofobowe)
zwrócone sà w stron´ grudki t∏uszczu i zag∏´biajà si´ w niej. Polarne cz´-
Êci czàsteczek myd∏a (hydrofilowe) pozostajà natomiast na zewnàtrz
warstwy t∏uszczu, kontaktujàc si´ bezpoÊrednio z wodà (ryc. 3.25).
W czasie próby wymieszania takiego uk∏adu cz´Êci polarne, otaczajàce
grudki t∏uszczu, uniemo˝liwiajà im ∏àczenie si´ w wi´ksze grupy. Cz´Êci
hydrofilowe myd∏a dzia∏ajà wi´c jak izolatory zapobiegajàce ∏àczeniu si´
t∏uszczu w wi´ksze skupiska.
Polecenia kontrolne
1. Podaj wzory strukturalne nast´pujàcych estrów:
a) maÊlan etylu,
c) propionian metylu,
b) mrówczan fenylu,
d) benzoesan fenylu.
2. Wypisz wszystkie izomery octanu etylu, b´dàce kwasami karboksylo-
wymi lub ich pochodnymi.
3. Napisz równania reakcji:
a) estryfikacji kwasu mrówkowego metanolem,
b) zoboj´tniania kwasu octowego wodorotlenkiem potasu,
c) zmydlania tripalmitynianu glicerolu wodorotlenkiem sodu.
4. Korzystajàc z dost´pnych êróde∏ informacji, dowiedz si´, jakà grupà
zwiàzków sà detergenty. Jak sàdzisz, czy „myd∏o w p∏ynie” nale˝y do
myde∏? Odpowiedê uzasadnij.
5. WyjaÊnij poj´cia:
a) ester,
b) t∏uszcz,
c) myd∏o,
d) twarda woda.
145
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
COONa
cz´Êç hydrofobowa
cz´Êç
hydrofilowa
W∏asnoÊci emulgujàce myd∏a sà zwiàzane z budowà jego czàsteczki.
Ka˝de myd∏o sk∏ada si´ z cz´Êci niepolarnej, nazywanej hydrofobowà,
i cz´Êci polarnej, nazywanej hydrofilowà:
Proces emulga-
cji t∏uszczu po-
lega na rozdzie-
leniu go na
niewielkie
kropelki.
Czàsteczka my-
d∏a sk∏ada si´
z cz´Êci hydro-
filowej i cz´Êci
hydrofobowej.
Dzi´ki takiej
strukturze my-
d∏o posiada
w∏aÊciwoÊci
czyszczàce.
COO
–
COO
–
COO
–
COO
–
COO
–
Ryc. 3.25. Grudki
t∏uszczu sà emulgo-
wane za pomocà
myd∏a. Czàsteczki
myd∏a ustawiajà si´
wokó∏ kropli t∏usz-
czu w ten sposób,
˝e ich niepolarne
fragmenty sà zag∏´-
bione w t∏uszczu,
a polarne grupy kar-
boksylowe pozosta-
jà w wodzie.

3. Jednofunkcyjne pochodne w´glowodorów
Reakcje estrów
1. Otrzymywanie
– reakcja kwasu z alkoholem, katalizowana przez st´˝ony kwas siar-
kowy(VI):
gdzie R jest podstawnikiem alifatycznym, aromatycznym lub atomem
wodoru, R' jest podstawnikiem alifatycznym lub aromatycznym, na
przyk∏ad:
2. Reakcje
– hydroliza, czyli rozpad pod wp∏ywem wody:
lub
gdzie R jest podstawnikiem alifatycznym, aromatycznym lub atomem
wodoru, R' jest podstawnikiem alifatycznym lub aromatycznym, na
przyk∏ad:
O
OR'
R—C
+ NaOH
H
2
O
—
O
ONa
R—C
+ R'—OH
—
temp.
$
O
OR'
R—C
H
2
O
+
H
2
SO
4
—
O
O—H
R—C
R'—OH
+
—
$
O
O—H
H—C
H
2
O
+
+
H
2
SO
4
—
O
O—CH
2
—CH
3
H—C—
OH
CH
3
—CH
2
—
$
O
O—H
R—C
H
2
O
+
+
R'—OH
R—C
—
O
OR'
—
H
2
SO
4
$
146
O
O—CH
2
—CH
3
CH
3
—C
H
2
O
+
—
H
2
SO
4
$
O
O—H
CH
3
—C
CH
3
—CH
2
—OH
+
—
H
2
SO
4
$
O
O—CH
2
—CH
3
CH
3
—C
NaOH
+
H
2
O
—
temp.
$
H
2
O
O
O—Na
CH
3
—C
CH
3
—CH
2
OH
+
—
temp.
$
lub
Wyszukiwarka
Podobne podstrony:
Chemia kwasy karboksylowe, estry, tłuszcze
Sprawdzian z chemii kwasy karboksylowe, estry, tłuszcze
Test Chemia kwasy karboksylowe alkohole estry wersja 1, Klasa III
KWASY KARBOKSYLOWEreaktyw 1
KWASY KARBOKSYLOWE id 256009 Nieznany
Kwasy karboksyl, Szkoła
przez 24 KWASY KARBOKSYLOWE2
kwasy karboksylowe 1 id 256027 Nieznany
przez 15 KWASY KARBOKSYLOWE2
przez 28 KWASY KARBOKSYLOWE2
Kwasy karboksylowe
kwasy karboksylowe 3
Kwasy karboksylowe otrzymywanie
kwasy karboksylowe, laborki liceum
więcej podobnych podstron