
Wiązanie jonowe

Charakterystyka
• Powstaje miedz atomami znacznie różniącymi się
elektroujemnością.
• Wiązanie jest bezkierunkowe i ma daleki zasięg.
• Związki jonowe mają wysokie temperatury topnienia.
• W stanie stałym zbudowane są z jonów ale prądu nie przewodzą.
• Przewodzą prąd w stanie stopionym.
• Rozpuszczają się w rozpuszczalnikach polarnych i takie roztwory
przewodzą prąd.
• Wzór związku jonowego nie odpowiada realnie istniejącym
cząsteczkom.
• Kryształy związków jonowych charakteryzują się wysokimi
liczbami koordynacyjnymi

• Istnieją bezpośrednie dowody eksperymentalne
wskazujące na obecność jonów w węzłach sieci
krystalicznej takich związków.
• Np. z badań dyfrakcji promieni rentgenowskich na
kryształach NaCl wynika że gęstość elektronowa:
– wokół każdego atomu chloru wynosi 17.70
– a wokół każdego atomu sodu 10.05
• Gdyby NaCl w stanie stałym składał się z atomów powinno
się otrzymać odpowiednio 17.0 i 11.0

Liczby koordynacyjne, a promienie jonowe
Liczba
koordynacyjna
Struktura
Krytyczny stosunek
promieni r
A
/r
B
3
Trójkąt
0.155
4
Tetraedr
0.225
4
Kwadrat
0.414
6
Oktaedr
0.414
8
Sześcian
0.732
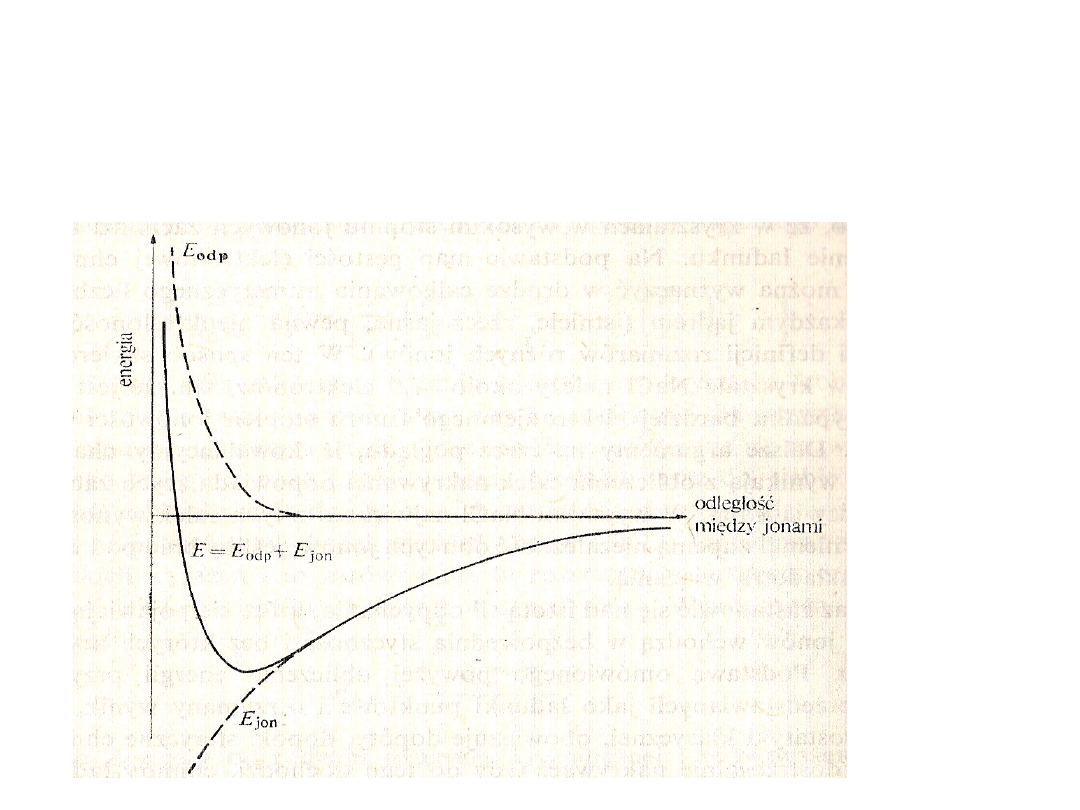
Energetyka wiązania jonowego
• Cs (5s
2
p
6
6s
1
) → Cs
+
(5s
2
p
6
) + e I = 375.4 kJ/mol
• Cl (3s
2
p
5
) + e → Cl
-
(3s
2
p
6
) E = -348.3 kJ/mol

Energia sieci krystalicznej
• Energia sieci – energia potrzebna do rozbicia 1 mola
substancji jonowej na gazowe jony znajdujące się
nieskończenie daleko od siebie
• Czynniki wpływające na energie sieci:
– Energia potencjalna przyciągania się jonów różnoimiennych
– Energia potencjalna odpychania się jonów jednoimiennych
– Energia odpychania się powłok elektronowych
n
1
1
d
e
Z
Z
A
N
U
0
2
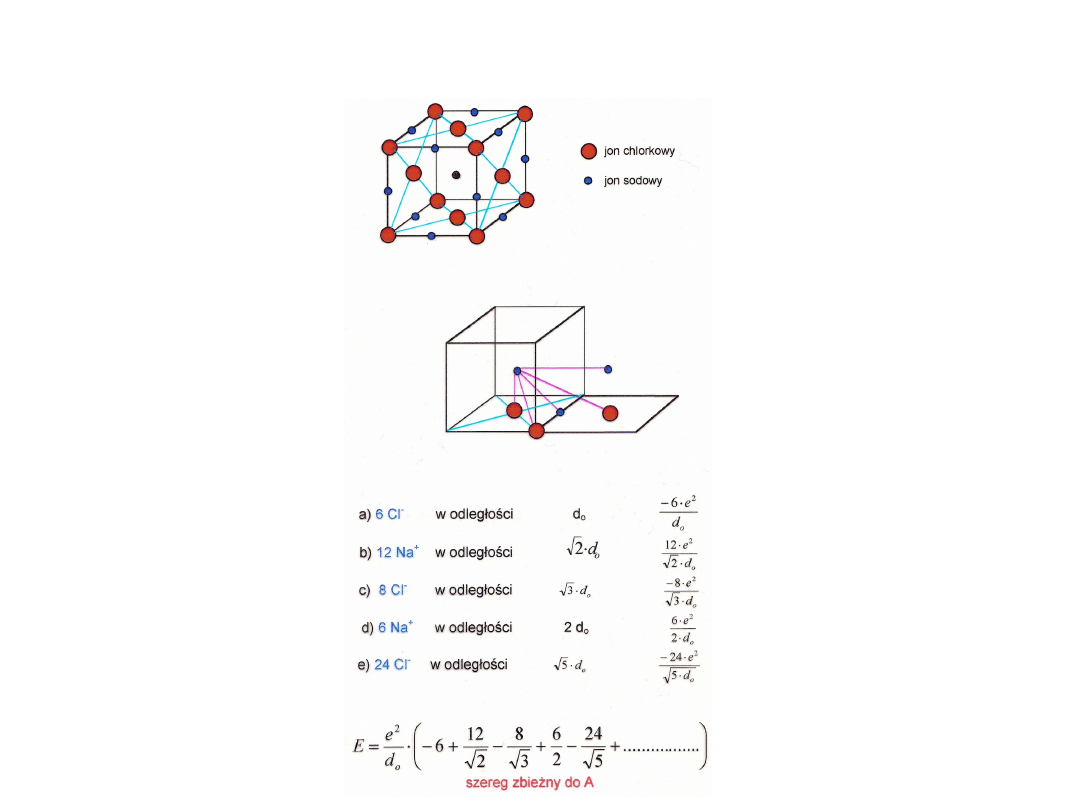
Stała Madelunga

Równanie Kapustinskiego
• Założenia:
A/const (0.87)
n = 9
d
0
= r
+
+ r
-
r
r
γ
Z
Z
108
U
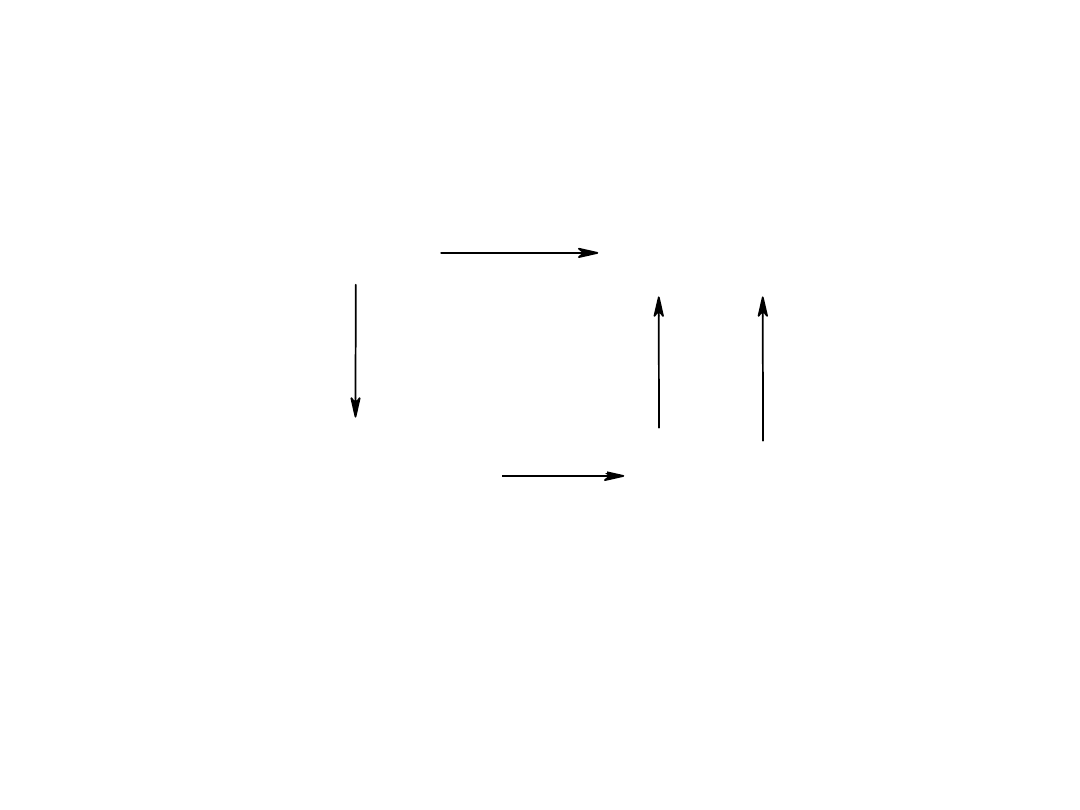
Obliczanie energii sieci z zastosowaniem cykli
termodynamicznych
NaCl
NaCl(s)
Na
+
(g)
+ Cl
-
(g)
U
Na
(s)
+ 1/2Cl
2 (g)
Na
(g)
+ Cl
(g)
Q
tw. NaCl
Q
subl. Na
1/2 D
Cl2
I
Na
E
Cl
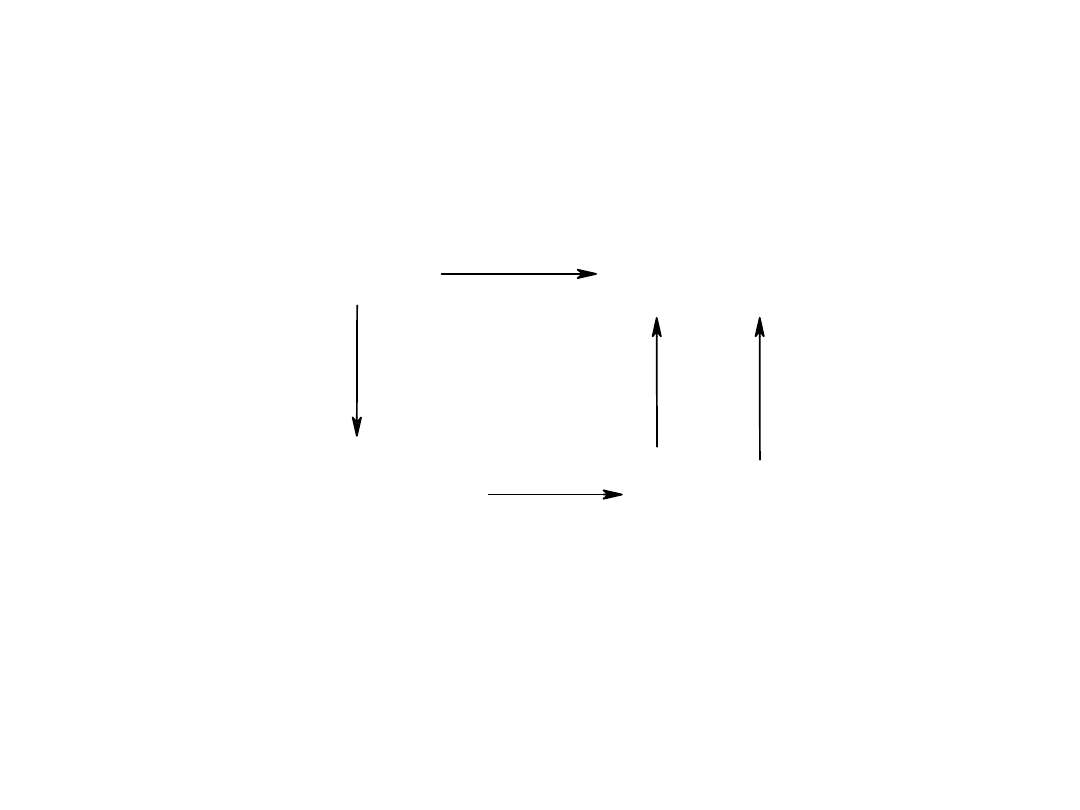
Obliczanie energii sieci z zastosowaniem cykli
termodynamicznych
MgO
Mg
2+
(g)
+ O
-2
(g)
U
Mg
(s)
+ 1/2O
2(g)
Mg
(g)
+ O
(g)
Q
tw. MgO
Q
subl. Mg
1/2 D
O2
I
1
+I
2
E
1
+E
2
MgO
(s)
Obliczanie energii sieci z zastosowaniem cykli
termodynamicznych
AlBr
3
Al
3+
(g)
+ 3Br
-
(g)
U
Al
(s)
+ 3/2Br
2(c)
Al
(g)
+ 3Br
(g)
Q
tw. AlBr3
Q
subl. Al
3/2 P
Br2
I
1
+I
2
+I
3
3E
Br
AlBr
3(s)
Inne rodzaje oddziaływań elektrostatycznych
oddziaływanie
energia [kJ/mol]
przykład
występowania
Jon – jon
kilkaset
sieci jonowe
Jon - dipol
do
kilkudziesieciu
solwatacja
Dipol - dipol
~ 20
struktura wody
Dipol – dipol
indukowany
kilka
Rozpuszczanie
gazów w wodzie
Dipol indukowany –
dipol indukowany
dziesiąte części
Skraplanie gazów
szlachetnych
Document Outline
Wyszukiwarka
Podobne podstrony:
chemia pytania wiązania jonowe i kowalencyjne
wiazania jonowe BTL3IIAFMOE74W3MSFJGHJBUIBBWBP6ML5EVZVI
chem3, Wiązania jonowe tworzą: a)pierwiastki gr. 1 i 2 oprócz H i Be z pierwiastkami gr. 16 i 17; b)
Wiązanie jonowe
kwasy i alkohole - chemia, Wiązanie jonowe występuje również w NaOH
chemia pytania wiązania jonowe i kowalencyjne
10) Wiązania chemiczne, wiązanie jonowe
wiazania jonowe
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
3 Równowagi jonowe w roztworach
Wykład 1, budowa atomu, wiązania chemiczne
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
Pecznienie to zdolnosc odwodnionych koloidow do wiazania wody
2 Atom i cząstka Wiązania chemiczne klucz
Rozpylanie jonowe
więcej podobnych podstron