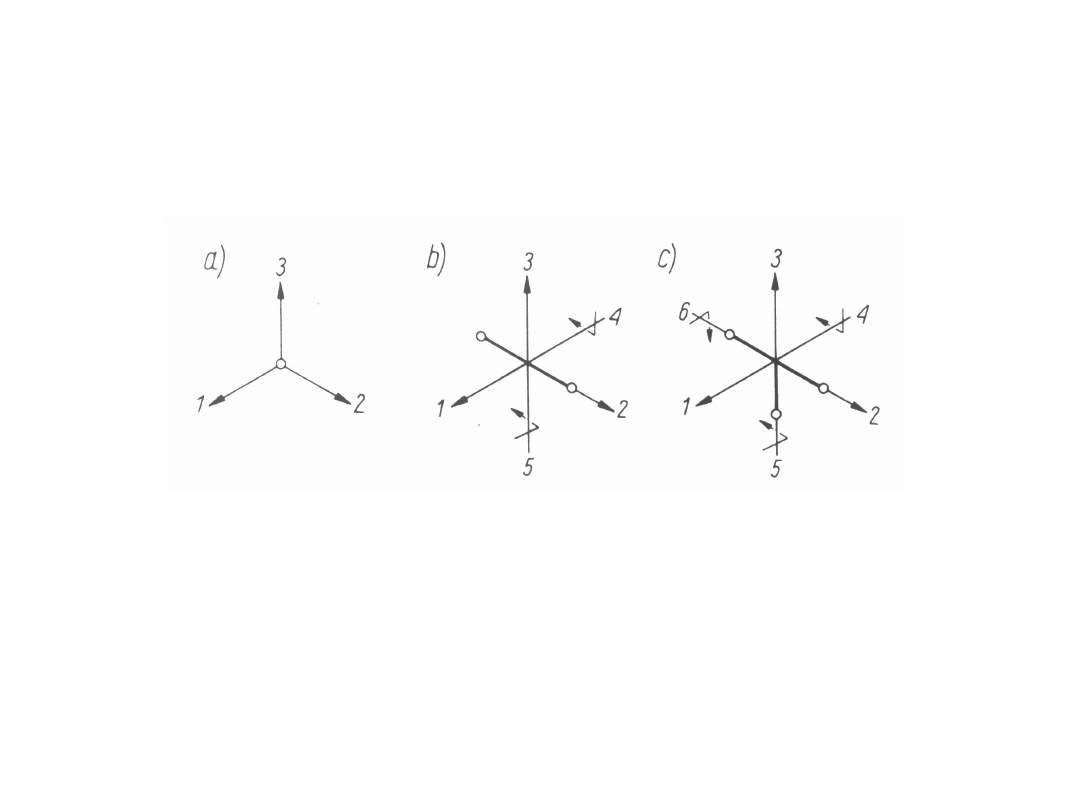
WŁAŚCIWOŚCI GAZÓW
DOSKONAŁYCH
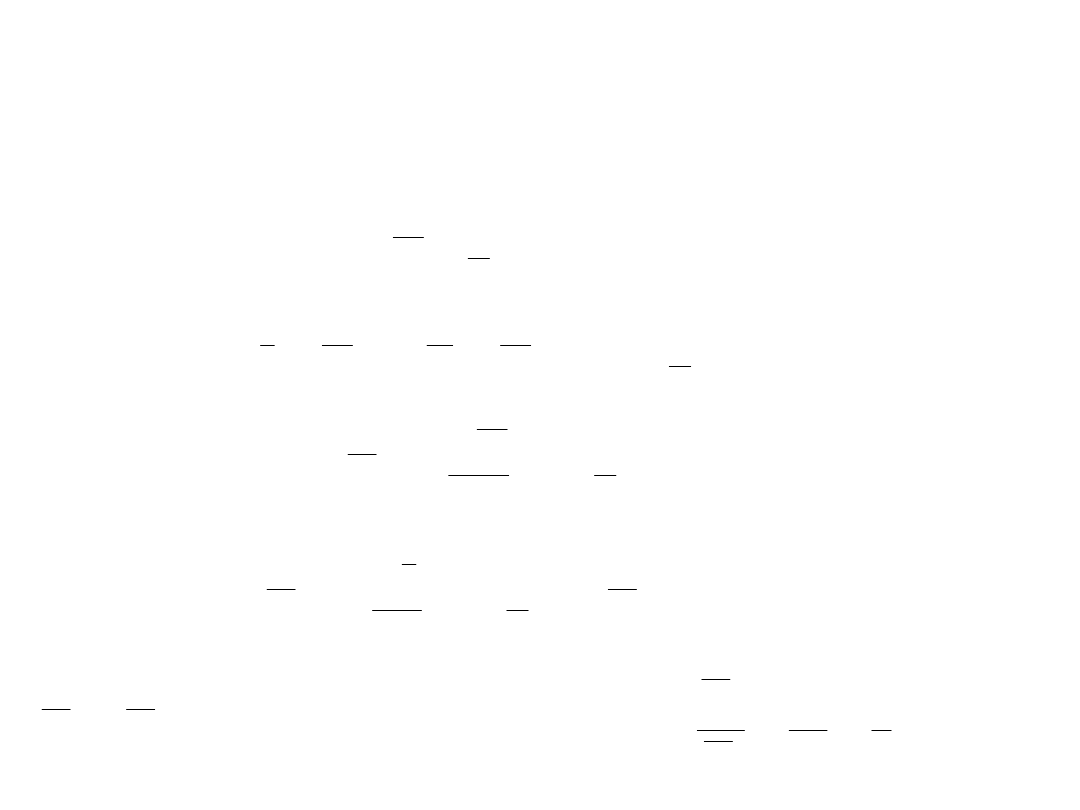
JEDNOATOMOWE GAZY DOSKONAŁE
BT
U
2
3
BT
BT
U
V
p
U
I
2
5
B
T
U
C
V
v
2
3
B
C
B
T
I
C
v
p
p
2
5
...
666
,
1
3
5
v
p
v
p
v
p
v
p
c
c
C
C
R
c
c
B
C
C
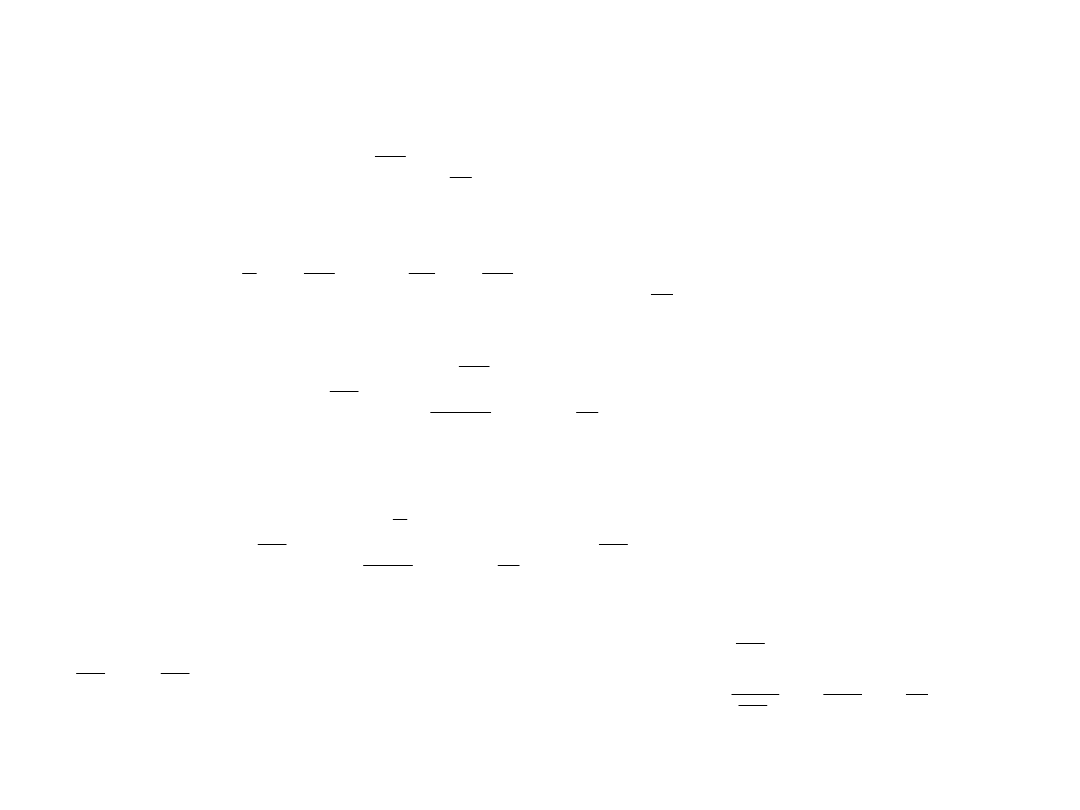
DWUATOMOWE GAZY DOSKONAŁE
BT
U
2
5
BT
BT
U
V
p
U
I
2
7
B
T
U
C
V
v
2
5
B
C
B
T
I
C
v
p
p
2
7
4
,
1
5
7
v
p
v
p
v
p
v
p
c
c
C
C
R
c
c
B
C
C
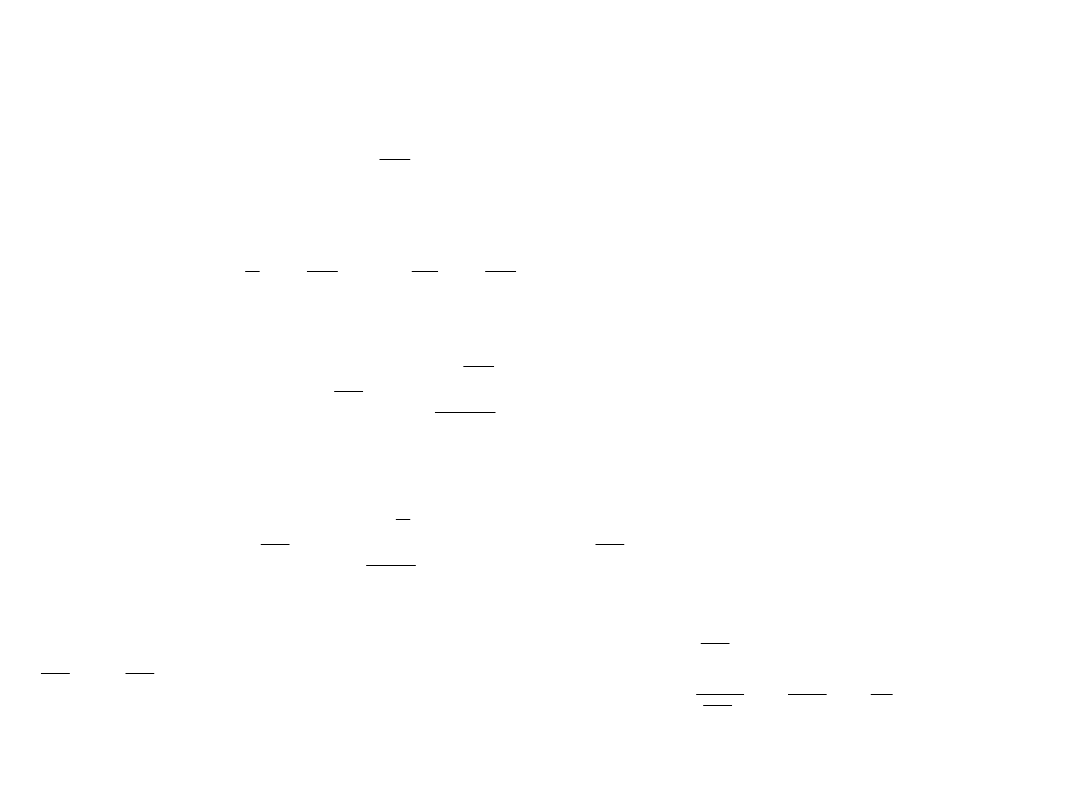
BT
U 3
BT
BT
U
V
p
U
I
4
B
T
U
C
V
v
3
B
C
B
T
I
C
v
p
p
4
...
333
,
1
3
4
v
p
v
p
v
p
v
p
c
c
C
C
R
c
c
B
C
C
WIELOATOMOWE GAZY DOSKONAŁE
GAZY PÓŁDOSKONAŁE

PRZEMIANY GAZÓW DOSKONAŁYCH
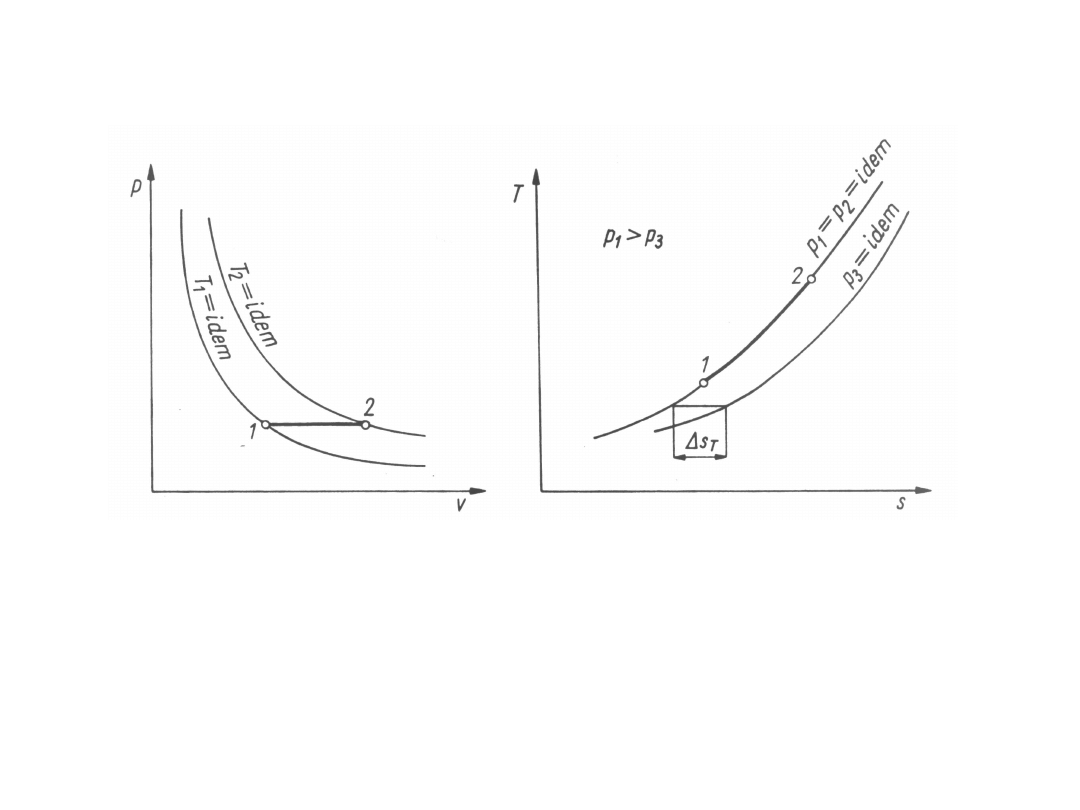
Przemiany izotermiczne
Przemiany izotermiczne są przemianami przy stałej
temperaturze (indeks T), tj. dT = 0, T
1
= T
2
= T =
idem.
Z równania stanu gazów doskonałych dla przemian
izotermicznych wynika, że
p
1
v
1
= p
2
v
2
= pv = RT
przy
stałej
temperaturze
iloczyn
ciśnienia
bezwzględnego przez objętość właściwą jest dla gazów
doskonałych wielkością stałą (prawo Boyle’a i
Mariotte’a).
Energia wewnętrzna właściwa i entalpia właściwa
gazów doskonałych są funkcjami tylko temperatury.
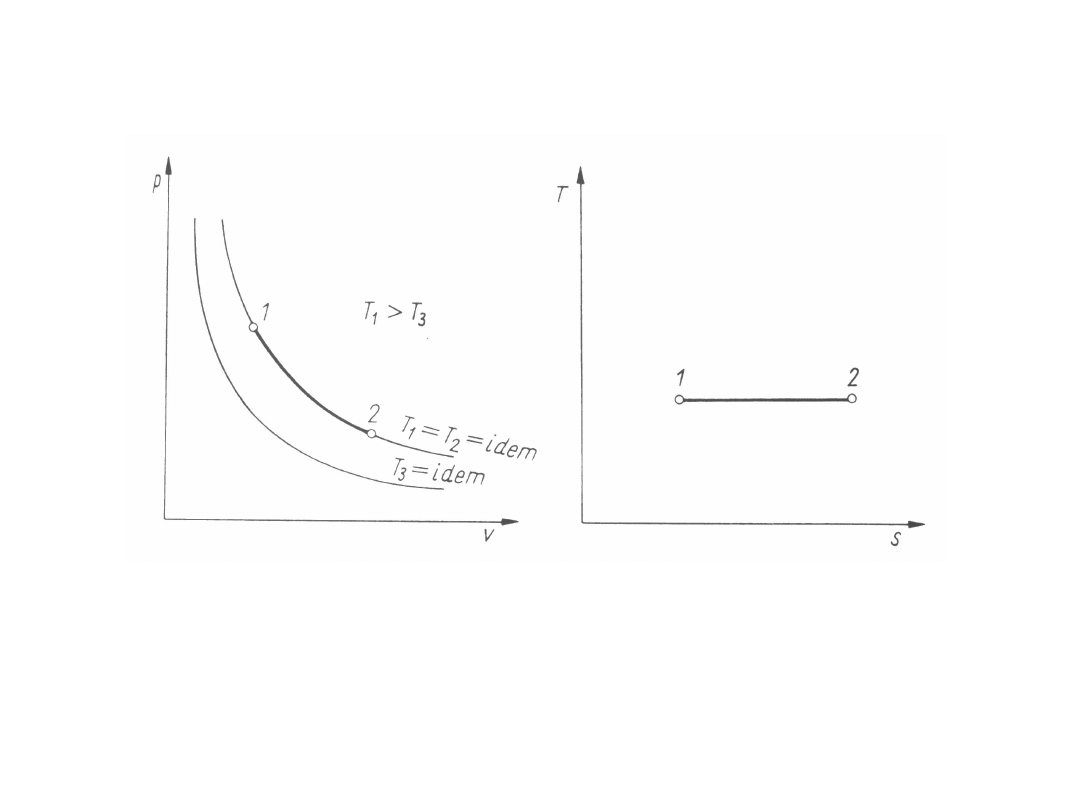

Przemiany izotermiczne gazów doskonałych są
zarazem przemianami izoenergetycznymi (u = idem)
oraz
izentalpowymi
(i = idem). Zatem z równań wyrażających pierwszą
zasadę termodynamiki wynika, że ciepło przemiany
izotermicznej gazów doskonałych jest równe pracy
zmiany objętości i pracy technicznej przemiany
2
,
1
2
,
1
2
,
1
tT
T
T
l
l
q
1
2
1
1
1
2
2
2
2
1
2
2
2
1
1
1
2
1
1
2
2
,
1
ln
ln
ln
ln
ln
ln
)
(
2
1
2
1
v
v
v
p
v
v
v
p
p
p
v
p
p
p
v
p
p
p
RT
v
v
RT
v
dv
RT
dv
v
p
l
v
v
v
v
T
T

Ciepło przemiany izotermicznej między stanami 1 i 2,
odniesione do 1 kg, można również prosto obliczyć z
przyrostu entropii właściwej:
)
(
1
2
2
,
1
2
1
s
s
T
Tds
q
s
s
T
Ponieważ znak ciepła przemiany izotermicznej jest
zgodny ze znakiem pracy zmiany objętości
przemiany i ze znakiem pracy technicznej, w
przypadku ekspansji (v
2
> v
1
) oraz rozprężania (p
2
<
p
1
) ciepło przemiany izotermicznej jest dodatnie, a
w przypadku kompresji (v
2
< v
1
) oraz sprężania (p
2
> p
1
) – ujemne.
Przyrost
entropii
właściwej
dla
przemiany
izotermicznej między stanami 1 i 2 można obliczyć
ze wzoru:
2
1
1
2
2
,
1
1
2
ln
ln
)
(
p
p
R
v
v
R
T
q
s
s
T
T

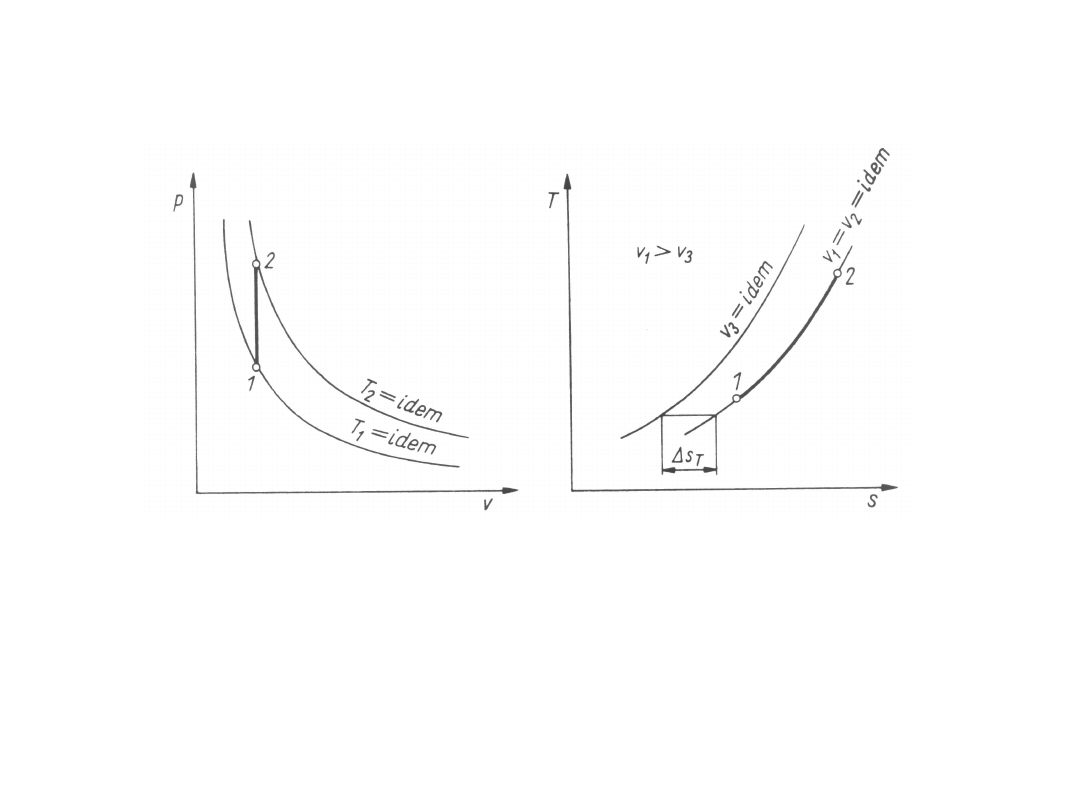
Przemiany izochoryczne
Przemiany izochoryczne są przemianami przy stałej
objętości (indeks V), a przy rozważaniu stałej ilości
jednorodnej substancji są także przemianami przy
stałej
objętości
właściwej
(indeks
v),
tj. dv = 0, v
1
= v
2
= v = idem. Obrazem
geometrycznym
przemiany
izochorycznej
jest
izochora.
Po podzieleniu stronami równań stanu gazów
doskonałych dla stanów 1 i 2 o jednakowych
objętościach właściwych otrzymuje się
1
2
1
2
T
T
p
p
Przy stałej objętości właściwej ciśnienie bezwzględne
gazu doskonałego jest wprost proporcjonalne do
temperatury bezwzględnej (prawo Charlesa).

Praca zmiany objętości dla przemiany izochorycznej
(dv = 0) jest równa zeru
2
1
0
2
,
1
v
v
v
pdv
l
Wobec tego z równania wyrażającego pierwszą zasadę
termodynamiki
wynika,
że
ciepło
przemiany
izochorycznej jest zużywane w całości na przyrost
energii wewnętrznej.
Ciepło przemiany izochorycznej między stanami 1 i 2,
odniesione do 1 kg, wynosi
1
0
2
0
1
2
2
,
1
1
2
T
c
T
c
u
u
q
T
v
T
v
v
a dla gazów doskonałych o stałym cieple właściwym
)
(
1
)
(
1
)
(
1
2
1
2
1
2
2
,
1
p
p
v
T
T
R
T
T
c
q
v
v
Na skutek izochorycznego ogrzewania wzrastają
temperatura i ciśnienie gazu doskonałego.
Praca
techniczna
przemiany
izochorycznej,
odniesiona do 1 kg, wynosi:
Przyrost
entropii
właściwej
dla
przemiany
izochorycznej między stanami 1 i 2 jest równy
a dla gazów doskonałych o stałym cieple właściwym
2
,
1
2
1
2
1
2
,
1
)
1
(
)
(
)
(
2
1
v
p
p
tv
q
T
T
R
p
p
v
vdp
l
1
2
1
2
1
2
ln
)
(
)
(
]
)
(
[
)
(
)
(
2
1
2
1
T
T
R
T
s
T
s
T
dT
R
T
c
T
dT
T
c
s
s
p
p
T
T
p
T
T
v
v
1
2
1
2
1
2
ln
ln
)
(
p
p
c
T
T
c
s
s
v
v
v

Na wykresie o współrzędnych T-s izochora gazu
doskonałego
o stałym cieple właściwym jest krzywą logarytmiczną.
Izochora
o większej objętości właściwej v
1
= idem przebiega na
wykresie
o współrzędnych T-s przy większych wartościach
entropii niż izochora o mniejszej objętości właściwej
v
3
= idem. Pozioma odległość między izochorami jest
stała i wynosi
3
1
1
3
ln
)
(
v
v
R
s
s
s
T
T

Przemiany izobaryczne
Przemiany izobaryczne są przemianami przy stałym
ciśnieniu (indeks p), tj. dp = 0, p
1
= p
2
= p = idem.
Obrazem geometrycznym przemiany izobarycznej
jest izobara.
Po podzieleniu stronami równań stanu gazów
doskonałych dla stanów 1 i 2 o jednakowych
ciśnieniach otrzymuje się
Przy stałym ciśnieniu objętość właściwa gazu
doskonałego
jest
wprost
proporcjonalna
do
temperatury bezwzględnej (prawo Gay-Lussaca).
Praca techniczna przemiany izobarycznej (dp = 0)
jest równa zeru
1
2
1
2
T
T
v
v
p
2
1
0
2
,
1
p
p
tp
vdp
l

Z
równania
wyrażającego
pierwszą
zasadę
termodynamiki
wynika,
że
ciepło
przemiany
izobarycznej jest zużywane w całości na przyrost
entalpii.
Ciepło przemiany izobarycznej między stanami 1 i 2,
odniesione do 1 kg, wynosi
a dla gazów doskonałych o stałym cieple właściwym
Praca zmiany objętości przemiany izobarycznej między
stanami 1 i 2, odniesiona do 1 kg, wynosi
1
0
2
0
1
2
2
,
1
1
2
T
c
T
c
i
i
q
T
p
T
p
p
)
(
1
)
(
1
)
(
1
2
1
2
1
2
2
,
1
v
v
p
T
T
R
T
T
c
q
p
p
2
,
1
1
2
1
2
2
,
1
1
)
(
)
(
2
1
p
v
v
p
q
T
T
R
v
v
p
pdv
l

Przyrost entropii właściwej dla przemiany izobarycznej
między stanami 1 i 2 dla gazów o stałym cieple
właściwym jest równy
Na wykresie o współrzędnych T-s izobara gazu
doskonałego o stałym cieple właściwym jest krzywą
logarytmiczną przebiegającą łagodniej niż izochora,
ponieważ podstyczne są równe ciepłu właściwemu
a c
p
> c
v
. Izobara o wyższym ciśnieniu p
1
= idem.
Pozioma odległość między tymi izobarami jest stała i
wynosi
1
2
1
2
1
2
ln
ln
)
(
v
v
c
T
T
c
s
s
p
p
p
1
3
2
3
ln
)
(
p
p
R
s
s
s
T
T

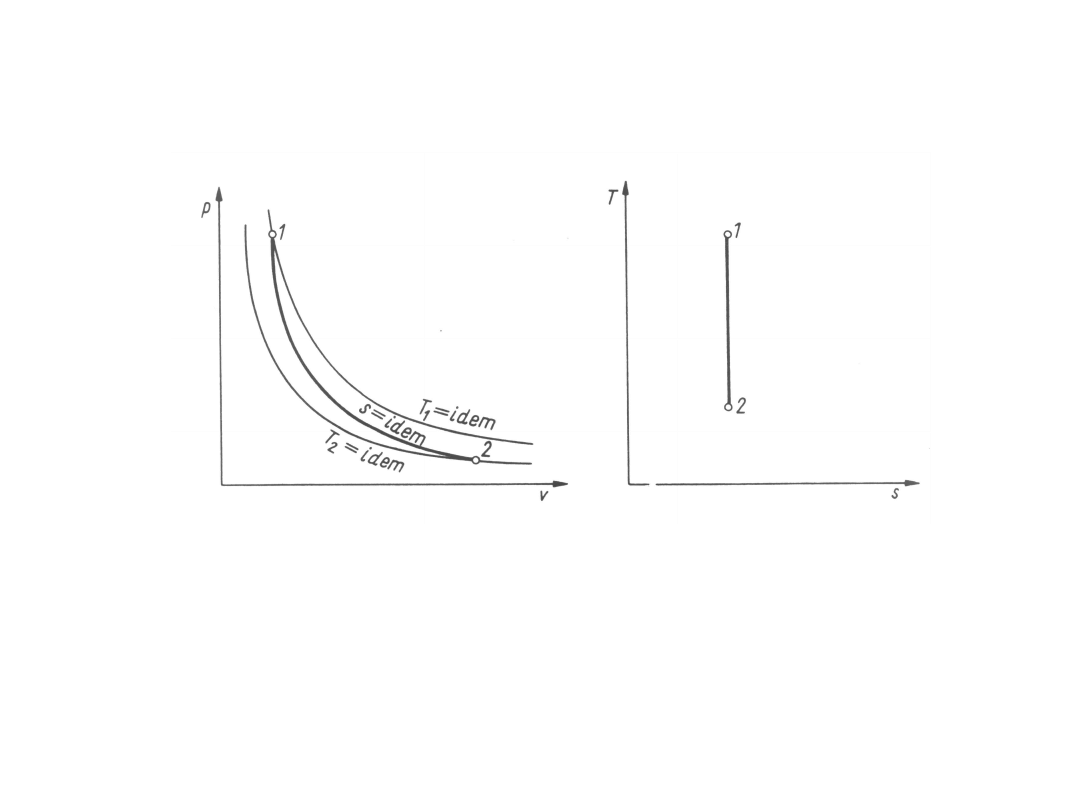
Przemiany adiabatyczne
Przemiany adiabatyczne są przemianami bez
wymiany
ciepła
z otoczeniem (dq
z
= 0). Odwracalne (dq
w
= 0)
przemiany
adiabatyczne
są
przemianami
izentropowymi:
0
,
0
ds
Tds
dq
dq
dq
w
z
Dla gazów doskonałych o stałym cieple właściwym
lub w postaci zależności między parametrami
dowolnego stanu przemiany izentropowej
;
1
2
1
1
2
2
1
1
2
p
p
v
v
v
v
p
p
idem
pv

Dla gazów doskonałych o stałym cieple właściwym
stosunek ciepła właściwego przy stałym ciśnieniu do
ciepła właściwego przy stałej objętości
nazywany
jest wykładnikiem izentropy.
Ponieważ
na wykresie o współrzędnych p- izentropa przebiega
bardziej stromo niż izoterma.
T
s
v
p
v
p
v
p
v
p
Jeżeli podzieli się stronami równania stanu gazów
doskonałych dla stanów 1 i 2
1
2
1
1
2
2
T
T
v
p
v
p
to po uwzględnieniu równań * otrzymuje się
1
1
2
1
1
2
1
2
1
1
2
;
T
T
v
v
v
v
T
T
1
1
2
1
2
1
1
2
1
2
;
T
T
p
p
p
p
T
T

lub w postaci zależności między parametrami
dowolnego stanu przemiany izentropowej
Ciepło przemiany izentropowej (ds = 0) między
stanami 1 i 2 jest równe zeru
idem
idem;
1
1
Tp
Tv
2
1
0
2
,
1
s
s
s
Tds
q
Z równania wyrażającego pierwszą zasadę
termodynamiki wynika więc, że praca przemiany
izentropowej jest wykonywana kosztem spadku
energii wewnętrznej i w odniesieniu do 1 kg
substancji dla gazów doskonałych o stałym cieple
właściwym wynosi
Praca techniczna przemiany izentropowej jest
wykonywana kosztem spadku entalpii i dla gazów
doskonałych o stałym cieple właściwym w
odniesieniu do 1 kg wynosi
1
1
2
1
1
2
1
1
1
2
2
1
1
2
1
2
1
2
,
1
1
1
1
1
1
)
(
1
)
(
p
p
RT
v
v
v
p
v
p
v
p
T
T
R
T
T
c
l
v
s
2
,
1
2
1
2
,
1
)
(
s
p
ts
l
T
T
c
l
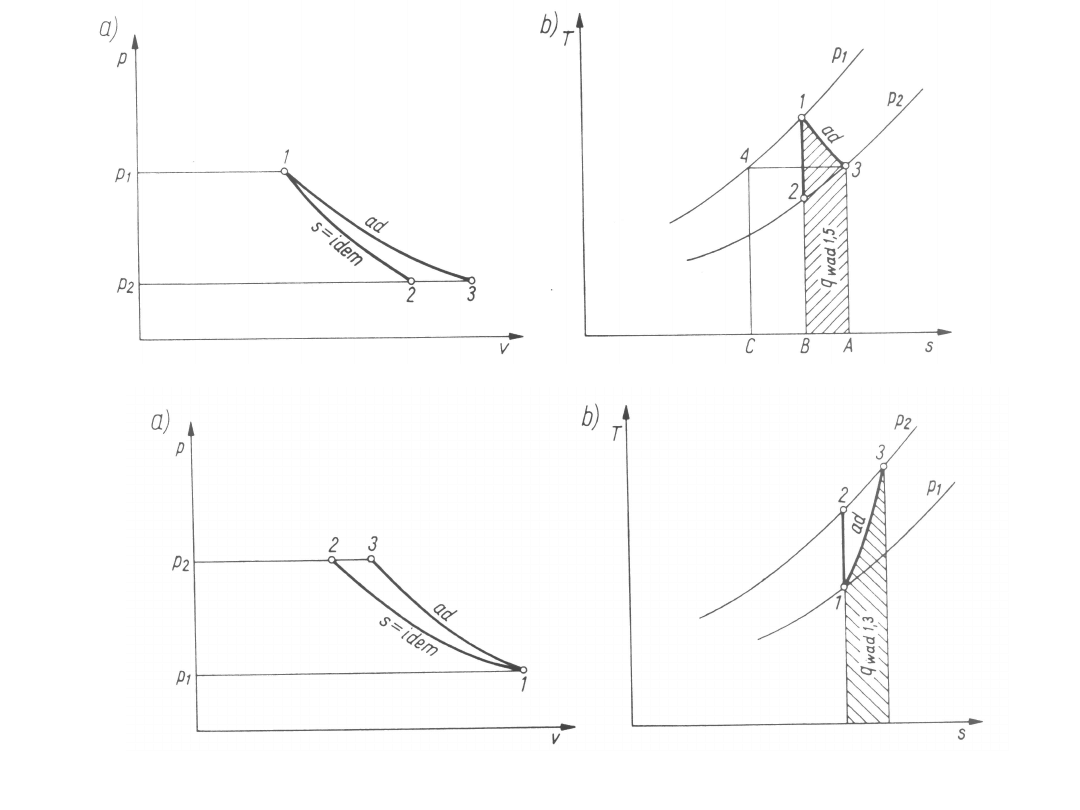

Zewnętrzne ciepło przemiany adiabatycznej jest
równe
zeru
(q
zad1,3
=
0).
Całkowite
ciepło
przemiany
adiabatycznej jest równe ciepłu rozpraszania pracy.
Zewnętrzna
praca
techniczna
przemiany
adiabatycznej jest wykonywana kosztem spadku
entalpii i dla gazów doskonałych (przy stałym cieple
właściwym) jest równa
Zewnętrzną
pracę
techniczną
przemiany
adiabatycznej można łatwo odczytać z wykresu o
współrzędnych i-s jako odpowiedni spadek entalpii
właściwej.
)
(
1
)
(
3
1
3
1
3
1
3
,
1
T
T
R
T
T
c
i
i
l
p
ztad

Sprawność izentropowa (adiabatyczna) rozprężania
jest zdefiniowana jako stosunek nieodwracalnego
adiabatycznego spadku entalpii do izentropowego
spadku
entalpii
od
tego
samego
stanu
początkowego
do
takiego
samego
ciśnienia
końcowego.
Sprawność izentropowa (adiabatyczna) sprężania
jest zdefiniowana jako stosunek izentropowego
wzrostu
entalpii
do
nieodwracalnego
adiabatycznego wzrostu entalpii od tego samego
stanu początkowego do takiego samego ciśnienia
końcowego.

Przemiany politropowe
Rodzina przemian politropowych (indeks n)
zdefiniowana jest przez równanie
gdzie wykładnik politropy n = idem jest wielkością
stałą dla danej przemiany, a dla różnych przemian
może przybierać dowolne wartości rzeczywiste
Obrazem geometrycznym przemiany politropowej jest
politropa
idem
n
pv
n
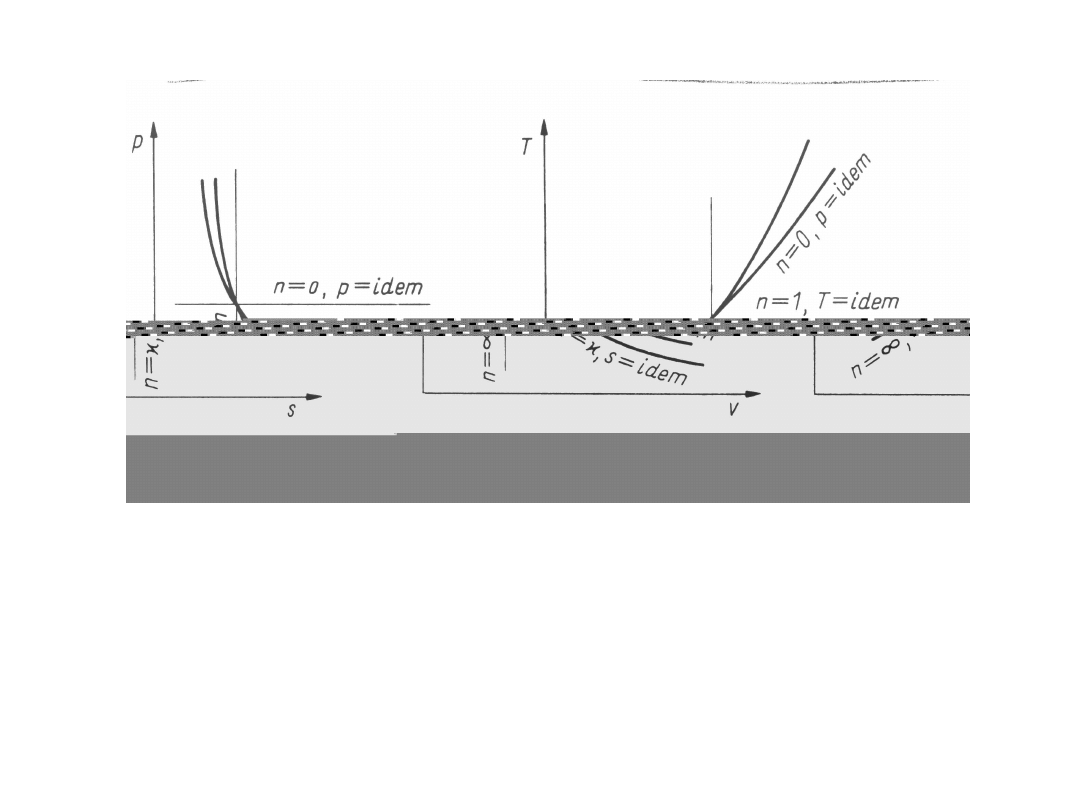
Dla szczególnych wartości wykładnika politropy
otrzymuje się:
- przemiany izobaryczne substancji dowolnych: n = 0,
p = idem;
-
-
przemiany izotermiczne gazów doskonałych: n = 1,
pv = idem,
T = idem
-
- przemiany izentropowe gazów doskonałych o
stałym cieple
właściwym;
n = , pv
= idem;
-
- przemiany izochoryczne substancji dowolnych: n =
,
v = idem.
Należy zauważyć, że przemiany izentropowe gazów
doskonałych
o cieple właściwym zależnym od temperatury nie są
przemianami politropowymi.
idem
1
v
p
1
1
2
1
1
2
1
2
1
1
2
;
n
n
T
T
v
v
v
v
T
T
1
1
2
1
2
1
1
2
1
2
;
n
n
n
n
T
T
p
p
p
p
T
T
n
n
p
p
v
v
v
v
p
p
1
2
1
1
2
2
1
1
2
;
Praca przemiany politropowej
n
n
n
n
n
n
n
p
p
n
v
p
v
v
n
v
p
p
p
n
RT
v
v
n
RT
T
T
n
R
l
1
1
2
1
1
1
2
1
1
1
1
1
2
1
1
2
1
1
2
1
2
,
1
1
1
1
1
1
1
1
1
)
(
1
Praca techniczna przemiany politropowej
2
,
1
1
1
2
2
2
,
1
2
,
1
)
(
n
n
tn
nl
v
p
v
p
l
l
Ciepło właściwe przemiany politropowej wynosi
R
n
n
R
n
n
T
n
T
c
n
R
T
c
T
c
v
v
n
1
1
1
1
1
1
1
)
(
)
(
1
)
(
)
(

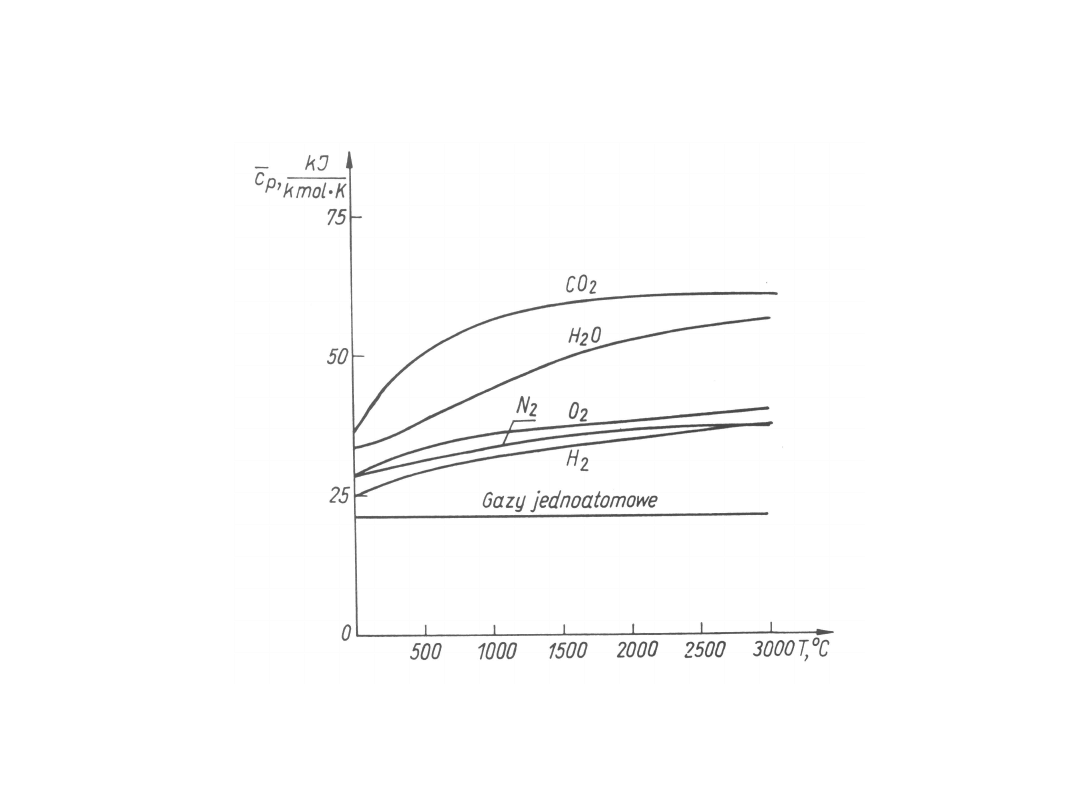
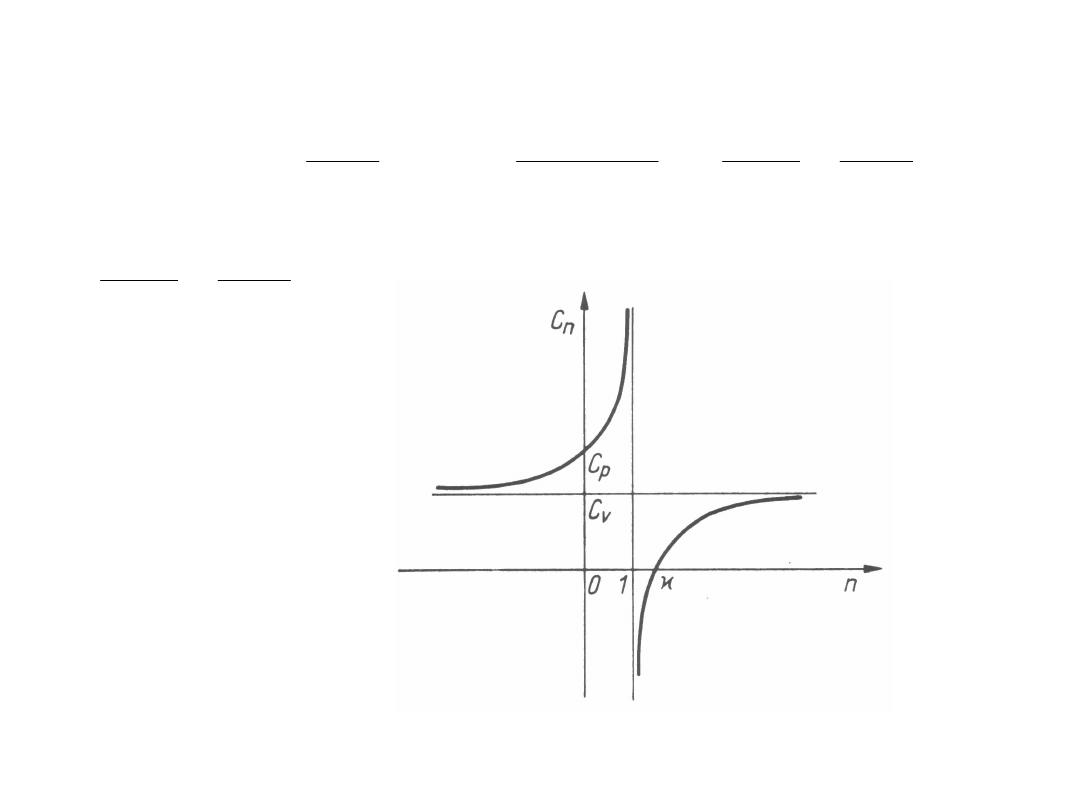
Na rysunku podano zależność ciepła właściwego
przemian politropowych od wykładniki politropy dla
gazów
doskonałych
o
stałym
cieple
właściwym.
Dla
przemian
izobarycznych, gdy n = 0, jest c
n
= c
= c
p
. Dla
przemian izotermicznych, gdy n = 1, jest
c
n
= c
T
= . Dla przemian izentropowych, gdy n = ,
jest c
n
= c
T
= . Dla przemian izentropowych, gdy n
=
,
jest
c
n
=
c
s
=
0.
Dla przemian izochorycznych, gdy n = , jest c
n
= c
.
Dla przemian izentropowych jest c
n
= 0, czyli n = .
Ciepło przemiany politorpowej między stanami 1 i 2,
odniesione do 1 kg, dla gazów doskonałych o stałym
cieple właściwym wynosi
v
n
p
n
v
n
c
c
c
c
n
n
n
c
c
1
)
(
1
)
(
1
)
(
1
2
1
2
1
2
2
,
1
u
u
n
n
T
T
n
n
c
T
T
c
q
v
n
n

Iloczyny parametrów p, v, T przeciwległych punktów
przecięć politrop (tj. iloczyny parametrów punktów
parzystych
i nieparzystych) w obiegu składającym się z dwóch
politrop
o jednakowych wykładnikach przeciętych dwoma
politropami
o jednakowych wykładnikach są sobie równe.
p
1
p
3
= p
2
p
4
v
1
v
3
= v
2
v
4
T
1
T
3
= T
2
T
4
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
Termodynamika wyklad 3
TERMODYNAMIKA wyklad I
Termodynamika wyklad IV
Termodynamika wyklad 1
Termodynamika wyklad III 3
Terma, Termodynamika wyklad II
Termodynamika wyklad 2
Zasady termodynamiki Wykład
Termodynamika wyklad 4 [16 03 2009]
Termodynamika wyklad 3
więcej podobnych podstron