
Umiejętność napisania konfiguracji
elektronowej prostych pierwiastków i
określenie na tej podstawie ich
wartościowości i położenia w układzie
okresowym.

Elektrony wokół jądra atomowego
rozmieszczone są na powłokach, które
nazywane są K, L. M, N, O… itd.
(pierwsza, znajdująca się najbliżej jądra
powłoka nazywana jest powłoką K, a kolejne
nazywane są od kolejnych liter alfabetu).

Elektrony znajdujące się na tej samej
powłoce różnią się nieznacznie energią,
natomiast elektrony znajdujące się na
dwóch różnych powłokach różnią się
znacznie energią.
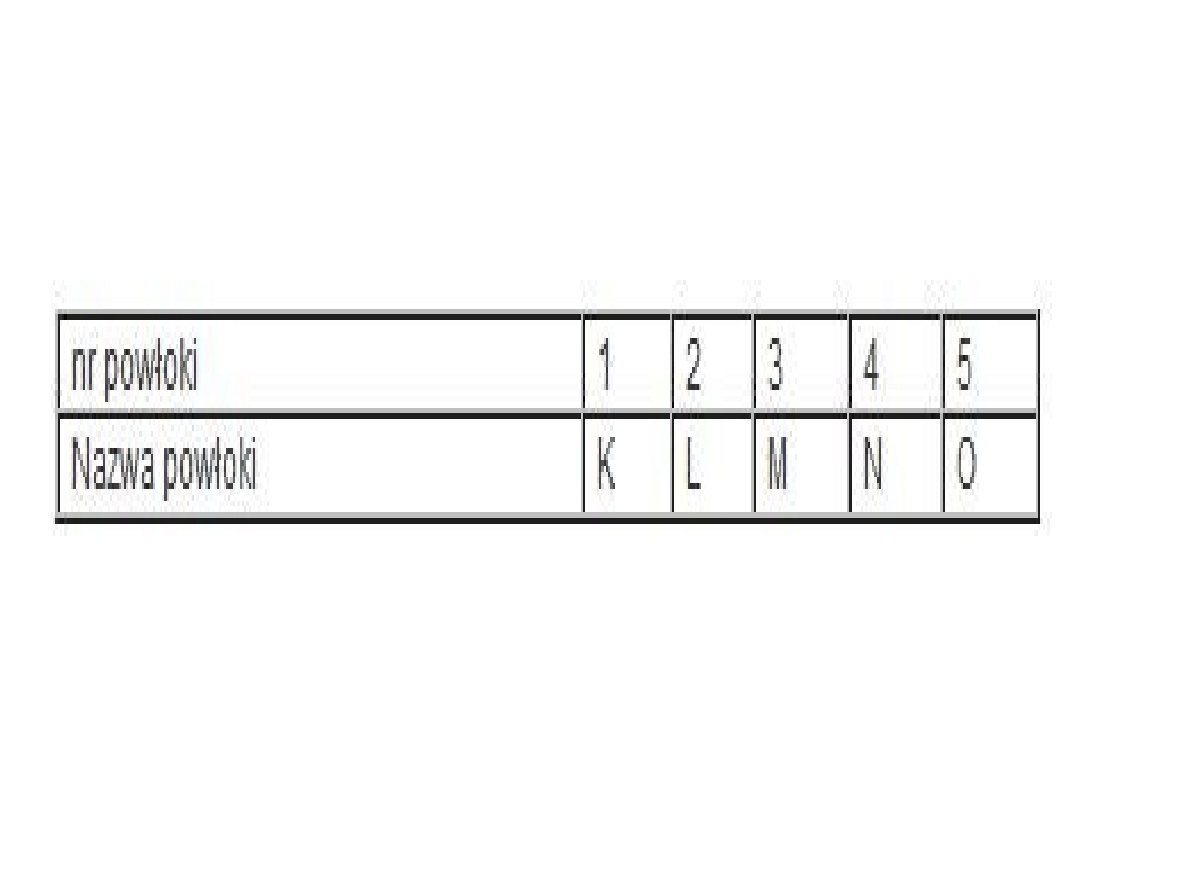
Jeżeli ponumerujemy powłoki:

Liczby określające nr powłoki nazywane są
główną liczbą kwantową n. Maksymalna
ilość elektronów na powłoce określona jest
wzorem: Maksymalna ilość
elektronów=2n(2), czyli na poszczególnych
powłokach może być:
* powłoka K (1) = 2
* powłoka L (2) = 8
Teraz policz ile maksymalnie elektronów
może być na powłoce M, N, O

Policzone?
To sprawdź

M = 18
N = 32
O = 50

Każda powłoka elektronowa zawiera w sobie
tzw. PODPOWŁOKI
Podpowłoka najniższego poziomu
energetycznego ma oznaczenie s a kolejne
według wzrastającej energii s, p, d i f.

Maksymalna liczba elektronów na tych
podpoziomach wynosi:
Na podpowłoce s mogą być tylko 2
elektrony
Na podpowłoce p może być tylko 6
elektronów
na podpowłoce d może być tylko 10
elektronów
na podpowłoce f może być tylko
14elektronów

Podpowłoka s – czyli grupa 1 i 2
Podpowłoka p – czyli grupa 13-18
itd

Powłoka 1( albo K ) zawiera tylko orbital
(podpowłokę )
s
(czyli może posiadać tylko
2 elektrony )
Powłoka 2( albo L ) zawiera tylko orbital
(podpowłokę )
s oraz p
(czyli może posiadać
tylko 8 elektronów )
Powłoka 3( albo M ) zawiera tylko orbital
(podpowłokę )
s oraz p i d
(czyli może
posiadać tylko 18 elektronów)

Rzeczywiste obsadzenie elektronami
zapisujemy za pomocą Liczb umieszczonych
u góry z prawej strony symbolu orbitalu. Np.
zapis :
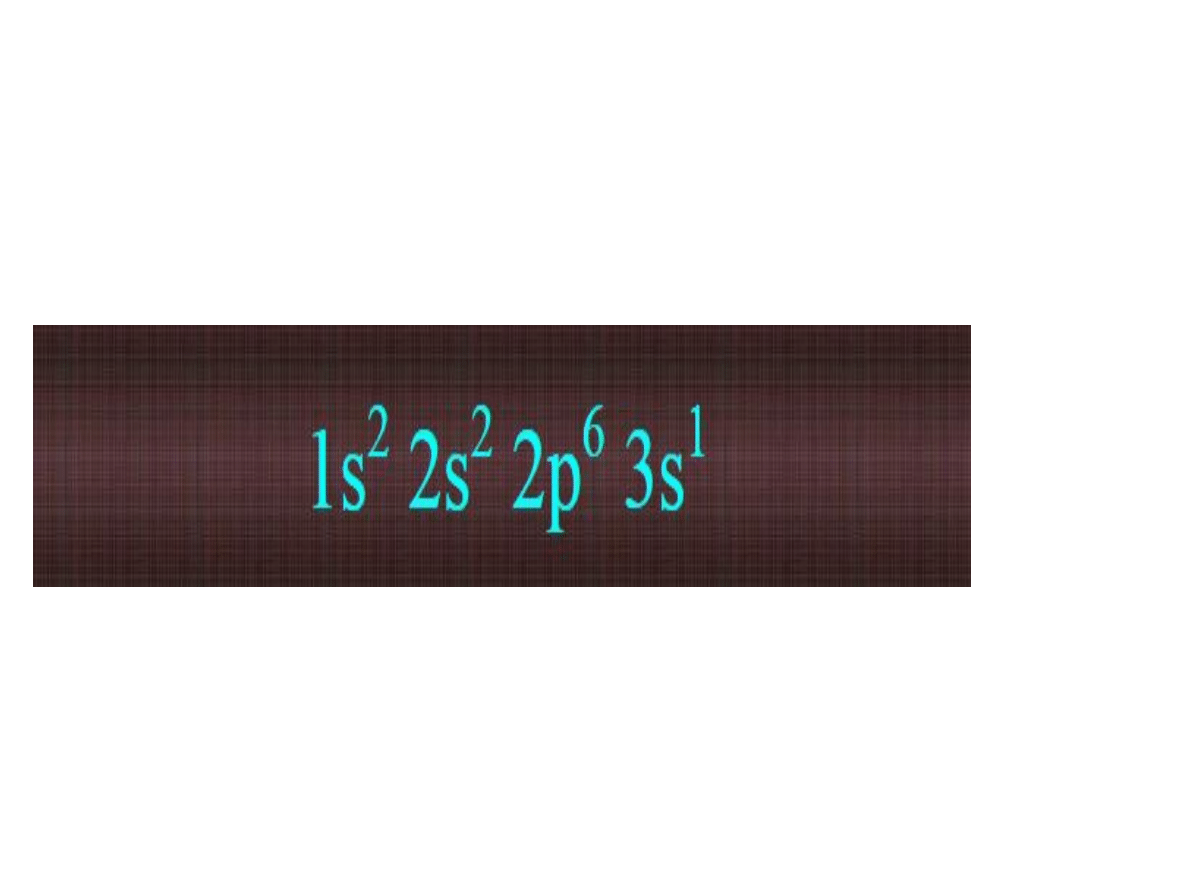

oznacza atom, który zawiera
11 elektronów,
rozmieszczonych na podpowłokach
Sumujemy cyferki u góry :D

2 elektrony na orbitalu 1s - powłoce 1
2 elektrony na orbitalu 2s , 6 elektronów na
orbitalu 2p - powłoce 2
1 elektron na orbitalu 3s - powłoce 3
Łącznie na 3 powłokach atom zawiera
2+2+6+1 = 11 elektronów

A ponieważ ile elektronów tyle protonów w
atomie , sprawdzamy jaki pierwiastek
posiada liczbę atomową 11, oczywiście jest
to Sód (Na, łac. natrium) - pierwiastek
chemiczny, z grupy metali alkalicznych w
układzie okresowym

Liczby występujące przed literami oznaczają
numery kolejnych powłok elektronowych.
Ich numeracja zaczyna się od powłoki
najbliższej jądra i rośnie wraz z oddalaniem
się od niego. Małe litery ("s", "p", "d" i "f")
oznaczają rodzaje typów orbitali, zaś górne
indeksy liczbowe oznaczają liczbę
elektronów znajdujących się na danym
poziomie orbitalnym, w danym typie
orbitalu.
Document Outline
- PowerPoint Presentation
- Slide 2
- Slide 3
- Jeżeli ponumerujemy powłoki:
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
Temat 2 Konfiguracja elektronowa
Konfiguracja elektronowa atomów
Konfiguracje elektronowe, Inżynieria chemiczna i procesowa
Konfiguracja elektronowa pierwiastków
konfiguracje elektronowe pierwiastków
konfiguracja elektronowa zadania
konfiguracja elektronowa
Konfiguracja elektronów
Konfiguracji elektronowa
konfiguracja elektronowa(1)
Konfiguracja elektronowa atomów (2)
KONFIGURACJA ELEKTRONOWA
Trwała konfiguracja elektronowa
10 Orbitale atomowe, konfiguracja elektronowa B
39 Właściwości pierwiastków grup głównych w powiązaniu z konfiguracją elektronową elektronów walency
konfiguracja elektronowa pierwiastków
Konfiguracji elektronowa
więcej podobnych podstron