
Mechanizm reakcji
addycji elektrofilowej
-Heterolityczny rozpad
cząsteczki
halogenu, halogenowodoru,
wody,
-Karbokation jako produkt
pośredni

Heteroliza
cząsteczki
halogenu
i powstanie
karbokationu
• Etap I:
Heteroliza
– w uproszczeniu można przyjąć, że
pod
wpływem wiązana π
w
cząsteczce alkenu
następuje
rozpad wiązania kowalencyjnego w cząsteczce np. Br –
Br
i
powstanie różnych jonów: Br – Br Br
+
+ Br
-
• Etap II:
Addycja jonu Br
+
do
elektronów π
w cząsteczce
alkenu i powstanie
karbokationu
H
H
H
|
H
• C C +
Br
+
H
–
C
–
+
C
karbokation
H
H
|
H
(produkt
przejściowy)
Br

Powstanie produktu
finalnego
• Etap III:
addycja jonu Br
-
do karbokationu
H
H H
|
H
| |
•
H
–
C
–
+
C
+
Br
-
H
–
C
–
C
–
C
|
H
| |
Br
Br Br
karbokation 1,2-di
bromo
etan
W identyczny sposób przebiega reakcja addycji
cząsteczki
chloru
,
halogenowodoru (HX)
przez
alkeny.

Powstanie
π
–
kompleksu
• W rzeczywistości
pod wpływem wiązania π
w cząsteczce alkenu
następuje silna polaryzacja
wiązania Br – Br
a tym samym
uwidocznienie się
ładunków cząstkowych na
atomach bromu
:
• Br
–
Br
Br
δ+
Br
δ-
• Atom bromu o
ładunku
cząstkowym dodatnim
oddziaływuje z
parą π
alkenu
w wiązaniu C = C,
w efekcie
powstaje nietrwały π – kompleks
a
wiązanie Br – Br
ulega dalszej polaryzacji
co prowadzi
do heterolitycznego zerwania tego
wiązania
i powstania
kationu
i anionu
bromkowego.

Powstanie
σ
–
kompleksu
(
karbokationu
)
• Kation bromu (Br+)
przyciąga parę
elektronową π wiązania podwójnego
i jej
kosztem powstaje wiązanie
C – Br
• Przekazanie
pary wiążącej π
na kation
bromu
powoduje uwidocznienie się na
drugim at. C wiązania podwójnego
ładunku
dodatniego,
ponieważ para wiążąca π została
utworzona przez uwspólnienie
niesparowanych elektronów z orbitali 2p
(
niezhybrydyzowanych)
obu atomów węgla
między którymi powstało wiązanie podwójne,
powstaje tzw. karbokation: σ – kompleks
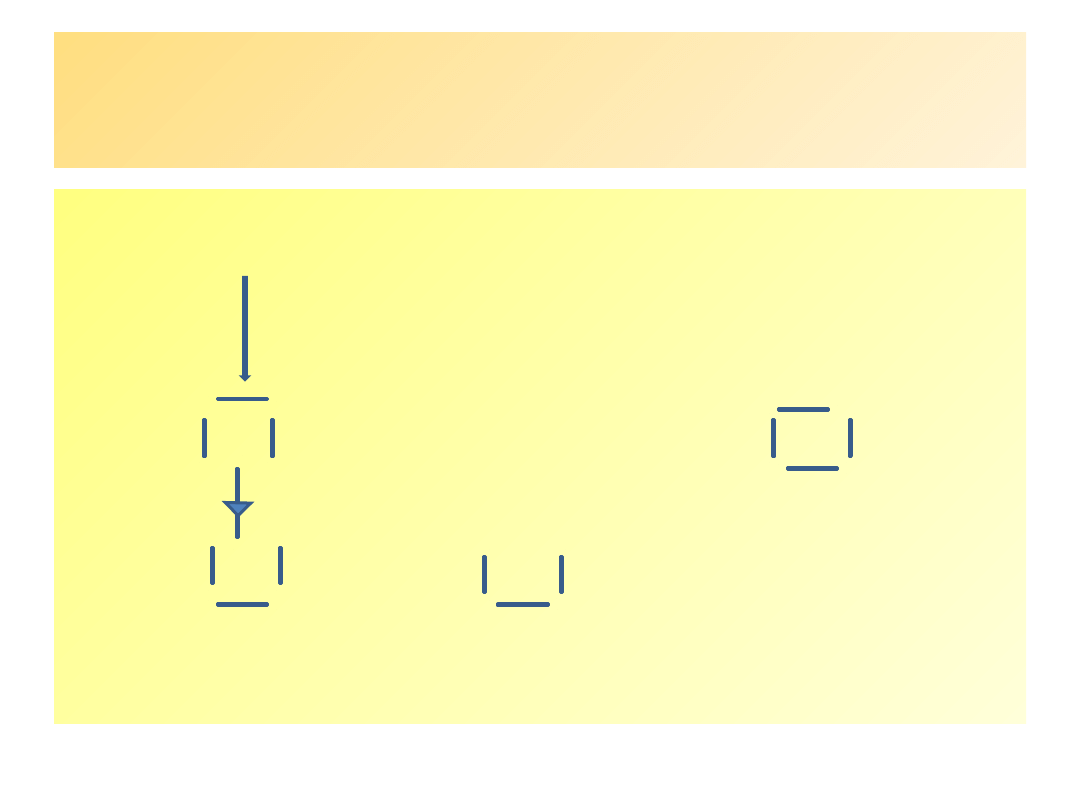
Powstanie
σ
–
kompleksu
(
karbokationu
) cd
• π
–
kompleks
σ
–
kompleks
(
karbokation
)
• H
2
C
=
CH
2
H
H
| |
Br
δ+
H
–
C
–
+
C
–
H
+
Br
-
|
Br
δ-
Br
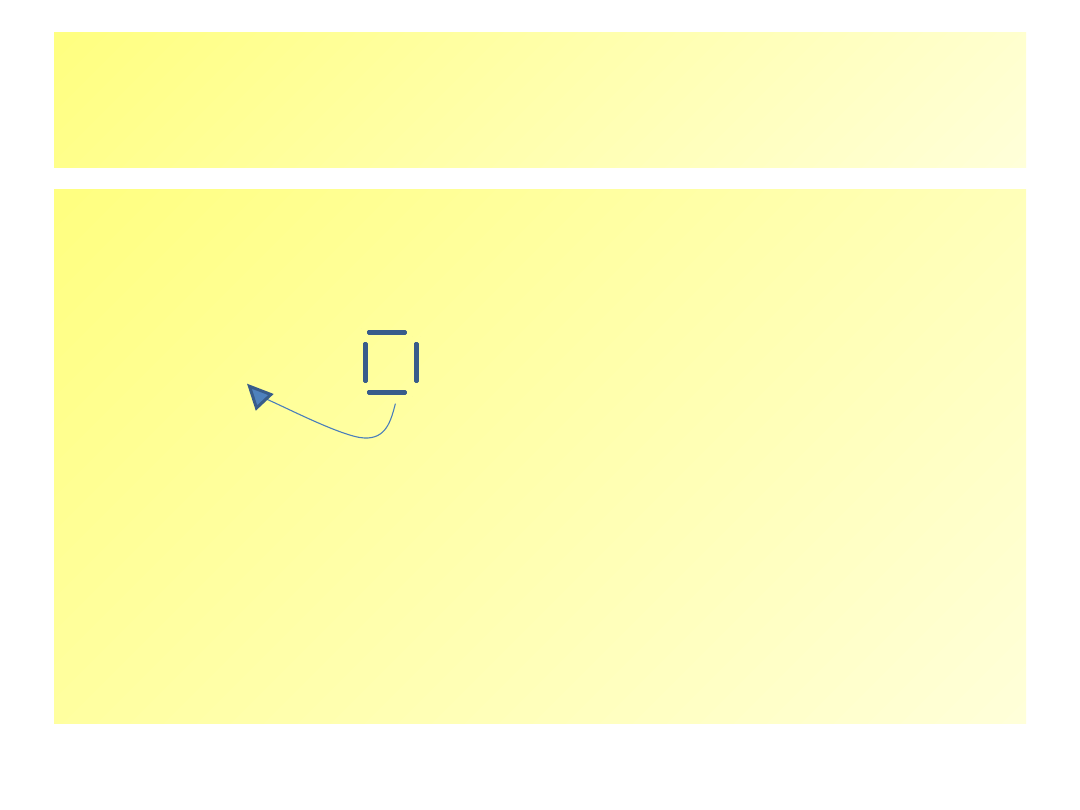
Powstanie produktu
finalnego
• Atak anionu bromkowego
na
karbokation
H H H H
| | | |
• H
–
C
–
+
C
–
H
+
Br
-
H
–
C
–
C
–
H
| | |
Br
Br
Br
W przypadku
addycji halogenowodoru
reakcja przebiega wg
tego
samego mechanizmu
z tym, że
proces ten zachodzi łatwiej,
ponieważ
w cząsteczkach HX wiązanie jest już spolaryzowane
a więc heteroliza ich cząsteczek zachodzi znacznie szybciej.
Addycja wody
wymaga obecności kationu H
+
,
który w I etapie z
alkenem tworzy karbokation.
Oprócz alkoholu
w ostatniej fazie
jest uwalniany
kation wodorowy
w wyniku odszczepienia go od
cząsteczki H
2
O
Document Outline
Wyszukiwarka
Podobne podstrony:
11 mechanizm reakcji alergicznychid 12496 ppt
WYKLAD3.DOC, Mechanizm reakcji nitrowania. Nitrowanie jako elektrofilowa substytucja w pierścieniu a
ElektroterapiaDarek ppt
Arkusz WSiP Reakcje redoks Elektrochemia
ALTERNATYWNE ELEKTROCHEMICZNE ppt
2 Ch organiczna podzial reakcje IIid 20221 ppt
39 Wzmacniacze elektrohydrauliczne zawory proporcjonalne i serwomechanizmy elektrohydrauliczne ppt
chorg w 10 addycje elektrofilowe
Rozwój oraz zastosowanie bankowości elektronicznej ppt
Typy i mechanizmy reakcji związków organicznych
ZALICZENIE LABORKI MASZYNY ELEKTRYCZNE, Energetyka Politechnika Krakowska Wydział Mechaniczny I stop
34. Mechanizm przepływu prądu elektrycznego, Fizyka - Lekcje
szybkość i mechanizm reakcji 6.1L(1), Technologia chemiczna, Chemia fizyczna, laboratorium
kolokwium-reakcja addycji, chemia organiczna
Zagadnienia na egzamin z Elektrotechniki, Energetyka Politechnika Krakowska Wydział Mechaniczny I st
2 reakcje zwiazkow organicznych ppt
więcej podobnych podstron