
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.


Ważne pojęcia
S
topień
utlenienia
Stopień utlenienia pierwiastka w dowolnym
połączeniu chemicznym jest pojęciem umownym i
określa ładunek, który istniałby na atomie tego
pierwiastka, gdyby elektrony w każdym wiązaniu
utworzonym przez dany atom należały do atomu
bardziej elektroujemnego.
U
tleniacz
Utleniaczami są atomy, jony lub cząsteczki
posiadające zdolność przyjmowania elektronów tzn.
odbierania ich od innych atomów lub grup atomów,
powodując w ten sposób ich utlenienie.
Utleniacze utleniając inne substancje, same ulegaja
redukcji
R
eduktor
Reduktorami są atomy, jony lub cząsteczki
posiadające zdolność oddawania elektronów innym
atomom, jonom lub cząsteczkom, powodując
redukcję tych substancji.
Reduktory w procesie redukcji same ulegają
utlenieniu.
U
tlenianie
(dezelektronacj
a)
Utlenianie to reakcja chemiczna, w której jakiś atom
(lub ich grupa) przechodzi z niższego na wyższy
stopień utlenienia (oddaje elektrony).

R
edukcja
( elektronacja)
Proces, w trakcie którego atom lub ich grupa
przechodzi z wyższego na niższy stopień utlenienia.
R
eakcja
utleniania-redukcji
( procesy
redoksowe, reakcja
redoks)
Reakcją utlenienia-redukcji nazywamy proces, w
którym następuje wymiana elektronów między
substancją utleniającą a substancją redukującą, na
skutek czego atomy pierwiastków biorących udział
w reakcji zmieniają swój stopień utlenienia.
P
rawo zachowania
ładunku
W układzie reagującym ilość elektronów pobranych i
oddanych jest taka sama. Oznacza to, że procesowi
utleniania zawsze towarzyszy proces redukcji.
R
eakcje
dysproporcjonowan
ia (dysmutacji,
autoredoksydacji,
samoutlenienia -
samoredukcji )
Pewien typ reakcji redoks, w którym utlenieniu i
redukcji ulegają jednocześnie różne atomy tego
samego pierwiastka, ten sam związek pełni role i
utleniacza i reduktora.
R
eakcje
synproporcjonowan
ia
W reakcji synproporcjonowania produktem procesu
utleniania i procesu redukcji jest ta sama
substancja.

Stopień utlenienia
Stopień utlenienia pierwiastka w związku chemicznym podaje się za
pomocą cyfry rzymskiej zapisanej nad symbolem pierwiastka (ujemny
stopień utlenienia poprzedza się znakiem minus).
Zasady określania stopnia utlenienia:
1.
Stopień utlenienia pierwiastków w stanie wolnym wynosi zawsze
zero, niezależnie od liczby wiązań, jakie tworzą między sobą atomy.
2.
Suma stopni utlenienia w cząsteczce obojętnej równa jest zero, a w
jonie złożonym równa jest ładunkowi tego jonu.
3.
Stopień utlenienia pierwiastka w prostym jednoatomowym jonie
równy jest ładunkowi tego jonu.
4.
Tlen w związkach z reguły ma stopień utlenienia -II, z wyjątkiem
związków, w których występuje wiązanie między dwoma atomami
tlenu oraz z wyjątkiem związków z fluorem.
5.
Wodór w związkach z reguły ma stopień utlenienia I, z wyjątkiem
wodorków metali i innych prostych związków z pierwiastkami mniej od
niego elektroujemnymi, w których ma stopień utlenienia -I.
6.
Litowce w związkach mają zawsze stopień utlenienia I, a berylowce
stopień utlenienia II.
7.
Fluor w związkach ma zawsze stopień utlenienia -I.
8.
Chlor w związkach z reguły ma stopień utlenienia -I, z wyjątkiem
związków z fluorem i z tlenem.
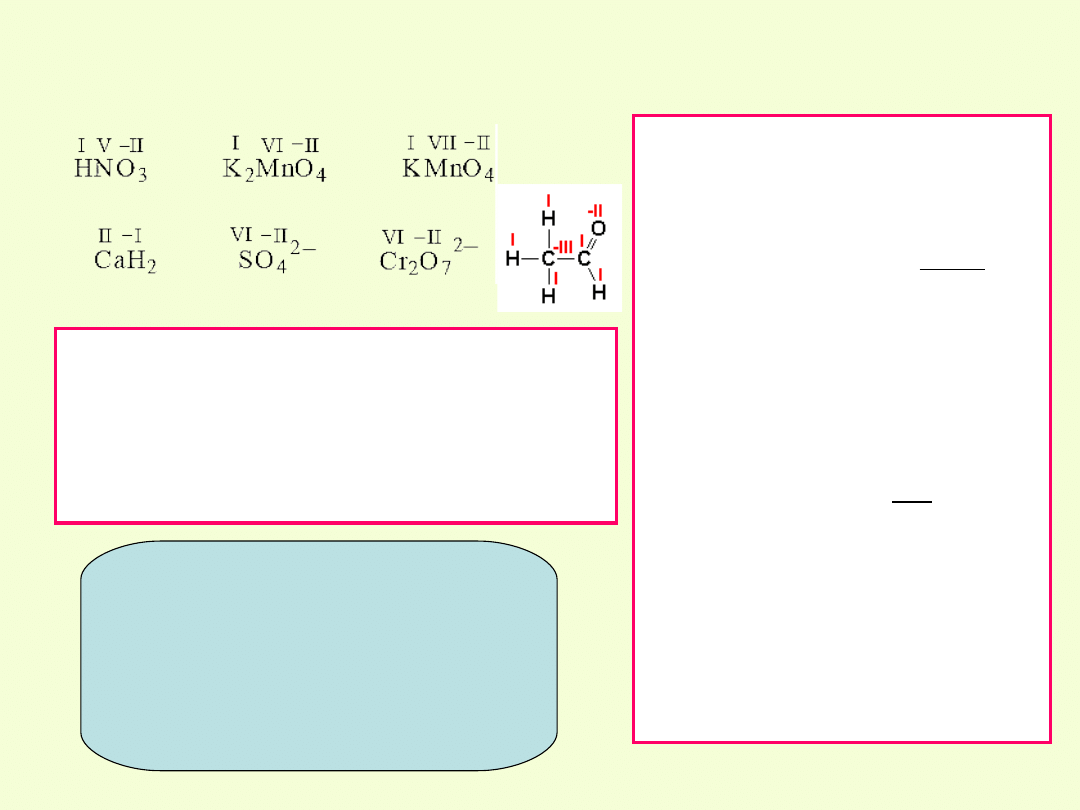
Przykłady określania stopnia utlenienia pierwiastka
w cząsteczce i jonie.
NH
3
wodór: stopień utlenienia I
ładunek cząsteczki 0
azot: x+3·(+1)= 0, x=-3
azot: stopień utlenienia -III
HClO
4
tlen: stopień utlenienia -2
wodór: stopień utlenienia +1
ładunek cząsteczki 0
x+4·(-2)+1=0, x=+7
chlor: stopień utlenienia VII
Cr
2
O
7
2-
tlen: stopień utlenienia -2
ładunek cząsteczki -2
2x+7·(-2)= -2, x=+6
chrom: stopień utlenienia VI
Na
2
S
2
O
3
sód: stopień utlenienia +1
tlen: stopień utlenienia -2
2x+2·(+1)+3·(-2)=0
siarka: stopień utlenienia II
Należy pamiętać, że stopnie
utlenienia są wielkościami
umownymi i zależą od
sposobu jak i reguł według
których się je oblicza. Służą
one jedynie do ″księgowania″
elektronów.

Metale
Chętniej oddają elektrony, dlatego najczęściej tworzą kationy i
występują w związkach na dodatnim stopniu utlenienia.
Niemetale
Chętnie przyjmują elektrony tworząc aniony i wystepują na ujemnym
stopniu utlenienia.
Półmetale
Zachowują się najczęściej jak metale i dlatego występują na dodatnim
stopniu utlenienia.
Gazy szlachetne
Mają idealną liczbę elektronów, dlatego bardzo rzadko tworzą związki,
a inne pierwiastki poprzez pobranie lub oddanie dążą do uzyskania
konfiguracji elektronowej odpowiedniego gazu szlachetnego.
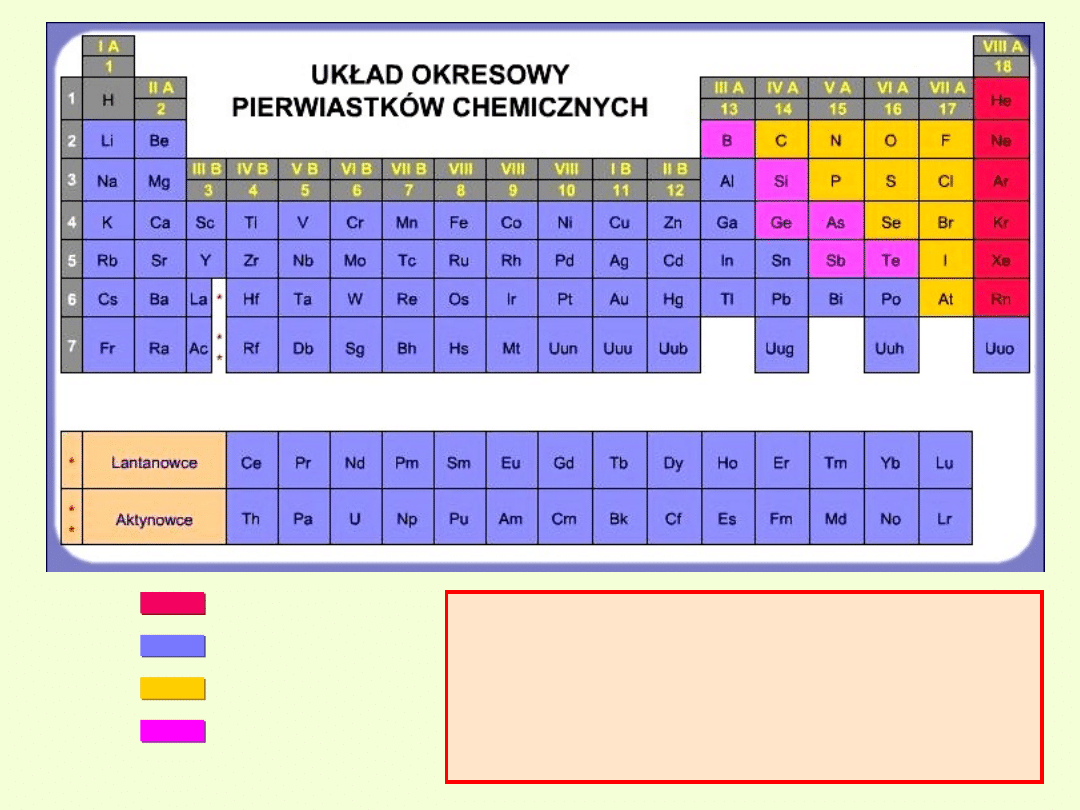
Gazy szlachetne
Metale
Niemetale
Półmetale
Żaden pierwiastek nie może uzyskać
wyższego stopnia utlenienia niż
tradycyjny numer grupy
( IA, IIA itp..) do której należy.
Wyjątek stanowią Cu, Au.
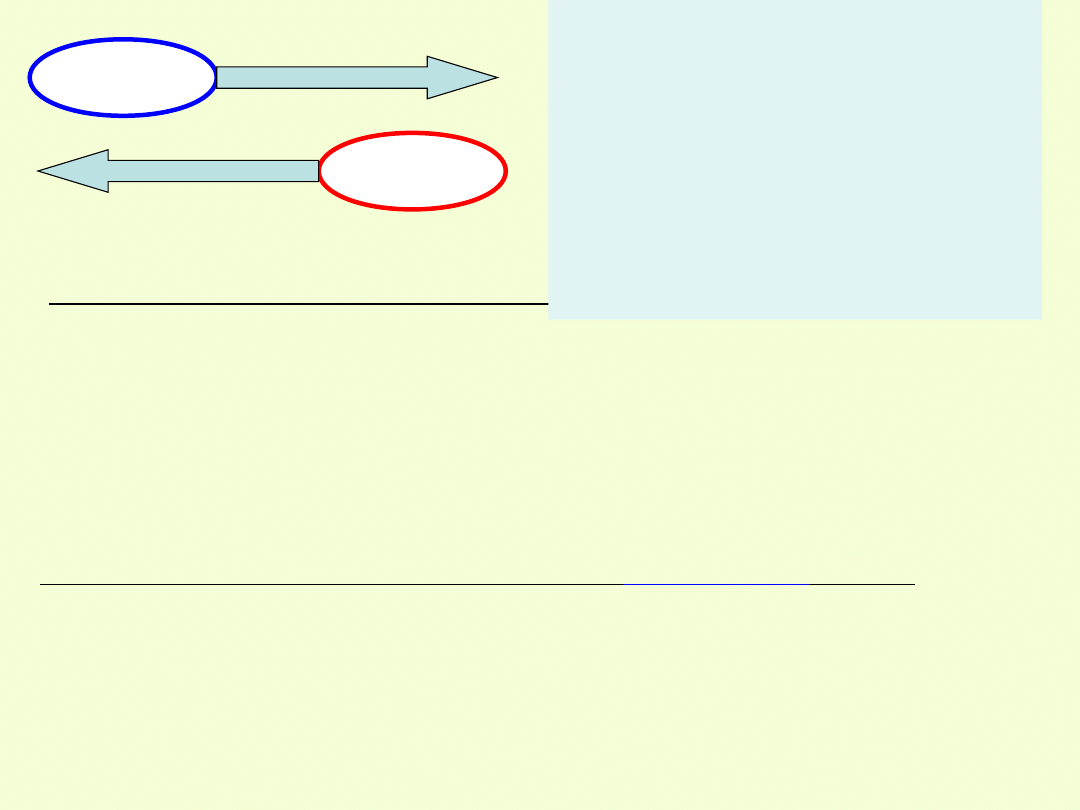
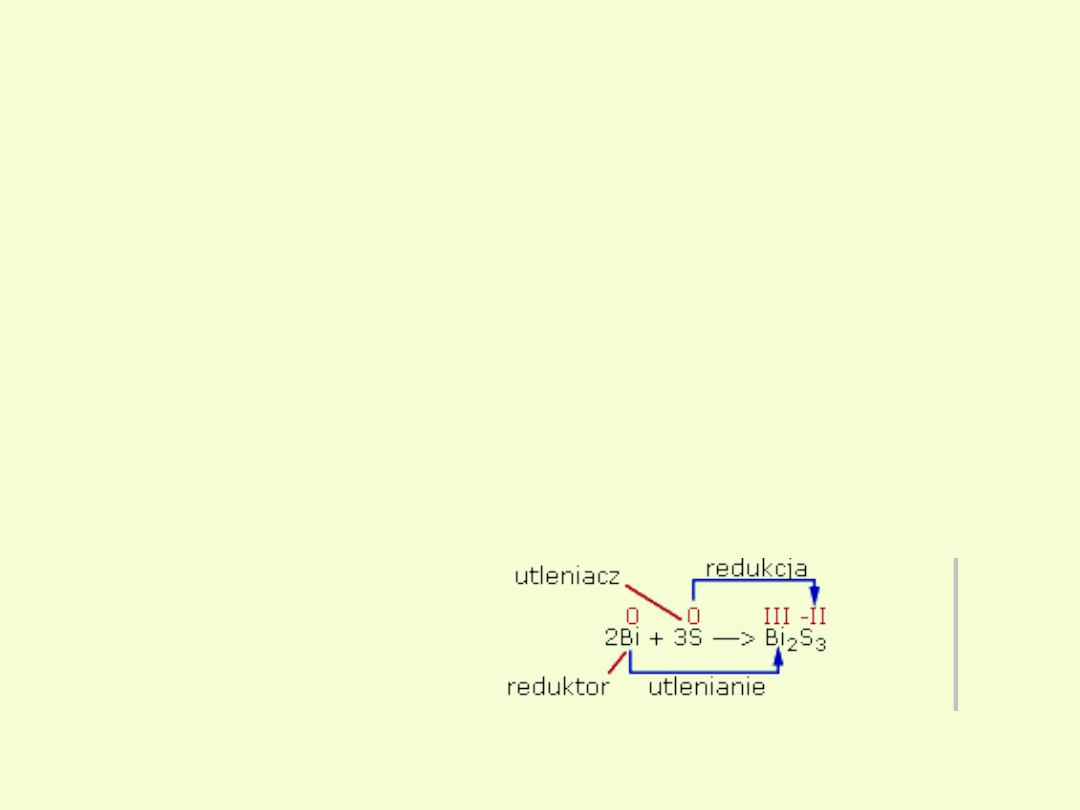
UTLENIACZ
redukcja
REDUKTOR
utlenienie
Do substancji ulegających redukcji, czyli
utleniaczy
należą:
Pierwiastki najbardziej elektroujemne (niemetale) a więc: fluor F
2
, chlor
Cl
2
, brom Br
2
oraz tlen O
2
,
Jony metali na wyższym stopniu utlenienia.
Związki chemiczne ( jak również ich jony ) w których występują pewne
pierwiastki na najwyższych stopniach utlenienia np. nadmanganian
potasowy KMnO
4
( Mn
VII
), dwuchromian potasowy K
2
Cr
2
O
7
( Cr
VI
), nadtlenek
wodoru H
2
O
2
( O
-I
), azotan potasowy KNO
3
( N
V
) kwas azotowy HNO
3
( N
V
)
oraz wiele innych.
Podczas reakcji elektrony
przechodzą od
reduktora
do
utleniacza
.
Proces utlenienia przebiega
zawsze równolegle z procesem
redukcji i odwrotnie, redukcji
towarzyszy utlenienie. Utleniacze,
utleniając inne substancje, same
ulegają redukcji.
Do substancji ulegających utlenieniu, czyli
reduktorów
należą:
Przede wszystkim pierwiastki najbardziej elektrododatnie (metale)
Jony metali i niemetali na niższym stopniu utlenienia.
Niemetale ( np. C, N, S, H )
Związki chemiczne, które posiadają atomy metali lub niemetali na
niższym stopniu utlenienia, np. chlorek cynowy SnCl
2
, chlorek żelaza
FeCl
2
, kwas siarkowy (IV) H
2
SO
3
, azotan (III) sodu NaNO
2
, tlenek węgla CO
itp.
Przykłady
reduktor
utleniacz
utlenianie- 2Ca
0
--> 2Ca
II
+ 4e
redukcja- O
0
2
+ 4e --> 2O
-II
3CuCl
2
+ 2Al --> 2AlCl
3
+
3Cu
2Ca + O
2
--> 2CaO
reduktor
utleniac
z
3Cu
+II
+ 6e --> 3Cu
0
| redukcja,
2Al
0
- 6e --> 2Al
+III
|
utlenienie,
Cu + 2H
2
SO
4
→ CuSO
4
+ SO
2
+
2H
2
O
redukto
r
utleniacz
Cu
0
– 2e --> Cu
+II
S
VI
O
4
2-
+ 2e --> S
IV
O
2

Wyznaczanie współczynników w równaniach reakcji
redoks
Metoda równań połówkowych (ion-electron method) korzysta z faktu, że
w wyniku reakcji chemicznej nie powstaje makroskopowy ładunek
elektryczny, co oznacza, że elektrony nie będą występować w bilansie
materiałowym reakcji.
Atom zwiększa swój stopień utlenienia oddając elektrony. W myśl prawa
zachowania masy i ładunku, w reakcji chemicznej ani atomy, ani
elektrony nie mogą zaginąć, więc inny atom musi te elektrony przyjąć
(ulega on redukcji).
Równanie reakcji chemicznej można rozbić na dwie części, tzw.
równania reakcji połówkowych.
W jednym równaniu reakcji zachodzi proces utlenienia, a w drugim
redukcji. Dla każdego z równań reakcji połówkowych współczynniki
równania dobiera się oddzielnie.
Liczba elektronów pobranych przez utleniacz musi być równa liczbie
elektronów oddanych przez reduktor. Taką wspólną liczbą elektronów dla
reduktora i utleniacza jest Najmniejsza Wspólna Wielokrotność - NWW.
B
reduktor
A
utleniacz
B
utleniacz
reduktorA
B
reduktor
e
n
B
utleniacz
e
n
z A
utleniac
reduktor A
Zapis reakcji połówkowych:
reduktor A – n
A
ē → utleniacz A
utleniacz B
+
n
B
ē
→
reduktor B
Bilansowanie reakcji redoks:
reduktor A – n
A
ē → utleniacz A
/×
n
B
utleniacz B + n
B
ē → reduktor B
/×
n
A
Zapis reakcji redoks powstaje na skutek dodania reakcji
cząstkowych stronami:
n
B
reduktor A
–
n
B
n
A
ē
+
n
A
utleniacz B
+
n
A
n
B
ē
→
n
A
reduktor B
+
n
B
utleniacz A

obliczamy stopnie utlenienia atomów po lewej i prawej stronie
równania reakcji (dla substratów i produktów)
Znajdujemy atomy, które zmieniły swój stopień utlenienia. Określamy
atom który uległ redukcji (utleniacz) i atom który uległ utlenieniu
( reduktor)
Zapisujemy połówkowe równania reakcji
- z udziałem atomu, który uległ redukcji
- z udziałem atomu, który uległ utlenieniu (kolejność dowolna)
W równaniu połówkowym jony z atomami, które zmieniły swój stopień
utlenienia powinny być zapisane w takiej postaci w jakiej występują w
równaniu reakcji.
Dodać w razie potrzeby H
2
O czy jony H
+
, OH
-
w celu zbilansowania
równania reakcji. Sprawdzamy czy każde z równań reakcji połówkowych
z osobna spełnia prawo zachowania masy i ładunku
Obliczamy NWW
(wspólną liczbą elektronów dla reduktora i utleniacza)
i mnożymy przez wyznaczone mnożniki.
Dodajemy stronami równania połówkowe, oraz zsumowujemy
wyrażenia podobne. Jeżeli po tej samej stronie równania reakcji wystąpią
jony wodorotlenowe i wodorowe, to łączymy je w cząsteczki wody.
W końcowym równaniu sprawdzamy bilans masy i ładunków.
Algorytm postępowania:
Przykłady
1.Reakcja bizmutu z siarką:
2. Substraty Bi
0
; S
0
Produkt Bi
III
2
S
-II
3
Bi
0
- 3e --> Bi
III
-
utlenianie
|×2
S
0
+ 2e --> S
-II
–
redukcja
|×3
3. 2Bi
0
-6e → 2Bi
III
3S
0
+ 6e → 3S
-II
4. 2Bi
0
+ 3S
0
- 6e +6e --> Bi
2
III
S
3
-II
Rozpatrywaną reakcję można zapisać jako:

środowisko obojętne:
dysponujemy tylko cząsteczkami wody, które
możemy dodać po stronie substratów. Z każdej cząsteczki wody
możemy wziąć jeden brakujący jon wodorowy (powstanie z niej jon
wodorotlenowy), lub przyłączyć do niej jeden atom tlenu (powstaną
dwa jony wodorotlenowe). Jeżeli w jednym równaniu połówkowym
powstają jony wodorowe lub wodorotlenowe, możemy ich użyć w
następnym równaniu połówkowym
środowisko kwaśne:
dysponujemy dowolną ilością cząsteczek wody i
jonów wodorowych. Brakującą ilość atomów tlenu uzupełniamy
dodając odpowiednią ilość cząsteczek wody. Brakującą ilość atomów
wodoru uzupełniamy jonami wodorowymi H
+
środowisko alkaliczne:
dysponujemy jonami wodorotlenowymi i
cząsteczkami wody, które możemy dodawać po stronie substratów w
takiej ilości by zbilansować równanie połówkowe pod względem prawa
zachowania masy. Brakującą ilość atomów tlenu uzupełniamy dodając
jony wodorotlenowe OH
-
w ilości dwukrotnie większej. Brakującą ilość
atomów wodoru uzupełniamy odpowiednią ilością cząsteczek wody.
Reakcja w środowisku obojętnym.
Jeśli środowisko reakcji jest obojętne, do substratów możemy dodawać
tylko wodę.
2KOH
SO
3K
2MnO
O
H
SO
3K
2KMnO
2KOH
SO
3K
2MnO
O
H
SO
3K
2KMnO
2OH
3SO
2MnO
O
H
3SO
2MnO
6H
3SO
8OH
2MnO
O
3H
6e
3SO
O
4H
6e
2MnO
6H
3SO
O
3H
6e
3SO
8OH
2MnO
O
4H
6e
2MnO
2H
SO
O
H
2e
SO
4OH
MnO
O
2H
3e
MnO
KOH
SO
K
MnO
O
H
SO
K
KMnO
4
2
w
6elektronó
redukcja
2
2
3
2
4
4
2
2
2
3
2
4
2
4
2
2
2
3
4
2
4
2
2
2
3
2
4
2
4
2
2
3
2
2
4
2
4
2
2
3
2
2
4
4
2
2
2
3
2
4
Utlenienie -6 elektronów

Reakcja w środowisku kwaśnym
Brakującą ilość atomów tlenu uzupełniamy dodając odpowiednią ilość
cząsteczek wody. Brakującą ilość atomów wodoru uzupełniamy jonami
wodorowymi H
+
O
3H
SO
6K
2MnSO
SO
3H
SO
5K
2KMnO
O
3H
SO
6K
2MnSO
SO
3H
SO
5K
2KMnO
O
3H
5SO
2Mn
6H
5SO
2MnO
10H
5SO
O
8H
2Mn
O
5H
10e
5SO
16H
10e
2MnO
10H
5SO
O
5H
10e
5SO
O
8H
2Mn
16H
10e
2MnO
5
2H
SO
O
H
2e
SO
2
O
4H
Mn
8H
5e
MnO
O
H
SO
K
MnSO
SO
H
SO
K
KMnO
2
4
2
4
4
2
3
2
4
2
4
2
4
4
2
3
2
4
2
2
4
2
2
3
4
2
4
2
2
2
2
3
4
2
4
2
2
3
2
2
4
2
4
2
2
3
2
2
4
2
4
2
4
4
2
3
2
4
elektronów
10
redukcja
Utlenianie – 10e
Reakcja w środowisku zasadowym
Brakującą ilość atomów tlenu uzupełniamy dodając jony wodorotlenowe
OH- w ilości dwukrotnie większej. Brakującą ilość atomów wodoru
uzupełniamy odpowiednią ilością cząsteczek wody.
O
H
SO
K
MnO
K
2KOH
SO
K
KMnO
2
O
H
SO
2MnO
2OH
2e
SO
2e
2MnO
O
H
SO
2OH
2e
SO
2MnO
2e
2MnO
O
H
SO
2OH
2e
SO
MnO
e
MnO
O
H
SO
K
MnO
K
KOH
SO
K
KMnO
2
4
2
2e
redukcja
4
2
3
2
4
2
2
4
2
4
2
3
4
2
2
4
2
3
2
4
4
2
2
4
2
3
2
4
4
2
4
2
4
2
3
2
4
Utlenienie – 2e

Mały Pomocnik:
http://www.webqc.org/balance.php
Podsumowanie
Stopień utlenienia to umowny ładunek atomów obliczany przy
założeniu, że cząsteczka składa się z samych jonów.
Stopień utlenienia zaznaczamy liczbą rzymską nad symbolem, a
przy stopniu ujemnym poprzedzamy ją znakiem „-”.
Algebraiczna suma stopni utlenienia w cząsteczce zawsze równa
jest „0”.
W związku ze stopniem utlenienia reakcje chemiczne można
podzielić na dwa rodzaje:
-reakcje zachodzące bez zmiany stopnia utlenienia atomów,
- reakcje zachodzące ze zmianą stopnia utlenienia atomów.
W reakcjach redoks liczba oddanych i pobranych elektronów musi
być taka sama.
Utleniacz pobiera elektrony sam się redukując, a reduktor oddaje
elektrony ulegając utlenieniu.
Atomy na najwyższym stopniu utlenienia mogą być tylko
utleniaczami a na najniższym tylko reduktorami.

Literatura
„ Repetytorium chemia od A do Z” M. Klimaszewska
„Układ okresowy, stopnie utlenienia, tworzenie jonów.” N. Kuźnik
Politechnika Śląska Wydział Chemiczny
„Chemia 3”– podręcznik ( zakres rozszerzony) S. Hejwowska, R.
Marcinkowski,J. Staluszka
http://www.chemorganiczna.com/
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
W15 reakcje utlenienia redukcji
5 Reakcje utleniania i redukcji Reakcje w roztworach
CHEM OG, cw 4, REAKCJE UTLENIANIA I REDUKCJI
06 Sprawozdanie z reakcji utleniania i redukcji Naprawiony
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
3.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
3.Reakcje utleniania i redukcji, Zad
Reakcje utleniania i redukcji
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
Wyklad 4. Reakcje utleniajaco-redukcyjne, pwr biotechnologia(I stopień), I semestr, Chemia ogó
1 7 Reakcje utleniania i redukcj +Odpowiedzi
2.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
Ćw. 10 i 11 - reakcje utleniania i redukcji - sprawko, Chemia ogólna i nieorganiczna
Reakcje utleniania i redukcji
Walkowiak, Chemia ogólna, Reakcje utleniająco redukcyjne
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
W15S-Reakcje utlenienia-redukcji, chemia, szkolka
więcej podobnych podstron