Metody analizy ilościowej
Metody klasyczne,
Metody
instrumentalne,
stechiometryczne
niestechiometryczne
1.Analiza wagowa
2. Analiza objętościowa
• alkacymetria
• redoksymetria
• kompleksometria
• precypitometria
1. Metody spektroskopowe
(emisyjna, absorpcyjna, mas)
2. Metody chromatograficzne
3. Metody elektrochemiczne
(polarografia, potencjometria
)
)
4. Inne
1.
1.
Analiza wagowa
Analiza wagowa
Ilościowe oznaczenie realizuje się
poprzez:
3. wydzielenie oznaczanego pierwiastka w wyniku
reakcji elektrodowej (elektrograwimetria).
1. oddzielenie oznaczanego składnika od roztworu
próbki poprzez jego strącenie w postaci trudno
rozpuszczalnego osadu (wagowa analiza
strąceniowa),
2. wydzielenie oznaczanego składnika z
analizowanej próbki
w postaci gazu o znanym składzie
chemicznym, w wyniku
ogrzewania lub reakcji chemicznej
zachodzącej w
podwyższonej temp. (wagowa analiza
gazowa),

1.1. Wagowa analiza strąceniowa
Etapy:
g) obliczanie masy analizowanej substancji.
a) wytrącenie osadu,
b) koagulacja osadu (starzenie
osadu),
c) odsączenie,
d) przemycie w celu pozbycia się zanieczyszczeń,
e) suszenie (ew. prażenie) osadu,
f) ważenie osadu.

Przykłady oznaczeń:
a)Oznaczanie baru
*
lub siarczanów
**
w postaci siarczanu baru
* Ba
2+
+ H
2
SO
4
= BaSO
4
+ 2H
+
** SO
4
2-
+ BaCl
2
= BaSO
4
+ 2Cl
-
b) oznaczenie Fe w postaci Fe
2
O
3
Fe
3+
(aq) +3 NH
3
·H
2
O→Fe(OH)
3
+ 3NH
4
+
2Fe(OH)
3
→ Fe
2
O
3
+ 2H
2
O
Ba
Ba
Ba
BaSO
BaSO
BaSO
Ba
M
n
m
M
m
n
n
4
4
4

Przykłady oznaczeń:
c) Oznaczanie wapnia w postaci tlenku wapnia
H
2
C
2
O
4
+ 2 NH
3
·H
2
O = C
2
O
4
2-
+ 2NH
4
+
+ 2H
2
O
Ca
2+
(aq)
+ C
2
O
4
2-
(aq) = CaC
2
O
4
CaC
2
O
4
CaO + CO
2
(g)_+ CO(g)
Ca
Ca
Ca
CaO
CaO
CaO
Ca
M
n
m
M
m
n
n

Wymagania stawiane osadom:
1. trudno rozpuszczalny, R10
-5
mol/dm
3
(zależne od analityka),
2. łatwy do sączenia i odmycia od zanieczyszczeń (zależne od
analityka)
3. duża masa cząsteczkowa związku a mała masa atomowa
oznaczanego pierwiastka (niezależne od analityka),
4. o znanym, ściśle określonym składzie chemicznym po
wysuszeniu/prażeniu (niezależne od analityka).

R R 3R
Ad 1)
przykład
Fe(OH)
3
= Fe
3+
+ 3OH
pIr=38,6 Ir = [Fe
3+
][OH
]
3
= R·(3R)
3
= 27R
4
stąd
R=9,8 · 10
-11
mol/dm
3
Wartość
R
można zmienić wykorzystując:
a) efekt wspólnego jonu (nadmiar odczynnika strącającego)
b) efekt matrycowy (siła jonowa roztworu; efekt solny)
c) pH roztworu

Czynniki wpływające na strukturę osadu:
-
szybkość tworzenia się zarodków krystalicznych
w = k (Q-R) / R
- szybkość wzrostu kryształów
V = k
’
(Q – R)
R – rozpuszczalność osadu
Q – „przesycenie” – stężenie roztworu bezpośrednio nad
osadem
BaSO
4
, MgNH
4
PO
4
Fe(OH)
3
,
AgCl
Cząstki o średnicy >10
-3
cm
Cząstki o
średnicy 10
-7
– 10
-4
cm
Łatwiejsze do sączenia i oczyszczenia Konieczna
koagulacja osadu
Osady krystaliczne
Osady koloidowe
Ad 2.
Postać
osadu

Optymalne warunki strącania:
1. Strącać z roztworów rozcieńczonych stosując rozcieńczony
odczynnik strącający (małe przesycenie)
2. Odczynnik strącający dodawać powoli i stopniowo
(małe przesycenie)
3. Mieszać roztwór (zapobiega przesyceniu)
4. Odczynnik strącający dodać w nadmiarze (nie przesadnym)
5. Strącać na gorąco gorącym roztworem (większa
rozpuszczalność osadu)
Wymogi (2) – (4) spełnia strącanie z roztworów
homogenicznych,
kiedy odczynnik strącający jest stopniowo
wytwarzany,
równocześnie w całym roztworze, w wyniku
powolnej reakcji
chemicznej.
Rezultat: powolny wzrost kryształów, duże
rozmiary bo mało
zarodków.

Strącanie z roztworów homogenicznych -
odczynniki
CH
3
CSNH
2
+ H
2
O = CH
3
COO
+
NH
4
+
+
H
H
2
2
S
S
tioacetamid (AKT)
strącanie siarczków
Sb, Mo, Cu, Cd
(CH
3
)
2
C
2
O
4
+ 2 H
2
O = 2CH
3
OH + 2H
+
+
C
C
2
2
O
O
4
4
2-
2-
szczawian dimetylowy
strącanie szczawianów
Mg, Zn, Ca
CO(NH
2
)
2
+ 3H
2
O = CO
2
+ 2NH
4
+
+
2OH
2OH
mocznik
strącanie wodorotlenków
Al,
Ga, Bi, Fe, Sn
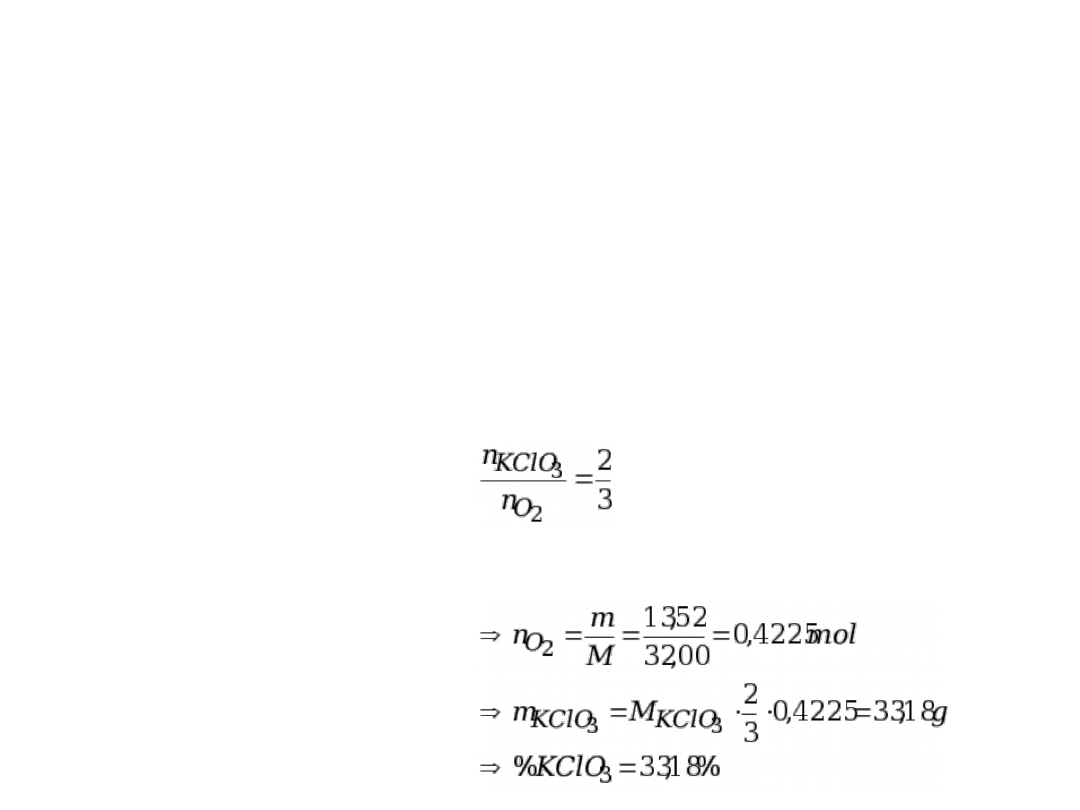
1.2. Wagowa analiza gazowa
Przykład 1:
oznaczanie SiO
oznaczanie SiO
2
2
SiO
2
+ 4HF → SiF
4
↑ + 2H
2
O
ubytek masy =
ubytek masy =
masa SiO
masa SiO
2
2
Przykład 2:
Mieszaninę chloranu (V) potasu i chlorku sodu
prażono do stałej masy. Ubytek masy stanowił 13,52% masy
początkowej. Jaki był procentowy skład mieszaniny?
2KClO
3
+ NaCl →2KCl + NaCl + 3O
2
ubytek masy = ?
ubytek masy = ?
to masa O
to masa O
2
2
Zależność stechiometryczna:
Rozwiązanie:
Niech m
M
=100,00 g → Δm=13,52 g = masa O
2

Przykład 3.
oznaczanie wilgotności
higroskopijnej.
m
(próbki mokrej)
– masa
(probki suchej)
=
masa H
2
O
Analiza wagowa - ocena
1. Dokładność do 0,01%
2. Dobra precyzja
3. Metoda bezwzględna (nie wymaga kalibrowania
ani stosowania wzorców)
4. Niskie koszty
5. Dobra selektywność a nawet specyficzność
6. Przeznaczona do składników głównych i
pobocznych
7. Opracowana dla większości nieorganicznych
anionów i kationów
8. Stosowana także do oznaczania substancji
organicznych (laktoza, cholesterol, nikotyna)

Przykłady pytań sprawdzających:
1. Podać przykłady wagowej analizy
strąceniowej. Opisać je odpowiedniki
reakcjami.
2. Wymienić optymalne warunki strącania
osadów
wykorzystywanych do wagowej analizy
strąceniowej.
3. Wymienić warunki jakie muszą spełniać osady
wykorzystywane w analizie wagowej.
4. W jaki sposób można wpływać na
rozpuszczalność wodorotlenków ?
5. Na czym polega strącanie z roztworów
homogenicznych. Podać przykład.

2. Analiza objętościowa (miareczkowa)
2. Analiza objętościowa (miareczkowa)
_____________________________________
_____________________________________
Polega na oznaczeniu objętości roztworu
(titranta) o znanym stężeniu
odpowiedniego odczynnika, która jest
potrzebna do całkowitego
(
*
)
przereagowania analitu (oznaczanego
jonu, substancji) z tym odczynnikiem.
(*)
Stężenie substancji oznaczanej nigdy nie spada do zera, co
wynika z odwracalności reakcji chemicznych.

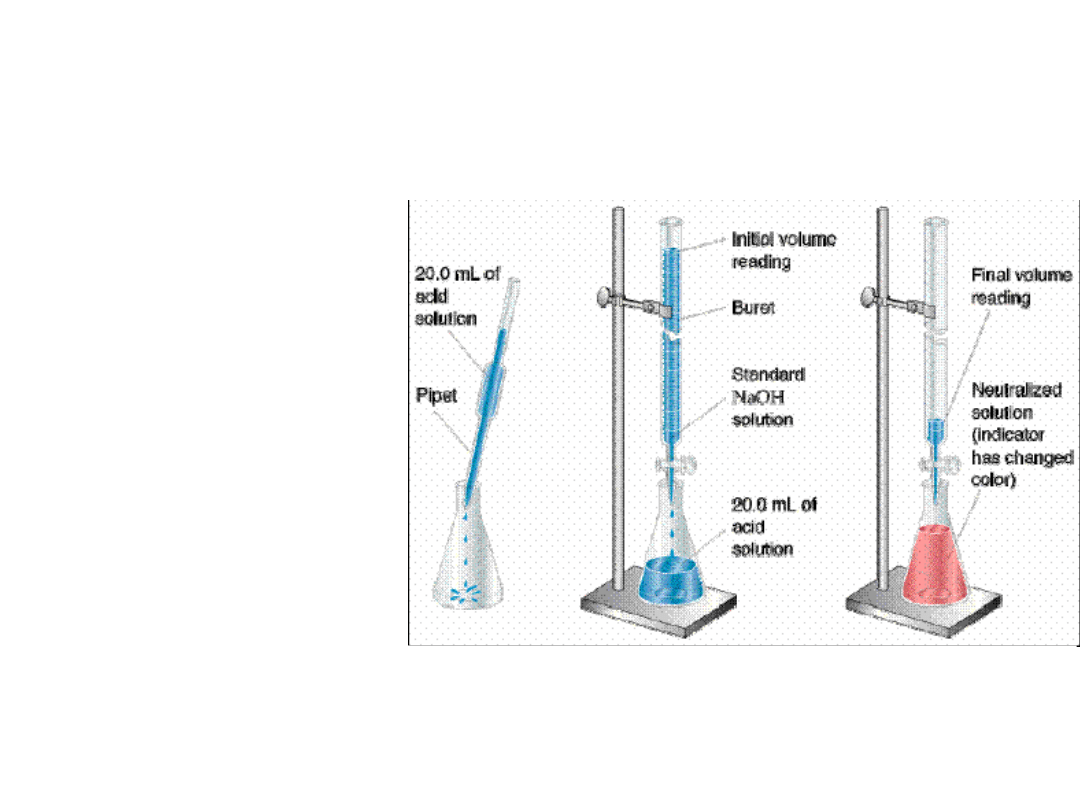
Przykład: Oznaczanie zawartości HCl metodą miareczkowania
Przykład: Oznaczanie zawartości HCl metodą miareczkowania
roztworem NaOH
roztworem NaOH
Rysunek z: www.odu/sci/xu/chem321.htm
Rysunek z: www.odu/sci/xu/chem321.htm
Podstawowe terminy:
1.Roztwór mianowany (titrant) -
roztwór o znanym
stężeniu używany do miareczkowania. Stężenie
titranta, czyli miano jest wyznaczane
(nastawiane) z dokładnością minimum 4 cyfr
znaczących.
2. Miareczkowanie – powolne dodawanie titranta z
biurety do kolby stożkowej (Erlenmeyera),
zawierającej dokładnie odmierzoną ilość analizy, do
momentu wskazującego na całkowite
przereagowanie analitu.
3. Wskaźnik – substancja, która wywołuje
obserwowalną fizycznie zmianę w pobliżu punktu
równoważności (np. zmiana barwy).
4. Punkt równoważności (PR) – odpowiada
momentowi końca reakcji, czyli sytuacji, gdy ilość
dodanego titranta jest dokładnie stechiometrycznie
równoważna ilości analitu (V
PR
).
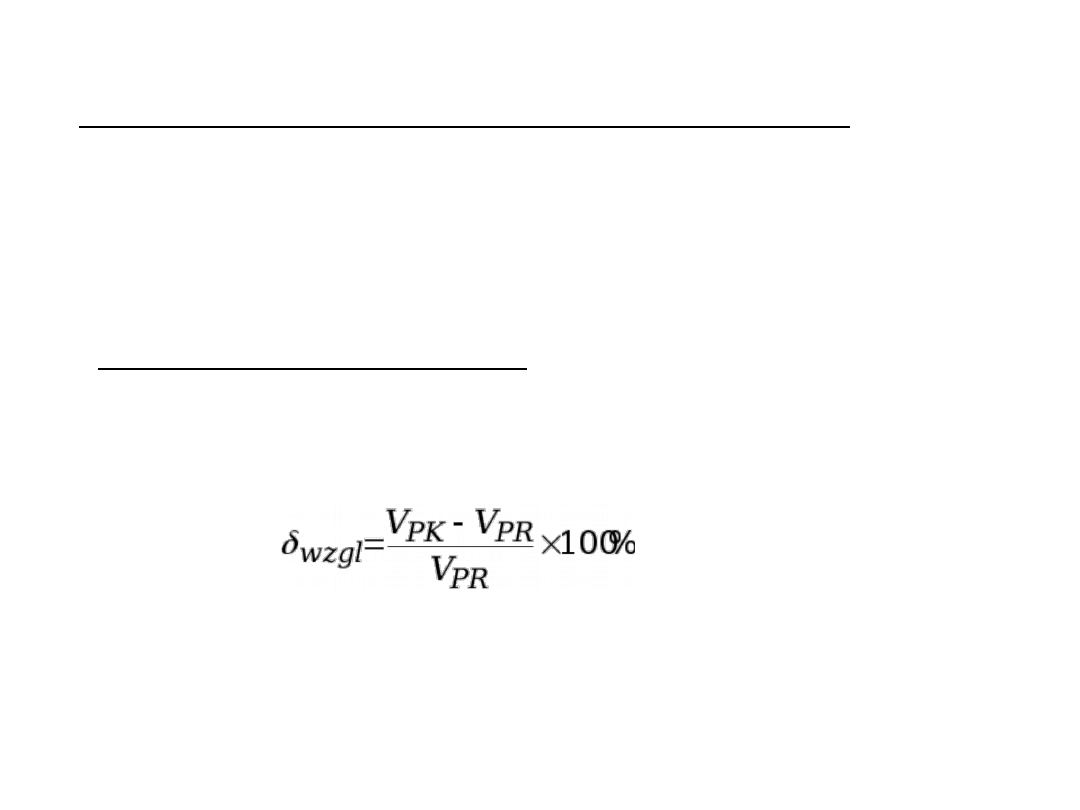
5. Punkt końcowy miareczkowania (PK) – prawie
nigdy obserwowany moment końca reakcji, czyli V
PK
miareczkowania nie pokrywa się z rzeczywistym
momentem końca reakcji (V
PR
), co wynika z trudności
w znalezieniu odpowiedniego wskaźnika.
6. Błąd miareczkowania – można wyrazić
różnicą V
PK
– V
PR
(błąd bezwzględny),
bądź

Cechy jakie powinny spełniać reakcje
wykorzystywane w analizie
miareczkowej
1.Ilościowy, stechiometrycznie jednoznaczny
przebieg;
2.Szybki przebieg;
3.Substraty i produkty powinny być trwałe w
środowisku roztworu;
4.Powinna być możliwa detekcja PK
miareczkowania, leżącego w wymaganej
bliskości PR miareczkowania.

Przyrządzanie roztworów mianowanych
Miano titranta
ustawia się bezpośrednio na
odważki substancji podstawowych (wzorzec
substancji podstawowych (wzorzec
pierwotny)
pierwotny)
lub pośrednio na inny roztwór
mianowany (wzorzec wtórny).
(wzorzec wtórny).
Cechy substancji podstawowej:
Cechy substancji podstawowej:
• wysoka czystość;
• nie powinna być higroskopijna;
• jej reakcja z roztworem mianowanym przebiega
ściśle stechiometrycznie;
• umiarkowanie droga;
• trwała w kontakcie z powietrzem;
• pożądane jest, aby miała możliwie dużą masę
molową (mniejszy procentowo błąd ważenia).

Przykłady wzorców pierwotnych:
wzorzec pierwotny (substancja podstawowa)
do
nastawienia miana HCl
a) węglan sodu (czysty !!)
Na
2
CO
3
+ 2HCl = Na
2
CO
3
+ CO
2
↑
+ H
2
O
b) boraks (uwodniony tetraboran sodu)
Na
2
B
4
O
7
+ 5H
2
O + 2HCl = 4H
3
BO
3
+ 2NaCl
• wzorzec pierwotny do nastawiania miana
NaOH
wodoroftalan potasowy
C
6
H
4
(COOH)COOK + NaOH = C
6
H
4
(COONa)COOK +
H
2
O
Wzorzec wtórny do nastawiania miana NaOH
kwas solny; H
+
+ OH
-
= H
2
O

Podział metod miareczkowych ze
względu na
typ reakcji zachodzącej podczas
miareczkowania
• Alkacymetria
• Kompleksometria
• Redoksymetria
• Metody wytrąceniowe
(precypitometria)
2.1. Alkacymetria
2.1. Alkacymetria
Titrant:
mocny kwas lub mocna zasada
HCl, H
2
SO
4
, HClO
4
NaOH, KOH, Ba(OH)
2
Typowe zastosowania:
• Oznaczanie kwasów (mocnych, słabych)
• Oznaczanie zasad (mocnych, słabych)
• Oznaczanie soli słabych kwasów i mocnych zasad
• Oznaczanie soli słabych zasad i mocnych kwasów
• Analiza elementarna (oznaczanie N, S, C, Cl, F, P) w
próbkach organicznych i materiale biologicznym, po
przekształceniu analitu w formę o własnościach
kwasowych lub zasadowych
Alka
limetria
A
cy
dymetria

Alkacymetria
Alkacymetria
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-----------------------------------------------------
-----------------------------------------------------
Podstawowe typy miareczkowania
alkacymetrycznego:
• Bezpośrednie - analit reaguje bezpośrednio z
odczynnikiem zawartym w titrancie
• Odwrotne - odmiareczkowanie nadmiaru
odczynnika za pomocą innego titranta (potrzeba
dwóch roztworów mianowanych)
Metody wyznaczania PK miareczkowania:
• Za pomocą wskaźników kwasowo-zasadowych (tzw.
pH)
• Metodami instrumentalnymi (potencjometrycznie,
konduktometrycznie)

Alkacymetria
Alkacymetria
-----------------------------------------------------------------
-----------------------------------------------------------------
---------
---------
Teoria wskaźników:
są to słabe kwasy lub zasady organiczne, których
forma
niezdysocjowana
ma barwę inną niż
forma
zdysocjowana
Wskaźnik typu kwasu:
HIn
+ H
2
O ↔
In
+ H
3
O
+
Wskaźnik o charakterze zasady:
In
+ H
2
O ↔
InH
+
+ OH
Aby zobaczyć kolor danej formy, jej stężenie musi być
Aby zobaczyć kolor danej formy, jej stężenie musi być
co najmniej
co najmniej
dziesięciokrotnie większe.
dziesięciokrotnie większe.
Np. gdy
[
HIn
]/[
In
]>10,
to widzimy barwę formy
HIn.
]
[
]
][
[
3
HIn
O
H
In
K
a
1
10
log
In)
(barwa
1
10
log
HIn)
(barwa
1
10
]
[
]
[
]
[
3
a
a
a
a
a
a
pK
pK
pH
pK
pK
pH
K
In
HIn
K
O
H
Zakres pH zmiany
barwy
wskaźnika= pK
a
±1
pK
b
±1

Alkacymetria
Alkacymetria
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
---------------------
---------------------
Ważniejsze wskaźniki kwasowo-zasadowe
Nazwa zwyczajowa Zakres zmiany pKa/pKb Zmiana
barwy
barwy
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Oranż metylowy
3,1 - 4,4
3,46
czerwona
– żółta
żółta
Czerwień metylowa 4,2 – 6,2
5,00
czerwona
–
żółta
żółta
Błękit bromotymolowy
6,2 – 7,6
7,10
żółta
żółta
–
niebieska
niebieska
Czerwień fenolowa 6,8 – 8,4
7,81
żółta
żółta
–
czerwona
czerwona
Fenoloftaleina
8,3 – 10,0
9,10
bezbarwna
bezbarwna
–
purpurowa
purpurowa
Tymoftaleina
9,3 – 10,5
9,30
bezbarwna
bezbarwna
– niebieska
niebieska
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-
Alkacymetria
Alkacymetria
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------
--------------------
Przykład 2.1-1.
Przykład 2.1-1.
Mamy roztwór NaOH o dokładnie
znanym stężeniu c
NaOH
i chcemy wyznaczyć stężenie roztworu HCl (c
HCl
=?)
Co robimy?
1. Odmierzamy
dokładnie
określoną objętość
roztworu HCl (V
HCl
)
2. Wyznaczamy
objętość V
PK
roztworu NaOH
wymaganą do zajścia
do końca reakcji
HCl + NaOH=NaCl
+H
2
O
czyli H
+
+ OH
= H
2
O
3. Obliczamy:
w PR
c
HCl
V
HCl
=
c
NaOH
V
PK
c
HCl
=c
NaOH
V
PK
/V
HCl
1
1
2
2
OH
H
n
n
(Dla H
2
SO
4
:
2·c
H2SO4
V
H2SO4
= c
NaOH
V
PK
)
Alkacymetria
Alkacymetria
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------
---------------------------------------------------------------
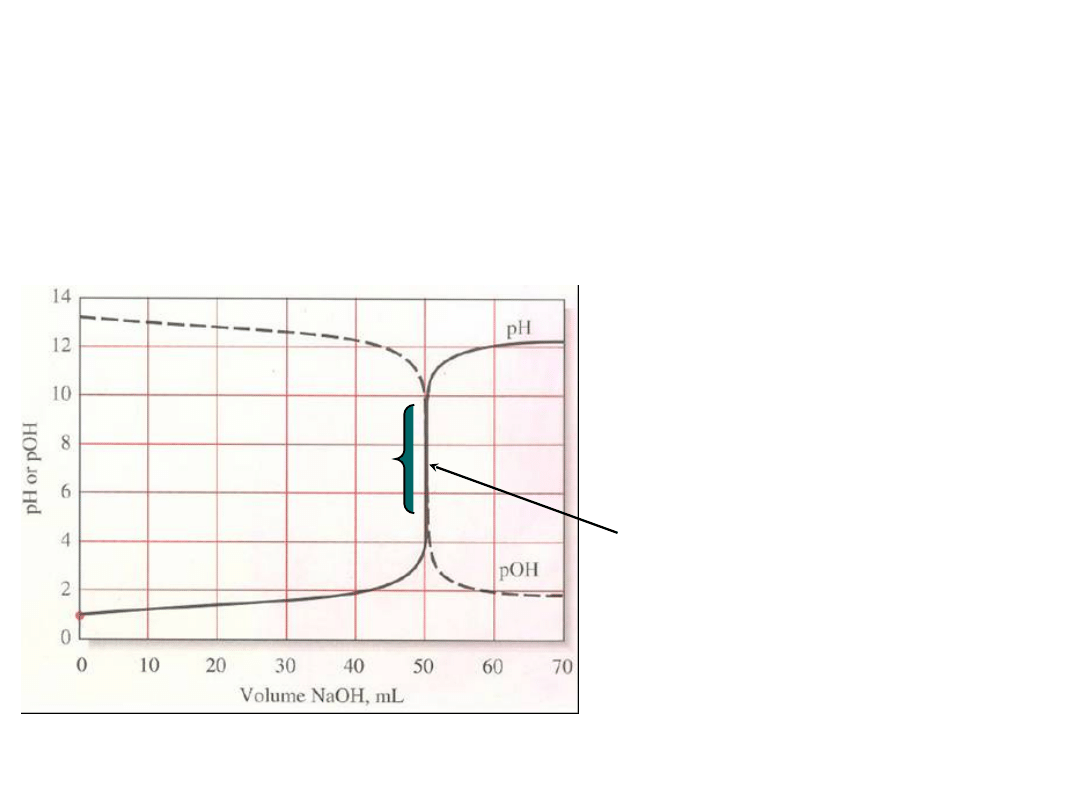
Krzywa miareczkowania alkacymetrycznego – krzywa
sigmoidalna
Na
osi Y
–
pH lub pOH
Na
osi X
- objętość dodanego titranta lub %
zmiareczkowania
Rys. z www.odu.edu/sci/xu/chem321.htm
W bezpośrednim
sąsiedztwie punktu
równoważności
zachodzą gwałtowne
zmiany wartości na osi
Y.
Punkt równoważności
(PR)
Skok
Skok
krzywej
krzywej
miarecz
miarecz
k.
k.

Alkacymetria
Alkacymetria
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
---------------
---------------
Obliczanie krzywej miareczkowania mocnej zasady ←
mocnym kwasem
A. Przed PR - z koncentracji nieprzereagowanego
reagenta, tutaj zasady
B. W PR – w roztworze sól mocnego kwasu i
mocnej zasady
i H
2
O
[H
+
] = [OH
]
[H
+
][OH
]=K
w
;
[H
+
]
2
=K
w
00
,
7
2
1
]
[
PR
w
w
pH
pK
pH
K
H
C. Za PR - z koncentracji
reagenta który
nieprzereagował, tutaj kwasu
PK
z
były
OH
dodana
H
V
V
n
n
H
]
[
PK
z
dodana
H
były
OH
w
V
V
n
n
H
K
OH
]
[
]
[
Alkacymetria
Alkacymetria
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
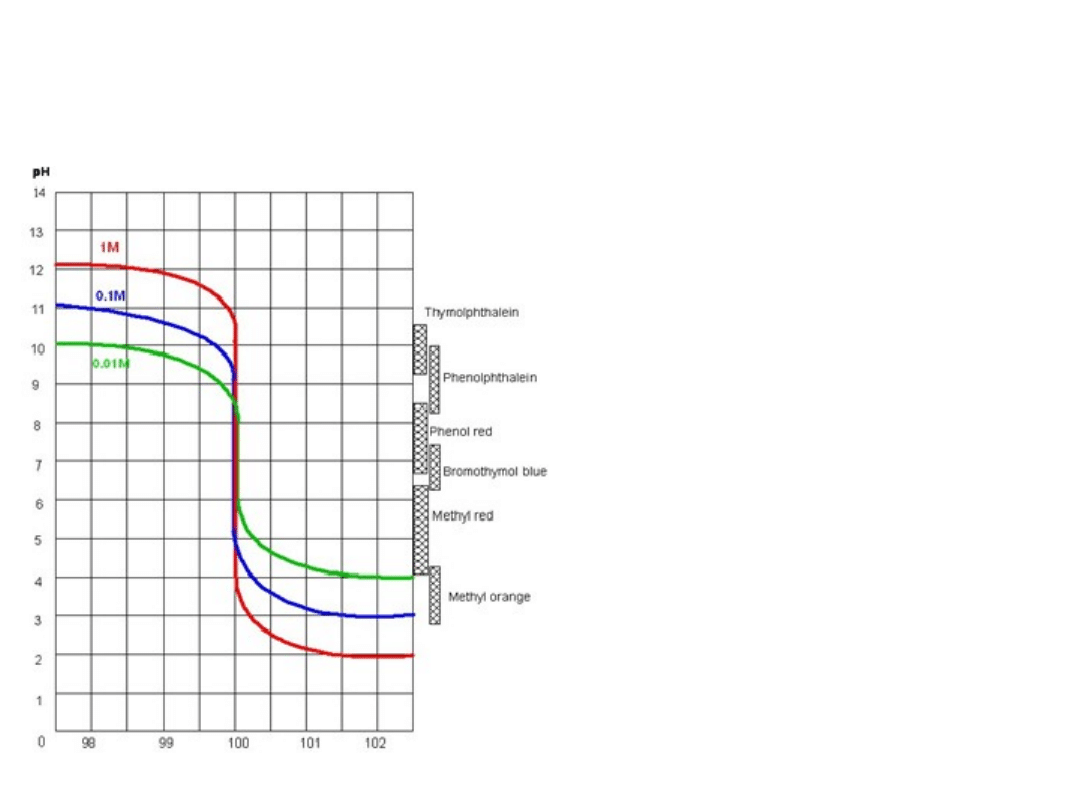
Krzywe miareczkowania 100 cm
3
roztworu
NaOH za pomocą roztworu HCl (c
z
=c
k
)
V
HCl
Wnioski analityczne:
1. pH
PR
=7,0 niezależnie od c
k
,
c
z
.
2. W miarę rozcieńczania
titranta (i analitu), skok
krzywej maleje. Maleje
więc precyzja oznaczenia.
3. Mocne kwasy i zasady
można oznaczać
miareczkowo zarówno
wobec fenoloftaleiny jak i
oranżu metylowego, pod
warunkiem, że ich stężenia
nie są zbyt małe.
4. Rozcieńczone kwasy
(zasady) należy
miareczkować wobec
błękitu bromotylowego
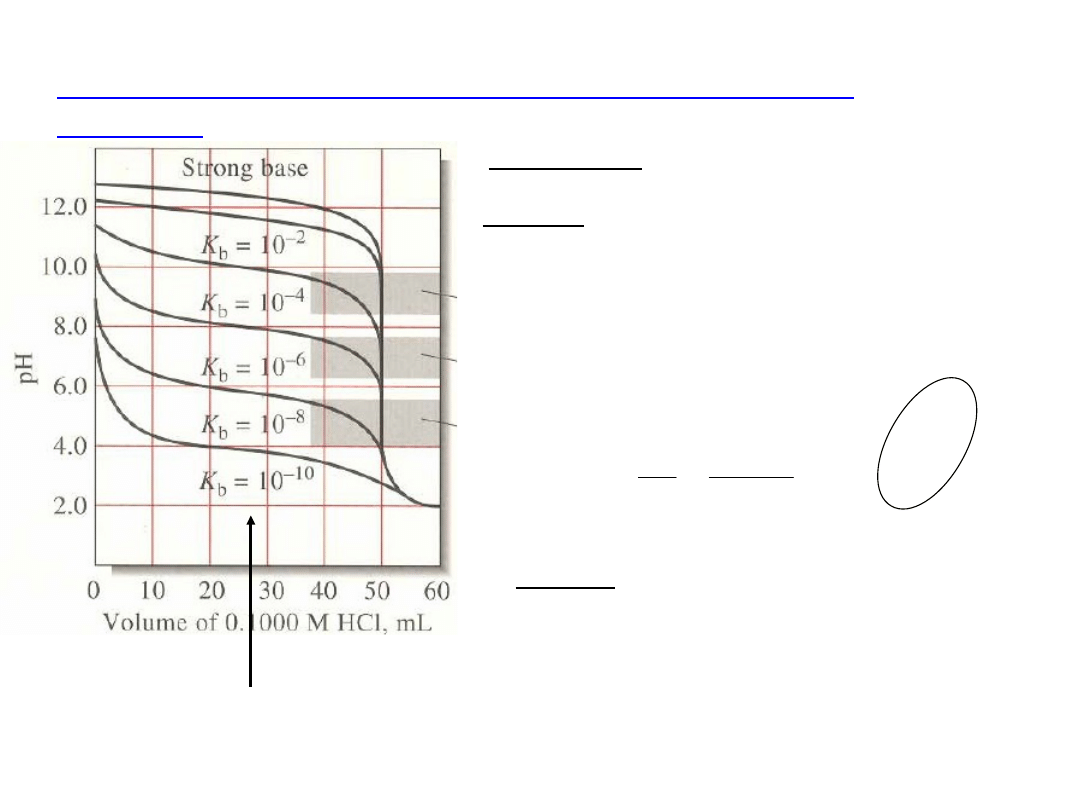
Krzywe miareczkowania słabych zasad (słabych
kwasów)
Alkacymetria
Alkacymetria
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Fenoloftaleina
Błękit bromotym.
Oranż metylowy
A. Przed PR – roztwór buforowy
B. W PR – roztwór soli słabej zasady
i mocnego kwasu (słabego kwasu
i mocnej zasady)
np.
NH
4
Cl → NH
4
+
+ Cl
NH
4
+
+ H
2
O =NH
4
OH + H
+
odczyn
kwaśny
]
[
]
[
]
[
4
2
H
NH
H
K
b
w
K
K
h
C. Za PR – nadmiar titranta decyduje
o pH (tak jak przy miareczkowaniu
mocnych kwasów i zasad)
pH
PR
i skok krzywej jest tym mniejszy,
im
słabsza jest zasada
pH
PR
jest tym większe , a skok
krzywej
jest tym mniejszy, im
słabszy jest
kwas
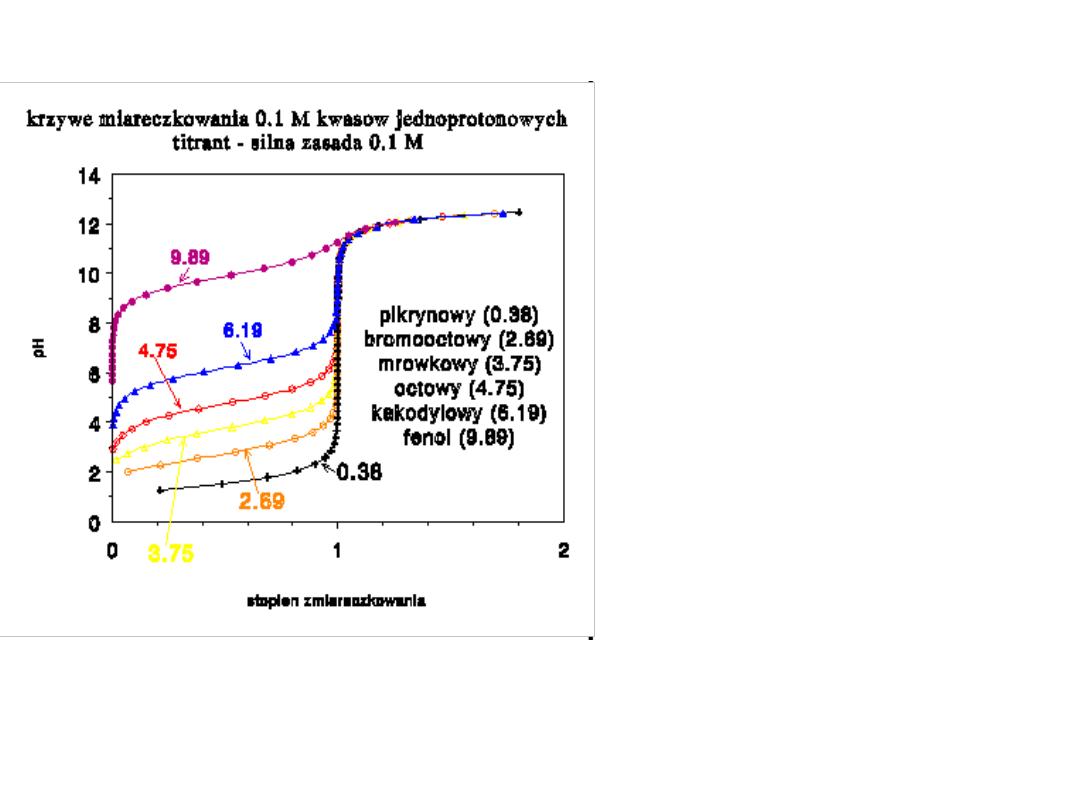
Alkacymetria
Alkacymetria
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Wnioski analityczne:
1. Słabe zasady
miareczkujemy wobec
wskaźników, których
zmiana barwy przypada
przy pH7, a słabe
kwasy wobec
wskaźników o zakresie
zmiany barwy przy
pH>7.
2. Wybór wskaźnika jest
bardziej ograniczony w
przypadku
miareczkowania słabych
kwasów (zasad) niż
mocnego kwasu (zasady)
również dlatego, że skok
krzywej miar. jest
mniejszy w przypadku
słabych kwasów (zasad).
Alkacymetria
Alkacymetria
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
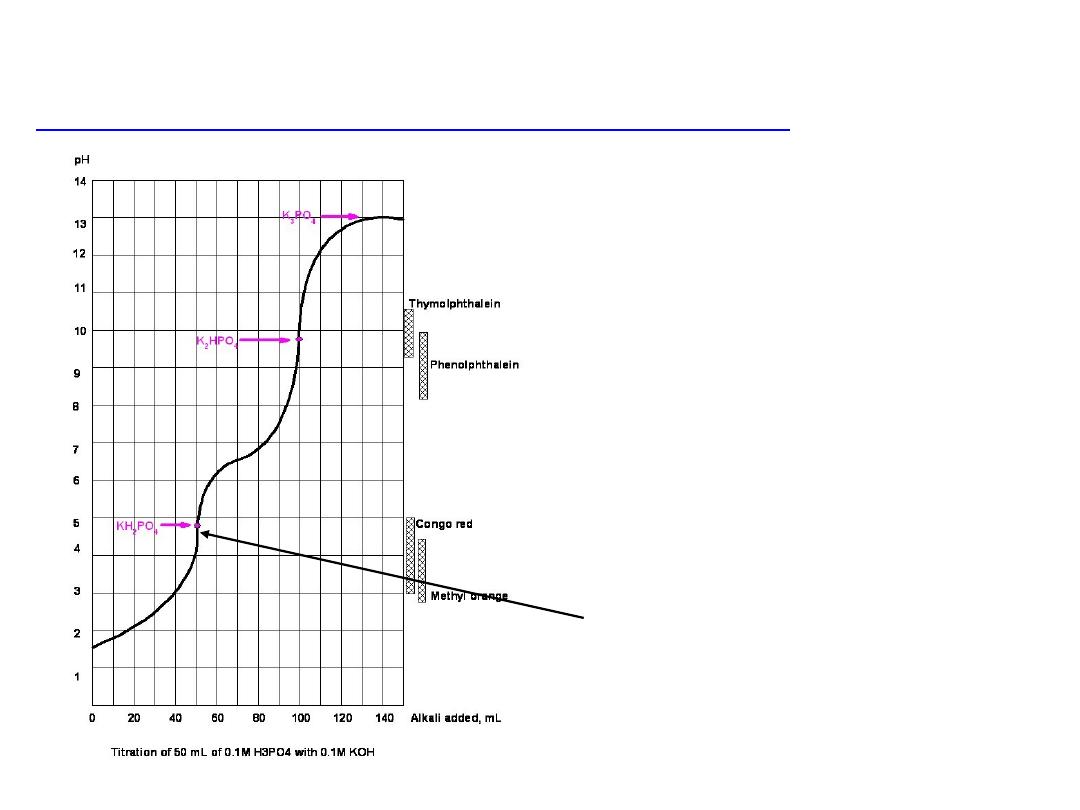
Miareczkowanie kwasów wieloprotonowych, np. H
3
PO
4
titrant KOH
H
H
3
3
PO
PO
4
4
+ OH
+ OH
–
= H
2
PO
4
–
+ H
2
O
H
2
PO
4
–
+ OH
–
= HPO
4
2–
+ H
2
O
HPO
4
–
+ OH
–
= PO
4
3–
+ H
2
O
H
3
PO
4
+ OH
–
= H
2
PO
4
–
+ H
2
O
H
2
PO
4
–
+ OH
–
= HPO
4
2–
+ H
2
O
HPO
4
–
+ OH
–
= PO
4
3–
+ H
2
O
OM
NaOH
PO
H
V
c
n
4
3

Alkacymetria
Alkacymetria
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
---------------------
---------------------
Miareczkowanie układów złożonych
Przykład:
Oznaczanie zawartości NaOH i Na
2
CO
3
w
mieszaninie metodą Wardera
Metoda polega na miareczkowaniu roztworu zawierającego NaOH
i Na
2
CO
3
za pomocą mianowanego
roztworu HCl wobec dwóch
wskaźników - wobec FF i OM.
NaOH
OH
–
+ H
+
= H
2
O
Na
2
CO
3
CO
3
2–
+ H
+
= HCO
3
–
HCO
3
–
+ H
+
= H
2
CO
3
= CO
2
+ H
2
O
V
V
OM
OM
Bilans liczności reagentów:
V
V
FF
FF
OM
HCl
CO
Na
FF
HCl
CO
Na
NaOH
CO
Na
3
HCO
CO
NaOH
OH
OM
HCl
HCO
CO
OH
FF
HCl
CO
OH
V
c
2n
n
V
c
n
n
więi
n
n
n
i
n
n
ale
V
c
n
n
n
V
c
n
n
3
2
NaOH
3
2
3
2
2
3
3
2
3
2
3

Przykłady pytań sprawdzających:
1. Czym różnią się terminy:
a) punkt równoważności i punkt końcowy
miareczkowania objętościowego
b) substancja podstawowa (wzorzec pierwotny) i wzorzec
wtórny.
2. Wymienić cechy substancji podstawowej.
3. Wyjaśnić mechanizm działania wskaźników wizualnych
stosowanych w miareczkowaniu alkacymetrycznym.
4. Naszkicować na jednym wykresie krzywą
miareczkowania
mocnego kwasu i mocnej zasady (wyraźnie opisać osie
i
zaznaczyć PR).
5. Zapisać reakcje jako zachodzą podczas
miareczkowania
mieszaniny NaOH i Na
2
CO
3
. Narysować odpowiednią
krzywą
miareczkowania.
Alkacymetria
Alkacymetria
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Analiza wagowa i Alkacymetria-kolokwium, chemia analityczna
Notatki z analitycznej analiza wagowa
analiza wagowa 2
pytania do kolokwium z analizy wagowej i alkacymetrii, chemia analityczna
Cwiczenie nr 10 Analiza ilościowa Alkacymetria Oznacznie weglanow i wodoroweglanow
analiza wagowa, Technologia chemiczna, Chemia analityczna, Laboratorium
analiza wagowa II, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
kolokwium - analiza wagowa, chemia analityczna
ANALIZA MIARECZKOWA. ALKACYMERIA, Biochemia, Biochemia
Analiza wagowa, Technologia chemiczna pw, 2 rok, anality
ANALIZA WAGOWA ZAGADNIENIA TEORETYCZNE I PROGRAM CWICZEN
2 Podział metod analizy ilościowej Analiza wagowa
Sprawozdanie - analiza wagowa, Studia, Chemia
analiza wagowa
Analiza wagowa
analiza wagowa
Analiza wagowa
analiza wagowa kartkówka
więcej podobnych podstron