
Równowagi
Równowagi
chemiczne
chemiczne

Rozpatrujemy
układ zamknięty
, w którym
zachodzi reakcja chemiczna :
aA bB
rR qQ
+
�
+
oraz ciśnienie i temperatura są stałe.
p,T = const
Entalpia swobodna takiego układu zależy
od składu układu. Zmieniające się w
trakcie przebiegu reakcji liczby moli
poszczególnych składników możemy
powiązać razem liczbą postępu reakcji
(ksi).
q
dn
r
dn
b
dn
a
dn
dn
d
Q
R
B
A
i
i

W układzie zamkniętym entalpia swobodna
jest funkcją ciśnienia, temperatury i składu,
który można opisać jedną zmienną – liczbą
postępu reakcji.
(
)
p
p T
T
p
p T
T
G G p T
G
G
G
dG
dT
dp
d
T
p
G
G
G
S
V
T
p
,
,
,
,
,
,
, ,
?
x
x
x
x
=
x
� �
� �
�
�
�
� �
=
+
+
x
� �
� �
� �
�
�
�
x
� �
� �
� �
� �
� �
�
�
�
� � =-
=
=
� �
� �
� �
�
�
�
x
� �
� �
� �
Entalpia
swobodna
reakcji
chemicznej
r
G
to zmiana entalpii
swobodnej układu zamkniętego o
nieskończenie
dużej
ilości,
w
którym zachodzi reakcja chemiczna
w
warunkach
izotermiczno-
izobarycznych, gdy liczba postępu
reakcji zmienia się o jeden.
r
T,p
G
G
� �
�
=D
� �
�
x
� �
G
0 →
1
p,T = const
r
G<0
r
G=0
r
G>0
G
sub
o
G
prod
o
G
o
r
G
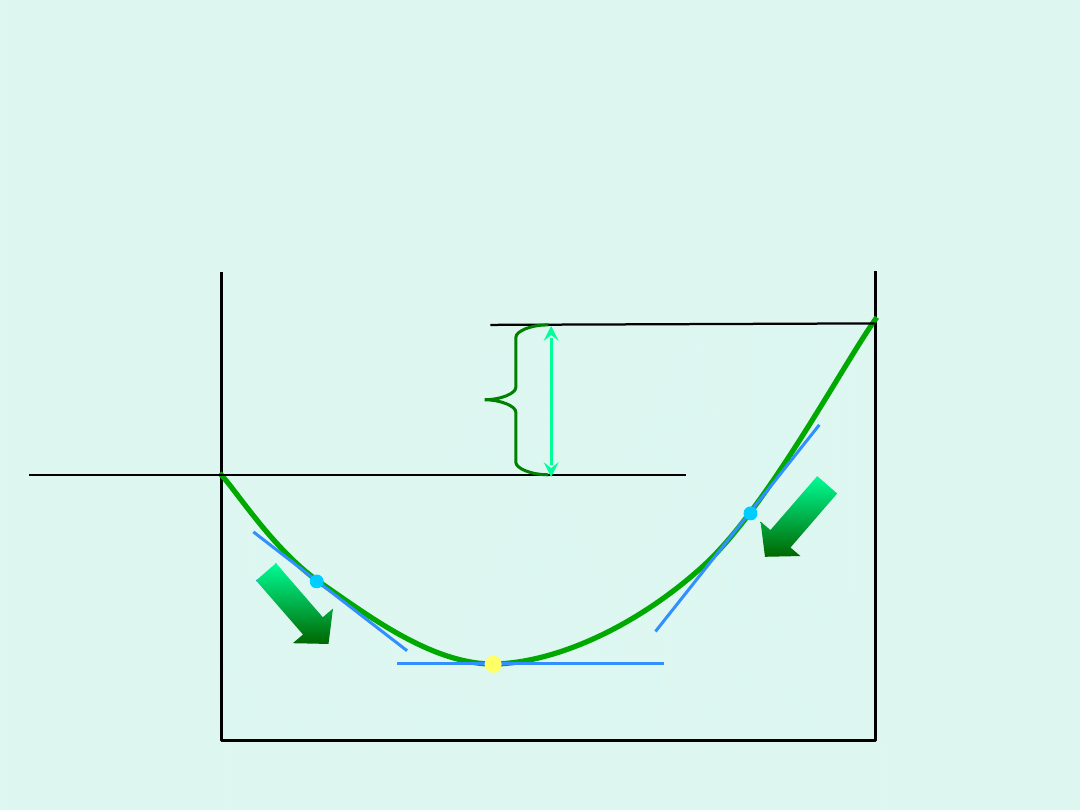
Zmiany entalpii swobodnej układu,
w którym zachodzi reakcja
chemiczna w funkcji liczby postępu
reakcji
r
G
1
0
r
G
T,p = const
reakcja
egzergonic
zna
reakcja
endergonic
zna
→
stan
równowa
gi
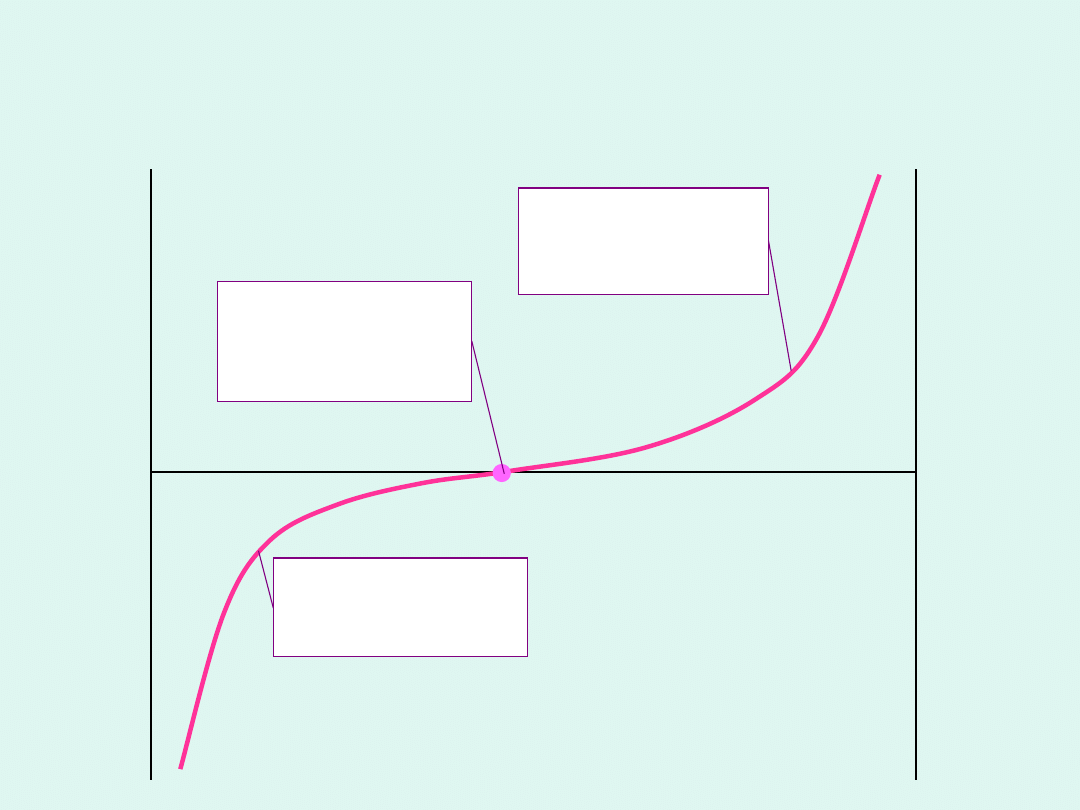
Zależność entalpii swobodnej
reakcji od liczby postępu reakcji

Reakcja egzergoniczna
to taka,
w wyniku której uzyskujemy
pracę użyteczną.
Reakcja endergoniczna
to taka,
która do zajścia w określonym
kierunku wymaga nakładu pracy z
zewnątrz.
0
1
G
T,p=const
1
2
3
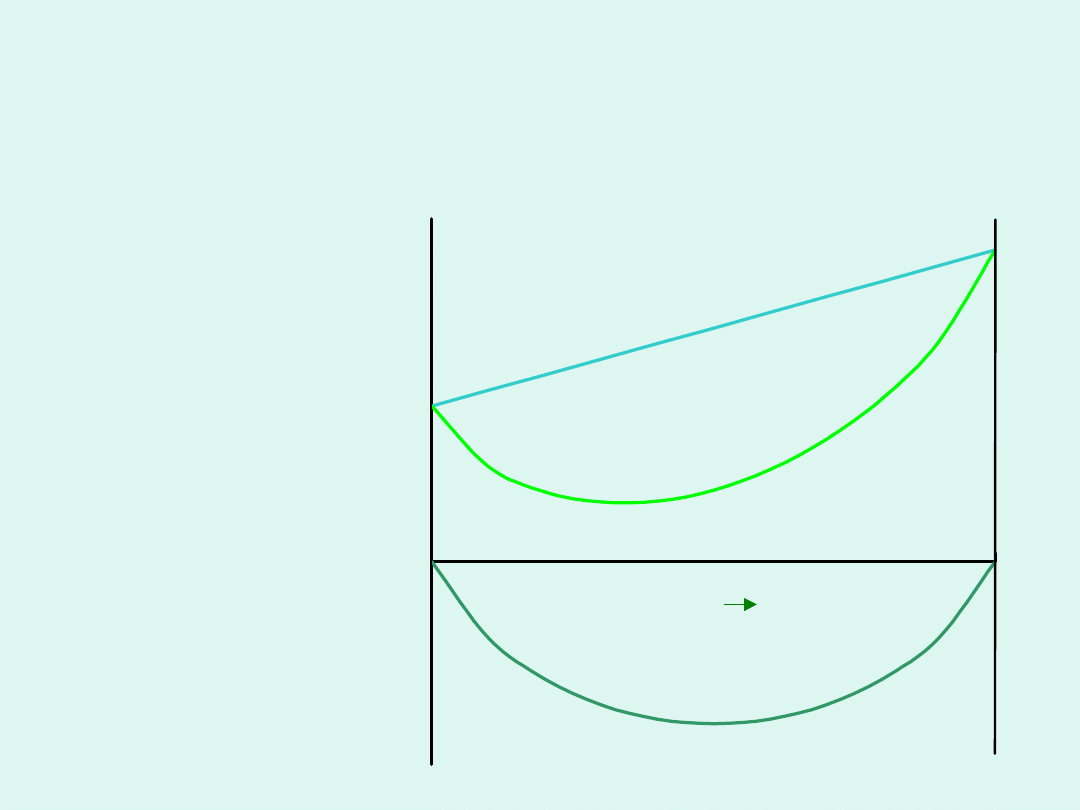
Co powoduje, że na krzywej zależności
entalpii swobodnej układu, w którym
zachodzi reakcja chemiczna, od liczby
postępu reakcji, pojawia się minimum ?
1
– zmiany
entalpii
swobodnej
układu
wynikające tylko
ze zmiany liczby
moli reagentów
2
– zmiany
entalpii
swobodnej
układu
wynikające tylko
z mieszania się
różnej liczby moli
reagentów
3 =1+2

Gdy
T,p = const
, to :
i
i
i
r
i
i
i
i
i
i
i
i
i
i
i
p
,
T
r
p
,
T
G
d
dn
d
dn
dn
dG
d
G
dG
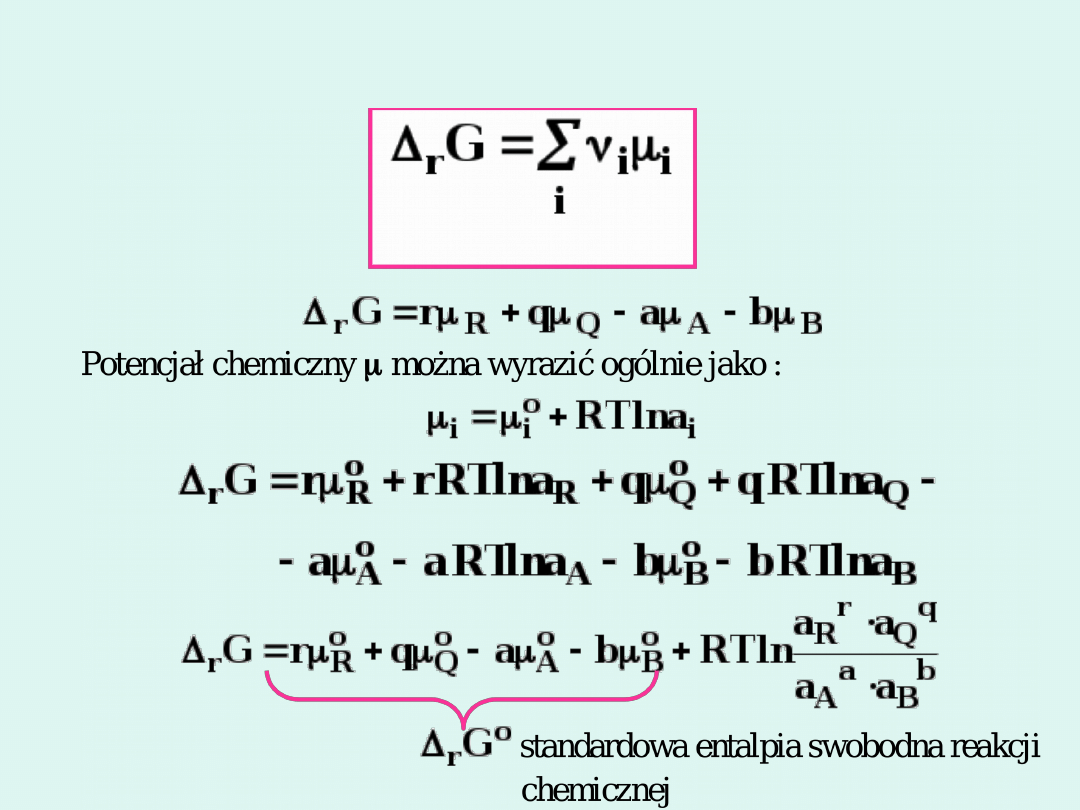
aA bB
rR qQ
+
�
+

Izoterma van’t Hoffa

Jeżeli
r
G < 0
, to reakcja przebiera
samorzutnie z lewa na prawo.
Jeżeli
r
G > 0
, to reakcja przebiera
samorzutnie z prawa na lewo.
Jeżeli
r
G = 0
, to reakcja osiągnęła
stan równowagi.
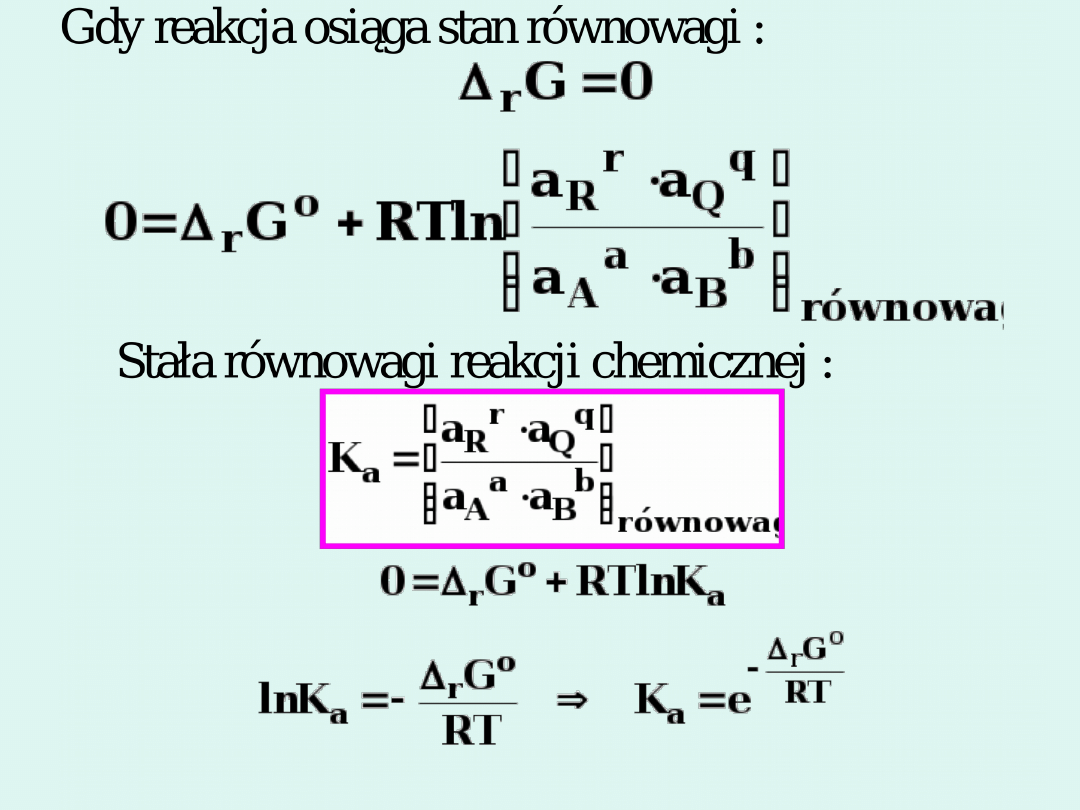

RT
G
a
o
r
e
K
Jeżeli
r
G
o
< 0
, to
K
p
> 1
.
Jeżeli
r
G
o
> 0
, to
K
p
< 1
.
Jeżeli
r
G
o
= 0
, to
K
p
= 1
.
Reakcje w fazie gazowej, gdy
reagenty traktujemy jako gazy
doskonałe
Q
R
o
o
A
B
o
o
q
r
p
a
b
p
p
p
p
K
p
p
p
p
� �
� �
� � � �
� � � �
� � � �
� � � �
� � � �
�
=
�
Stała równowagi ciśnieniowa
K
p
i
o
i
i
o
p
RT
p
ln
m =m +
Stała równowagi ciśnieniowa zależy tylko od
temperatury !
Reakcje w fazie gazowej, gdy
reagenty traktujemy jako gazy
doskonałe
( )
( )
( ) ( )
q
r
R
Q
x
a
b
A
B
x
x
K
x
x
�
=
�
Stała równowagi
K
x
wyrażona przez
ułamki molowe
i
i
i
RT
x
*
ln
m =m +
Stała równowagi
K
x
zależy od temperatury i
ciśnienia !
Związek pomiędzy K
p
i K
x
( )
( )
( ) ( )
( )
( )
( )
( )
Q
R
Q
R
o
o
o
o
A
B
A
B
o
o
o
o
r
g
i
i
q
r
q
r
p
a
b
a
b
q
r
r q a b
R
Q
a
b
o
A
B
p
x
o
r
g
i g prod
i g sub
prod
sub
p
x P
x
x
P
p
x
x
P
K
K
p
x P
x P
p
p
p
p
p
p
K
p
p
x P
x P
p
p
p
p
Kp
,
,
+ - -
D n
= �
�
�
�
�
� �
� �
�
�
�
�
� � � �
�
�
�
�
� � � �
�
�
� � � �
�
� �
�
� � � �
�
� �
�
� � � �
�
� �
�
�
� �
�
� �
� �
�
� �
=
�
� �
� �
D n
=
n
-
n
�
�
�
� �
�
=
=
�
�
�
�
=
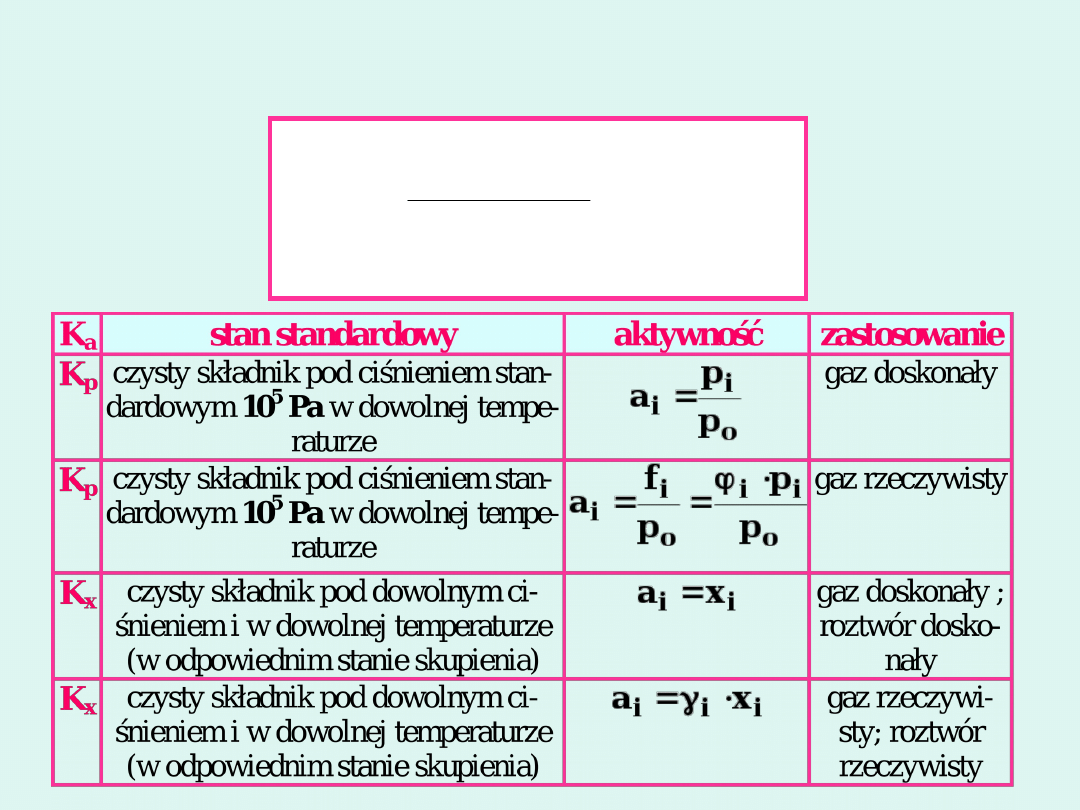
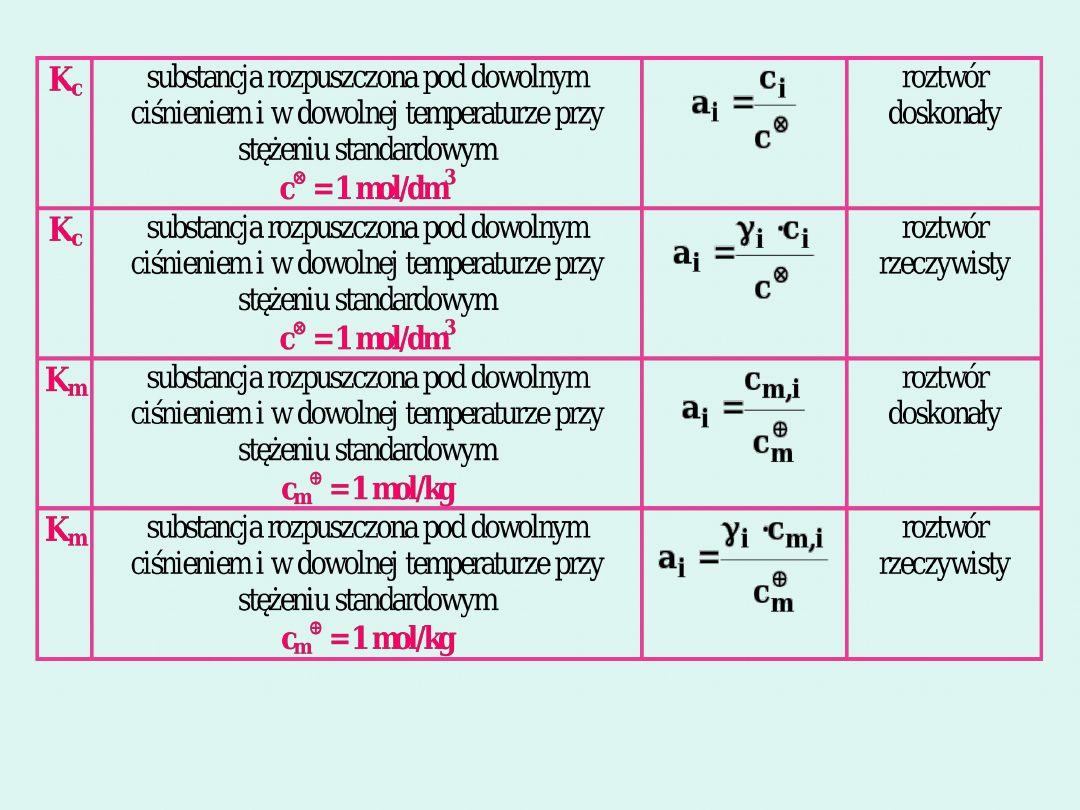
Sposoby wyrażania stałych
równowagi i ich zastosowanie
równowaga
b
B
a
A
q
Q
r
R
a
a
a
a
a
K

Wpływ temperatury i
ciśnienia na stan
równowagi reakcji
chemicznej
Wpływ temperatury na stan
równowagi reakcji chemicznej
Zakładamy, że ciśnienie jest stałe
p = const.
Korzystamy z równania
Gibbsa-Helmholtza
:
2
o
r
p
a
p
a
p
T
K
RT
a
o
r
2
o
r
p
T
G
T
H
T
K
R
T
K
R
T
K
RT
G
T
H
T
a
o
r
ln
ln
ln
ln

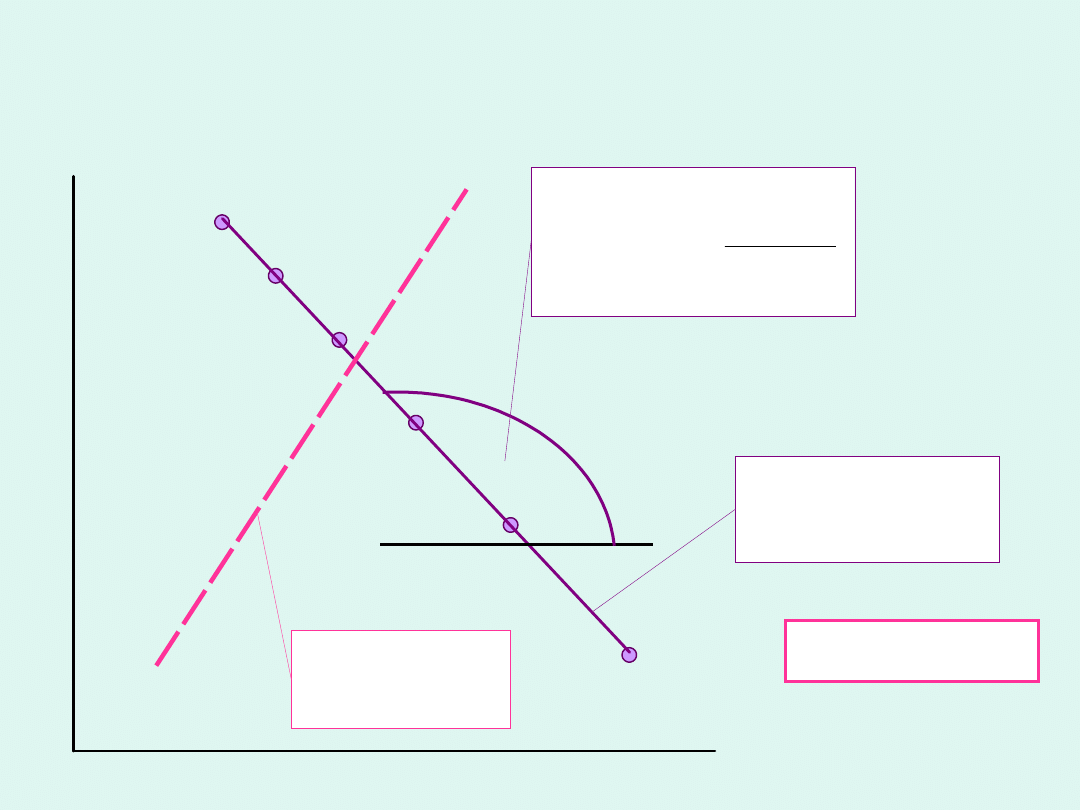
Izobara van’t Hoffa
a 2
2
a 1
1
2
a 2
a 1
1
o
a
r
2
p
o
r
a
2
K
T
o
r
a
2
K
T
T
o
K
r
K
2
T
K
H
T
RT
H
d
K
dT
RT
H
d
K
dT
RT
H
dT
RT
,
,
,
,
ln
ln
ln
ln
�
D
�
�
=
�
�
�
�
�
D
=
D
=
D
=
�
�
�

Jeżeli przedział temperatur, w którym
wykonujemy całkowanie jest niewielki,
możemy przyjąć, że
r
H
o
jest stała.
Wówczas :
2
2
2
a 2
a 1
1
1
1
a 2
a 1
a 2
a 1
a 2
a 1
T
T
o
o
o
T
K
r
r
r
K
2
2
T
T
T
o
o
K
r
r
K
2
1
1
2
o
K
r
2
1
K
2 1
K
1 2
K
o
r
2
1
H
H
H
dT
1
T
dT
R
R
T
RT
T
H
H
1
1
1
1
R
T
T
R
T
T
H T
T
R
T T
RT T
H
T
T
,
,
,
,
,
,
,
,
ln
ln
ln
ln
D
D
D
� �
=
=
=
-
� �
� �
D
D
�
�
�
�
=
-
+
=
-
�
�
�
�
�
�
�
�
D
-
=
�
D
=
-
�
�
o
o
r
r
a
2
2
o
r
a
H
H
dT
d K
dT
R
RT
T
H
1
K
C
R
T
ln
ln
D
D
=
=
D
=-
� +
�
�
�
Możemy też założyć, że entalpia reakcji jest
stała w szerokim zakresie temperatur i
scałkować bez granic :
lnK
p
reakcja
endotermiczn
a
reakcja
egzotermic
zna
R
H
tg
a
o
r
a
R
H
o
r
Wyznaczanie entalpii reakcji na
podstawie zależności stałej równowagi od
temperatury

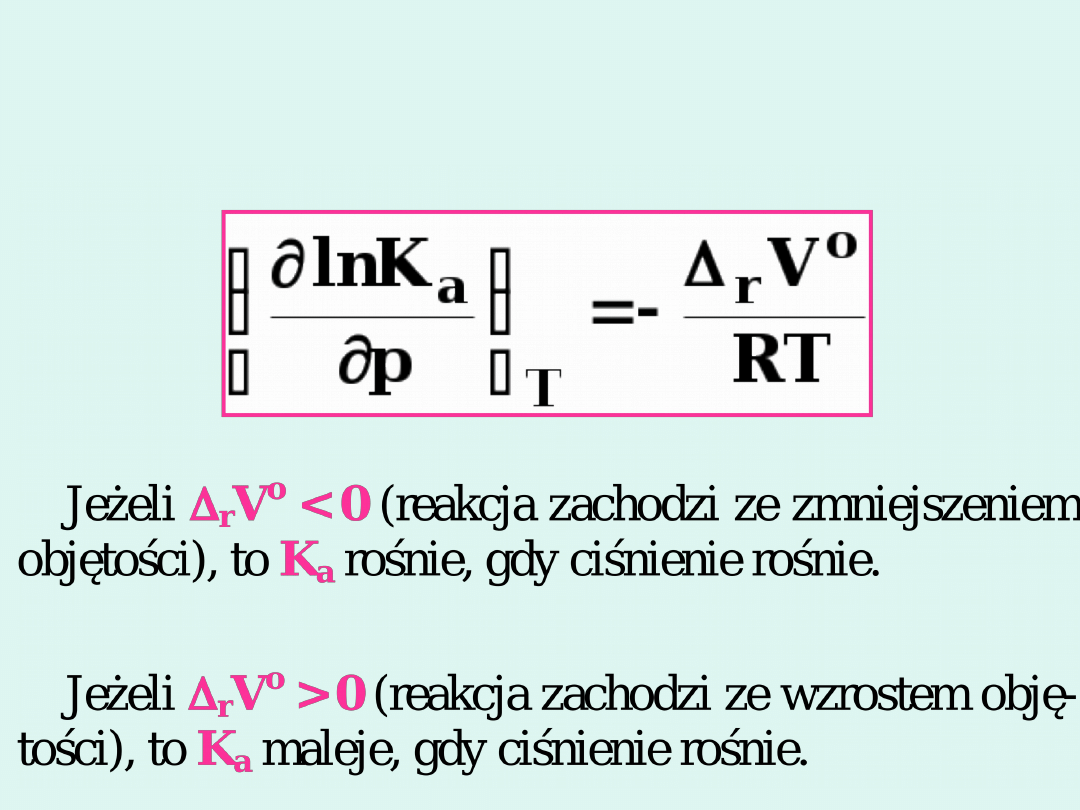
Wpływ ciśnienia na stałą
równowagi chemicznej
Rozpatrujemy układ w stałej temperaturze.
Od ciśnienia zależą stałe równowagi
K
x
,
K
m
i
K
c
.
Stała równowagi
K
p
nie zależy od ciśnienia
!

o
r
T
o
r
V
p
G
r
V
o
– standardowa zmiana objętości w reakcji
chemicznej czyli różnica objętości czystych,
rozdzielonych produktów i substratów w stanie
standardowym.
substr
substr
o
i
,
m
i
prod
prod
o
i
.
m
i
o
r
V
V
V
(
)
o
r
a
a
a
T
T
a
o
r
T
G
RT
K
RT
K
K
RT
p
p
K
RT
V
p
ln
ln
ln
ln
D
=-
�
�
�-
�
�
�
=-
�
�
�
�
�
�
�
�
�
�
�
�
�
�
�
-
=D
�
�
�
�
�
Izoterma van Laara-
Plancka
RT
V
p
K
ln
*
r
T
x
RT
V
p
K
ln
r
T
c
RT
V
p
K
ln
r
T
m

Dla reakcji przebiegających w fazie
gazowej uwzględniamy tylko reagenty
gazowe i w pierwszym przybliżeniu
traktujemy je jak gazy doskonałe.
RT
V
p
K
ln
*
r
T
x
substr
substr
g
*
i
,
m
i
prod
prod
g
*
i
,
m
i
g
*
r
V
V
V
g
i
r
g
*
substr
substr
g
i
prod
prod
g
i
g
*
g
*
i
,
m
p
RT
V
p
RT
p
RT
V
p
RT
V
r
r

p
p
K
ln
g
i
r
T
x

p
p
K
ln
g
i
r
T
x
g
i
r
2
1
2
x
1
x
1
2
1
x
2
x
1
2
g
i
r
1
x
2
x
p
p
g
i
r
K
K
x
g
i
r
x
p
p
K
K
p
p
K
K
p
dp
K
d
dp
p
K
d
,
,
,
,
ln
ln
ln
ln
,
,

Reakcje w fazach
skondensowanych
W tym wypadku zmiany objętości są bardzo
małe, rzędu cm
3.
Powoduje to, że wpływ
ciśnienia na stan równowagi takich reakcji
jest nieznaczny. Aby stała równowagi
zmieniła się w zauważalny sposób ciśnienie
musi się zmienić o kilka rzędów wielkości.
RT
V
p
K
ln
r
T
m

1
2
r
1
m
2
m
p
p
r
K
K
m
r
m
p
p
RT
V
K
K
dp
RT
V
K
d
dp
RT
V
K
d
2
1
2
m
1
m
,
,
ln
ln
ln
,
,
Jeśli założymy, ze zmiana objętości jest
stała (nie zależy od ciśnienia) to możemy
uzyskać scałkowana postać izotermy van
Laara-Plancka.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
11 Równowaga chemiczna
11 Równowaga chemiczna
11 Resusc 2id 12604 ppt
11 U Fizjologia wysilkuid 12643 ppt
11 WYMIANA JONOWAid 12683 ppt
wlasciwosci chemiczne alkenow 1 ppt
11 OPARZENIA I ODMROŻENIAid 12536 ppt
więcej podobnych podstron