Wykład 11 – RÓWNOWAGA CHEMICZNA
RÓWNOWAGA
CHEMICZNA
Reakcje odwracalne, pojęcie równowagi dynamicznej. Prawo
działania mas, stała równowagi i jej zależność od temperatury.
Zależność położenia stanu równowagi od stężenia, temperatury
i ciśnienia (reguła przekory). Dobór optymalnych warunków
reakcji na przykładzie syntezy amoniaku.

Wykład 11 – RÓWNOWAGA CHEMICZNA
Przypomnienie
●
Odwracalność reakcji
KLASYFIKACJA REAKCJI CHEMICZNYCH
– reakcja ODWRACALNA
Reakcję nazywamy odwracalną lub równowagową,
jeżeli w jej wyniku ustala się stan równowagi w którym
współistnieją produkty i substraty w określonych
proporcjach.
N
2
+ 3H
2
⇆ 2NH
3
Równowaga
– pomiędzy jakimi wielkościami?
Wykład 11 – RÓWNOWAGA CHEMICZNA
Szybkości reakcji odwracalnych
CO + 2H
2
S ⇆ 2H
2
O + CS
2
r
2
r
1
Równania kinetyczne
r
1
= k
1
[CO] [H
2
S]
2
r
2
= k
2
[H
2
O]
2
[CS
2
]
r
t
r
1
r
2
r
1
= r
2
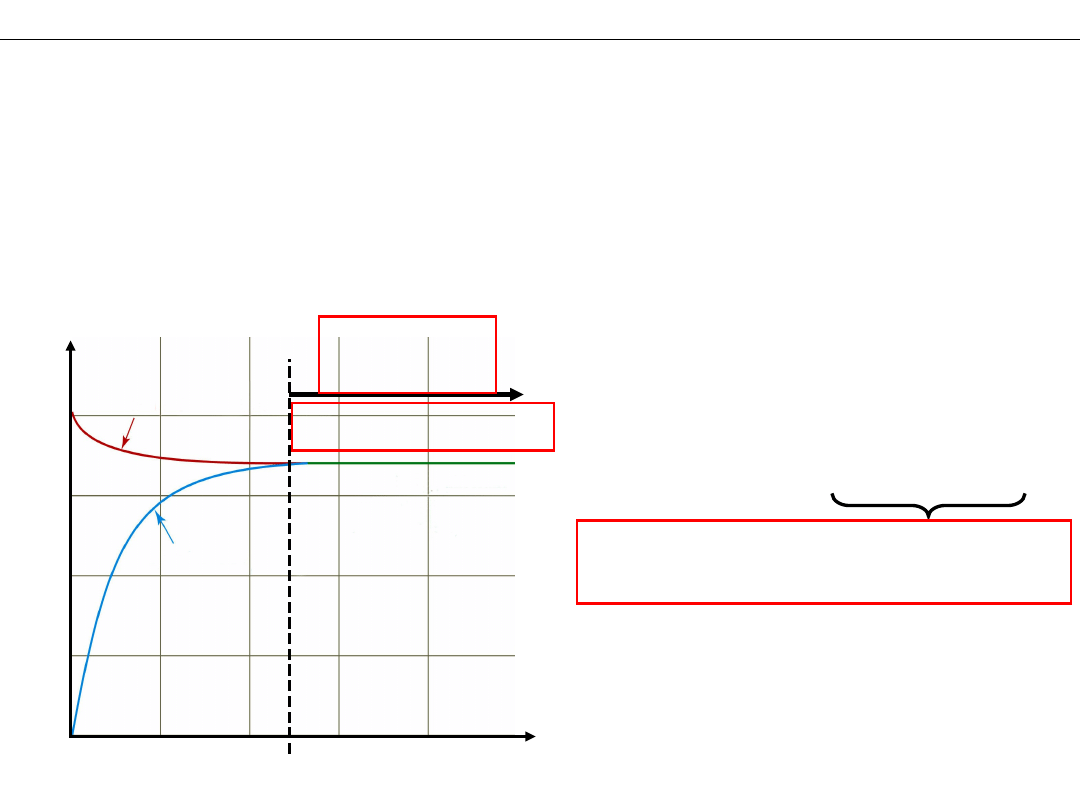
Stan równowagi
r
1
= r
2
W stanie równowagi:
Jak zmieniają się
szybkości
r
1
i
r
2
w czasie?
≠ 0
reakcje nadal przebiegają –
RÓWNOWAGA DYNAMICZNA
W jednostce czasu taka
sama ilość (liczność)
substratów znika i
jednocześnie powstaje
w reakcji odwrotnej.
t
[X]
[H
2
S]
[CS
2
]
0
Wykład 11 – RÓWNOWAGA CHEMICZNA
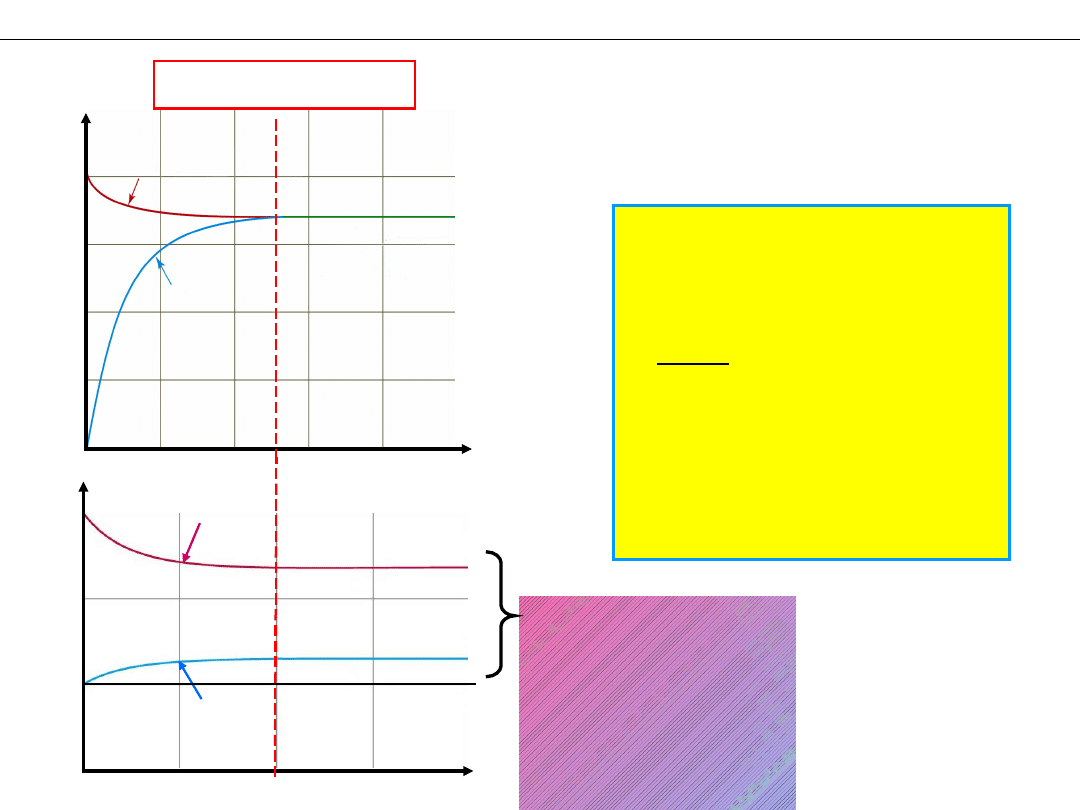
Co jest stałe
w stanie równowagi?
r
t
r
1
r
2
Stan równowagi
r
1
= r
2
= const.
– szybkości
r
1
i
r
2
Odp:
– stężenia wszystkich
reagentów
[X]
CO + 2H
2
S ⇆ 2H
2
O + CS
2
r
2
r
1
W stanie
równowagi,
w jednostce
czasu,
wybranego
reagenta
tyle samo
powstaje
i tyle samo znika.
k
2
k
1
Wykład 11 – RÓWNOWAGA CHEMICZNA
CO + 2H
2
S ⇆ 2H
2
O + CS
2
r
2
r
1
r
1
= k
1
[CO] [H
2
S]
2
r
2
= k
2
[H
2
O]
2
[CS
2
]
r
1
= r
2
W stanie równowagi:
=
k
1
[CO] [H
2
S]
2
k
2
[H
2
O]
2
[CS
2
]
Rozdzielenie wartości
stałych od zmiennych
[CO] [H
2
S]
2
=
[H
2
O]
2
[CS
2
]
=
K
K
– stała równowagi
„Prawo Działania Mas”
PRODUKTY
SUBTRATY
Wykład 11 – RÓWNOWAGA CHEMICZNA
„PRAWO DZIAŁANIA MAS”
Szczególny przypadek właściwego
Prawa Działania Mas,
zwanego Prawem Guldberga i Waagego
W stanie równowagi
chemicznej,
stosunek iloczynu stężeń
produktów
do iloczynu stężeń substratów
ma wartość stałą,
charakterystyczną dla danej
reakcji
i temperatury
W układach gazowych, stan równowagi można
opisać poprzez ciśnienia cząstkowe (parcjalne)
x
C
c
· x
D
d
K
=
x
A
a
· x
B
b
x
x
i
– ułamek molowy
·
K
=
·
p
p
B
p
o
( )
b
p
C
p
o
( )
c
p
D
p
o
( )
d
p
A
p
o
( )
a
p
o
= 1,013 ·10
5
Pa
K =
p
K
c
)
(
p
o
RT
c+d–a–b
aA + bB ⇆ cC + dD
[A]
a
· [B]
b
[C]
c
· [D]
d
K
=
[X]=
c
(mol/dm
3
)
c
o
=1
(mol/dm
3
)
c
Wykład 11 – RÓWNOWAGA CHEMICZNA
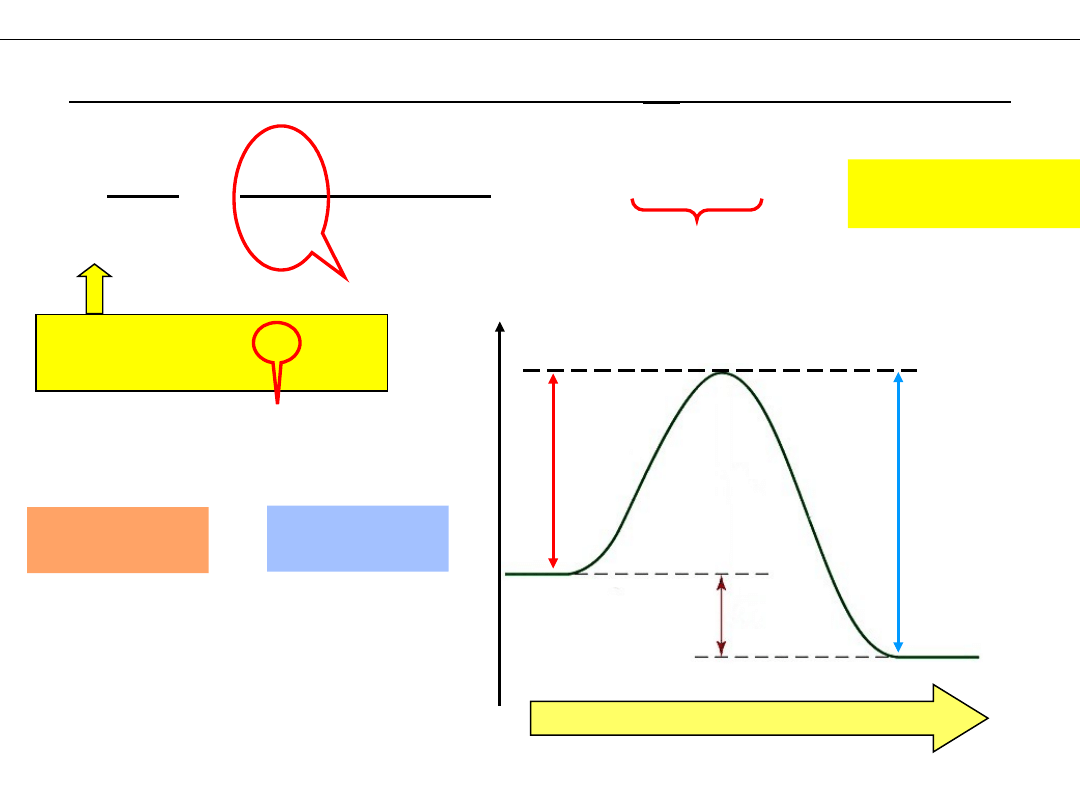
E
droga reakcji
PRODUKTY
SUBSTRATY
ΔH
Zależność stałej równowagi
K
od temperatury
K
=
k
1
k
2
k = k
0
· e
–Ea/RT
k
01
· e
–Ea1/RT
k
02
· e
–Ea2/RT
=
= Ae
–(Ea1–Ea2)/RT
ΔH
=A e
–(ΔH)/RT
aA + bB ⇆ cC + dD
1
2
Ea1
Ea2
SUBSTRATY
PRODUKTY
?
A
?
[CaCO
3
]
[CaO]
· [CO
2
]
K
=
c
CaCO
3
= CaO + CO
2
Wykład 11 – RÓWNOWAGA CHEMICZNA
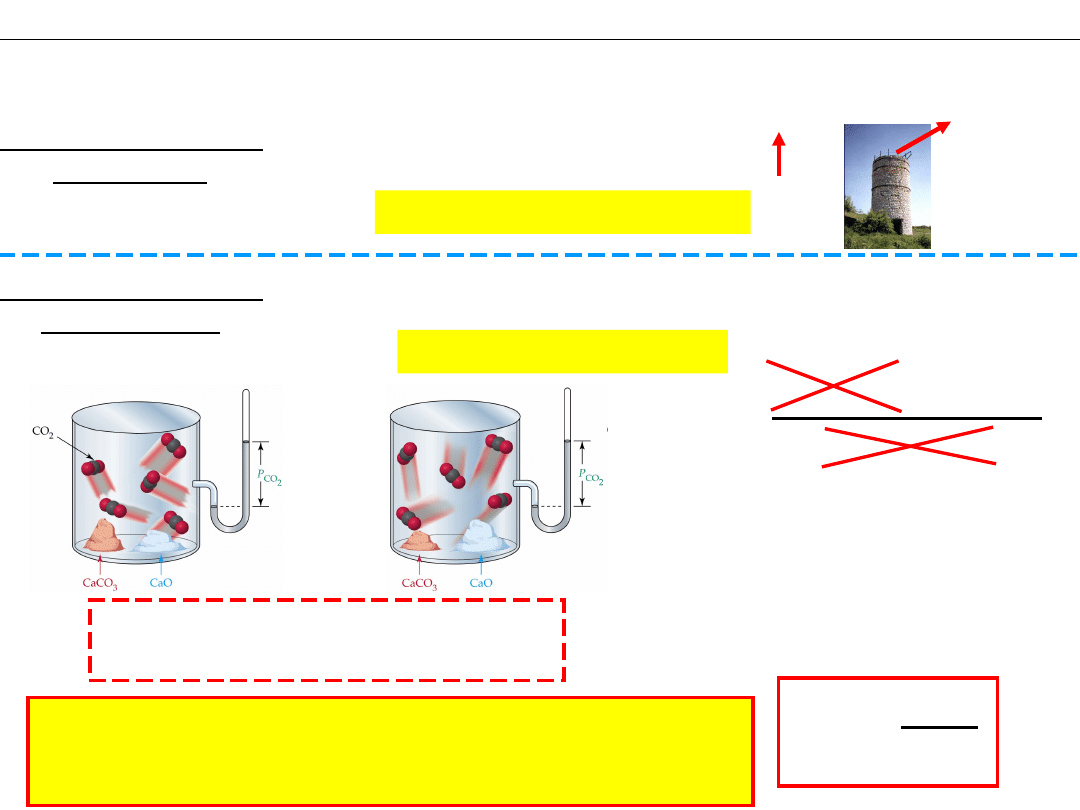
Równowaga w układach heterogenicznych
Reakcja w układzie
OTWARTYM
Wapiennik
CO
2
Reakcja NIEODWRACALNA
Reakcja w układzie
ZAMKNIĘTYM
CaCO
3
= CaO + CO
2
Reakcja ODWRACALNA
Stężenia substancji stałych, CaO
i CaCO
3
, nie zmieniają się !
(masa, liczność są
proporcjonalne do objętości,
m=V·d )
[CO
2
]
K
=
c
p
p
o
=
K
p
CO
2
Ciśnienie CO
2
nie zależy od ilości
(liczności) substancji stałych
ZASADA OGÓLNA: Prawo działania mas
obejmuje tylko te reagenty, których stężenia
mogą się zmieniać.

Wykład 11 – RÓWNOWAGA CHEMICZNA
REGUŁA PRZEKORY
− Reguła Le Chateriera i Brauna
Henri Louis Le Chatelier
1850-1936)
Jeżeli na układzie będącym w stanie
równowagi zostanie wymuszona jakaś
zmiana, to układ dąży do uzyskania
nowego stanu równowagi,
przeciwdziałając wprowadzonej zmianie.
Karl Ferdinand Braun
1850-1918; Nobel 1910
Inaczej: Działanie zewnętrzne
naruszające stan równowagi układu
wywołuje w nim zmiany które
zmniejszają to działanie.
Krótko: Układ "w równowadze" działa "na
przekór".
Przykład - wahadło
Wahadło
Focaulta
Wykład 11 – RÓWNOWAGA CHEMICZNA
Stan równowagi reakcji chemicznej można naruszyć poprzez:
A – zmianę STĘŻENIA reagenta (głównie dodanie)
B – zmianę TEMPERATURY (podgrzanie, schłodzenie)
C – zmianę CIŚNIENIA CAŁKOWITEGO
(dla niektórych reakcji z reagentami
gazowymi)
Przykład – Synteza amoniaku
N
2
+ 3H
2
⇆ 2NH
3
reakcja homogeniczna
w fazie gazowej
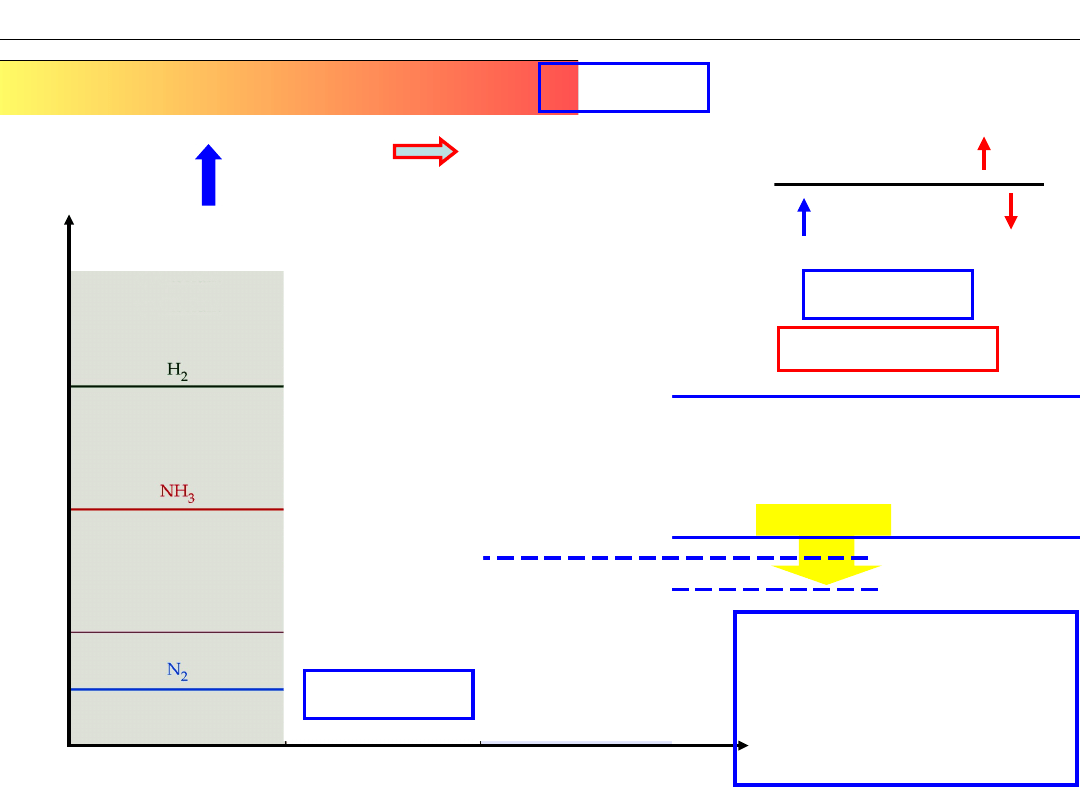
[NH
3
]
2
[N
2
]
· [H
2
]
3
K
=
c>
t
[X]
Wykład 11 – RÓWNOWAGA CHEMICZNA
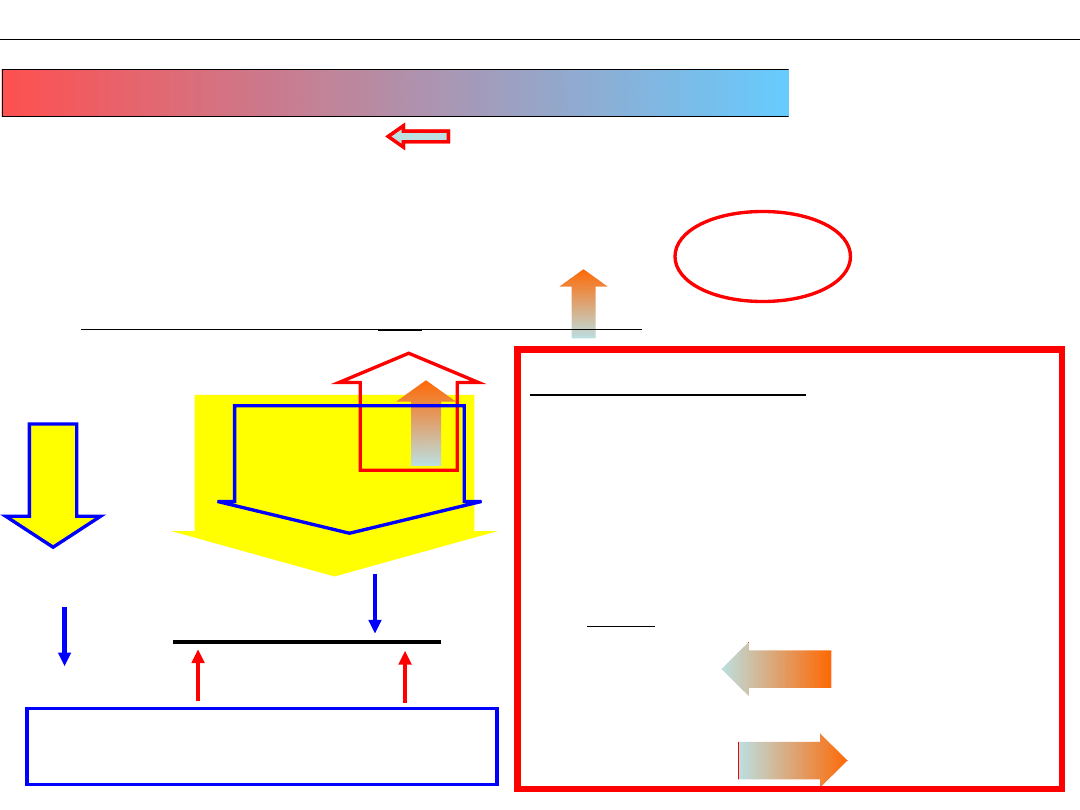
Zmiana STĘŻENIA reagenta
N
2
+ 3H
2
⇆ 2NH
3
dodanie N
2
Reakcja
układu
Stan
równowagi
Nowa
równowaga
Wniosek 1: Dodanie reagenta
(wzrost stężenia)
przyspiesza reakcję,
która zmniejsza jego stężenie
Wniosek 2:
Dodanie azotu
przesunęło równowagę
w stronę produktu
(„w PRAWO”)
reakcja układu
dodanie N
2
dodanie N
2
Wykład 11 – RÓWNOWAGA CHEMICZNA
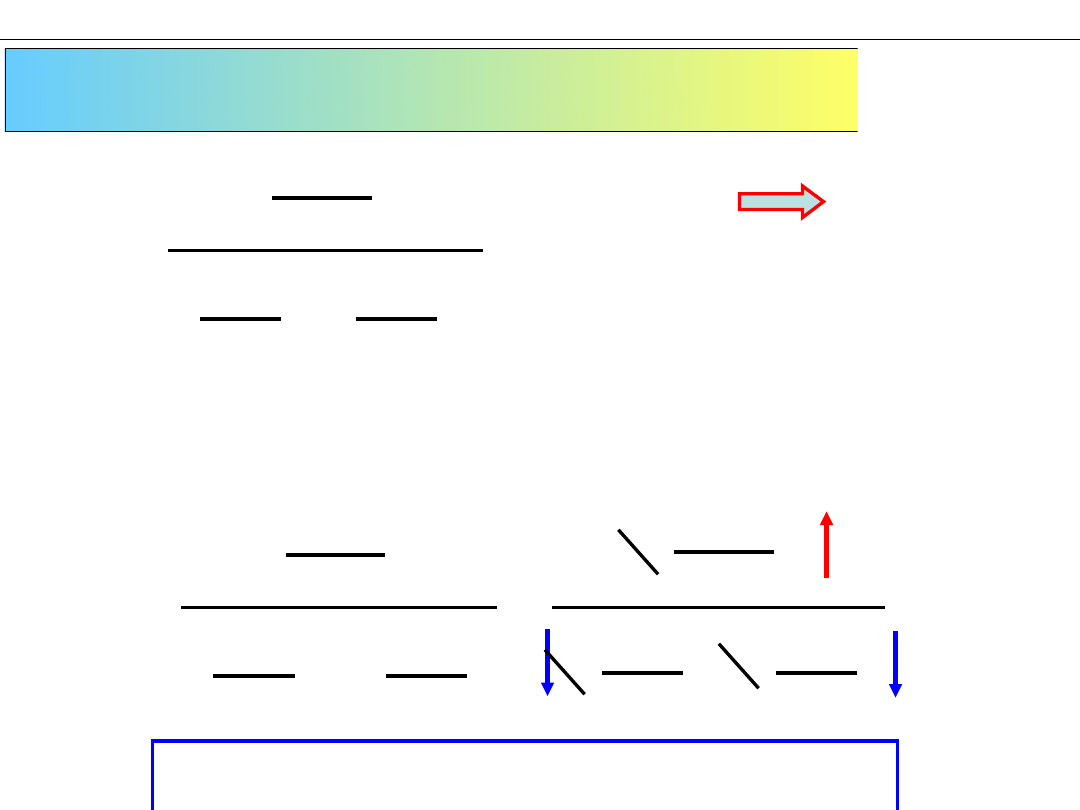
Zmiana TEMPERATURY (podgrzanie, schłodzenie)
K
=A e
–(ΔH)/RT
N
2
+ 3H
2
⇆ 2NH
3
ΔH
o
= –92,4 kJ/mol
Jak zmieni się stała
K
po wzroście T?
A e
–(–92,4)/RT
=
A
e
92,4/RT
=
e
92,4/R
T
K
=
A
[NH
3
]
2
[N
2
]
· [H
2
]
3
K
=
c
<
Równowaga przesunie się
w stronę substratów ( „w LEWO”)
1. Podniesienie temperatury
wymaga podgrzania,
dostarczenia dodatkowej energii
do układu
2. Układ usiłuje zmniejszyć wzrost
energii i przyspiesza reakcję
endotermiczną.
EGZO-
N
2
+ 3H
2
⇆ 2NH
3
ΔH
o
<0
ENDO-
Sposób uproszczony
Wykład 11 – RÓWNOWAGA CHEMICZNA
Zmiana CIŚNIENIA CAŁKOWITEGO
(dla niektórych reakcji z reagentami gazowymi)
N
2
+ 3H
2
⇆ 2NH
3
Jak zmieni się stała
K
p
po dwukrotnym wzroście ciśnienia
całkowitego
P
?
K
=
·
p
p
p
o
( )
2
p
p
o
( )
NH
3
N
2
p
p
o
( )
H
2
3
2
p
2
p
2
p
K
=
·
p
p
o
(
)
2
p
o
( )
NH
3
N
2
p
o
( )
H
2
3
≠
p
2
=
·
p
o
( )
p
p
o
( )
NH
3
N
2
p
p
o
( )
H
2
3
4
2
8
<
K
p
Równowaga przesunie się w stronę produktu ( „w
PRAWO”)
Wzrosną dwukrotnie wszystkie ciśnienia cząstkowe
p
i
4
Wykład 11 – RÓWNOWAGA CHEMICZNA
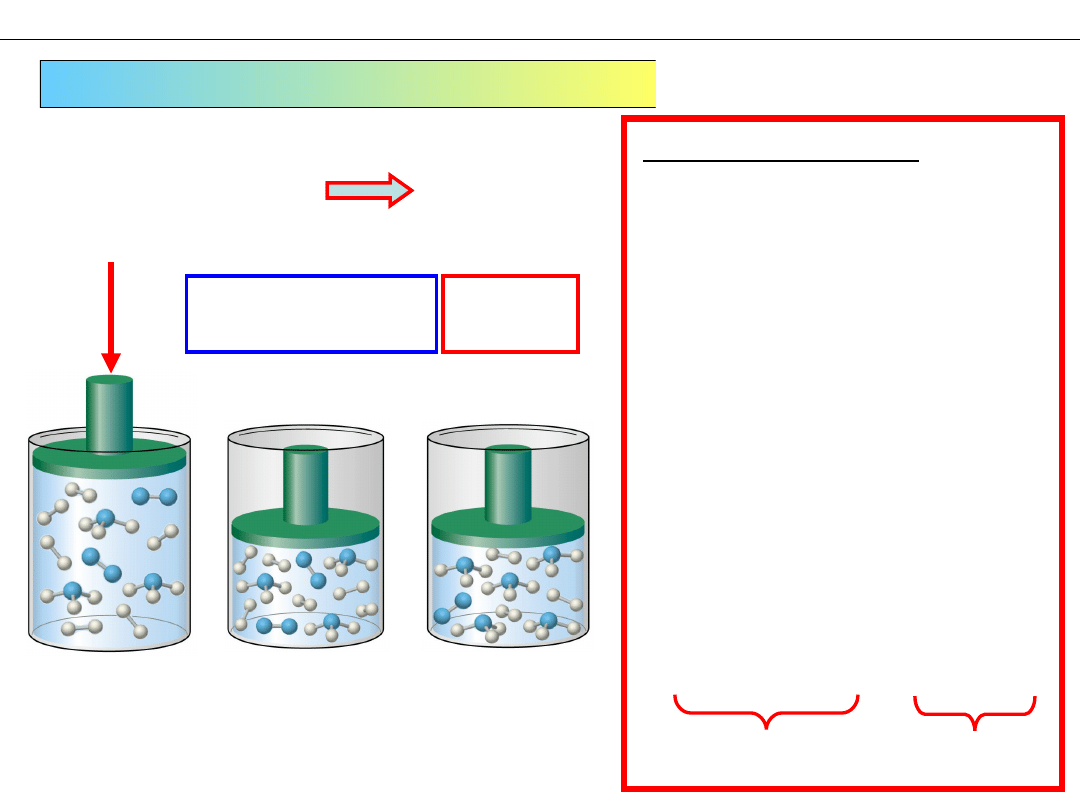
Zmiana CIŚNIENIA CAŁKOWITEGO (c.d.)
N
2
+ 3H
2
⇆ 2NH
3
Wzrost ciśnienia
całkowitego P
Reakcja
układu
2. Układ odczuł wzrost
ciśnienia całkowitego P
i stara się je obniżyć
3. Ciśnienie całkowite P jest
określone przez równanie
stanu gazu:
pV =
nRT
T = const.
4. Układ może zmienić tylko
całkowitą liczbę moli
n
5. Układ przyspiesza
reakcję podczas której
maleje sumaryczna liczba
moli
Sposób uproszczony
N
2
+ 3H
2
⇆ 2NH
3
4
mole
2
mole
F
1. Sprężamy gaz
(więcej NH
3
)
Wykład 11 – RÓWNOWAGA CHEMICZNA
N
2
+ 3H
2
⇆ 2NH
3
Krótki test z REGUŁY PRZEKORY
ΔH
o
= –92,4 kJ/mol
Zmiana w układzie
równowagowym
PRAWO
LEWO
Przesunięcie
stanu równowagi w
obniżenie temperatury
PRAWO
obniżenie stężenia H
2
LEWO
obniżenie ciśnienia
LEWO
wzrost liczności NH
3
LEWO
wzrost liczności N
2
PRAWO
wzrost temperatury
LEWO
wzrost ciśnienia
PRAWO
Korzystne dla
wydajności reakcji !!!
PRZEMYSŁOWA
PRODUKCJA AMONIAKU
Ciśnienie – 450 Atm.
(~45MPa)
Temperatura – 500 C
Nadmiar N
2
– 3 krotny
Katalizator – Fe
Proces Habera-Boscha
OCENA TESTU
„same piątki !!!”
Wykład 11 – RÓWNOWAGA CHEMICZNA
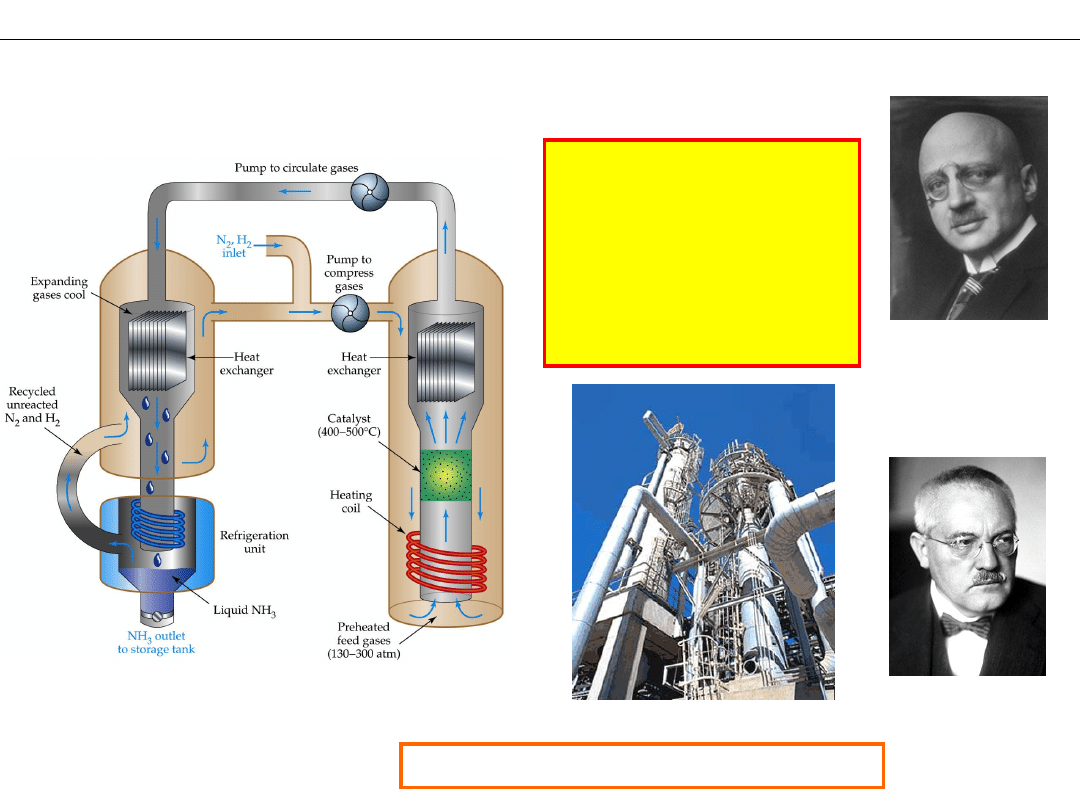
Proces Habera-Boscha
PRZEMYSŁOWA PRODUKCJA AMONIAKU
Ciśnienie – 300 Atm.
(~30MPa)
Temperatura – 500 C
Nadmiar N
2
– 3 krotny
Katalizator – Fe
Fritz Haber
1868- 1934
Nobel 1918
Carl Bosch
1874-1940
Nobel 1931
T
wrzenia
[C]
NH
3
–33
N
2
–
196
H
2
–
253
Instalacja przemysłowa
N
2
+ 3H
2
⇆ 2NH
3
Produkcja światowa ~120 mln ton
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
11 Równowagi chemiczneid 12587 ppt
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
7 równowaga chemiczna sprawozdanie
Lista 4 Równowagi chemiczne
Równowaga chemiczna
Równowagi chemiczne
Wykład 2, Równowagi chemiczne, woda
więcej podobnych podstron