
N
2
O
4
2 NO
2
→
←
RÓWNOWAGA
CHEMICZNA
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Reakcje chemiczne:
♦ nieodwracalne („praktycznie nieodwracalne” ???)
• reakcje wybuchowe, np. wybuch nitrogliceryny:
2 C
3
H
5
N
3
O
9
→ 6 CO
2
+ 3 N
2
+ 5 H
2
O +
1
/
2
O
2
• reakcje rozpadu promieniotwórczego, np. rozpad uranu
• gdy jeden z produktów opuszcza środowisko reakcji (tzn. jest
gazem, jest trudno rozpuszczalny lub słabo zdysocjowany):
CaCO
3
+ 2 HCl
→ CaCl
2
+ CO
2
↑
+ H
2
O
AgNO
3
+ NaCl
→ AgCl
↓
+ NaNO
3
2 NaOH + H
2
SO
4
→ Na
2
SO
4
+ 2 H
2
O

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
♦ odwracalne
→ v
1
v
1
= k
1
· c
A
a
· c
B
b
W stanie równowagi chemicznej obie szybkości są sobie równe:
a A + b B c C + d D
← v
2
v
2
= k
2
· c
C
c
· c
D
d
k
1
· [A]
a
· [B]
b
= k
2
· [C]
c
· [D]
d
ponieważ dla oznaczenia stężeń molowych substratów i produktów
w stanie równowagi stosuje się symbole: [A], [B], [C], [D], więc:
v
1
= v
2
(v
1
= v
2
> 0
; równowaga dynamiczna)
→
←
„prawo działania mas”
b
a
d
c
c
[B]
[A]
[D]
[C]
K
⋅
⋅
=
K
c
- stężeniowa stała równowagi (zależy od temperatury);
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
termodynamiczna stała równowagi:
Δn = (c + d) − (a + b)
gdy n = 0 to K
c
= K
x
= K
p
K
p
i K
x
- stałe równowagi, w których stężenia substancji są wyrażone
za pomocą ciśnień cząstkowych lub ułamków molowych;
b
B
a
A
d
D
c
C
x
x
x
x
x
K
⋅
⋅
=
Δn
c
p
Δn
p
x
Δn
c
x
T)
(R
K
K
p
K
K
p
T
R
K
K
⋅
⋅
=
⋅
=
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛ ⋅
⋅
=
−
b
B
a
A
d
D
c
C
p
p
p
p
p
K
⋅
⋅
=
Δn - różnica pomiędzy liczbą moli gazowych produktów i substratów
b
B
a
A
d
D
c
C
a
a
a
a
a
K
⋅
⋅
=

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Reakcje odwracalne pomiędzy substancjami w różnych fazach:
(g)
− gaz, (c) − ciecz, (s) − ciało stałe
FeO
(s)
+ CO
(g)
Fe
(s)
+ CO
2(g)
→
←
CO
CO
x
CO
CO
p
2
c
x
x
K
p
p
K
[CO]
]
[CO
K
2
2
=
=
=
CaCO
3(s)
CaO
(s)
+ CO
2(g)
→
←
2
CO
p
p
K
=
„Stała równowagi reakcji przebiegającej w danym kierunku jest zawsze równa
odwrotności stałej równowagi reakcji przebiegającej w kierunku przeciwnym.”
(1)
H
2
O H
2
+
1
/
2
O
2
(2)
2 H
2
O 2 H
2
+ O
2
O]
[H
]
[O
]
[H
K
2
1/2
2
2
(1)
c
⋅
=
2
2
2
2
2
(2)
c
O]
[H
]
[O
]
[H
K
⋅
=
( )
(2)
c
2
(1)
c
K
K
=
→
←
⇒
→
←
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Parametry zewnętrzne:
•
stężenie reagentów
•
ciśnienie
•
katalizator
•
temperatura
WPŁYW CZYNNIKÓW ZEWNĘTRZNYCH
NA RÓWNOWAGĘ CHEMICZNĄ
W praktyce przesuwanie równowagi reakcji w pożądanym kierunku
prowadzi się poprzez równoczesną zmianę kilku czynników
warunkujących tę równowagę.
Wartość K
c
wskazuje czy uprzywilejowane są substraty (nieb. kw.) czy produkty reakcji
(pom. kw.). Substraty przeważają, gdy K
c
jest małe, a produkty gdy K
c
jest duże. Ilość
substratów i produktów jest jednakowa, gdy wartość K
c
jest zbliżona do jedności.

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Reguła przekory Le Chateliera – Brauna
„Jeżeli na układ znajdujący się w stanie równowagi działa jakiś bodziec
zewnętrzny, to układ zachowuje się w taki sposób, aby osłabić jego
działanie, poprzez osiągnięcie nowego stanu równowagi.”
„Każdej akcji odpowiada kontrakcja”
Henri Louis Le Chatelier
(1850-1936)
Karl Ferdinand Braun
(1850-1918)
Nagroda Nobla w 1909 r.
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
zmiana stężenia jednej lub kilku substancji reagujących wywołuje zmianę
stężenia pozostałych substancji z zachowaniem wartości stałej równowagi;
• zwiększenie stężenia substratów będzie prowadziło do zwiększenia
stężenia produktów, a więc będzie przesuwało równowagę w prawo;
• ten sam efekt, tzn. przesunięcia równowagi w prawo, można wywołać
przez zmniejszenie stężenia produktów, poprzez ich usuwanie ze
środowiska reakcji;
• odwrotny proces, przesuwania równowagi reakcji w lewo, może być
wywołany przez zwiększenie stężenia produktów lub zmniejszenie
stężenia substratów;
•
stężenie reagentów
np. 2
SO
2
+ O
2
2 SO
3
2 NOCl 2 NO + Cl
2
→
←
→
←

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
zmiana ciśnienia ogólnego układu może wywołać przesunięcie stanu
równowagi reakcji przebiegającej w fazie gazowej, ale tylko,
gdy sumy liczby moli gazowych substratów i produktów są różne;
• wzrost ciśnienia zewnętrznego przesuwa równowagę w kierunku
reakcji, w której objętość składników gazowych jest mniejsza;
p
1
· V
1
= p
2
· V
2
np.
3 H
2
+ N
2
2 NH
3
- wzrost ciśnienia ogólnego (zmniejszenie objętości)
przesuwa równowagę reakcji w prawo;
- zwiększenie objętości (zmniejszenie ciśnienia)
przesuwa równowagę reakcji w lewo;
•
ciśnienie
→
←
np.
C
(s)
+ H
2
O CO + H
2
→
←
http://www.chm.davidson.edu/ChemistryApplets/equilibria/Volume.html
Równowaga.html.url
np.
H
2
+ Cl
2
2 HCl
- zmiana ciśnienia ogólnego nie wywiera wpływu na stan
równowagi tej reakcji, ponieważ liczba moli (objętości)
gazowych substratów jest równa liczbie moli (objętości)
gazowego produktu, co oznacza, iż objętość układu nie
ulega zmianie;
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
np.
N
2
O
4
2 NO
2
- wzrost ciśnienia ogólnego (zmniejszenie objętości)
przesuwa równowagę reakcji w lewo;
- zwiększenie objętości (zmniejszenie ciśnienia)
przesuwa równowagę reakcji w prawo;
→
←
→
←
•
katalizator
obecność katalizatora nie ma wpływu na położenie
stanu równowagi, powoduje jedynie szybsze jego osiągnięcie

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
np.
N
2
+ O
2
2 NO
Δ
H > 0
CaCO
3(s)
+ 10 kJ CaO
(s)
+ CO
2(g)
- podwyższenie temperatury przesuwa równowagę
tych reakcji w prawo
np.
2 O
3
3 O
2
+ 16 kJ
4 HCl + O
2
2 H
2
O + 2 Cl
2
Δ
H < 0
- z kolei podwyższenie temperatury przesuwa
równowagę tych reakcji w lewo
•
temperatura
→
←
1/ zmiana temperatury powoduje nie tylko przesunięcie stanu
równowagi, ale również zmianę wartości stałej równowagi;
2/ podwyższenie temperatury, zgodnie z regułą przekory,
przesuwa równowagę w kierunku reakcji endotermicznej
(ciepło wydzielone w reakcji można traktować jako produkt);
→
←
→
←
→
←
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
POTENCJAŁ TERMODYNAMICZNY A STAŁA RÓWNOWAGI
a
ΔG = ΔG
o
+ R · T · ln K
dla reakcji:
a A + b B c C + d D
b
B
a
A
d
D
c
C
a
a
a
a
a
K
⋅
⋅
=
ponieważ warunek równowagi to:
ΔG = 0
więc:
ΔG
o
= – R · T · ln K
→
←
TEMPERATURA A STAŁA RÓWNOWAGI
izobara van’t Hoffa:
T
1
R
ΔH
K
ln
⋅
−
=
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
−
−
=
1
2
1
2
T
1
T
1
R
ΔH
K
K
ln
to:
jeżeli dla:
T
2
→
K
2
a dla:
T
1
→
K
1
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Miarą przesunięcia stanu równowagi pod wpływem zmiany
stężenia lub ciśnienia jest stopień przereagowania.
STOPIEŃ PRZEREAGOWANIA
Stopień przereagowania
α - stosunek liczby moli substratu, które
uległy reakcji, do początkowej liczby
moli tego substratu.
AB A + B
(p,
α)
→
←
1 -
α
α
α
n
AB
+ n
A
+ n
B
= n = 1 +
α
ponieważ:
⇓
⇓
⇓
p
n
n
p
i
i
⋅
=
to:
p
α
1
α
p
p
p
K
2
2
AB
B
A
p
⋅
−
=
⋅
=
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
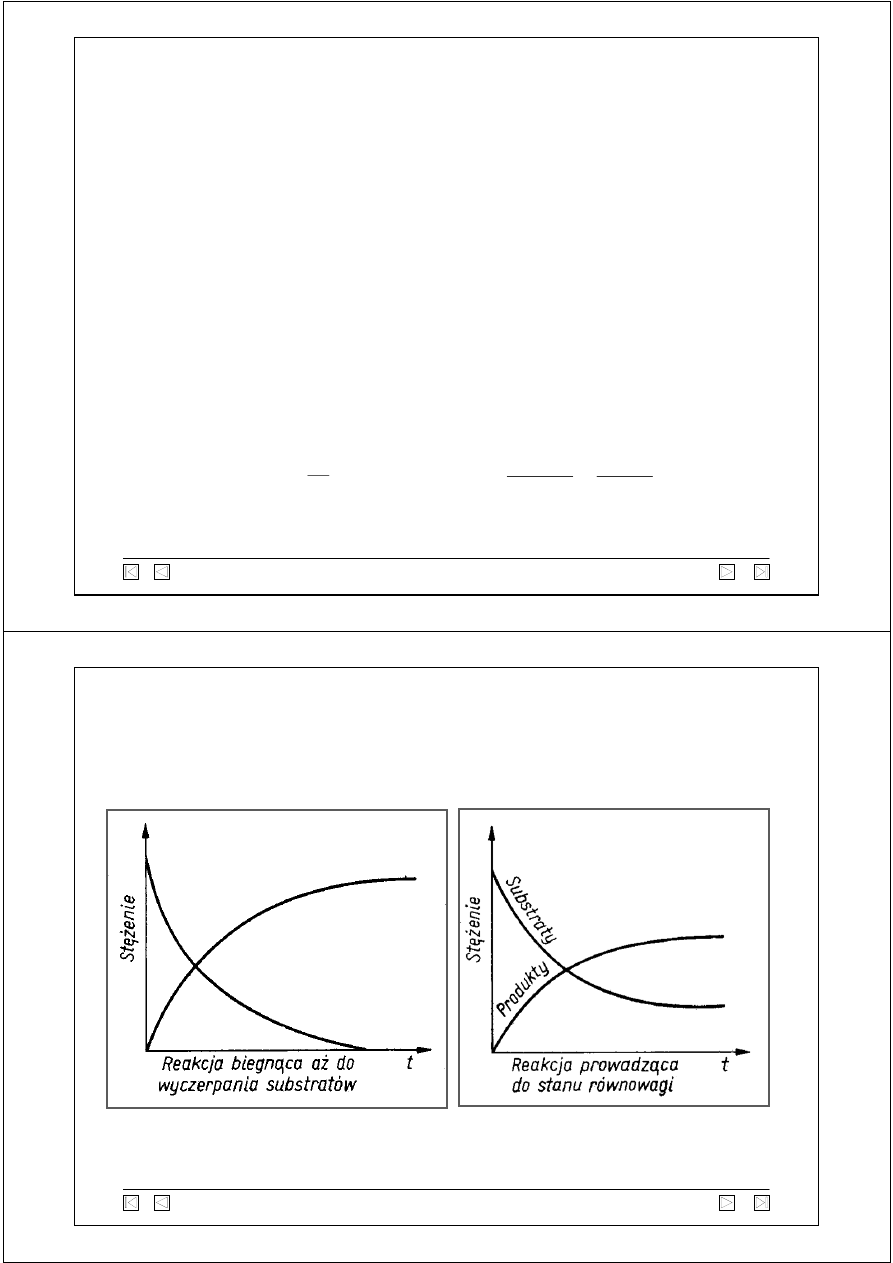
Wykresy zmian stężenia reakcji w funkcji czasu
c
A
c
B
A B
A
→ B
→
←
[B]
[A]
WYKRESY -
KINETYKA I RÓWNOWAGA CHEMICZNA
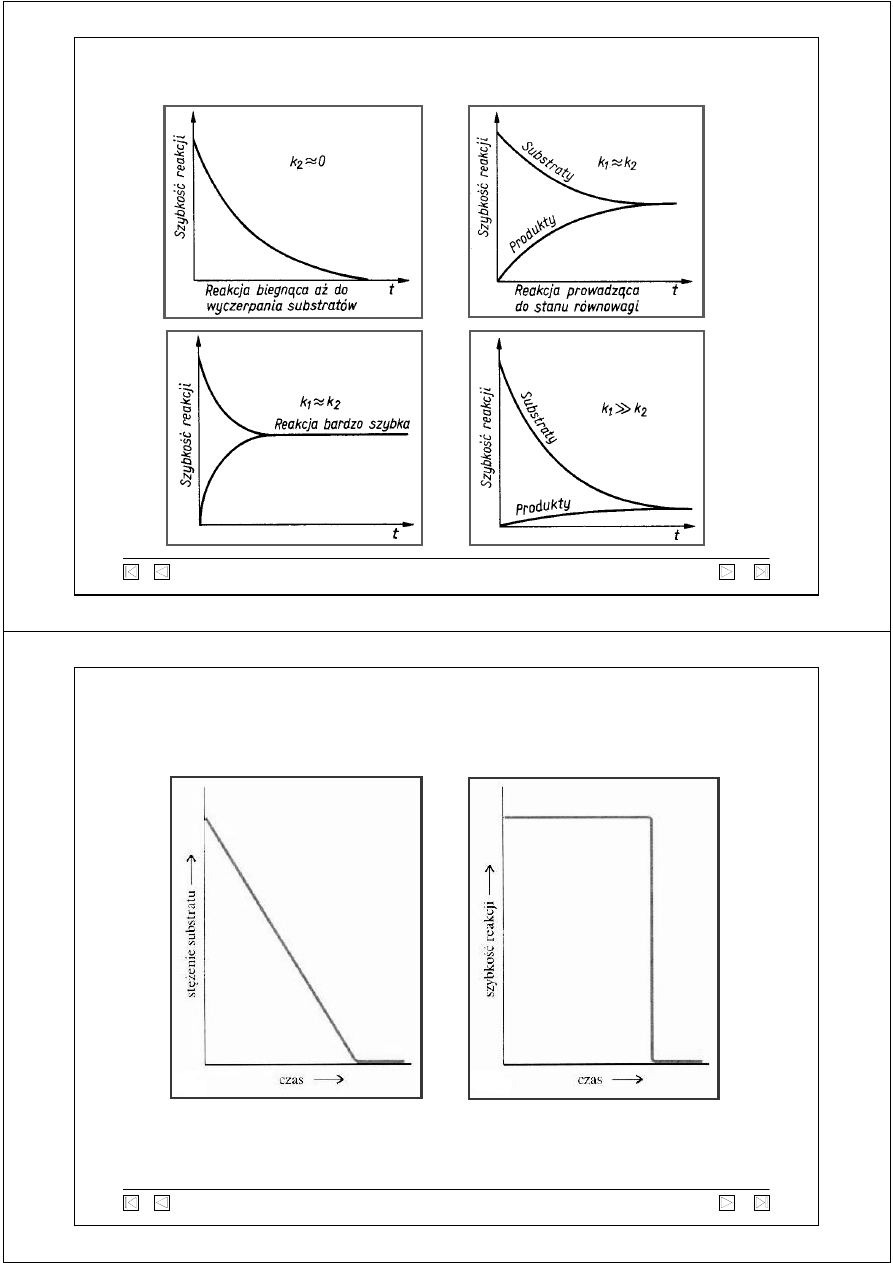
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Wykresy zmian szybkości reakcji w funkcji czasu
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Wykresy zmian stężenia substratu i szybkości reakcji
w funkcji czasu dla reakcji zerowego rzędu
Stężenie substratu zmniejsza się liniowo do zera, szybkość reakcji jest
niezależna od stężenia i pozostaje stała, dopóki nie zużyje się cała
jego ilość - wówczas szybkość gwałtownie spada do zera.
Wyszukiwarka
Podobne podstrony:
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
11 Równowagi chemiczneid 12587 ppt
11 Równowaga chemiczna
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
7 równowaga chemiczna sprawozdanie
Lista 4 Równowagi chemiczne
Równowaga chemiczna
Równowagi chemiczne
Wykład 2, Równowagi chemiczne, woda
więcej podobnych podstron