Chemiczne ЕєrГіdЕ‚a prД…du
1
CHEMICZNE Е№RГ“DЕЃA PRД„DU
Dr Regina Borkowska KChNiTCS, p. 423
TreЕ›Д‡ wykЕ‚adu po czД™Е›ci odpowiada podrД™cznikom
• A. Czerwiński „Akumulatory, baterie, ogniwa”
• A. Kisza „Elektrochemia”
• Każdy podręcznik chemii fizycznej w obszarze elektrochemii,
• E-books w BG : „Handbook of batteries”, „Battery Technology
Handbook”, „Fuel Cells”
Ale zawiera teЕј elementy z innych, mniej dostД™pnych ЕєrГіdeЕ‚!!!
Ergo
obecnoЕ›Д‡ nie zwalnia od lektury
Lektura nie zastД™puje obecnoЕ›ci
FinaЕ‚ -- test na ostatniej godzinie wykЕ‚adu
Chemiczne ЕєrГіdЕ‚a prД…du
2
Ogniwo galwaniczne
Wprowadzenie
• źródła energii w przyrodzie i technice
• Jak to się zaczęło?
• Historia ogniw = historia energii elektrycznej
Jako urzД…dzenie elektrochemiczne :
Reakcje elektrodowe
Termodynamika i kinetyka
WЕ‚asnoЕ›ci materiaЕ‚Гіw
Jako ЕєrГіdЕ‚o energii :
PorГіwnanie cech technicznych
Pozycja na rynku energetycznym
Technologia i ekonomika
Chemiczne ЕєrГіdЕ‚a prД…du
3
Wytwarzanie energii elektrycznej
• Paliwo – spalanie – efekt cieplny – energia
mechaniczna – generowanie elektryczności
ENERGIA CHEMICZNA - poЕ›rednio - ELEKTRYCZNA
• Odnawialne źródła energii ( wiatr, woda płynąca,
geotermia) – transformacja pracy w energię
elektrycznД…
• Ogniwa galwaniczne, paliwowe, słoneczne
ENERGIA CHEMICZNA – bezpośrednio - ELEKTRYCZNA
Chemiczne ЕєrГіdЕ‚a prД…du
4
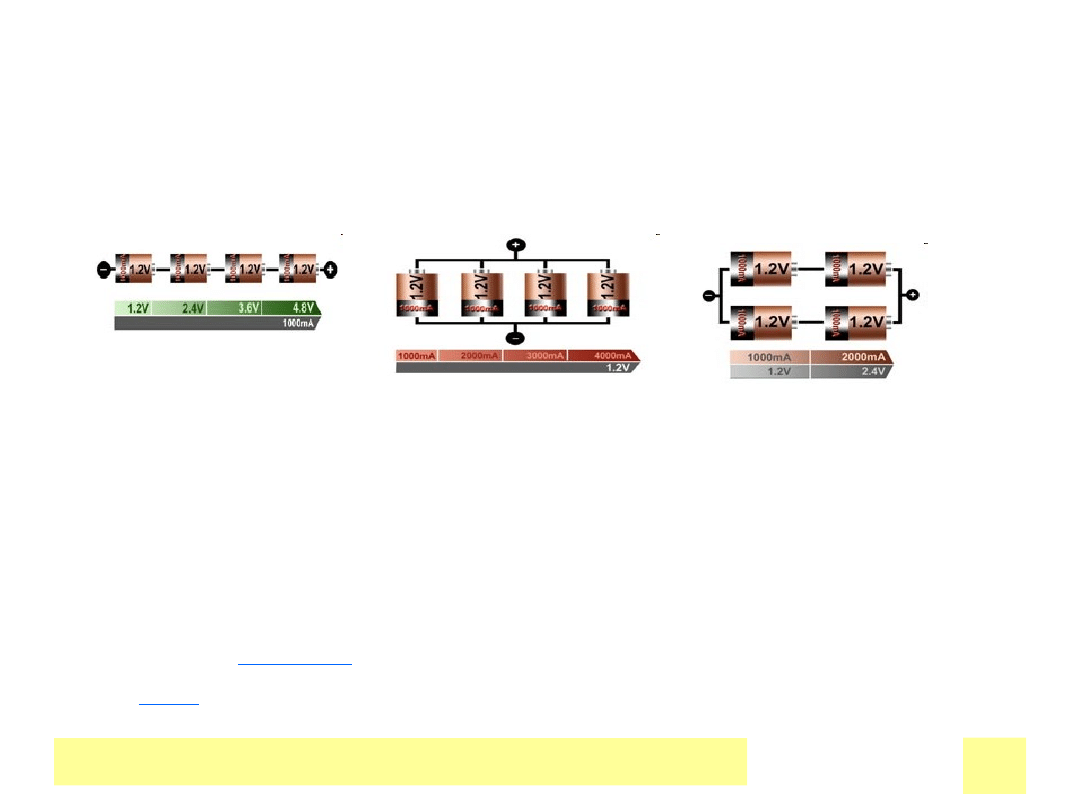
RODZAJE OGNIW
• Ogniwa pierwotne i wtórne
Substancje chemiczne w
elektrodach
WyraЕјane jako Q
reakcje
elektrodowe
WyraЕјone jako U
Energia = U . Q
•
ogniwa
paliwowe
StrumieЕ„
reagentГіw
reakcje
elektrodowe
WyraЕјone jako U
Energia = U . Q
IZOLOWANE
PRZENOЕљNE
NIEZALEЕ»NE OD SIECI ELEKTOENERGETYCZNEJ
Chemiczne ЕєrГіdЕ‚a prД…du
5
Energia a moc
• Energia = U • Q , zależy od różnicy potencjałów anoda-
katoda i iloЕ›ci materiaЕ‚u elektroaktywnego
• Moc = U • Q / t = U • I , zależy od różnicy potencjałów
anoda –katoda oraz od szybkości procesów elektrodowych

Chemiczne ЕєrГіdЕ‚a prД…du
6
Kilka waЕјnych momentГіw w historii
1780 L. Galvani – „elektryczność
zwierzęca”
1800 A. Volta – stos (bateria z płytek
cynkowych i srebrnych, oddzielonych
tkaninД… nasД…czonД… np.solankД…)
1866 G. Leclanche – bateria Zn – katodaMnO
2
1859 G. Plante’ – akumulator Pb-H2SO4 (płyty Pb)
1881 – Faury et al – zamiast Pb pasty na nośniku

Chemiczne ЕєrГіdЕ‚a prД…du
7
Od izolowanych ЕєrГіdeЕ‚ prД…du
do sieci elektroenergetycznej
Indukcja elektromagnetyczna – odkrycie M.Faraday ok. 1840
• Generator elektromechaniczny – Siemens ok.. 1857
• T. A . Edison : żarówka 1879, system oświetlenia w Nowym
Jorku, akumulator Ni-Fe
• DC contra AC – Edison contra Westinghouse, pierwsza
elektrownia w USA – Niagara Falls – zalety dostawy energii
w postaci prД…du zmiennego o wysokim napiД™ciu
Chemiczne ЕєrГіdЕ‚a prД…du
8
Obwody elektryczne zawierajД…ce
ogniwa
• Sterowanie napięciem i natężeniem prądu – łączenie ogniw
• Prawo Ohma w prostych obwodach : rezystancja -
zewnД™trzna (obciД…Ејenie) , wewnД™trzna ( elementy ogniwa),
polaryzacyjna (zwiД…zana z reakcjД…)
E = I ( R
inter
+ R
pol
+ R
load
)
• Energia i moc
Energia
= Q в€™U = I в€™ t в€™ U = (m / k) в€™U
Moc
= energia wytworzona/zuЕјyta w jednostce czasu
Chemiczne ЕєrГіdЕ‚a prД…du
9
Reakcja elektrodowa, potencjaЕ‚ elektrody
• φ= φ
o
+ RT/nF ln ( a
Me /
a
Me(n+)
)
• Potencjał standardowy przy jednostkowych aktywnościach - φ
o
• + odchylenie od standardu ze względu na stężenie
• Potencjał NIE JEST wielkością mierzalną
Reakcja elektrodowa
• Przeniesienie ładunku i masy przez granicę faz elektroda-elektrolit
• Fazy : elektroda = faza skondensowana przewodząca elektronowo
elektrolit = obszar materiaЕ‚u o przewodnictwie jonowej
Efekty reakcji elektrodowej
• Zmiana stopnia utlenienia jonu/atomu w cząsteczce
• Zmiany towarzyszące : tworzenie / zanik faz
zmiany struktury krystalograficznej / morfologii
Chemiczne ЕєrГіdЕ‚a prД…du
10
Reakcje elektrodowe w pГіЕ‚ogniwach
F
2
↔2F
-
2.86V
PbO
2
↔PbSO
4
1.65 V
Ag
+
↔Ag
0.79 V
MnO
2
↔MnOOH ~
0.7 V
Cu
2+
↔ Cu
0.34 V
2 H
+
↔ H
2
0 V
Ni
2+
↔ Ni
-0.25 V
PbSO
4
↔ Pb
-0.35 V
CdO ↔ Cd
-0.78 V
Mg
2+
↔ Mg
-2.3 V
Li
+
↔ LI
-3.05 V

Chemiczne ЕєrГіdЕ‚a prД…du
11
A
red
в†’B
ox +
n
e
-
Anodic reaction
Cathodic
reaction
C
ox
+ n e-
в†’D
red
Potential П†
ox
Potential П†
red
Reakcja sumaryczna
A + B = C +
D
E = О” П†
Siła elektromotoryczna E – skutek zmiany entalpii swobodnej reakcji
Tak wiД™c wiД…ЕјД…c О”G z SEM w/g rГіwnania = -О”G /nF
I definiujД…c Eo = О”G o/nF (standard) dostajemy rГіwnanie Nernsta
E = Eo – RT / nF ln K
Gdzie K – stała równowagi reakcji
ABCD
Chemiczne ЕєrГіdЕ‚a prД…du
12
Znaki
+ / -
w ogniwach - konwencja
Po lewej potencjaЕ‚ bardziej ujemny : Zn = Zn
2+
+ 2e П† = - 0.76 V
Po prawej bardziej dodatni : Cu = Cu
2+
+ 2e П† = 0.34 V
formalny zapis tego ogniwa
ObwГіd / Zn / Zn SO
4
aq
// CuSO
4 aq
/ Cu / obwГіd
znak
-
// znak
+
Ale .....
Chemiczne ЕєrГіdЕ‚a prД…du
13
Struktura i funkcje elektrod
A/
reaktywne elektrody metaliczne (osadzanie-roztwarzanie,
tworzenie zwiД…zkГіw na powierzchni
Reagent i kolektor prД…du (2 w 1)
przeniesienie ładunku i masy – na powierzchni
B/
elektrody obojД™tne
metale, grafit, pГіЕ‚przewodniki
Kolektor prД…du, nie ulega przemianom
przeniesienie ładunku i masy – na powierzchni
C/
elektrody wielofunkcyjne i wieloskЕ‚adnikowe
skЕ‚adnik elektroaktywny (czД™sto nieprzewodzД…cy)
matryca przewodzД…ca elektronowo
dodatki o funkcjach specjalnych
przeniesienie ładunku i masy – w miejscach potrójnego
styku faz
Cond.
matrix
Redox active
electrolyte
U
Chemiczne ЕєrГіdЕ‚a prД…du
14
RГіЕјne typy ogniw
• Ogniwa pierwotne, „klasyczne”
• Ogniwa pierwotne o specjalnych cechach – zapasowe,
termiczne
• Ogniwa wtórne – akumulatory
• Ogniwa paliwowe
• Ogniwa fotowoltaiczne
Ogniwo
:
SEM lub OCV
Max natД™Ејenie prД…du
z gД™stoЕ›ci prД…du i
powierzchni elektrod
Bateria (stos)
MoЕјliwoЕ›Д‡ sumowania napiД™Д‡,
natД™ЕјeЕ„ prД…du i pojemnoЕ›ci
Chemiczne ЕєrГіdЕ‚a prД…du
15
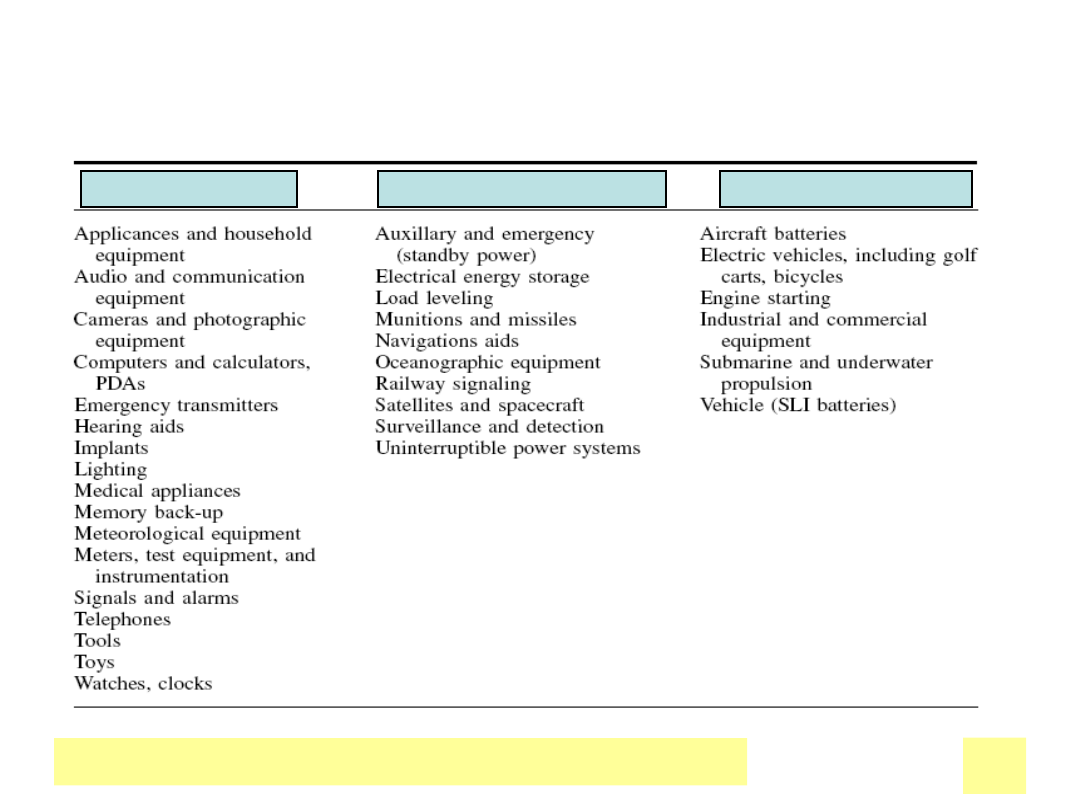
Grupy typowych zastosowaЕ„
UrzД…dzenia przenoЕ›ne
PrzemysЕ‚, agencje rzД…dowe
Transport, pojazdy
Chemiczne ЕєrГіdЕ‚a prД…du
16
Anoda Zn
• Potencjał standardowy Zn – Zn
2+
= -0.76 V
• T.t. = 419
o
C
• Łatwość obróbki metalurgicznej i mechanicznej
• Łatwo rozpuszczalne sole proste i kompleksowe, niska toksyczność
Zn – w większości popularnych ogniw pierwotnych
( - bez uwzglД™dnienia ogniw litowych)
Chemiczne ЕєrГіdЕ‚a prД…du
17
Ogniwa Zn/MnO
2
• Układ Leclanche’go – elektrolity obojętne lub lekko kwaśne:
reakcja anodowa – produktem sole Zn rozpuszczalne
w
elektrolicie
( NH
4
Cl, NH
4
OH, ZnCl
2
в†’ kompleksy Zn z OH
-
i Cl-)
• Układ alkaliczny – elektrolit stężony KOH:
reakcja anodowa – produktem stały ZnO – nie zmienia
siД™
skЕ‚ad roztworu
• Różnice w mechanizmie reakcji → różnice w wydajności ogniw :
maksymalna gД™stoЕ›Д‡ prД…du w ukЕ‚adzie alkalicznym
wyЕјsza
Chemiczne ЕєrГіdЕ‚a prД…du
18
Elektroda Zn
• Stała anoda : Zn – 2e
-
в†’ Zn
2+
(do roztworu) + 2e
-
в†’ Zn
osadzanie proszku, igieЕ‚ (в†’ specyfika procesu
elektrokrystalizacji metali)
Objętość elektrody ↑ kontakt elektryczny w obszarze anody ↓
• Anoda z proszku : Zn – 2e
-
в†’ ZnO ( w roztworze OH
-
) + 2e
-
в†’
Zn (jako proszek)
• Zn folia, blacha - złożona struktura (Zn + matryca
+ lepiszcze)
100% metalu jako energia - część elektrody „ nieczynna” jako
ЕєrГіdЕ‚o energii
Chemiczne ЕєrГіdЕ‚a prД…du
19
Katoda MnO
2
• Mn
IV
O
2
+ H
2
O ↔ Mn
III
O(OH) + OH
-
(inne zwiД…zki Mn
III
teЕј moЕјliwe)
• OH
-
bierze udział w reakcji anodowej – tworzenia
kompleksГіw Zn
• Przy zwiększaniu „poboru prądu” możliwe ograniczenia
szybkoЕ›ci reakcji anodowej z uwagi na niskie stД™Ејenie jonГіw
kompleksujД…cych
• Dotyczy „układu Leclanche’go” (sole Zn rozpuszczone w
elektrolicie)
Chemiczne ЕєrГіdЕ‚a prД…du
20
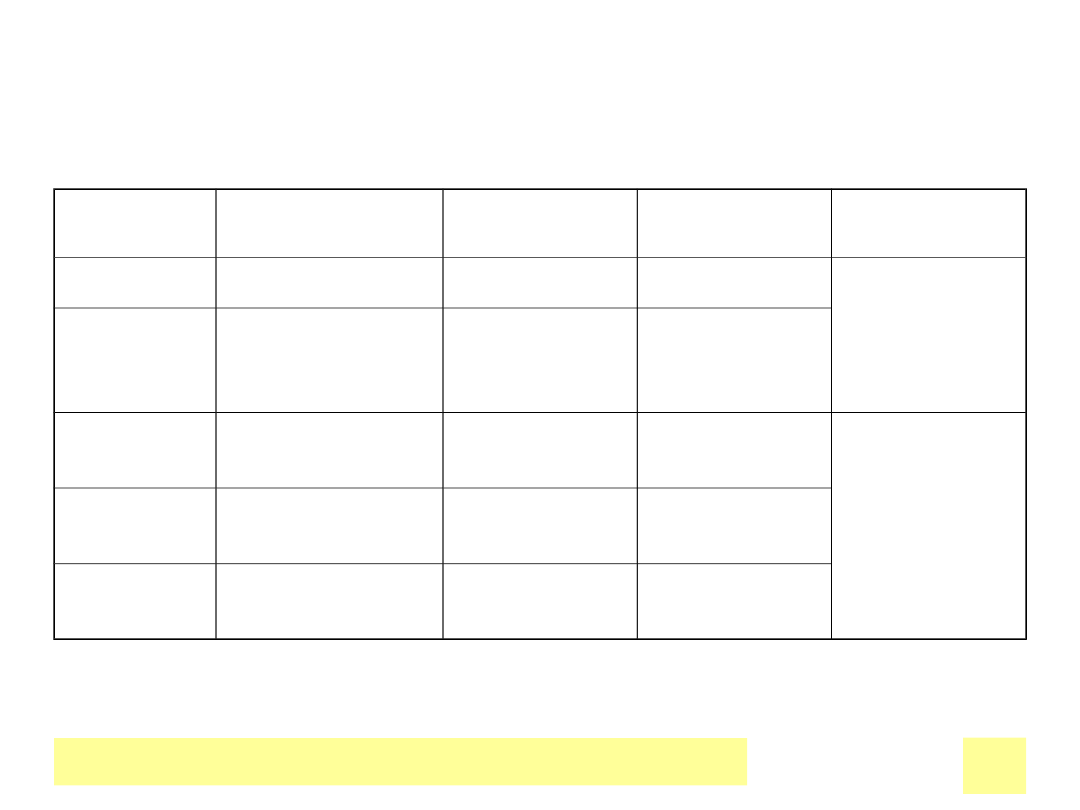
Ogniwa z anodД… Zn
Ogniwo
Katoda
Elektrolit
OCV lub SEM
(V)
Daniell
Cu в†’ Cu
2+
ZnSO
4
/CuSO
4
1.2
Produkt
anodowy –
rozpuszczal
ne sole
cynku
Leclanche MnO
2
в†’MnO(OH
)
NH
4
Cl, ZnCl
2
1.6
Alkali
MnO
2
в†’MnO(OH
)
KOH
1.55
Produkt
anodowy
-ZnO
Cynk-
powietrze
O
2
в†’ O
2-
(na
elektrodzie C)
KOH
1.45
Cynk-
srebro
Ag
2
O в†’ Ag
KOH
1.6

Chemiczne ЕєrГіdЕ‚a prД…du
21
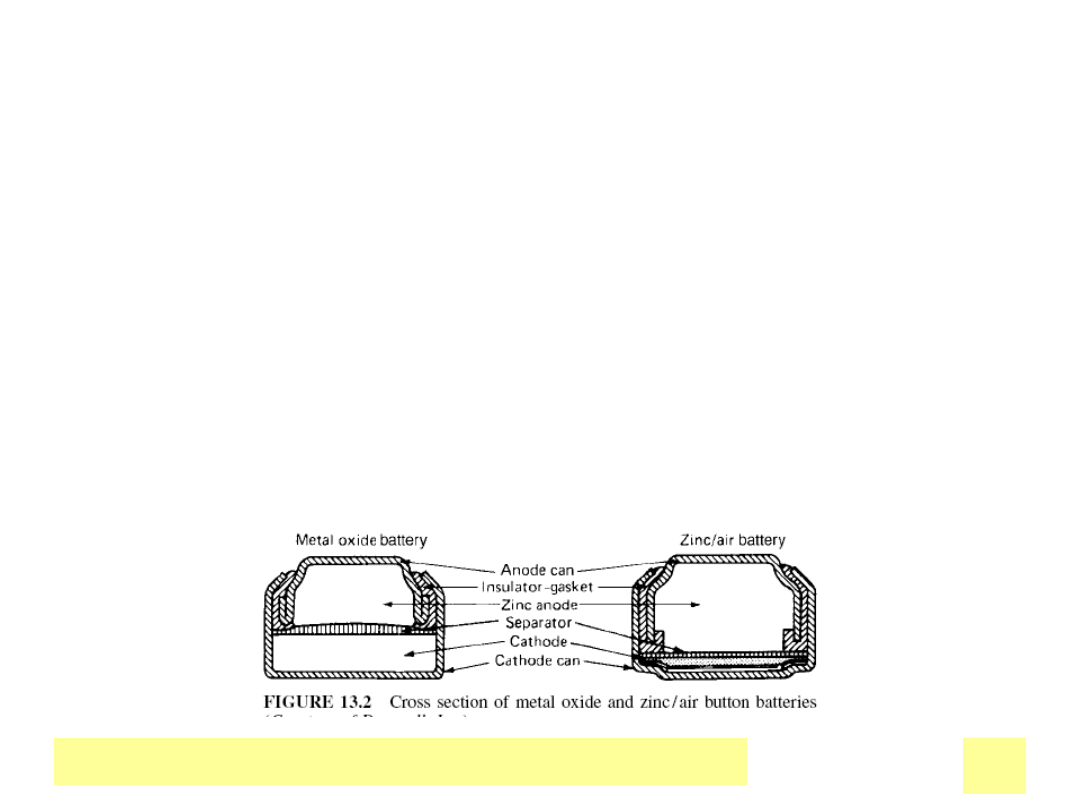
Ogniwa Zn/MnO
2
Chemiczne ЕєrГіdЕ‚a prД…du
22
Cynk - powietrze
• A : Zn → Zn
2+
(jako ZnO) + 4e
-
• C : O
2
+ 2 H
2
O + 4e
-
в†’ 4 OH
-
SEM = 1.65 V
• Reakcja katodowa na obojętnej elektrodzie ( grafit + katalizator +
lepiszcze)
• Dostawa tlenu wymuszana podciśnieniem w obszarze katody
• Powolna reakcja elektrody tlenowej – główne ograniczenie wielkości prądu
• Procesy przeszkadzające : Zn + O
2
OH-
+ CO
2
utrata wody

Chemiczne ЕєrГіdЕ‚a prД…du
23
Pojazdy elektryczne z ogniwami
•
Testy autobusów „zero-emission” - USA, Niemcy, programy europejskie
•
Wymienialna kaseta anodowa z Zn, jako elektrolit Ејelowany KOH
•
Ca. 200 Wh/kg and 90 W/kg przy 80% d.o.c.
•
Systemy hybrydowe, np. superkondensatory wspomagajД…ce przyspieszanie
•
Regeneracja anod poza pojazdem
Chemiczne ЕєrГіdЕ‚a prД…du
24
Jak uzyskać większe napięcie?
• Potencjały Redox dla par Me – Me
n+
• Specjalne warunki rozładowania
• Eliminacja wody
Zn-Zn
2+
-0.76 V
O
2
-OH
-
0.4 V
Mg-Mg
2+
-2.36 V
Ag
+
-Ag
0.8 V
Na-Na
2+
-2.92 V
MnO2-MnO(OH) app. 0.74 V
Li-Li
+
-3.05 V
F
2
– 2F
-
2.87 V
Roztwory niewodne
Synteza w atmosferze obojД™tnej
ogniwa rezerwowe
jednorazowe rozЕ‚adowanie
Chemiczne ЕєrГіdЕ‚a prД…du
25
Ogniwa zapasowe (aktywowane)
• Separowane elementy –
• Kontakt elektroda – elektrolit – na sygnał : zamknięcie obwodu wewnątrz
ogniwa
• Nie nadają się do przerywanego poboru energii
• Dłuuugi czas składowania (nie zachodzą reakcje uboczne i
samorozЕ‚adowanie)
• Dostawa energii – krótki czas, wysokie gęstości prądu
• Aktywacja na sygnał (decyzja) lub po zajściu wydarzenia (np. zalanie wodą)
Suche elektrody
elektrolit :
-zamkniД™ty w pojemniku
-sГіl do stopienia
Chemiczne ЕєrГіdЕ‚a prД…du
26
Ogniwa zapasowe - przykЕ‚ady
• Mg reakcje anodowe
Mg + 2 H
2
O
Mg(OH)
2
+ 2H
+
+ 2e Mg(OH)
2
+ H
2
(Mg pokryte MgO, Mg w kontakcie z wodД…,
proton rekombinuje z OH reakcja nie wnosi nic do
z przestrzeni katodowej) wielkoЕ›ci prД…du z ogniwa
• Zawsze biegną obie reakcje, na wydzielanie H
2
„marnuje się” część
elektrody, ALE
• Wydzielanie gazu
в†’
intensywne mieszanie
в†’
szybki transport
в†’
wysoka wartoЕ›Д‡ prД…du
Chemiczne ЕєrГіdЕ‚a prД…du
27
Ogniwa zapasowe - przykЕ‚ady
• Katody w ogniwach Mg :
• 2 AgCl + 2e → Ag + 2 Cl-
• 2 CuCl + 2e → Cu + 2 Cl-
• Inne proste sole : PbCl2 , CuSCN, Cu2I2
• Reakcja sumaryczna : Mg + PbCl
2
= MgCl
2
+ Pb
• Elektrolity : woda morska, proste sole (np. w ampułkach do
rozpuszczenia lub naniesiona na suche separatory
• konstrukcja: katody kompozytowe, mechaniczna separacja
elektrod, nasiД…kalne separatory,

Chemiczne ЕєrГіdЕ‚a prД…du
28
Zastosowania – baterie aktywowane
•Systemy ratownicze na wodzie i w powietrzu
•Boje sygnalizacyjne, sonarowe
•Wyposażenie tratw ratunkowych
•Różne sygnały i alarmy
•Sprzęt oceanograficzny, meteo itp.
•Inne, także militarne

Chemiczne ЕєrГіdЕ‚a prД…du
29
Podstawy – ogniwa pierwotne i wtórne
PIERWOTNE
WTГ“RNE
Nieodwracalne zuЕјycie elektrod
Odzysk elektrod – przez
dostarczenie energii el. Odtwarza
siД™ stan utlenienia i strukturД™
elektrody
Proces anodowy i katodowy
odnoszД… siД™ do konkretnej
elektrody, zachodzД… tylko raz
Reakcje kat. i anod. PowtarzajД…
siД™ przemiennie na obu
elektrodach w cyklu Е‚adowanie-
rozЕ‚adowanie
Elektrody metaliczne
(jednorazowe)
Produkty mogą być rozpuszczalne
w elektrolicie
Substraty i produkty pozostajД… w
fazie elektrody
Reakcje redox typu „all-solid
state”
Minimalizowanie zmian w
strukturze i ksztaЕ‚cie elektrod
Chemiczne ЕєrГіdЕ‚a prД…du
30
Podstawy – ogniwa pierwotne i wtórne
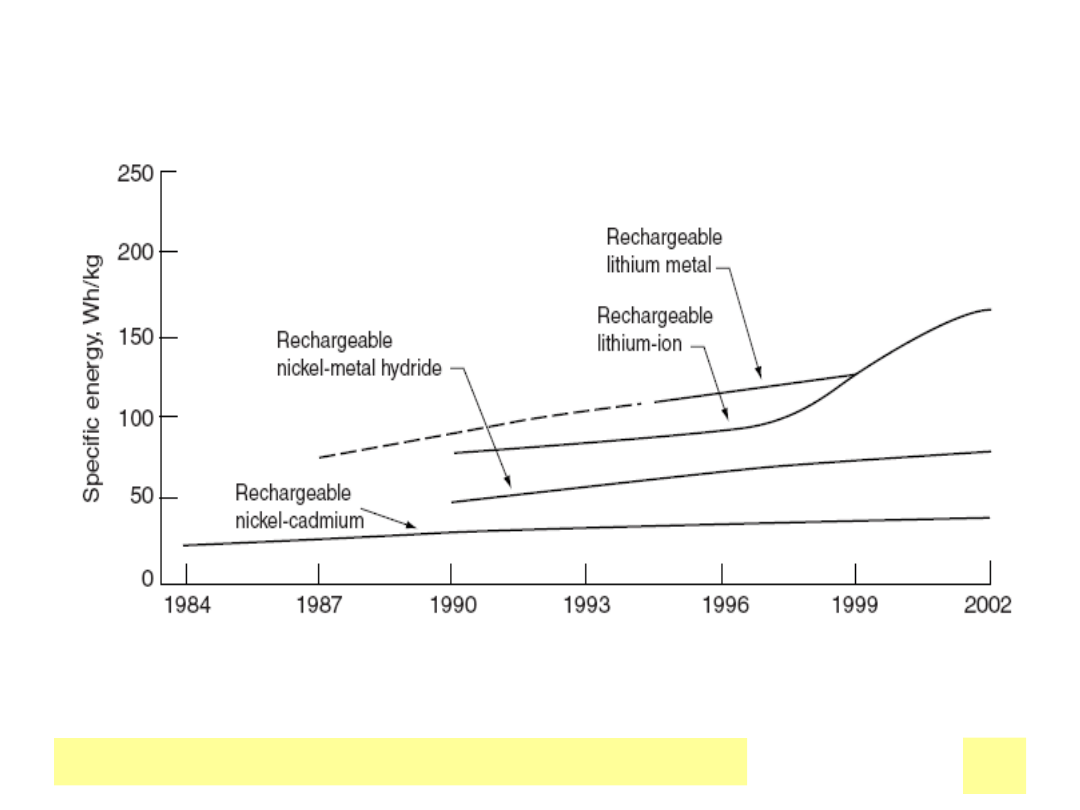
• Gęstość energii : od < 20 (Pb) , 35 (NiCd), 75 (NiMeH) do150
Wh/kg (Li-ion)
• Ilość cykli 220-700 (Pb) 500 – 2000 (Ni-Cd)
• Napięcie 2 V (Pb) 1.2 V (Ni-Cd)
• Płaska charakterystyka rozładowania
• Szybka utrata ładunku (przechowywanie Ni-Cd – w stanie rozład.,
Pb trzeba utrzymywać naładowane ze względu na zasiarczanie
pЕ‚yt)
• Stosowanie zaworów – wydzielanie H
2
/ O
2
przy przeЕ‚adowaniu, ale
moЕјliwe teЕј wydzielanie gazГіw przy b. gЕ‚Д™bokim rozЕ‚adowaniu
• Szczelne zamknięcie ogniw – rekombinacja tlenu ( tlen
wydzielajД…cy siД™ anodowo pod koniec Е‚adowania dyfunduje do
katody i utlenia nadmiar masy katodowej -- nie wytwarza siД™
nadciЕ›nienie gazu :
Chemiczne ЕєrГіdЕ‚a prД…du
31
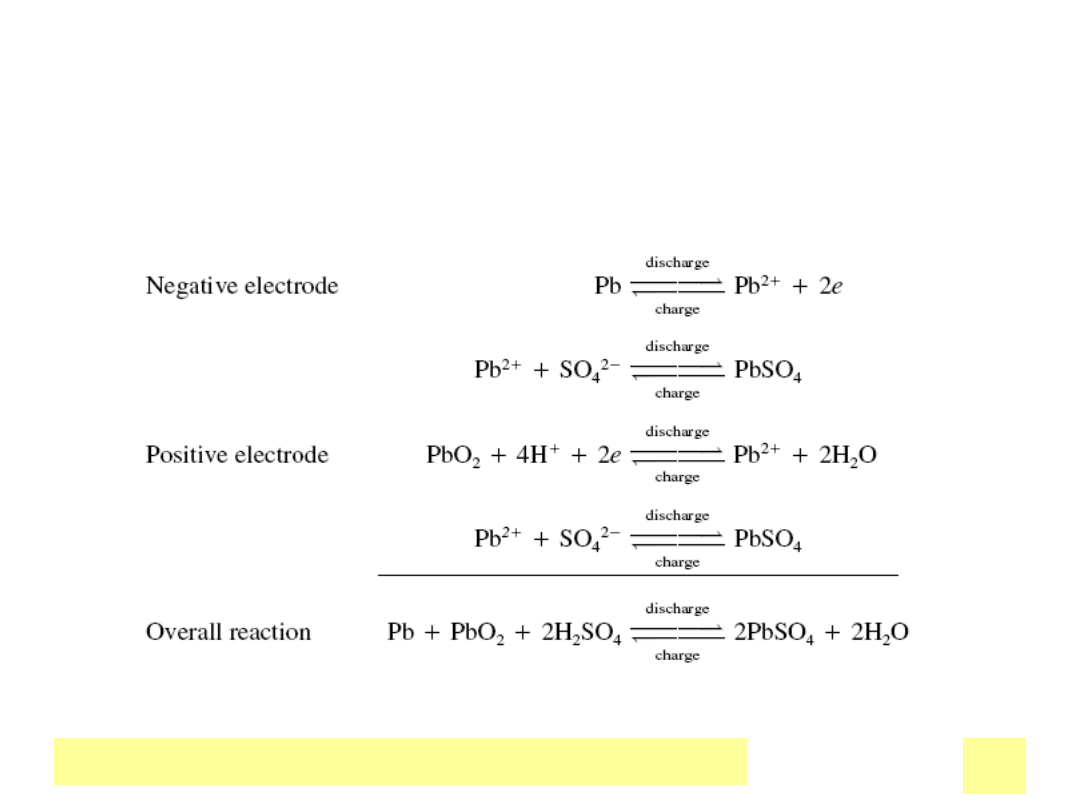
Chemiczne ЕєrГіdЕ‚a prД…du
32
Akumulator kwasowo-oЕ‚owiowy

Chemiczne ЕєrГіdЕ‚a prД…du
33
CYKL
„masa ujemna”
„masa dodatnia”
praca
Pb в†’ PbSO
4
(utlenianie)
StД™Ејenie H
2
SO
4
↓
PbO
2
в†’ PbSO
4
(redukcja)
StД™Ејenie H
2
SO
4
↓
ЕЃado
wanie
PbSO
4
в†’ Pb
(redukcja)
StД™Ејenie H
2
SO
4
↑
PbSO
4
в†’ PbO
2
(utlenianie)
StД™Ејenie H
2
SO
4
↑

Chemiczne ЕєrГіdЕ‚a prД…du
34
RozЕ‚adowanie akumulatora
• C
H2SO4
• PbSO
4
– izolator ( ok. 10
10
ОЏcm)
• V
mol PbSO4
> V
mol Pb, PbO2
porowatoЕ›Д‡
utrudnienia dyfuzji elektrolitu
R
wewn
Przy U = const szybko maleje J
Przy I = const szybko maleje U

Chemiczne ЕєrГіdЕ‚a prД…du
35
Akumulatory zasadowe
• Ni –Cd
, Ni – Fe,
Ni – MeH
( 1.2V)
Ag – Zn
( 1.5V)
Ni – Zn (1.6V)
• Katoda Ni
Ni
III
OOH + H
2
0 + e
-
Ni(OH)
2
+ OH
-
• Anoda Cd
Cd + 2(OH
-
) Cd(OH)
2
+ 2e
-
• Ag-Zn : Ag
2
O + H
2
O + 2e 2Ag + 2 OH
-
Zn + 2(OH
-
) Zn(OH)
2
+ 2e
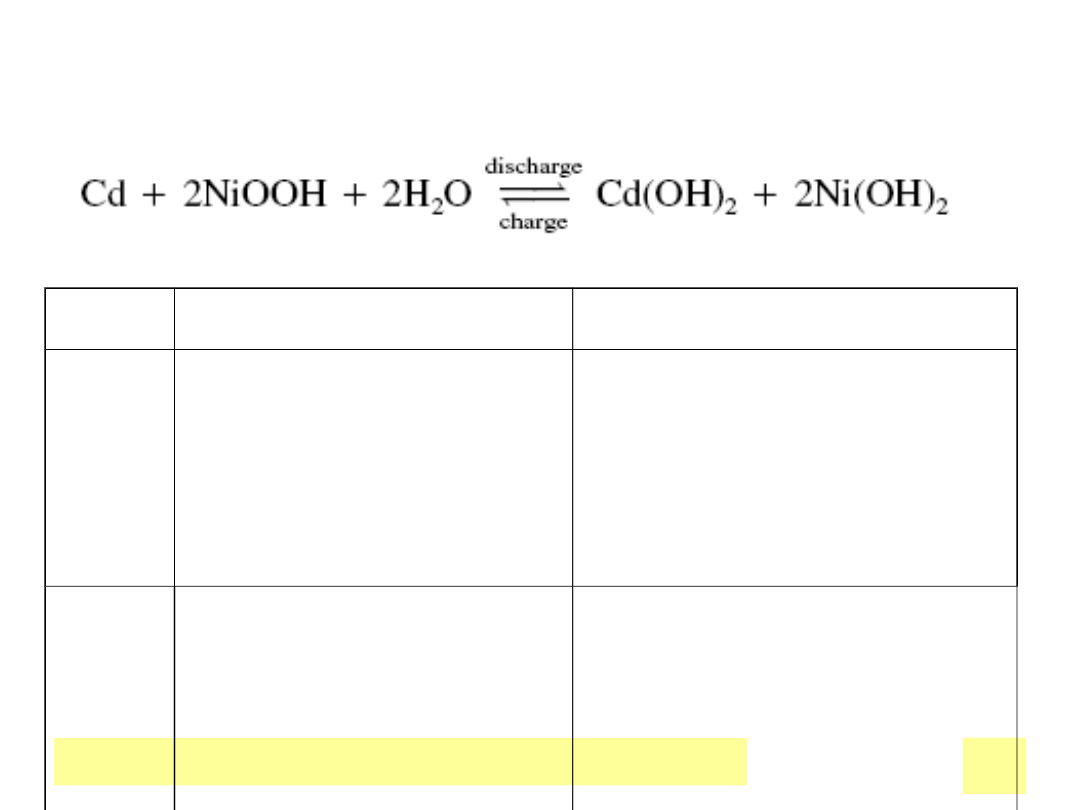
Chemiczne ЕєrГіdЕ‚a prД…du
36
Akumulator Ni-d
CYKL
„masa ujemna”
„masa dodatnia”
praca
Cd в†’ Cd(OH)
2
(utlenianie)
NiOOH в†’ Ni(OH)
2
(redukcja)
ЕЃado
wanie
Cd(OH)
2
в†’
(redukcja)
Ni
II
(OH)
2
в†’ Ni
III
OOH
(utlenianie)
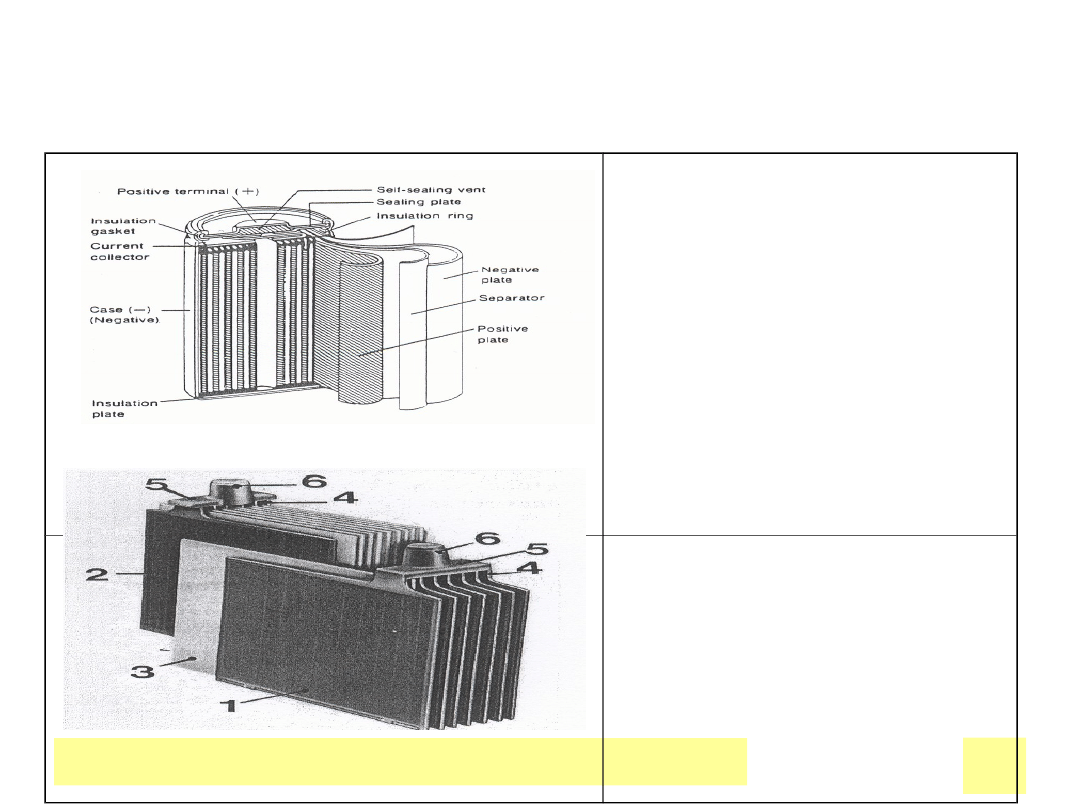
Chemiczne ЕєrГіdЕ‚a prД…du
37
Akumulatory
Ni-Cd
•Konstrukcja : Szyny
stalowe perforowane
napeЕ‚nione materiaЕ‚em
sypkim
•Płyty spiekane
Pb kwasowe
•Płyty pastowane
•Elektrody cylindryczne
•Elektrody w/g Plante’go
(Pb)

Chemiczne ЕєrГіdЕ‚a prД…du
38
Wydzielanie tlenu i wodoru na
elektrodach
• Reakcje możliwe w roztworach wodnych, niekorzystne dla pracy ogniw
• Potencjały równowagowe : E (H
+
/H
2
) = 0V , E (OH
-
/O
2
) = 0.4 V
• ALE – na różnych elektrodach występują nadpotencjały związane ze
zjawiskami na granicy faz elektroda - produkt gazowy
• Kierunek wzrastającego nadpotencjału wydzielania wodoru:
Pt - Ni - Ag - Zn - Cd - Pb(i zwiД…zki Pb)
• Pod koniec ładowania/rozładowania możliwe współwydzielanie gazów
• Konsekwencje: nadciśnienie wewnątrz akumulatora, gromadzenie
H
2
i
O
2
• „rekombinacja tlenu” – różnicowanie mas elektrod, np. m
Cd
> m
Ni
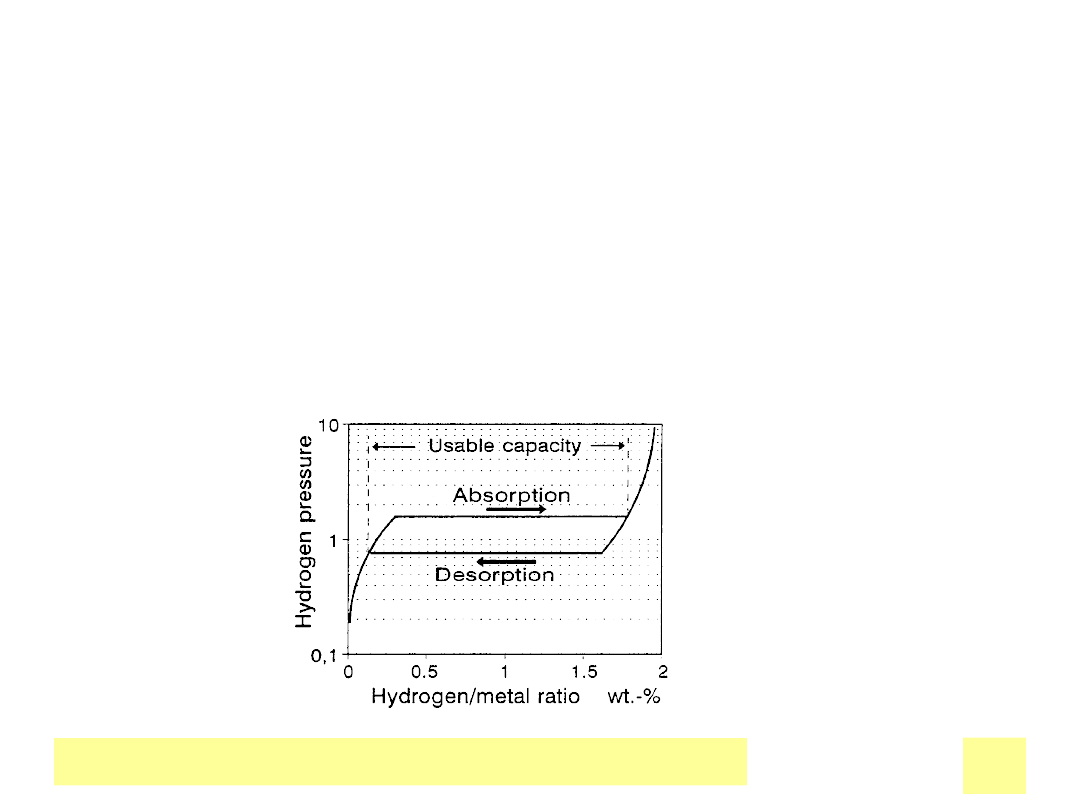
Chemiczne ЕєrГіdЕ‚a prД…du
39
Nikiel – wodorki metali
• Anoda : NiO(OH) + H
2
O + e в†’ Ni(OH)
2
+ OH
-
• Katoda : H
2
+ 2 (OH
-
) в†’ 2 H
2
O + 2e
• Wodór magazynowany jako wodorek w fazie metalicznej
• Pojemność elektrody wodorkowej ok. . 0.4 Ah/g -- porównywalna z
Cd i Ni w technologii pЕ‚yt spiekanych - 0.3-0.5 Ah/g
Chemiczne ЕєrГіdЕ‚a prД…du
40
Mechanizm reakcji na elektrodzie Me
ЕЃadowanie
RozЕ‚adowanie
PrzeЕ‚adowanie
Me-H
H
2
O
OH
-
OH
-
H2O
H2O
O
2
H
ads
H
2
H
ads
H
ads
OdwracalnoЕ›Д‡ reakcji elektrodowej, katalityczna adsorpcja H
I rekombinacja H-O
2

Chemiczne ЕєrГіdЕ‚a prД…du
41
Stopy absorbujД…ce wodГіr
(„wodorochłonne)
• A – metale tworzące stabilne wodorki
• B – słabe wodorki, , kataliza, odporność na korozję, sterowanie ciśnieniem
H
ads
Klasa
(baza)
SkЕ‚adniki
PojemnoЕ›Д‡
Ah/kg
Uwagi
AB
5
(LaNi
5
)
A: Mischmetall, La, Ce,
Ti
B: Ni, Co, Mn, Al
≈ 300
NajczД™Е›ciej
stosowane
AB
2
(TiNi
2
)
A: Zr, Ti
B: Ni, Fe, Cr, V
≈ 400
Stopy typu
„Ovonic”
• Nikiel - katalizator dysocjacji H
2
, wpЕ‚ywa na tworzenie wodorkГіw Zr, Ti, V
Chemiczne ЕєrГіdЕ‚a prД…du
42
Ogniwa litowe
Masa atomowa
LITHIUM
ZINC
PotencjaЕ‚ standardowy
(V)
-3.05
-0.76
Temp. topnienia (
o
C)
181
419
gД™stoЕ›Д‡ (kg/m
3
)
534
7100
RГіwnowaЕјnik elchem.
(Ah/g)
3.86
0.82
•Reaktywność litu: redukuje większość materiałów (np..
TeflonВ®)
•Stabilna pasywacja – warunek stabilności chemicznej
elektrody
•Co się dzieje z kationami Li – produktem procesu anodowego
Dlaczego nie zostawiamy nadmiaru litu w elektrolicie ( tak jak
np. cynku w ogniwie Leclanche’go)
•Transport i wykorzystanie w reakcji katodowej
Reakcja anodowa : Li = Li+ + 1e

Chemiczne ЕєrГіdЕ‚a prД…du
43
Anoda
Metaliczny Li (folia)
Interkalacja : Li – Li
+
w matrycy
Przy rozЕ‚adowaniu stabilna
warstwa pasywna
ЕЃadowanie : osad gД…bczasty,
dendryty, moЕјliwoЕ›Д‡ zwarcia
wewnętrznego – korozja świeżo
osadzonego litu
Zastosowanie – ogniwa
pierwotne
Ogniwa wtórne –
PrГіby z elektrolitami
polimerowymi
PojemnoЕ›Д‡: 3.86Ah/g, akum. < 1
Ah/g
MateriaЕ‚y wД™glowe : sadza, grafit
etc.
6 – 12 C atomów C przyjmuje 1
atom litu
Pierwszy cykl – tworzenie SEI
(Solid Electrolyte Interface)
CzД™Е›Д‡ litu tracona na reakcjД™ z
elektrolitem
NiektГіre zwiД…zki metali
przejЕ›ciowych majД… zdolnoЕ›Д‡ do
tworzenia soli z Li
+
PojemnoЕ›Д‡: 0.372 Ah/g
Chemiczne ЕєrГіdЕ‚a prД…du
44

Chemiczne ЕєrГіdЕ‚a prД…du
45
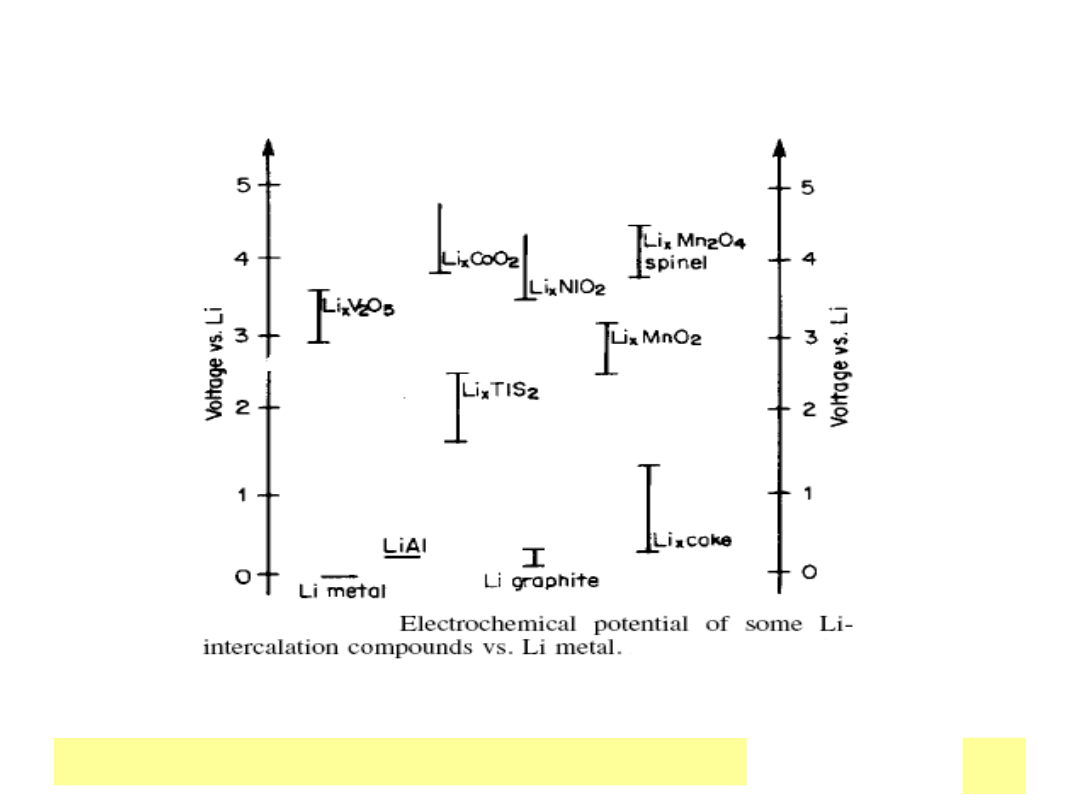
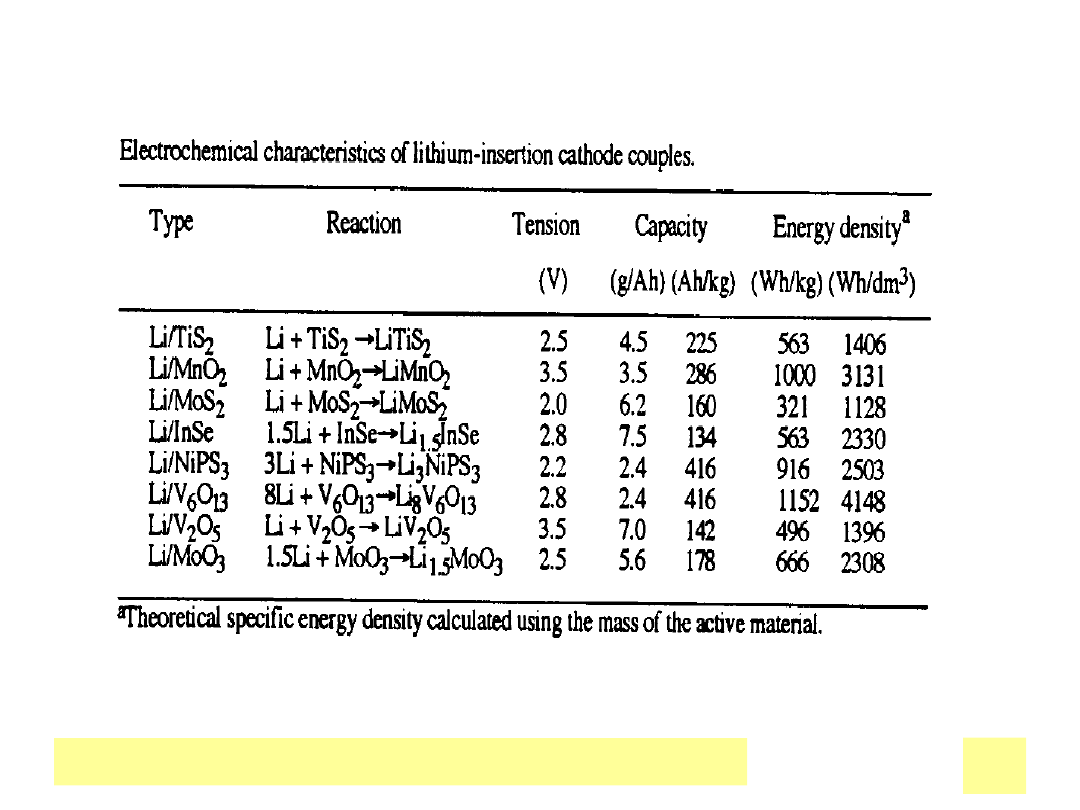
Katody
• Potencjały redox w zakresie 0 – 1 V ,, OCV ogniw 3 do 4 V
StaЕ‚e : Me
x
O
y
Redukcja jonu metalu do niЕјszego
stopnia utlenienia, np.. Mn
IV
O
2
–
Mn
III
O
2
Wbudowanie kationu Li
+
do
struktury
Reakcja topotaktyczna
Inne: V
2
O
5
, (CF)
n
, TiS
2
PojemnoЕ›ci: 0.31(MnO
2
), 0.86(CF)
Ah/g
Rozpuszczalne
SO
2
+ 2e в†’ S
2
O
4
2-
( w rozpuszczalniku + sГіl
litowa)
Chlorek tionylu:
SOCl
2
+ 4e в†’ S + SO
2
Chlorek sulfurylu
:
SO
2
Cl
2
+ 2e
в†’ SO
2
(rozpuszczalnik dla soli litowej)
Pojemności : ≈ 0.4 Ah/g
Chemiczne ЕєrГіdЕ‚a prД…du
46
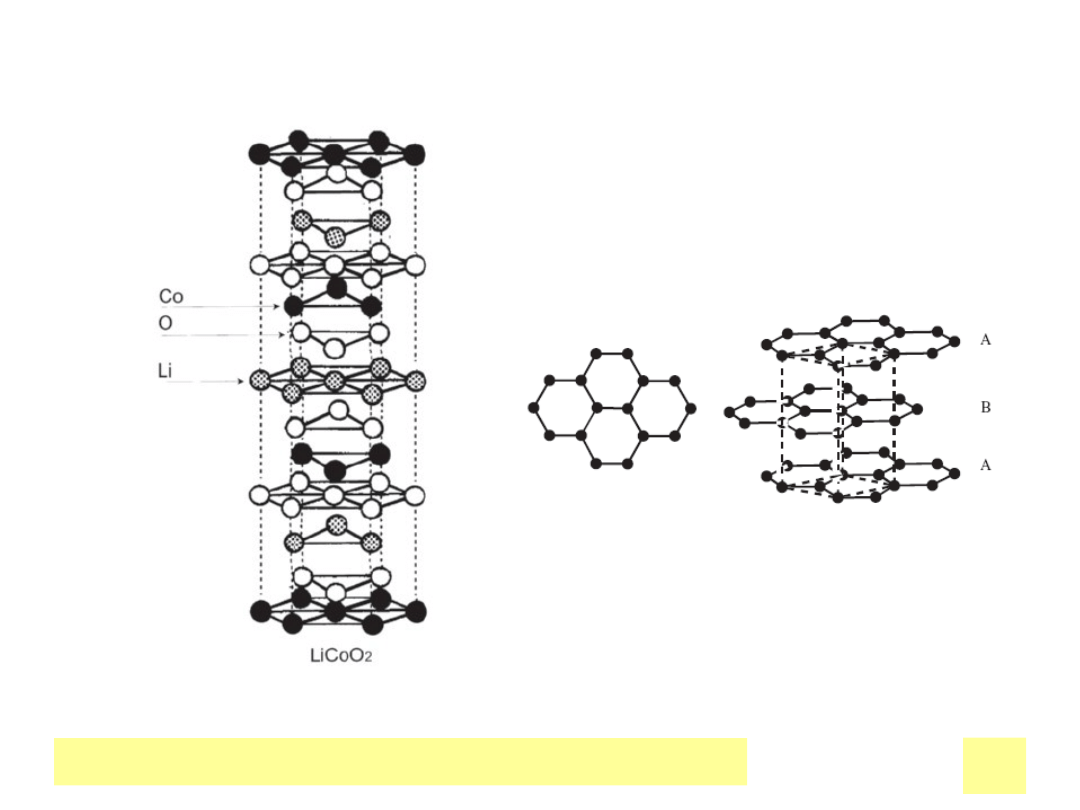
Chemiczne ЕєrГіdЕ‚a prД…du
47
Layered structure of LiCoO
2
Carbon layers in regular graphite
Chemiczne ЕєrГіdЕ‚a prД…du
48
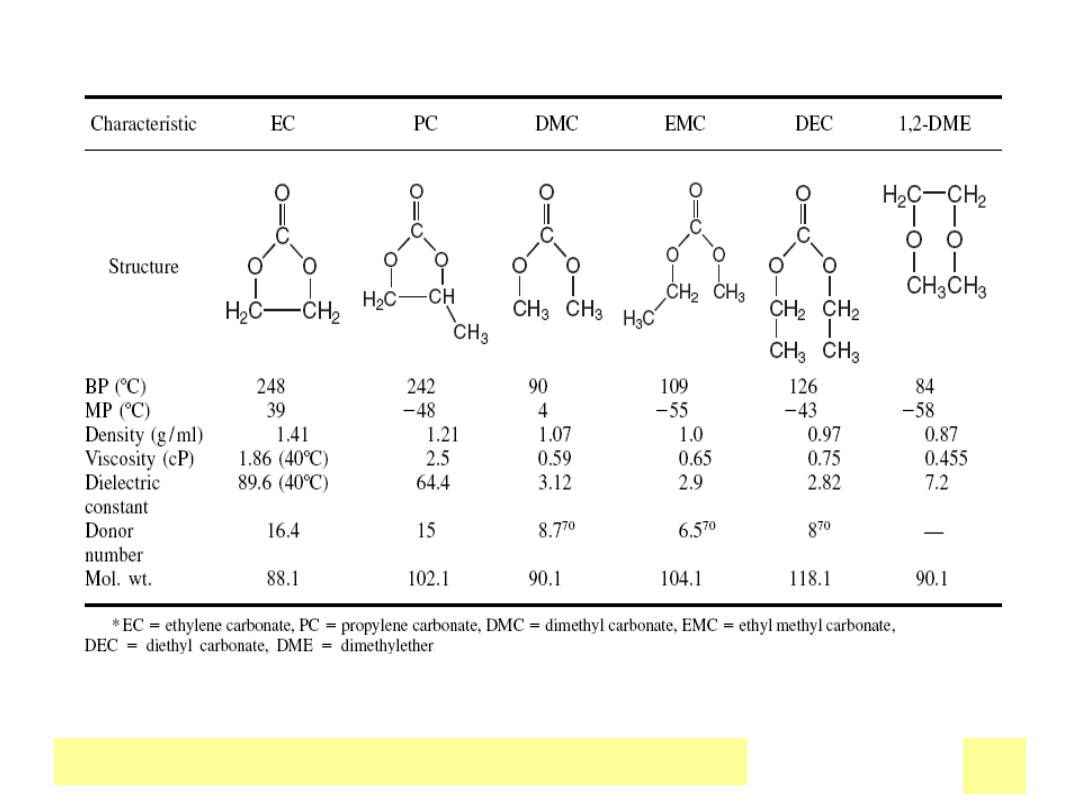
Elektrolity
przewodnictwo, liczba przenoszenia Li
+
StabilnoЕ›Д‡ elektrochemiczna i termiczna
CiekЕ‚e organiczne
•Aprotyczne
•Ochronna warstwa pasywna na Li
•Sole Li rozpuszczają się i dysocjują
•Cechy fizyczne i chemiczne:
stabilne, nietoksyczne, niepalne
•przewodnictwa ≈ 1e
-3
S/cm
Polimerowe
•Przewodzenie Li via
•Miejsca koordynacyjne na łańcuchu
•(np.. Poli(tlenek etylenu))
•Stałe folie, procesowalne
•Bardziej stabilne względem Li
•Przewodnictwa : 1e
-7
–1e
-4
S/cm
Е»elowe
2 w 1 : matryca z obojД™tnego polimeru, unieruchomiony w porach elektrolit ciekЕ‚y

Chemiczne ЕєrГіdЕ‚a prД…du
49
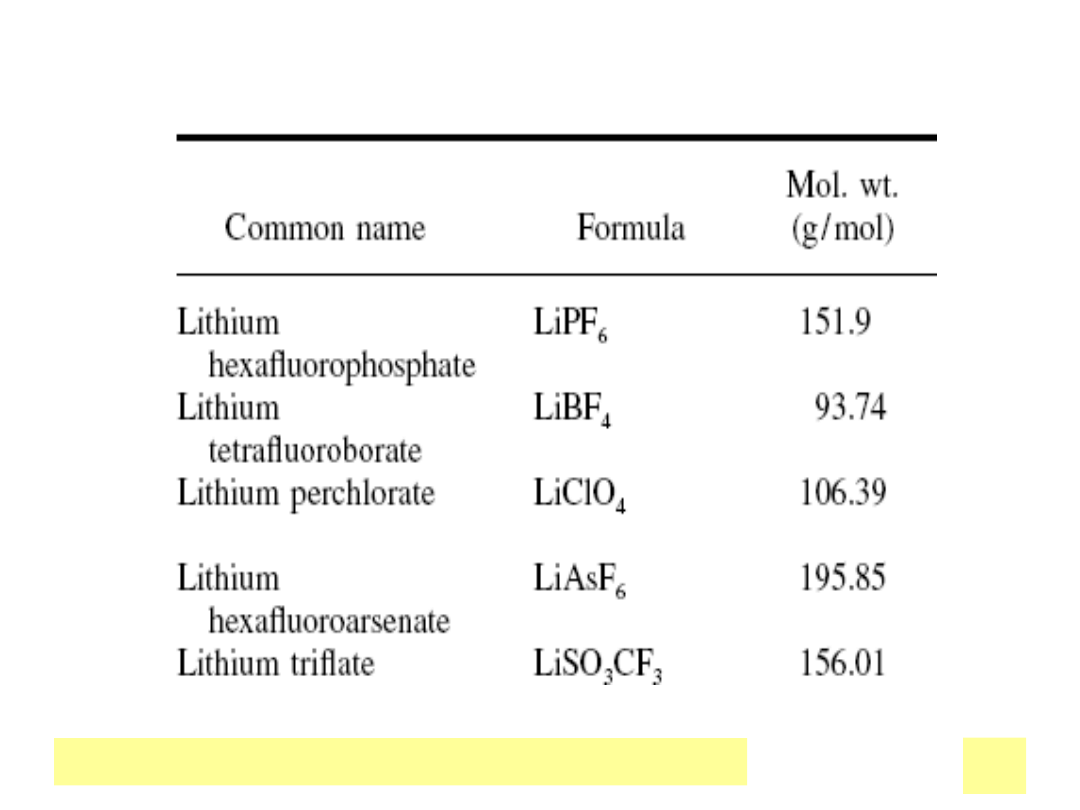
RoztwГіr
Przewodnictwo jonowe (20
o
C)
(S/cm)
1M H
2
SO
4
10
-1
NafionВ®folia
(H
+
)
10-2
1M LiBF
4
w
acetonitrylu
10
-3
Kompleks PEO-
LiClO
4
10
-5
Chemiczne ЕєrГіdЕ‚a prД…du
50
Chemiczne ЕєrГіdЕ‚a prД…du
51
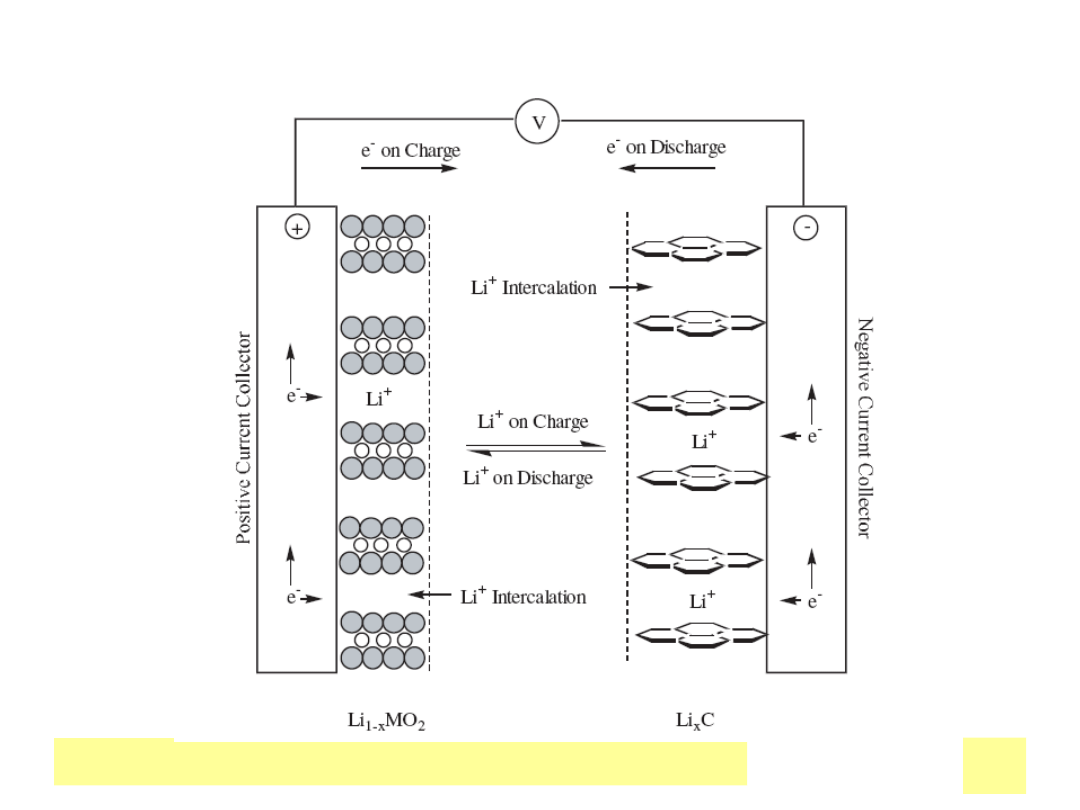
Chemiczne ЕєrГіdЕ‚a prД…du
52
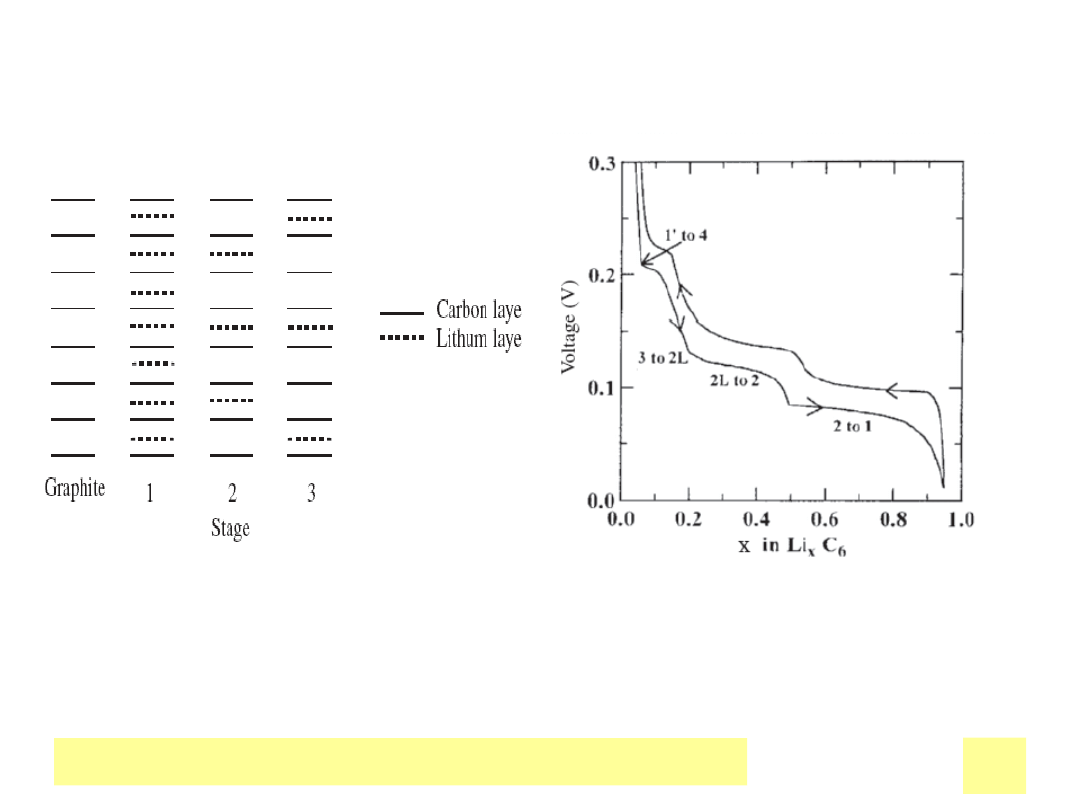
Chemiczne ЕєrГіdЕ‚a prД…du
53
Stopniowa interkalacja Li do grafitu, obserwowana jako plateaux napiД™cia
Chemiczne ЕєrГіdЕ‚a prД…du
54
Parametry
• SEM lub OCV
• Napięcie startowe ( nominalne)
• Napięcie końcowe
• Pojemność teoretyczna
• Pojemność „użytkowa” (rated capacity)
• Masowa i objetościowa gęstość energii
• Czas składowania, czas utrzymania ładunku
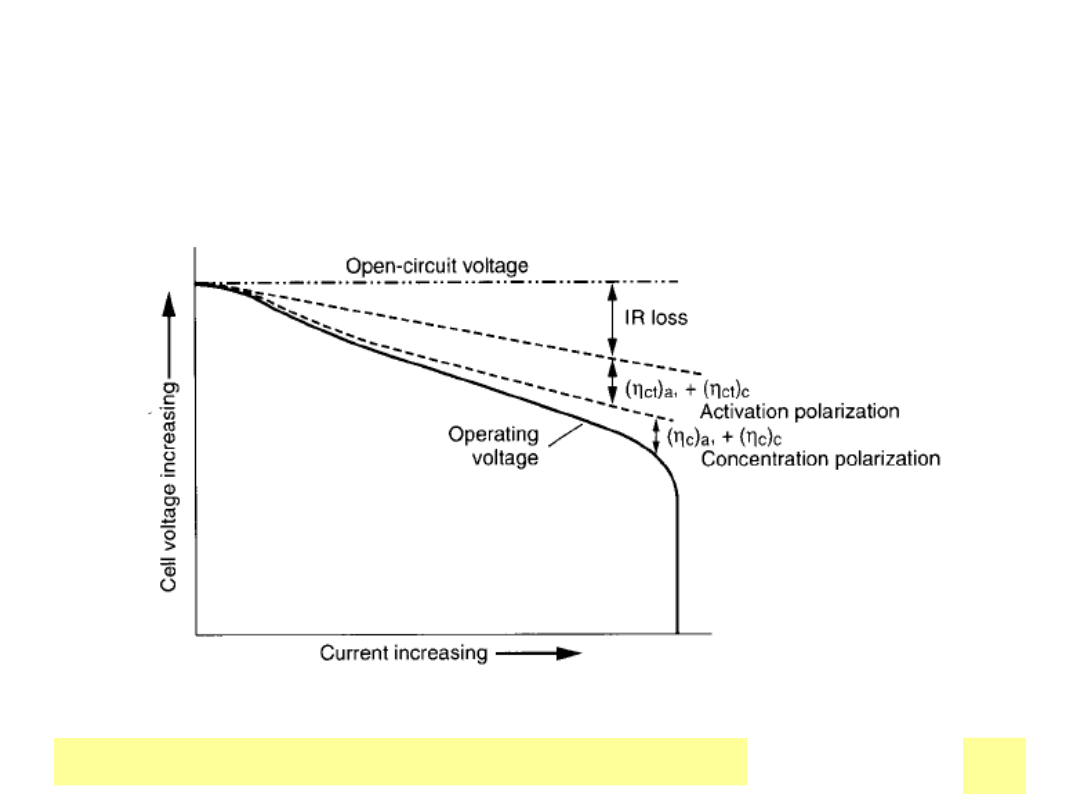
Chemiczne ЕєrГіdЕ‚a prД…du
55
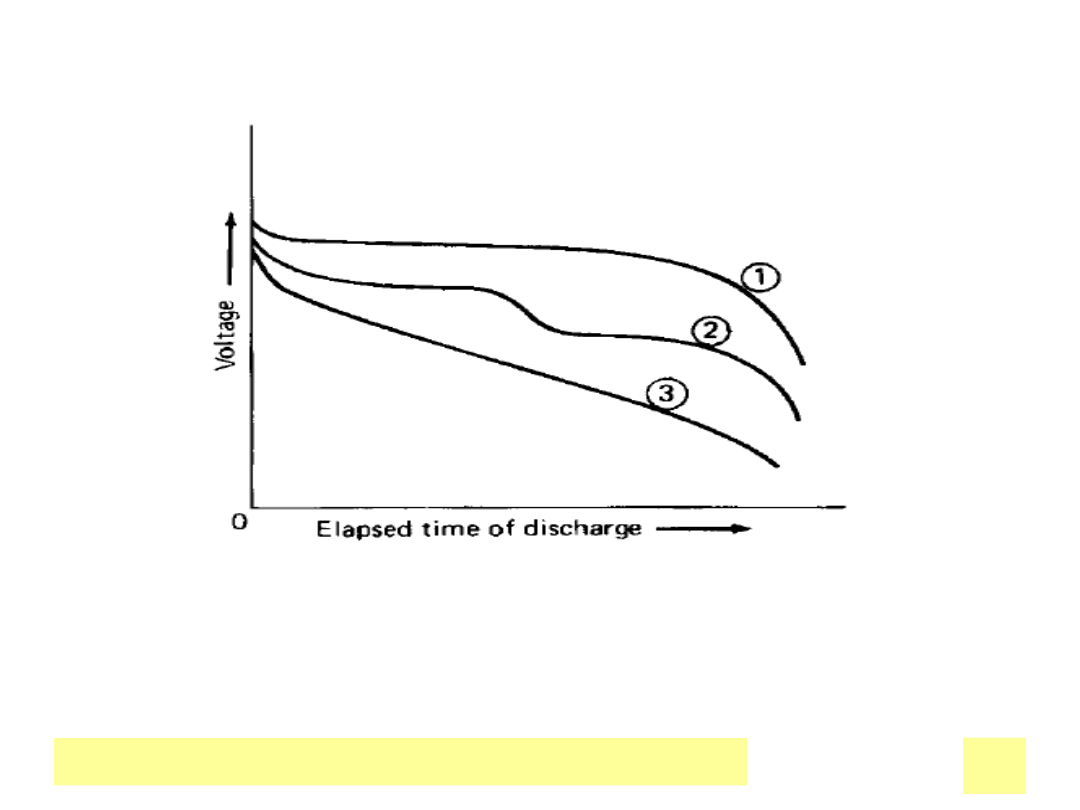
• Rozładowanie ogniwa – charakterystyka prąd – napięcie
Chemiczne ЕєrГіdЕ‚a prД…du
56
NapiД™ciowe profile rozЕ‚adowania
1. płaski – przemiana el-chem. nie wpływa na właściwości elektr.
2. zmienny – zmiany w mechaniźmie r-cji wpływające na potencjały
3. staЕ‚e nachylenie - ciД…gЕ‚a zmiana wielkoЕ›ci wpЕ‚ywajД…cej na char.
elektr.
Chemiczne ЕєrГіdЕ‚a prД…du
57
Ogniwa paliwowe
• Reagenty doprowadzane strumieniem do obojętnych
chemicznie elektrod
• Tlen – wodór lub tlen – inne paliwo (reduktor)
• Sumaryczna reakcja – tworzenie wody lub wody i dwutlenku
wД™gla
• W reakcje na elektrodach wchodzą substraty gazowe,
doprowadzane poprzez objД™toЕ›Д‡ elektrody do granicy faz
elektroda-elektrolit
• Gazowe substraty nie powinny dyfundować przez elektrolit do
elektrody przeciwnej
Chemiczne ЕєrГіdЕ‚a prД…du
58
2H2 в†’ 4H+ + 4eв€’
O2 + 4eв€’ + 4H+ в†’
2H2O
2H2 + O2 в†’ 2H2O
2H2 + 4OHв€’ в†’ 4H2O + 4eв€’
O2 + 4eв€’ + 2H2O в†’ 4OHв€’
Elektrolit kwasowy
Elektrolit zasadowy
SEM = 1.2 V (w temp. pokojowej)
Chemiczne ЕєrГіdЕ‚a prД…du
59
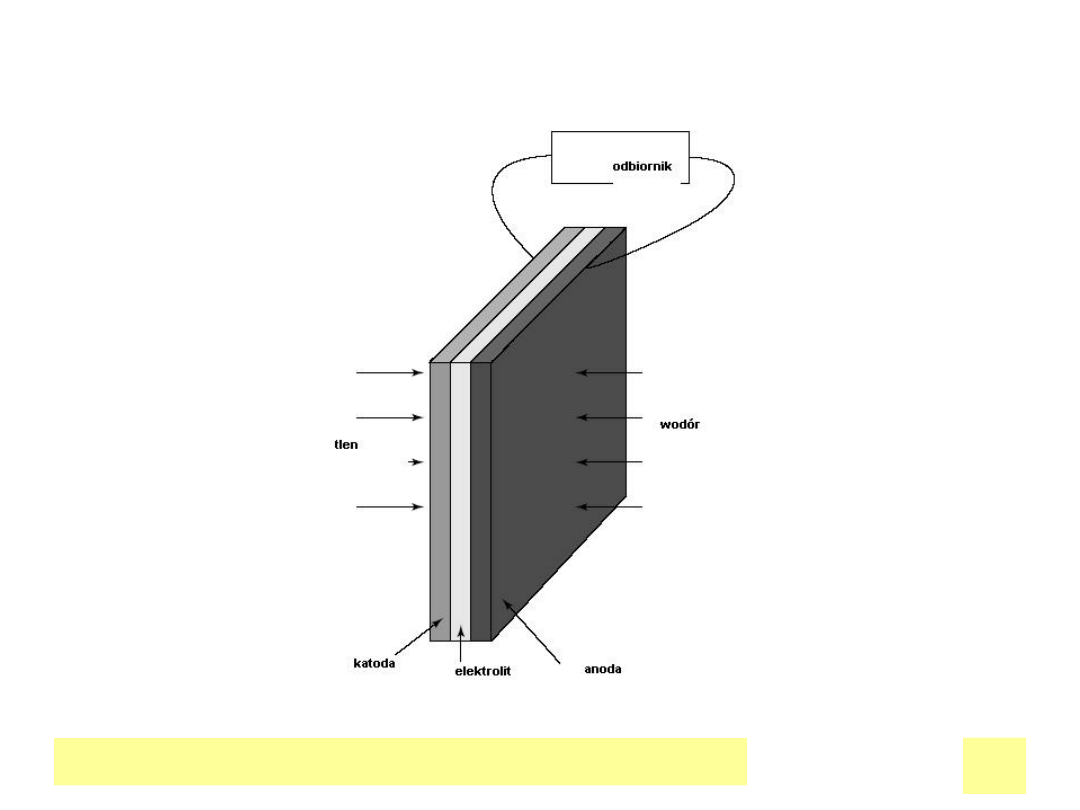
Schemat ogniwa paliwowego
Chemiczne ЕєrГіdЕ‚a prД…du
60
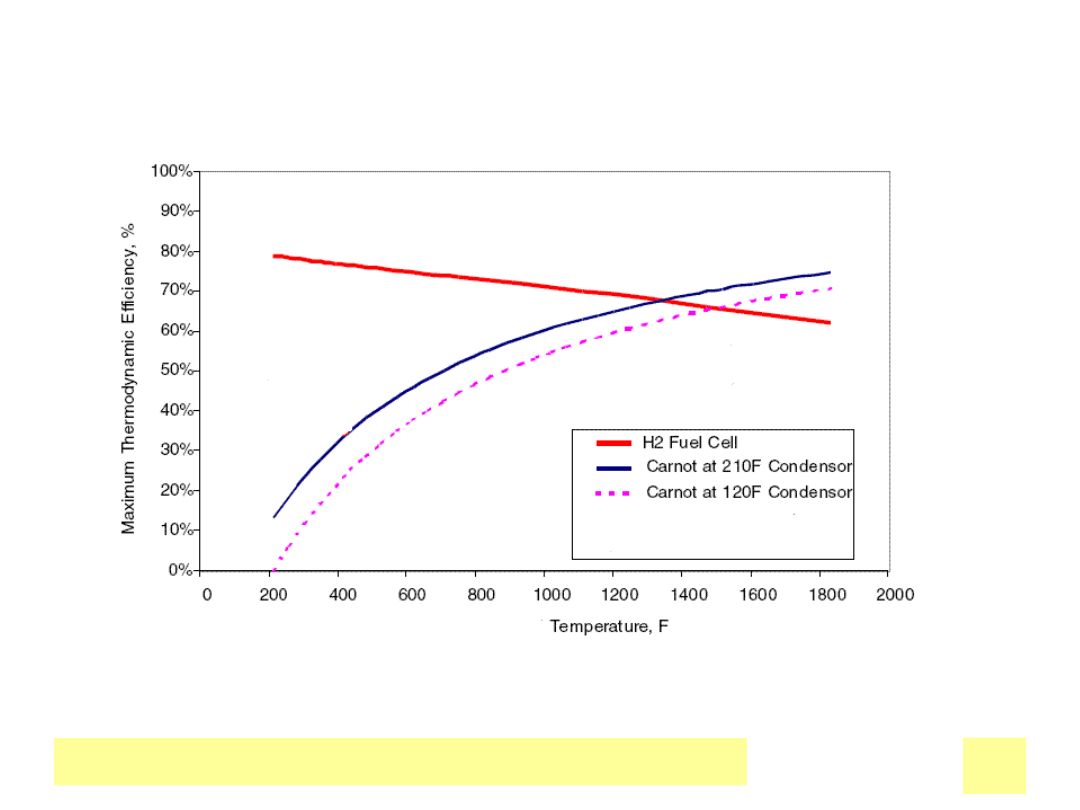
PorГіwnanie wydajnoЕ›ci cyklu Carnota z ogniwem paliwowym
WydajnoЕ›Д‡ termodynamiczna
Chemiczne ЕєrГіdЕ‚a prД…du
61
PEMFC
AFC
PAFC
MCFC
SOFC
Typ elektrolitu
H
+
(aniony
zwiД…zane z
membranД…
polimerowД…)
OH
-
(zwykle wodny
roztwГіr KOH)
H
+
(roztwГіr
H3PO4)
CO
3
2-
(zwykle
eutektyk
LiKaCO
3
)
O
2
2-
(matryca
ceramiczna
zawierajД…ca
wolne jony
tlenkowe)
WewnД™trzny
reforming
Nie
Nie
nie
Tak (stosowna
temperatura)
Tak
(stosowna
temperatura)
Utleniacz
Powietrze, O
2
Czyste
powietrze, O
2
Powietrze,
pow.
wzbogacone
Powietrze
powietrze
Temperatura
pracy (
o
C)
65 – 85
90 – 260
190 – 210
650 – 700
750 - 1000

Chemiczne ЕєrГіdЕ‚a prД…du
62
Ogniwa alkaliczne
zastosowane
w misji Apollo
2 jednostki po 1.5 kW
dostarczaЕ‚y energiД™ elektr. i
znacznД… czД™Е›Д‡ wody pitnej
Chemiczne ЕєrГіdЕ‚a prД…du
63
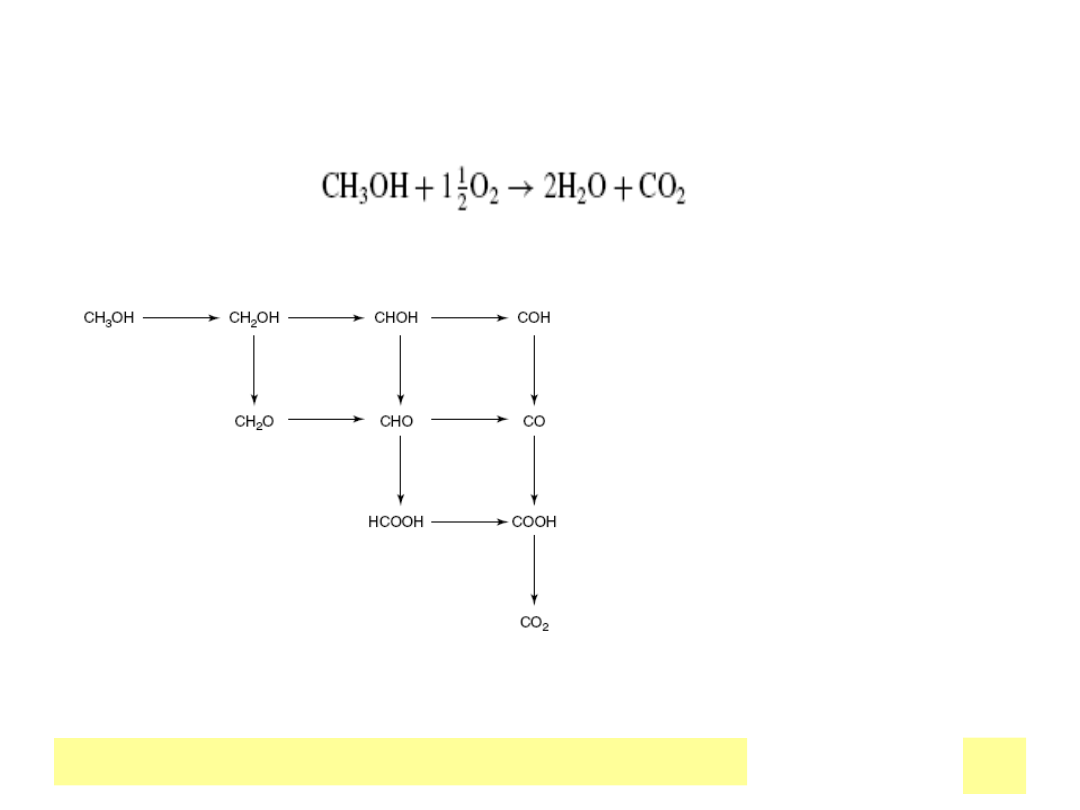
Metanol w ogniwie
paliwowym
Katalizatory:
Pt/Ru na matrycy C
Ok. 2 mg/cm
2
( w ogniwach wodorowych
ok. 0.2)

Chemiczne ЕєrГіdЕ‚a prД…du
64
Zasilanie wodorem :
Czysty wodГіr lub wodГіr z reformingu:
CnHm + n H2O в†’ n CO + (m/2 + n) H2
CO – „trucizna” katalizatora Pt na poziomie 50 ppm
W gazie po reformingu CO rzД™du 1000 ppm !!
Tzw. dodatkowy reforming parowy
CO + H2O в†’ CO2 + H2
Szkic struktury elektrody z
katalizatorem Pt
naniesionym na drobiny
grafitu
Włókna – matryca
polimerowa
Chemiczne ЕєrГіdЕ‚a prД…du
65
Ogniwa fotowoltaiczne
przemiana energii promieniowania
elektromagnetycznego w energiД™
elektrycznД…
podstawa – zjawisko fotowoltaiczne – powstawanie różnicy
potencjaЕ‚Гіw na styku materiaЕ‚Гіw o rГіЕјnych wЕ‚aЕ›ciwoЕ›ciach
elektrycznych –
na złączu p-n lub złączu Schottky’ego
Istota zjawiska - w obszarze fizyki ciaЕ‚a staЕ‚ego,
w szczegГіlnoЕ›ci materiaЕ‚Гіw o wЕ‚asnoЕ›ciach pГіЕ‚przewodzД…cych.
zastosowanie – baterie słoneczne
Chemiczne ЕєrГіdЕ‚a prД…du
66
Uproszczony opis zjawiska :
•absorpcja kwantu energii przez materiał o strukturze pasmowej
•(PASMA ENERGETYCZNE... itd.)
•może powstać para elektron-dziura,
•przejście elektronu z pasma podstawowego do pasma
przewodnictwa
•stan nietrwały – czas życia nośnika (podawany jako tzw.
swobodna droga dyfuzji), zaleЕјny od struktury materiaЕ‚u,
•rekombinacja, efekt zaabsorbowanej energii ►
•rozproszenie po sieci krystalicznej
! jeЕјeli noЕ›nik Е‚adunku powstanie w pobliЕјu zЕ‚Д…cza p-n
moЕјliwe jego przejЕ›cie do obszaru drugiej czД™Е›ci zЕ‚Д…cza
przed upЕ‚yniД™ciem czasu Ејycia !
Chemiczne ЕєrГіdЕ‚a prД…du
67
W stanie rozwartego obwodu powstaje na zЕ‚Д…czu
napiД™cie,
po zamkniД™ciu obwodu popЕ‚ynie prД…d в–є ogniwo
Napięcia rzędu 0.5 – 1 V z pojedynczych ogniw
Realizacja techniczna ogniwa
cienka warstwa pГіЕ‚przewodnika typu p wystawiona na
dziaЕ‚anie promieniowania sЕ‚onecznego,
wytworzona na warstwie „spodniej:” półprzewodnika
typu n lub metalu,
gruboЕ›Д‡ warstwy absorbujД…cej mniejsza niЕј swobodna
droga dyfuzji w danym materiale
Chemiczne ЕєrГіdЕ‚a prД…du
68
Jak siД™ majД… materiaЕ‚y
pГіЕ‚przewodnikowe do energii
przesyЕ‚anej nam ze SЕ‚oneczka?
E
foton
= h . ОЅ = h . c / О»
podstawiajД…c szybkoЕ›Д‡ Е›wiatЕ‚a i wartoЕ›Д‡ staЕ‚ej Plancka
przybliЕјamy
E = 1.24 / О» , gdzie О» w Ојm
Chemiczne ЕєrГіdЕ‚a prД…du
69
Widmo SЕ‚oЕ„ca a przerwa energetyczna
• E kwantu odnosimy do szerokości przerwy energ. w
pГіЕ‚przewodniku
• Zakres promieniowania widzialnego : ok.. 1.6 eV (czerwone)
– ok.. 3,3 eV (fiolet)
• Niektóre wartości E
g
: Si – 1.1eV Ge - 0.7 eV AsGa -
1.43eV GaP - 2.2 eV InAs – 0.36eV
• W jednym materiale
- wykorzystujemy czД™Е›Д‡ promieniowania o E
foton
> E
g
- z kaЕјdego kwantu wykorzystujemy energiД™ rГіwnД… E
g
,
nadwyЕјka tracona na rozpraszanie cieplne po
sieci
krystalicznej materiaЕ‚u
Chemiczne ЕєrГіdЕ‚a prД…du
70
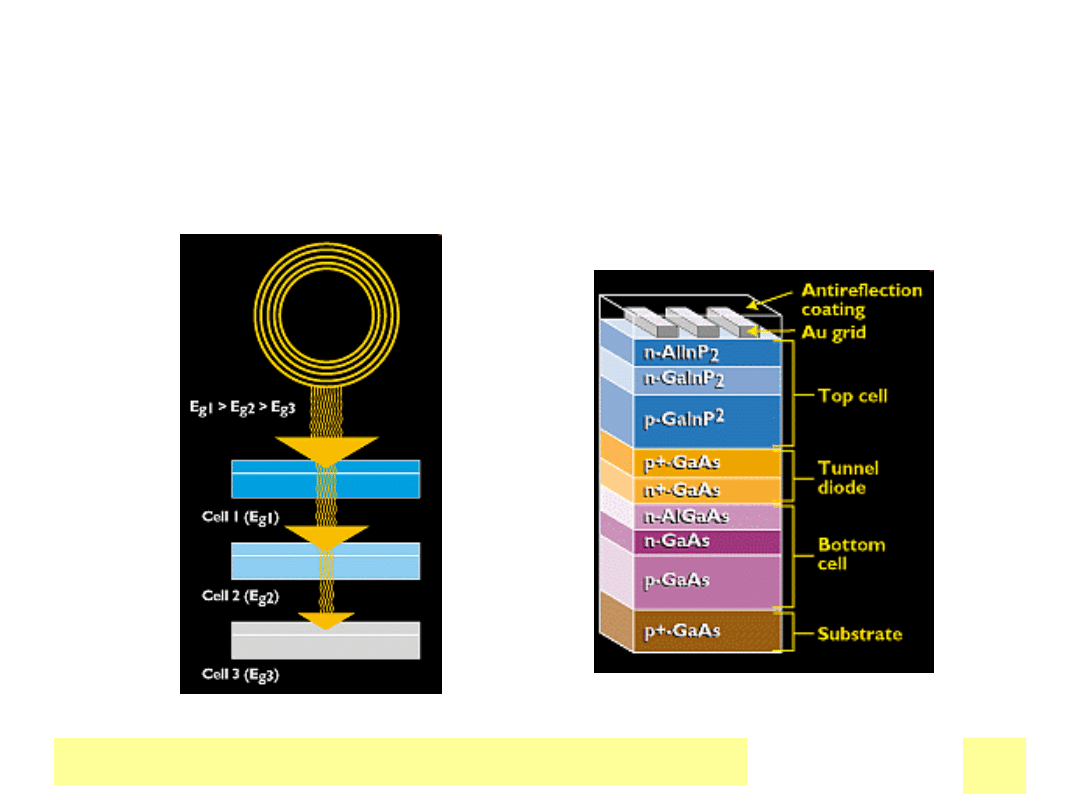
Ogniwa PV wielozЕ‚Д…czowe
Chemiczne ЕєrГіdЕ‚a prД…du
71
WydajnoЕ›Д‡ konwersji
energii w ogniwach PV
w zaleЕјnoЕ›ci od materiaЕ‚u
Amorficzny krzem (c.w.) 6%
Polikrystaliczny krzem (pЕ‚ytki)14-
16%
WielozЕ‚Д…czowe (lab) 42%
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
Wyszukiwarka
Podobne podstrony:
ЕЃД…cznoЕ›c 6 Chemiczne ЕєrГіdЕ‚a prД…du elektrycznego, Konspekty, ЕЃД„CZNOЕљД† (marianoitalianooo)
Chemiczne ЕєrГіdЕ‚a prД…du
Chemiczne ЕєrГіdЕ‚a prД…du
chemiczne zrodla pradu
Е№RГ“DЕЃA PRД„DU ELEKTRYCZNEGO
lab zrodla pradu
ЕєrГіdЕ‚a prД…du i napiД™cia
sprawdzone, FIZ 50, ObwГіd wyidealizowany. Do biegunГіw A i B ЕєrГіdЕ‚a prД…du zmiennego przyЕ‚Д…czony jest
Е№rГіdЕ‚a prД…du
Spawalnicze zrodla pradu - sprawko, Uczelnia, Technologia Spajania
Chemiczne ЕєrГіdЕ‚a energii elektrycznej Ogniwa galwaniczne
Laboratoryjne ЕєrГ
wiД™cej podobnych podstron