

Po co to wszystko?
Po co to wszystko?
Coraz większe zanieczyszczenie środowiska,
efekt cieplarniany, zmniejszające się zasoby
paliw nieodnawialnych to światowe problemy,
dlatego należy właściwie gospodarować
zasobami energii. Naprzeciw wychodzą
chemiczne źródła prądu. Obserwuje się rozwój
prac nad konstrukcją akumulatorów niklowo-
wodorkowych oraz litowo-jonowych. Również
koncepcja ogniw paliwowych ewoluuje.
Prawdopodobnie ekologiczne samochody
napędzane za pomocą ogniw paliwowych
zastąpią stare, o niskiej sprawności silniki
benzynowe.
Chemiczne źródła prądu
Chemiczne źródła prądu
Ogniwa
Ogniwa
Galwaniczne
Galwaniczne
Paliwowe
Paliwowe
•
Nieodnawialne
Nieodnawialne
(popularne baterie)
(popularne baterie)
•
Odnawialne
Odnawialne
(akumulatory)
(akumulatory)
•
z membraną do wymiany
z membraną do wymiany
protonów
protonów
•
odwracalne ogniwo paliwowe
odwracalne ogniwo paliwowe
•
bezpośrednie ogniwo metanolowe
bezpośrednie ogniwo metanolowe
•
z zestalonym elektrolitem
z zestalonym elektrolitem
tlenkowym
tlenkowym
•
ze stopionym węglanem
ze stopionym węglanem
•
z kwasem fosforowym
z kwasem fosforowym
•
alkaliczne ogniwo paliwowe
alkaliczne ogniwo paliwowe

Początki ogniw
Początki ogniw
galwanicznych
galwanicznych
W siedemdziesiątych latach XVIII wieku Lugiego
Galvanii badał wpływ prądu elektrycznego na reakcje
mięśni spreparowanych udek żab. Stwierdził że udka żabie
ulegają skurczom po dotknięciu ich, z obu końców, prętami
wykonanymi z różnych metali.
Odkryciami Galvaniego zainteresował się fizyk
Alessandro Volta, który zamiast udek żabich do swoich
badań użył elektrolitu (wody morskiej), w której zanurzone
były elektrody wykonane z dwóch różnych metali.
Wywnioskował, że przyczyną skurczów żabich ciał było
zamknięcie obwodu stykających się ze sobą metali przez
wilgotną tkankę mięśniową żab. Volt do zamykania obwodu
używał wody morskiej, a później kawałka filcu nasyconego
kwasem siarkowym (VI) i po wstawieniu do między dwie
płytki różnych metali stwierdził za pomocą elektroskopu, że
między obiema płytkami wytwarza się napięcie
elektryczne.
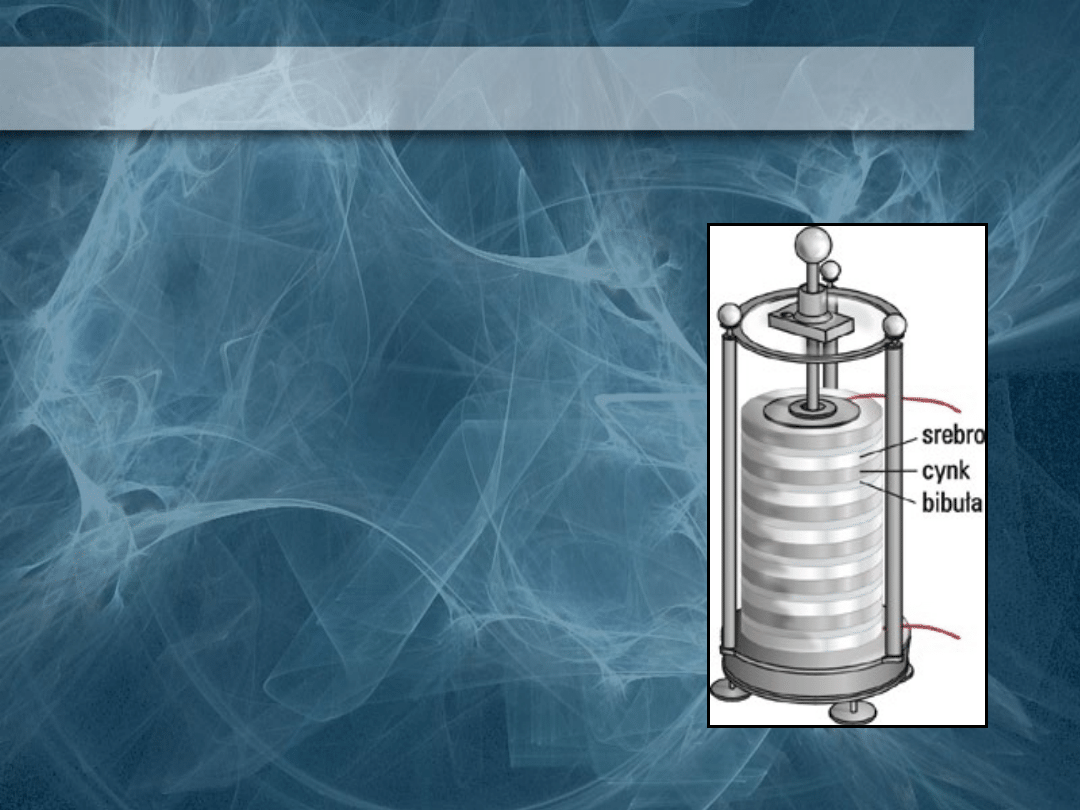
Stos Volty
Stos Volty
Rozbudowując swój pomysł
Volta złożył większą ilość
metalowych par płytek
poprzedzielanych kawałkami
filcu nasączonego kwasem
siarkowym (VI). Po zetknięciu
wolnych końcówek przewodu
przepływał przez nie prąd. Z
otrzymanego urządzenia, tzw.
stosu Volty, można było
otrzymać prąd elektryczny o
dość dużym napięciu. W 1800
roku Volta zbudował pierwsze
ogniwo.
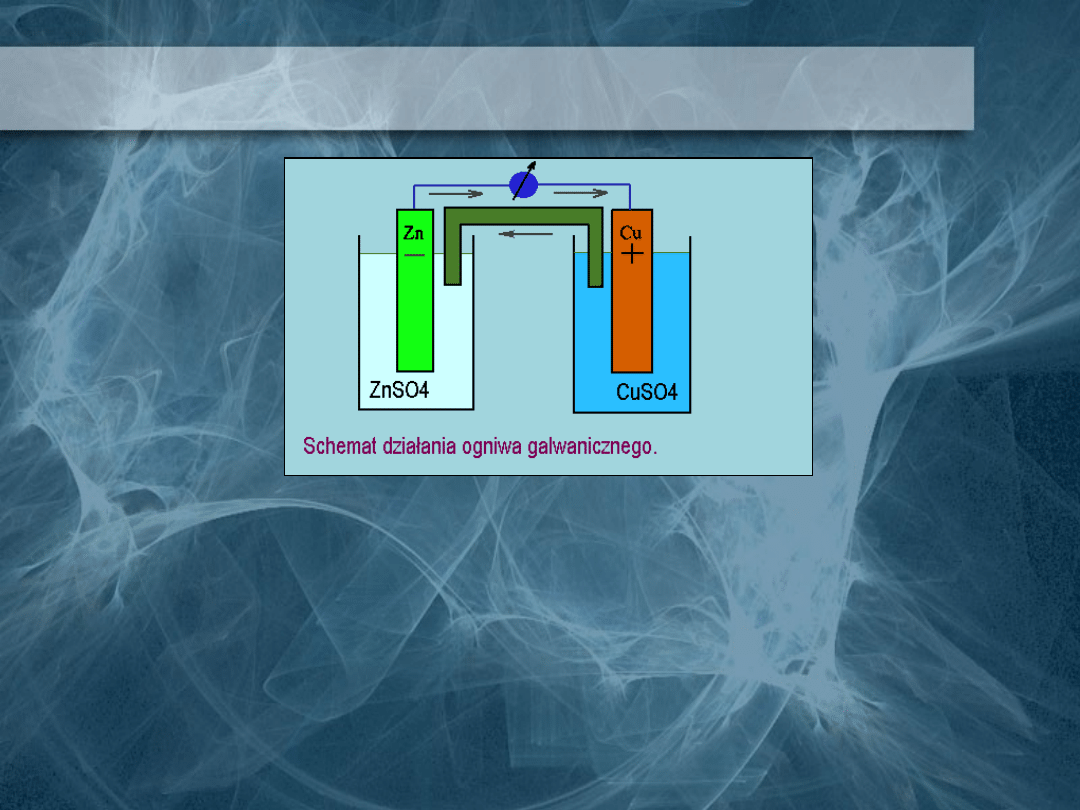
Ogniwa galwaniczne
Ogniwa galwaniczne
Ogniwem galwanicznym nazywamy układ,
który jest zbudowany z dwóch elektrod
(od lewej: katody i anody) połączonych
przewodnikiem metalicznym. W
powyższym układzie płynie prąd
elektryczny.

Ogniwa galwaniczne c.d.
Ogniwa galwaniczne c.d.
Zasada działania ogniw galwanicznych -
w trakcie reakcji chemicznej zostają
uwolnione elektrony, które są nośnikiem
energii przekazywanej na sposób elektryczny.
Większość reakcji chemicznych polega na
wymianie elektronów między atomami lub
jonami substancji biorących udział w reakcji
(reagentów). Są to reakcje utleniania-
redukcji. Podczas poniższej reakcji uwalnia
się energia która jest bezpośrednio
zamieniana na energię elektryczną.
1
1
1
Red
e
n
Oks
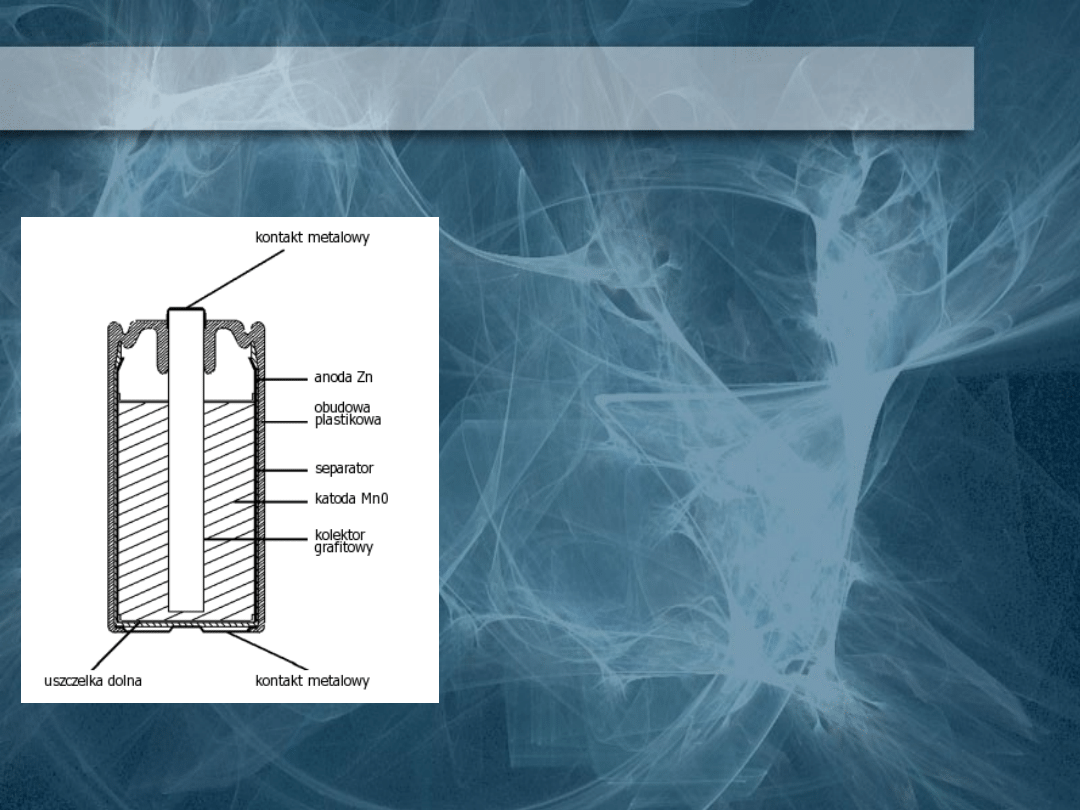
Ogniwo Leclanchego
Ogniwo Leclanchego
W 1866 r. G. Leclanche
skonstruował układ nazwany na jego
cześć ogniwem Leclanchego. W ogniwie
elektrodą dodatnią jest tlenek manganu
(IV), a elektrodą ujemną cynk. Poborcą
prądu katody jest pręt wykonany z
przewodzącego węgla. Pręt węglowy
otoczony jest warstwą sproszkowanego
dwutlenku manganu zmieszanego z
grafitem (depolaryzator). Całość jest
zanurzona jest w naczyniu cynkowym
(anoda) wypełnionym stężonym
roztworem chlorku amonu. Przykładem
takiego ogniwa są popularne baterie.
Ogniwo to zostało ulepszone przez
Ferrego, który zastosował zamiast
roztworu elektrolitu substancję
porowatą (np. skrobię) nasyconą tym
roztworem. W ten sposób powstało
ogniwo suche.

Inne przykłady ogniw
Inne przykłady ogniw
W wyniku utrudnionego dostępu podczas I wojny światowej do
rud manganowych w latach 30. XX w. popularne stały się ogniwa
cynkowo-powietrzne, których zasada działania polega na redukcji
tlenu z powietrza na materiałach węglowych oraz na utlenianiu
anody cynkowej. Reakcje przebiegają w wodnym roztworze NaOH
lub KOH. Najważniejszą zaletą takiego ogniwa jest tlenowa katoda o
niewielkiej masie i jej praktycznie nieograniczona pojemność (tlen z
powietrza).
W wyniku tego ogniwo o wymiarach popularnej baterii R20 ma
kilkakrotnie większą pojemność elektryczną od ogniwa
Leclanchego.
Kolejnym przykładem są ogniwa wysokotemperaturowe
ze stałym elektrolitem, które jako anodę wykorzystują ciekły sód.
Działanie tych ogniw determinuje przede wszystkim przewodnictwo
jonów sodu w elektrolicie. Ze względu na budowę ogniwa te działają
prawidłowo w przedziale temperatur 200-400 stopni Celsjusza.

Akumulatory -
Akumulatory -
wprowadzenie
wprowadzenie
Akumulator to rodzaj ogniwa galwanicznego zdolny do
wielokrotnego gromadzenia i uwalniania energii elektrycznej dzięki
odwracalnym reakcjom chemicznym zachodzącym w elektrolicie oraz
na styku elektrolitu elektrod. Podczas działania akumulatorów
wyróżniamy dwa cykle: ładowanie i praca. Wspomniane wcześniej
odwracalne reakcje są w rzeczywistości identyczne w obu tych cyklach,
jednakże zachodzą one w przeciwnych kierunkach. Faktem, który
sprawia, że akumulatory mają ograniczoną żywotność są niepożądane
nieodwracalne reakcje zachodzące podczas działania akumulatorów.
Najpopularniejsze rodzaje akumulatorów to:
• kwasowo-ołowiowy - masowo wykorzystywany w samochodach,
• niklowo-kadmowy (NiCd) – alkaliczny np. w postaci baterii AA lub
AAA,
• litowo-jonowy (Li-ion) – wykorzystywany np. w laptopach czy
telefonach komórkowych.

Zasady działania
akumulatorów
Kwasowo-ołowiowy
Składa się z katody (metaliczny ołów), anody (tlenek ołowiu IV) i
elektrolitu (wodny roztwór kwasu siarkowego z różnymi dodatkami).
Jego działanie opiera się o reakcje utleniania w katodzie:
Zgodnie z równaniami jedno ogniwo produkuje prąd o napięciu 2,1V.
Typowy akumulator samochodowy składa się z 6 takich ogniw.
Litowo-jonowy
Elektrody wykonane są z porowatego węgla i tlenków metali,
elektrolit zaś stanowią rozpuszczone w mieszaninie organicznych
rozpuszczalników złożone chemicznie sole litowe. W związku z
wymaganym częstym ładowaniem takiego akumulatora, nadaje się on
idealnie do zastosowania w takich urządzeniach
jak telefony komórkowe czy laptopy.
i redukcji w anodzie:
Ogniwa paliwowe
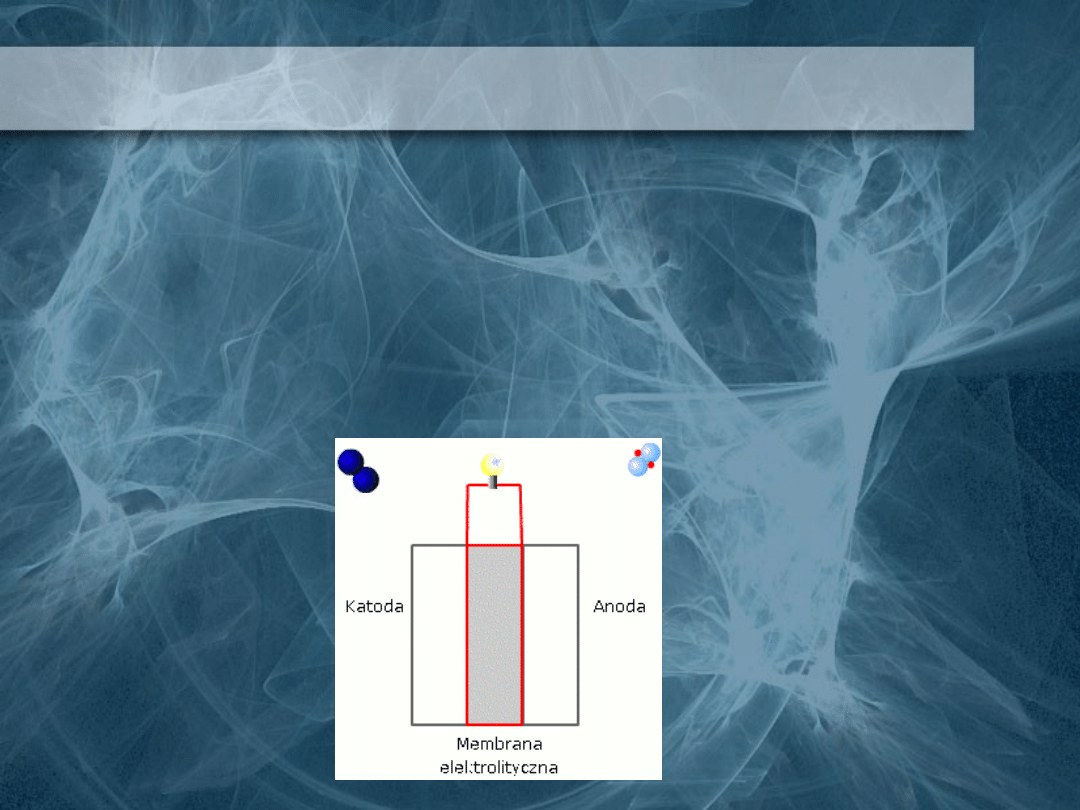
Ogniwa paliwowe
Ogniwem paliwowym nazywamy
układ generujący energię elektryczną
z reakcji utleniania stale
dostarczanego do niego z zewnątrz
paliwa.

Rodzaje ogniw paliwowych
Rodzaje ogniw paliwowych
Podział ogniw paliwowych bazuje na zastosowanym w ogniwie
elektrolicie. Zastosowany elektrolit determinuje temperaturę
reakcji zachodzącej w ogniwie oraz rodzaj paliwa zasilającego
ogniwo.
• PEM (Proton Exchange Membrane) – elektrolit: Polimer w
stanie stałym, paliwo:
wodór;
• AFC (Alkaline Fuel Cell) – e. : Roztwór KOH, paliwo wodór;
• DMFC (Direct Metanol Fuel Cell) – e. : Polimer w stanie
stałym; paliwo:
metanol;
• PAFC (Phosphoric Acid Fuel Cell) – e. : Kwas fosforowy,
paliwo: wodór;
• MCFC (Molten Carbonate Fuel Cell) - e. : Stopiony węglan,
paliwo: wodór,
metan, metanol, gaz LPG i inne.
•SOFC (Solid Oxide Fuel Cell) – e. : Ceramika tlenkowa, paliwo:
wodór,
metan, metanol, gaz LPG i inne.

Budowa i działanie ogniw
Budowa i działanie ogniw
paliwowych
paliwowych
1. Bezpośrednie ogniwo metanolowe (rys. 1) - posiada
polimerową membranę, taką jak ogniwa paliwowe z membraną
do wymiany protonów. Różnica między tymi ogniwami tkwi w
rodzaju paliwa, a także w konstrukcji anody, która w ogniwie
metanolowym pozwala na dokonanie wewnętrznego rozpadu
metanolu i uzyskanie wodoru do zasilania. Ogniwa metanolowe
mają sprawność równą 40%. Stosowane są do budowy baterii dla
urządzeń przenośnych.
2. Ogniwo paliwowe z zestalonym elektrolitem tlenkowym
(rys. 2) - ma membranę wykonaną z ceramiki tlenkowej. Pracuje
w wysokich temperaturach 650-1000 stopni Celsjusza. Posiada
wysoką sprawność - do 85%. Powyższe ogniwo stosuje się w
budowie stacjonarnych generatorów energii elektrycznej i ciepła.

Budowa i działanie ogniw
paliwowych
3. Alkaliczne ogniwo paliwowe (rys. 3) - elektrolitem jest
KOH, reakcja przebiega w temperaturach od 100-250 stopni
Celsjusza (zależna od stężenia roztworu KOH), pierwsze
ogniwo zastosowane w kosmonautyce.
4. Ogniwo paliwowe ze stopionym węglanem (rys. 4) -
elektrolitem jest stopiony węglan litu/potasu. Pracuje w
wysokich temperaturach i używane jest do produkcji
elektrowni małej i średniej mocy.
Rys. 1 Rys. 2 Rys. 3
Rys. 4

Ogniwo paliwowe z kwasem
Ogniwo paliwowe z kwasem
fosforowym
fosforowym
Elektrolitem jest kwas ortofosforowy (V),
sprawność wynosi 40%, dodatkowo para
wodna produkowana przez ogniwo, może
być zamieniana na ciepło.

Zalety ogniw paliwowych
Zalety ogniw paliwowych
1.
Wysoka jakość dostarczanej energii – dostarczana
energia jest odporna na zakłócenia, dzięki czemu jest
idealną dla tak wrażliwych urządzeń jak aparatura
medyczna czy komputery.
2.
Wysoka sprawność – często osiąga poziom 50%, czasami
dochodzi nawet do 85%. Wynika to z małej masy ogniw w
porównaniu do innych źródeł energii o podobnej mocy.
3.
Możliwość stosowania różnych rodzajów paliw –
wodór stosowany w ogniwach może pochodzić z różnych
źródeł energii alternatywnej.
4.
Ochrona środowiska – w porównaniu z generatorami
spalinowymi ogniwa paliwowe produkują 25 razy mniej
zanieczyszczeń. W przypadku zasilania wodorem
ograniczają się one głównie do pary wodnej.
5.
Skalowalność – ogniwa paliwowe można łączyć, w celu
osiągnięcia pożądanego poziomu mocy.

Bibliografia
• Czerwiński A., Akumulatory, baterie i ogniwa, Wydawnictwa
Komunikacji i Łączności, Warszawa 2005.
• Czerwiński A., Czerwińska A., Jeziorska M., Kańska M.,
Chemia. Część 3. Kształcenie w zakresie rozszerzonym.
Podręcznik dla liceum ogólnokształcącego, liceum
profilowanego i technikum, Wydawnictwa Szkolne i
Pedagogiczne, Warszawa 2004.
• Cisak A., Werblan L., Wysokoenergetyczne nie wodne
ogniwa galwaniczne, PWN, Warszawa,1986.
• Encyklopedia PWN
• Internet (Wikipedia, Google-Images)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
chemiczne żródła prądu
Łącznośc 6 Chemiczne źródła prądu elektrycznego, Konspekty, ŁĄCZNOŚĆ (marianoitalianooo)
Chemiczne źródła prądu
chemiczne zrodla pradu
ŹRÓDŁA PRĄDU ELEKTRYCZNEGO
lab zrodla pradu
źródła prądu i napięcia
sprawdzone, FIZ 50, Obwód wyidealizowany. Do biegunów A i B źródła prądu zmiennego przyłączony jest
Źródła prądu
Spawalnicze zrodla pradu - sprawko, Uczelnia, Technologia Spajania
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
Laboratoryjne źródła prądu
ŹRÓDŁA PRĄDU ELEKTRYCZNEGO
Chemiczne źródła energii elektrycznej
Źródła prądu stałego
więcej podobnych podstron