
Druga zasada
Druga zasada
termodynamiki
termodynamiki
Trzecia
Trzecia
zasada
zasada
termodynamiki
termodynamiki
Warunki
Warunki
samorzutności
samorzutności
procesów
procesów


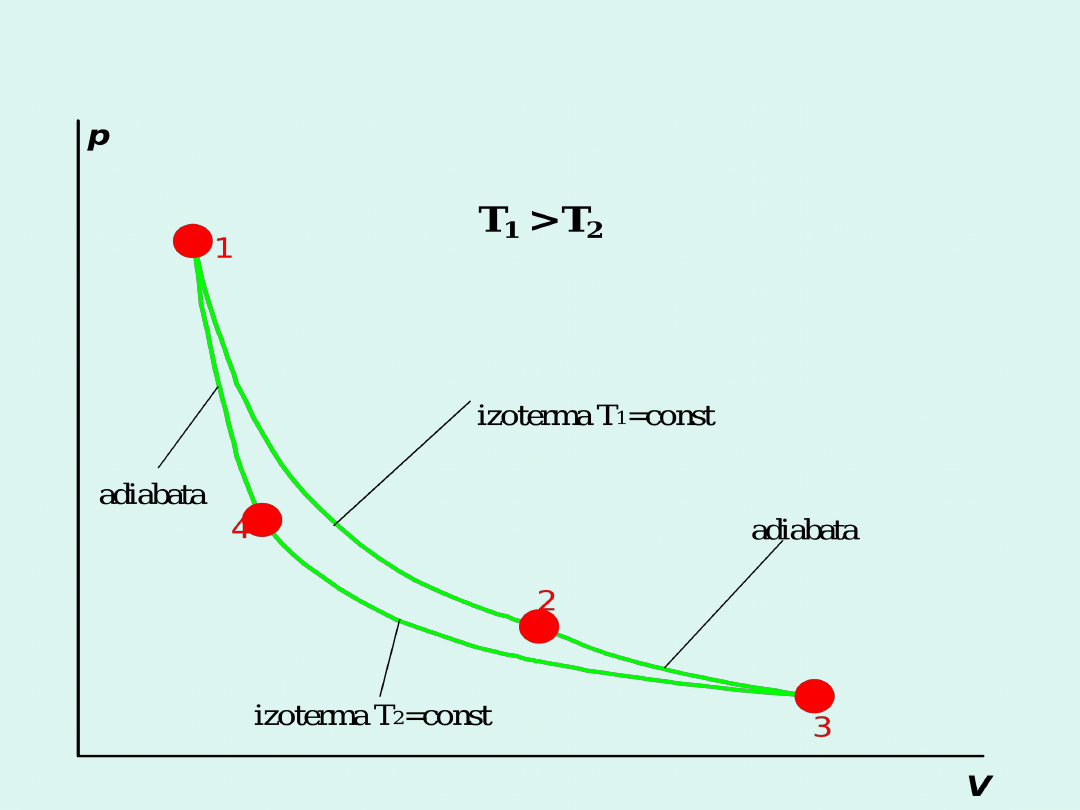
Cykl Carnota
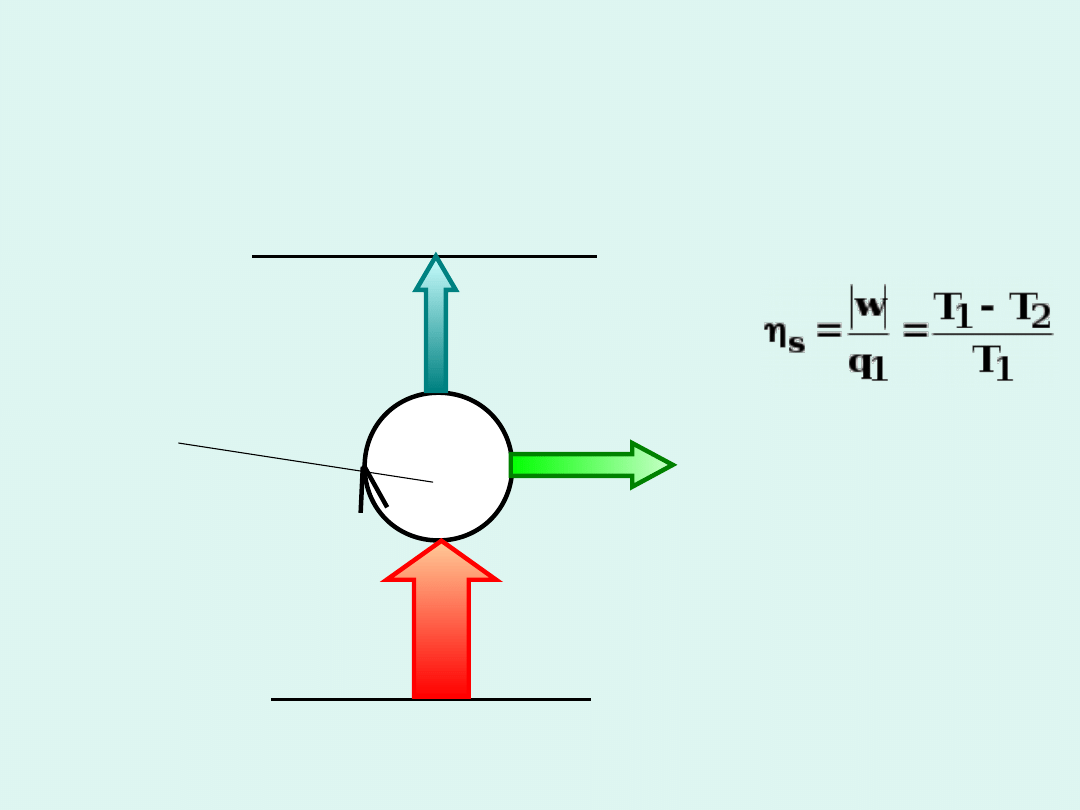
źródło ciepła
T
1
chłodnica
T
2
pracujący układ
q
1
q
2
w
T
1
>
T
2
Schemat silnika
cieplnego
Wydajność
silnika
cieplnego
Słuszne, gdy
silnik pracuje w
sposób
odwracalny.
1
2
1
lny
nieodwraca
odwracalny
lny
nieodwraca
T
T
T
0
T
q
T
q
T
T
T
q
q
q
2
2
1
1
1
2
1
1
2
1
0
T
q
T
q
T
T
T
q
q
q
2
2
1
1
1
2
1
1
2
1
Dla procesu
odwracalnego
Dla procesu
nieodwracalne
go
2
1
2
1
q
q
w
q
q
w
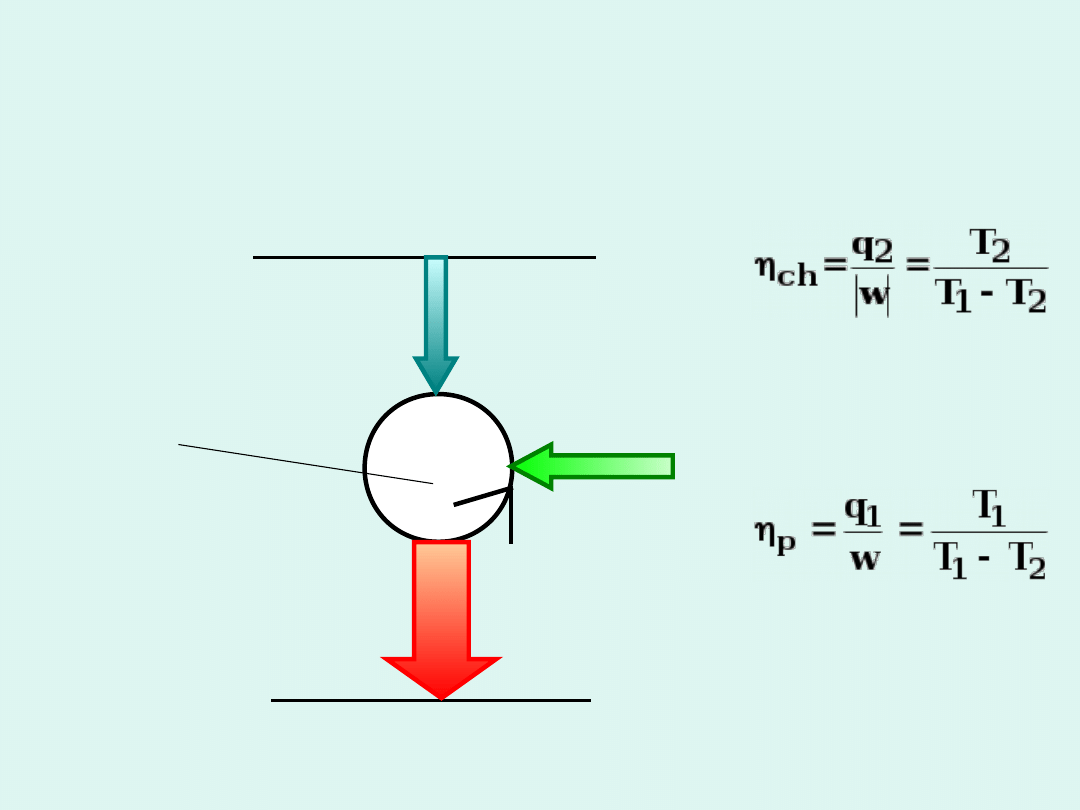
zbiornik ciepła
T
1
ciało ochładzane
T
2
pracujący układ
q
1
q
2
w
T
1
>
T
2
Schemat lodówki lub pompy
cieplnej
wydajność
lodówki
idealnej
wydajność
pompy
cieplnej
Słuszne, gdy
przemiany
zachodzą w
sposób
odwracalny.
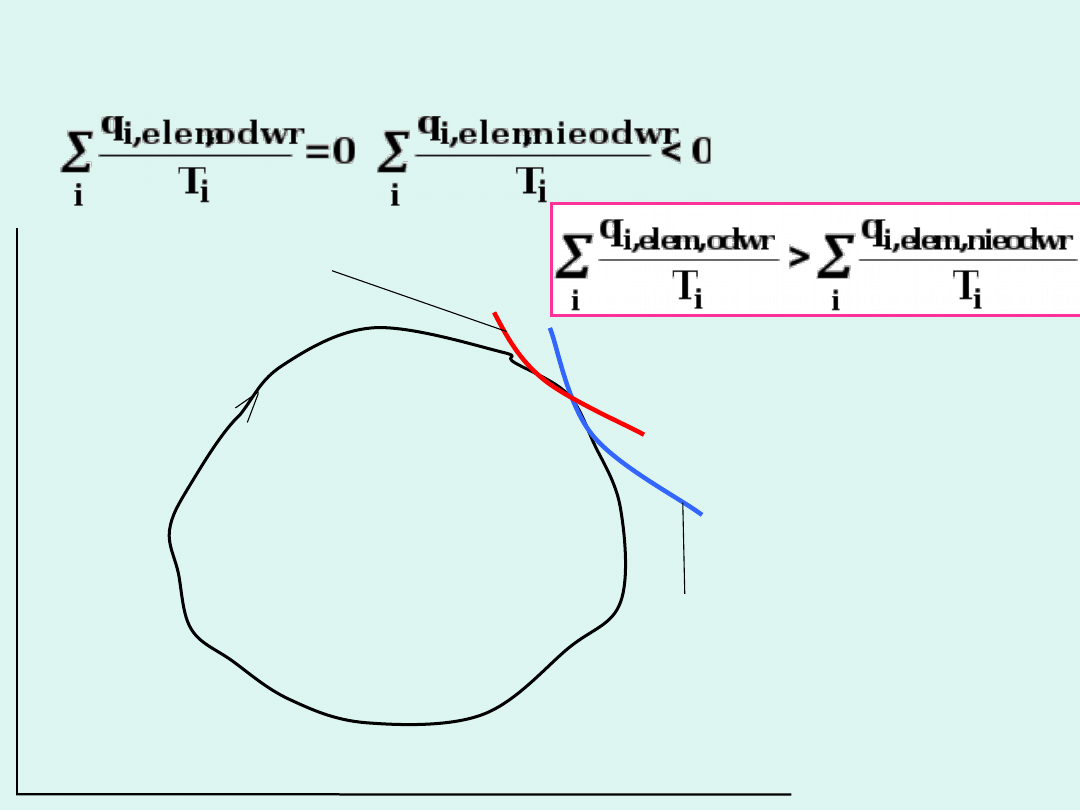
p
V
izoterma T
i
= const ; q
i,elementarne
adiabata
Karnotyzacja dowolnego cyklu

Definicja entropii
Różniczka
entropii
to
stosunek
elementarnego ciepła (różniczki ciepła)
wymienionego z otoczeniem w sposób
odwracalny do temperatury, w której ta
wymiana nastąpiła.
def
odwracalne
dq
dS
T
�
Entropia jest funkcją stanu.
Jest miarą uporządkowania układu.

Matematyczny zapis drugiej
zasady termodynamiki przy
użyciu entropii
ukladu
otoczenia
ukladu
otoczenia
dS
dS
0
S
S
0
+
�
D
+D
�
ukladu
otoczenia
ukladu
otoczenia
ukladu
otoczenia
gdy dS
dS
0
gdy dS
dS
0
gdy dS
dS
0
+
>
+
=
+
<
Proces samorzutny,
nieodwracalny
Stan równowagi,
proces odwracalny
Proces niesamorzutny
(samorzutnie
zachodziłby w
przeciwnym kierunku)

Entropia i druga zasada
termodynamiki
dq
dS
T
�
dq
gdy dS
T
dq
gdy dS
T
dq
gdy dS
T
>
=
<
Proces samorzutny,
nieodwracalny
Stan równowagi,
proces odwracalny
Proces niesamorzutny
(samorzutnie
zachodziłby w
przeciwnym kierunku)
Nierówność
Clausiusa

Z pierwszej zasady termodynamiki
'
'
dw
Vdp
dH
dq
dw
pdV
dU
dq
T
dw
Vdp
dH
dS
T
dw
pdV
dU
dS
'
'
dq
dS
T
�
Połączony zapis
pierwszej i drugiej
zasady
termodynamiki

Jeśli w układzie zachodzi proces odwracalny, i
brak jest pracy nieobjętościowej, to :
T
Vdp
dH
dS
T
pdV
dU
dS
2
1
2
1
2
1
T
Vdp
dH
T
pdV
dU
dS
S
Molekularna interpretacja
entropii
Entropia jest miarą uporządkowania
układu.
W
miarę
wzrostu
nieuporządkowania entropia rośnie.
proces
samorzutny
S > 0
stan
nieuporządkowany
proces wymuszony,
niesamorzutny
S < 0
stan uporządkowany
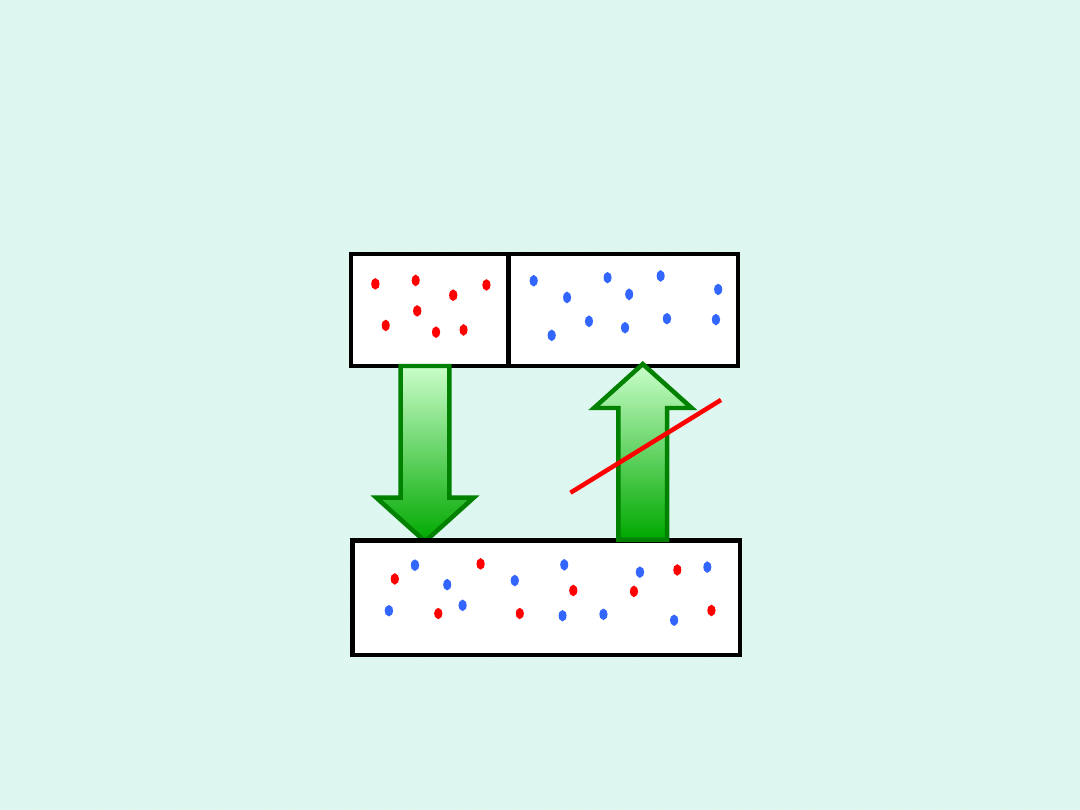
samorzutne
mieszanie
mix
S >
0
gaz A
n
A
, V
A
gaz B
n
B
, V
B
mieszanina
n
A
+n
B
, V
A
+V
B
-
mix
S
rozdzieleni
e
mieszaniny
Mieszanie izotermiczno-izobaryczne gazów
doskonałych
T = const p = const
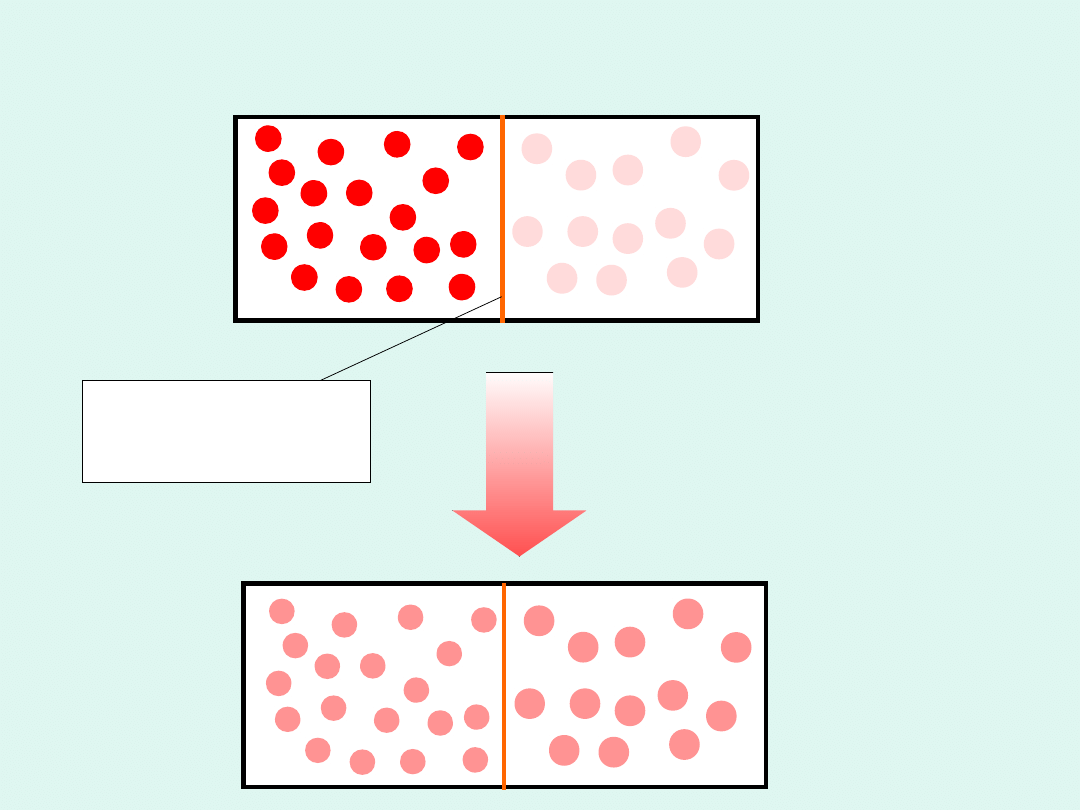
przegroda
diatermiczna
T
1
>
T
2
Wyrównywanie
temperatur - energie
kinetyczne cząsteczek
wyrównują się -
proces samorzutny
S
> 0
Adiabatyczne wyrównywanie temperatur

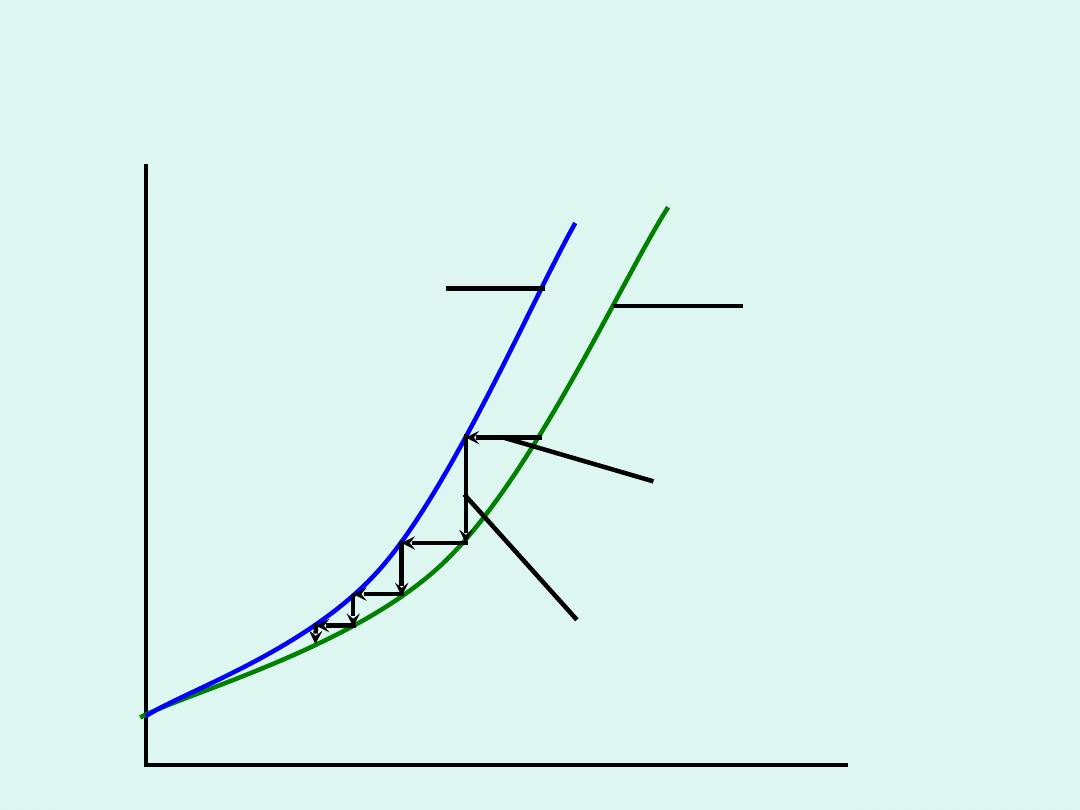
Teoremat cieplny Nernsta
Zmiana entropii towarzysząca dowolnej
przemianie fizycznej lub chemicznej dąży do 0,
gdy temperatura dąży do 0 K.
0
T
as
0
S
Wynika z niego niemożność osiągnięcia
temperatury zera bezwzględnego (0 K).
S
T
stan
stan
przemiana
adiabatyczna
S
=0
przemiana
izotermiczna
S =
S
-
S
Nieosiągalność temperatury 0 K


Wnioski z trzeciej zasady
termodynamiki
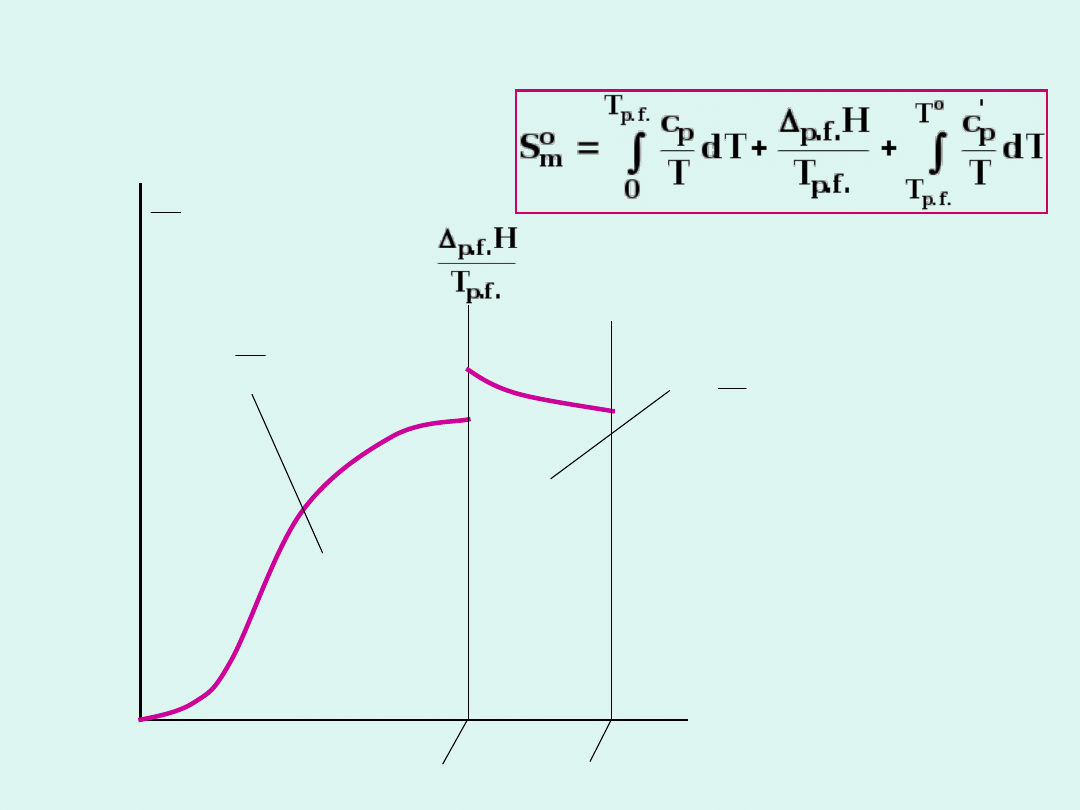
Dla 1 mola substancji, gdy p = const
0
m
T
m
T
K
0
m
m
S
S
dS
S
,
,
Na mocy trzeciej zasady termodynamiki
S
m,0
= 0
Wobec tego możemy określić bezwzględną
wartość entropii molowej substancji.
Podawane są one dla ciśnienia
standardowego
p
o
= 10
5
Pa
. Są to
standardowe entropie.
K
mol
J
S
o
m
T
T
p.f
.
T
o
0
o
.
f
.
p
T
T
dT
T
p
c
o
f
p
T
T
p
dT
T
c
.
.
'
T
p
c
Wyznaczanie entropii standardowej
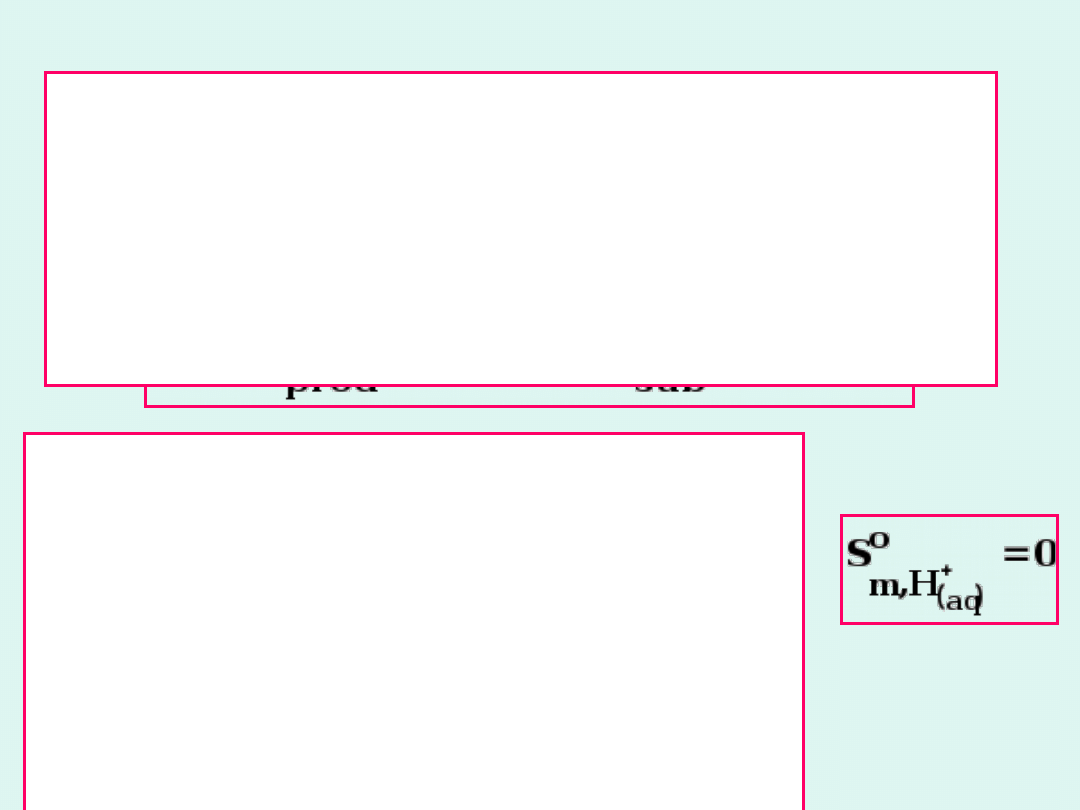
Standardowe
entropie
Standardowa entropia reakcji
jest
różnicą entropii standardowych czystych
rozdzielonych
produktów
i
czystych,
rozdzielonych substratów, pomnożonych
przez
odpowiednie
współczynniki
stechiometryczne.
Dla
jonów
definiuje
się
standardowe entropie jonu
jako
entropie tworzenia jednego mola
całkowicie zsolwatowanych jonów
w
rozcieńczeniu
nieskończenie
wielkim z czystych, rozdzielonych
pierwiastków,
przy
czym
standardowa
entropia
uwodnionego jonu wodorowego w
dowolnej
temperaturze
wynosi
zero.

Wnioski z drugiej zasady
termodynamiki
dq
dS
T
�
Dla procesów adiabatycznych
q = 0 đq = 0
0
S
0
dS
adiab
adiab
0
S
0
dS
0
S
0
dS
0
S
0
dS
adiab
adiab
adiab
adiab
adiab
adiab
Proces samorzutny
Stan równowagi
(proces odwracalny)
Proces
niesamorzutny
(zachodziłby
samorzutnie w
odwrotnym
kierunku)

Aby zastosować drugą zasadę termodynamiki do
typowych warunków, w jakich zachodzą procesy
fizyczne (np. przemiany fazowe) i reakcji
chemicznych trzeba zdefiniować dwie nowe
funkcje termodynamiczne.
Energia
swobodna
Helmholtza
Entalpia
swobodna
Gibbsa
TS
U
F
TS
H
G
Energia swobodna i entalpia swobodna są
funkcjami stanu.

1
dw
Vdp
SdT
dG
dw
Vdp
SdT
TdS
dG
TdS
SdT
TdS
dG
dH
SdT
TdS
dH
dG
dw
Vdp
dH
TdS
T
dw
Vdp
dH
dS
/
'
'
'
'
'
dw
Vdp
SdT
dG

Jeżeli proces przebiega w stałej temperaturze i
pod stałym ciśnieniem, to :
p = const dp =0
i
T = const dT = 0
'
,
dw
dG
T
p
Proces samorzutny
Stan równowagi
(proces odwracalny)
Proces
niesamorzutny
(zachodziłby
samorzutnie w
odwrotnym
kierunku)
'
'
'
'
'
'
,
,
,
w
G
dw
dG
w
G
dw
dG
w
G
dw
dG
T
p,
T
p
T
p,
T
p
T
p,
T
p

Jeżeli proces przebiega w stałej temperaturze i
pod stałym ciśnieniem i dodatkowo nie ma pracy
nieobjętościowej, to :
p = const dp =0
i
T = const dT = 0 dw’ = 0
0
dG
T
p
,
Proces samorzutny
Stan równowagi
(proces odwracalny)
Proces niesamorzutny
(zachodziłby
samorzutnie w
odwrotnym kierunku)
0
G
0
dG
0
G
0
dG
0
G
0
dG
T
p,
T
p
T
p,
T
p
T
p,
T
p
,
,
,
Proces izotermiczno- izobaryczny przebiega w sposób
samorzutny przy braku pracy nieobjętościowej, wtedy
i tylko wtedy, gdy entalpia swobodna układu maleje.

Jeżeli proces przebiega w stałej temperaturze i w
stałej objętości, to :
V = const dV =0
i
T = const dT = 0
'
,
dw
dF
T
V
Można wykazać, że :
'
dw
pdV
SdT
dF
Jeżeli dodatkowo nie ma pracy
nieobjętościowej
dw’ = 0
0
dF
T
V
,
Proces izotermiczno- izochoryczny przebiega w
sposób samorzutny przy braku pracy
nieobjętościowej, wtedy i tylko wtedy, gdy energia
swobodna układu maleje.

'
dw
Vdp
SdT
dG
Jeżeli proces zachodzi w sposób odwracalny,
bez wykonywania pracy nieobjętościowej,
to :
Vdp
SdT
dG
Entalpia swobodna jest funkcją temperatury i
ciśnienia
G(T,p)
.
dp
p
G
dT
T
G
dG
T
p
V
p
G
i
S
T
G
T
p

Entalpia swobodna jest funkcją stanu.
Wobec tego jej różniczka jest różniczką
zupełną. Wynika stąd, że drugie pochodne
mieszane entalpii swobodnej muszą być
sobie równe.
p
T
p
T
2
T
p
2
T
V
p
S
T
p
G
p
T
G
,
,
Relacja
Maxwella

Zależności pomiędzy funkcjami
termodynamicznymi

Standardowa
entalpia
swobodna
tworzenia
związku
chemicznego
to
zmiana entalpii swobodnej towarzysząca
utworzeniu 1 mola związku z czystych,
rozdzielonych pierwiastków w warunkach
standardowych, przy czym powstający
związek jak i pierwiastki muszą być w
najtrwalszej w tych warunkach odmianie
termodynamicznej. Standardowa entalpia
swobodna tworzenia pierwiastków w ich
najtrwalszej odmianie termodynamicznej
wynosi zero.
Standardowa
entalpia
swobodna
tworzenia jonu
to zmiana entalpii
swobodnej towarzysząca powstaniu 1
mola
solwatowanych
jonów
w
rozcieńczeniu nieskończenie wielkim z
czystych, rozdzielonych pierwiastków w
warunkach
standardowych.
Standardowa
entalpia
swobodna
tworzenia
uwodnionego
jonu
wodorowego w dowolnej temperaturze
wynosi zero.
0
G
o
H
tw
aq

sub
sub
o
tw
i
prod
prod
o
tw
i
o
r
G
G
G
Standardowa
entalpia
swobodna
reakcji
(standardowa zmiana entalpii
swobodnej reakcji) bądź przemiany
fizycznej to różnica entalpii swobodnych
czystych, rozdzielonych produktów i
czystych, rozdzielonych substratów w
stanie standardowym w tej samej,
określonej temperaturze.

S
T
H
G
Udziały decydujące o samorzutności
procesów przy p = const i T =
const
0
G
T
p,

Zależność entalpii swobodnej
od temperatury
V
p
G
S
T
G
Vdp
SdT
dG
T
p
Gdy ciśnienie jest
stałe, to :
SdT
dG
p
Ponieważ entropia ma zawsze wartość dodatnią,
to wraz ze wzrostem temperatury, entalpia
swobodna maleje.

p
p
p
T
G
T
G
H
T
G
T
H
G
S
T
G
TS
H
G
T
H
G
T
G
p
Równanie Gibbsa-
Helmholtza
2
p
T
G
p
T
G
T
G
T
T
p
T
G
T
H
G
2
p
T
G
T
H
T
Równanie Gibbsa-
Helmholtza
2
p
T
G
T
H
T
Dla procesu
izobarycznego :

Zależność entalpii swobodnej
od ciśnienia
V
p
G
S
T
G
Vdp
SdT
dG
T
p
Gdy temperatura jest
stała, to :
p
dG
Vdp
=
Ponieważ objętość ma zawsze wartość dodatnią,
to wraz ze wzrostem ciśnienia, entalpia
swobodna rośnie.

Załóżmy, że mamy 1 mol gazu doskonałego.
o
p
p
p
RT
o
m
m
p
p
m
G
G
m
m
m
m
p
p
RT
dp
G
G
dp
V
dG
p
RT
V
dp
V
dG
o
o
m
o
m
ln
o
o
m
m
p
p
RT
G
G
ln
o
m
G
Standardowa molowa entalpia swobodna.
Jest funkcją temperatury.

Dla gazu doskonałego stanem
standardowym jest stan czystego gazu
pod ciśnieniem standardowym
p
o
= 10
5
Pa
i w dowolnej, ustalonej
temperaturze.

Gaz
rzeczywisty
o
o
m
m
p
f
RT
G
G
ln
f
– lotność
Lotność jest to funkcja termodynamiczna, zależna od
ciśnienia i temperatury, dobierana tak, aby spełnione
było powyższe równanie.
1
p
f
0
p
gdy
p
f
lim
0
p
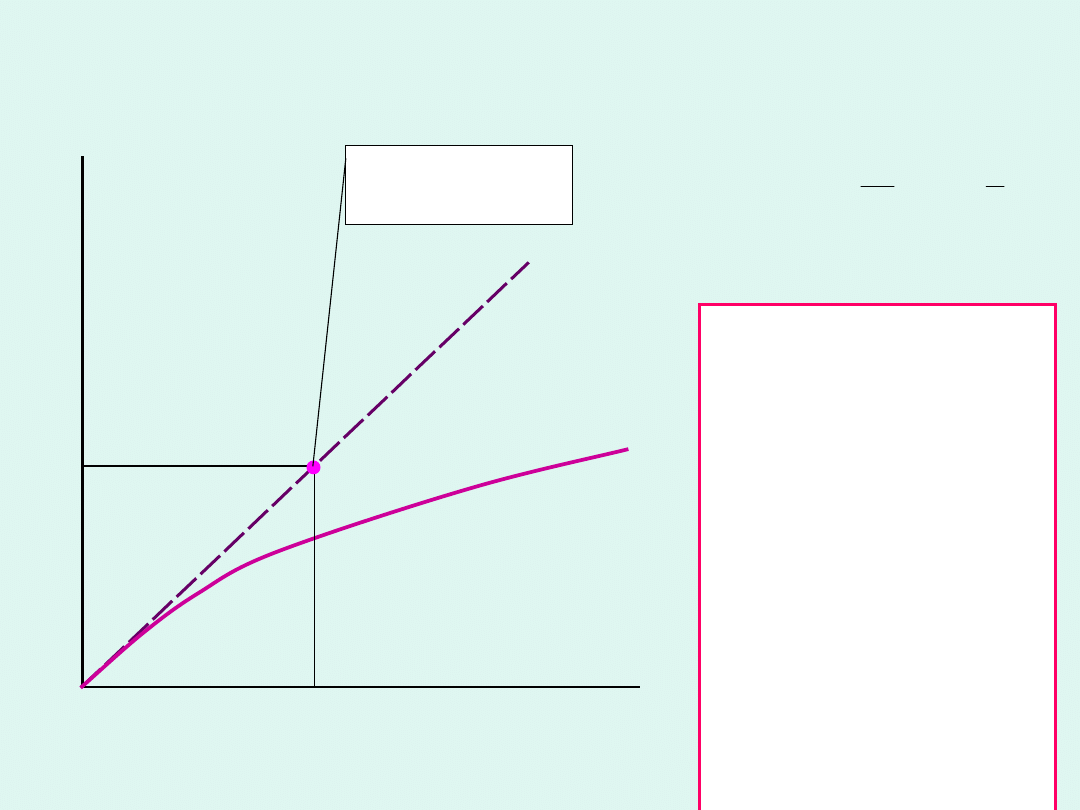
gaz
doskona
ły
gaz
rzeczywis
ty
hipotetyczny
stan
standardowy
l
o
t
n
o
ś
ć
ciśnienie
p
o
f
o
0
1
p
f
p
f
ln
RT
G
G
lim
0
p
o
o
m
m
Stan standardowy
dla
gazu
rzeczywistego to stan
gazu rzeczywistego w
hipotetycznym stanie
pod
ciśnieniem
standardowym
(10
5
Pa),
w
określonej
temperaturze, gdyby
zachowywał się on
jak
przy
bardzo
niskich
ciśnieniach
(przy
ciśnieniu
dążącym do zera).
Sposób przyjęcia stanu standardowego dla
gazu rzeczywistego

o
o
m
m
p
p
RT
G
G
ln
1
0
p
gdy
1
lim
0
p
p
f
- współczynnik lotności
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
Wykład Ch F II zasada
Wykład Ch F I zasada
3 Wykład Ch F I zasada1 2
Wykład Ch F I zasada
Wyklad FP II dla studenta
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
GF w3 2.03, Geologia GZMiW UAM 2010-2013, I rok, Geologia fizyczna, Geologia fizyczna - wykłady, 01,
wykład francuz II
więcej podobnych podstron