
Pojęcia wstępne
Pojęcia wstępne
termodynamiki
termodynamiki
Pierwsza
Pierwsza
zasada
zasada
termodynamiki
termodynamiki

Układ
to część wszechświata, którą
akurat jesteśmy zainteresowani.
Otoczenie
to reszta wszechświata
poza interesującym nas układem.
Układ oddzielony jest od otoczenia
granicą.
Stan układu określony jest przez wiele
zmiennych parametrów (np.
temperatura, ciśnienie, objętość, ilość,
skład).

Parametry
(wielkości)
mogą
być
intensywne i ekstensywne.
Parametry intensywne
to te, których
wielkość nie zależy od masy (ilości)
substancji. Zaliczamy do nich :
temperaturę,
ciśnienie,
każdą
wielkość liczoną na 1 mol lub gram
substancji - np. objętość molowa,
ciepło molowe, ciepło właściwe.
Parametry
ekstensywne
to
te,
których wielkość zależy od masy
(ilości) substancji. Np. pojemność
cieplna układu, energia wewnętrzna,
objętość.

W toku dalszego wykładu omawiać będziemy układy
zamknięte.

Energia
to potencjalna zdolność do wykonania
pracy. Wyróżniamy energię kinetyczną i potencjalną.
Praca
jest wykonywana wówczas, gdy ciało jest
przesuwane przeciwko jakiejś sile. Pracę dzielimy
zwykle na pracę objętościową związaną ze zmianą
objętości i inne (np. elektryczną).
Różniczka pracy objętościowej
Pracę objętościową obliczamy zawsze
całkując po drodze przemiany !
'
'
dw
dw
dw
w
w
w
obj
obj
k
o
V
V
z
obj
z
obj
dV
p
w
dV
p
dw

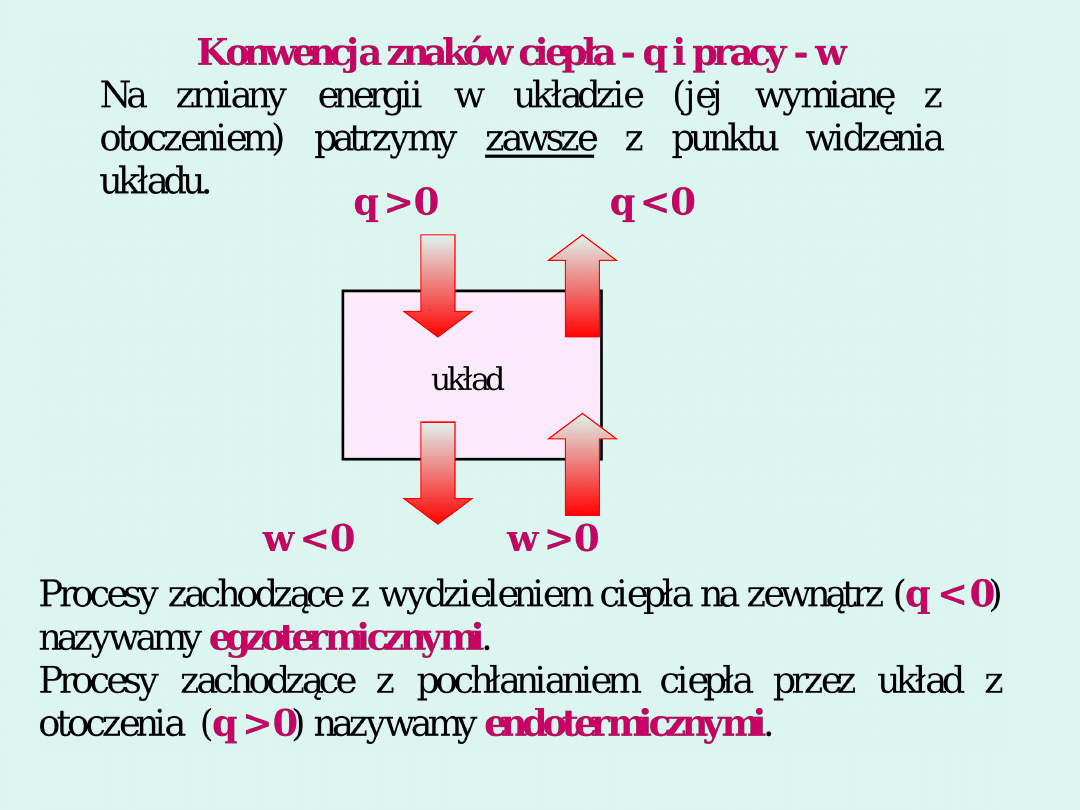
Ciepło
jest formą wymiany energii w wyniku różnicy
temperatur pomiędzy układem a otoczeniem.
Granica oddzielajaca ukłd zamkniety od otoczenia
może mieć charakter diatermiczny lub adiabatyczny.
Granica układu
diatermiczna
– pozwala na wymianę
energii w postaci ciepła (przepływ ciepła).
Granica układu
adiabatyczna
– nie pozwala na
wymianę energii w postaci ciepła (przepływ ciepła)
pomiędzy układem a otoczeniem.
q = 0
Mówimy, że
proces (przemiana) zachodzący
wówczas w układzie jest procesem
adiabatycznym
(zachodzi bez wymiany ciepła z otoczeniem).

Procesy odwracalne i
nieodwracalne
Proces odwracalny
(quasi statyczny) to
taki, który zachodzi pod wpływem
nieskończenie małej siły napędowej,
poprzez szereg kolejnych stanów
równowagi. W każdej chwili można go
przerwać i po tej samej drodze cofnąć do
stanu początkowego.
Proces nieodwracalny
to taki, który
zachodzi pod wpływem skończonej siły
napędowej. Nie można go cofnąć po tej
samej drodze do stanu początkowego.
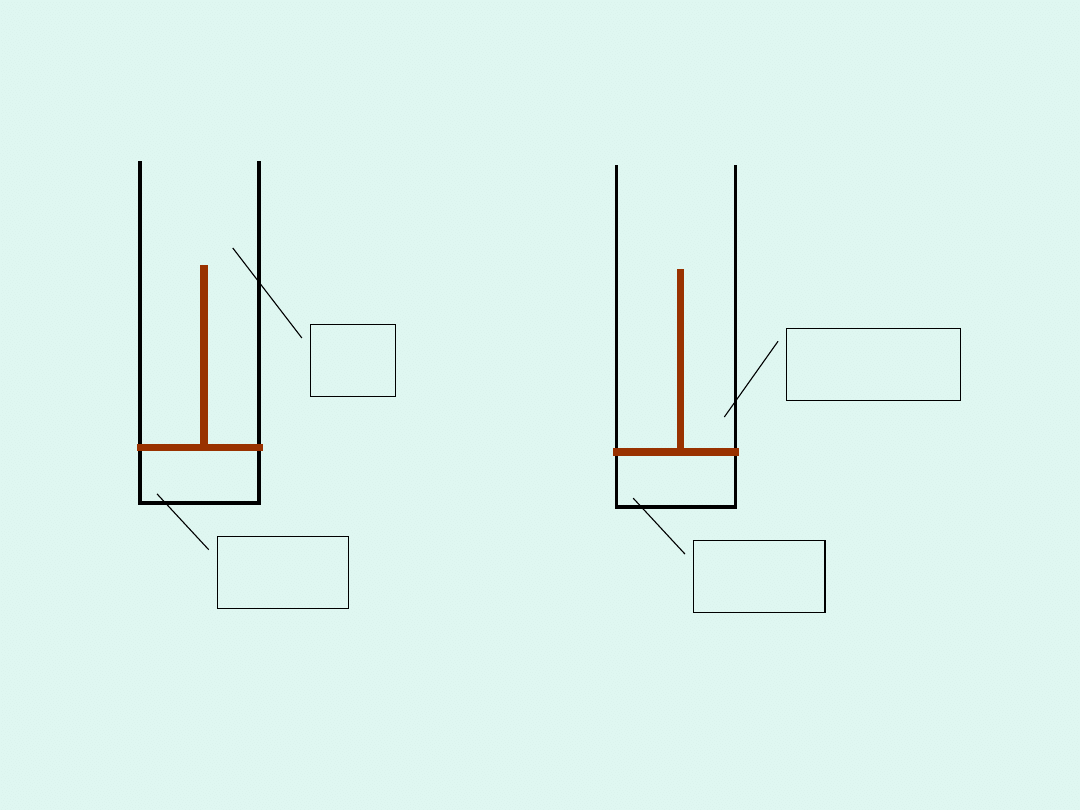
Procesy odwracalne i nieodwracalne
Izotermiczne rozprężanie gazu
V
o
,
p
o
p
k
V
o
,
p
o
p
o
-dp
w sposób nieodwracalny w sposób
odwracalny

Funkcje stanu
Funkcja stanu
zależy tylko od parametrów
stanu.
Każda funkcja stanu ma trzy podstawowe
własności
.
Zmiana funkcji stanu w jakimś procesie nie zależy od
drogi tego procesu, a jedynie od stanu początkowego
i końcowego.
W procesie cyklicznym (gdy stan końcowy i
początkowy są takie same) jest zmiana wynosi zero.
Różniczka funkcji stanu jest różniczką zupełną.
1
2
Z
Z
Z
0
dZ

Równowaga
termodynamiczna
Układ jest w stanie równowagi
termodynamicznej, jeśli jest w stanie :
równowagi mechanicznej (ciśnienie
wewnątrz całego układu jest
jednakowe)
równowagi termicznej (temperatura w
każdym punkcie układu jest jednakowa)
równowagi chemicznej (skład w każdym
punkcie danej fazy układu jest
jednakowy)
Stężenia wszystkich składników w
obrębie fazy
są stałe, podobnie
w fazie
. Jednak dla każdego ze
składników ich stężenia w fazach
i
są różne.

Energia wewnętrzna U
jest to suma
wszystkich rodzajów energii zawartych w
układzie
(energii
kinetycznej
ruchu
postępowego i rotacyjnego cząsteczek,
energii kinetycznej i potencjalnej oscylacji
cząsteczek,
energii
oddziaływań
międzycząsteczkowych, energii oddziaływań
cząsteczek z zewnętrznymi polami), za
wyjątkiem energii kinetycznej i potencjalnej
układu jako całości.
Nie można określić wartości energii
wewnętrznej danego układu. Można określić
tylko, o ile ona się zmieniła.
Energia wewnętrzna jest funkcją stanu.
Oznacza to, że
Zmiana energii wewnętrznej w jakimś
procesie nie zależy od jego drogi, a jedynie
stanu początkowego i końcowego.
Zmiana energii wewnętrznej w procesie
cyklicznym wynosi zero.
Różniczka energii wewnętrznej jest
różniczką zupełną.
1
2
U
U
U
0
dU

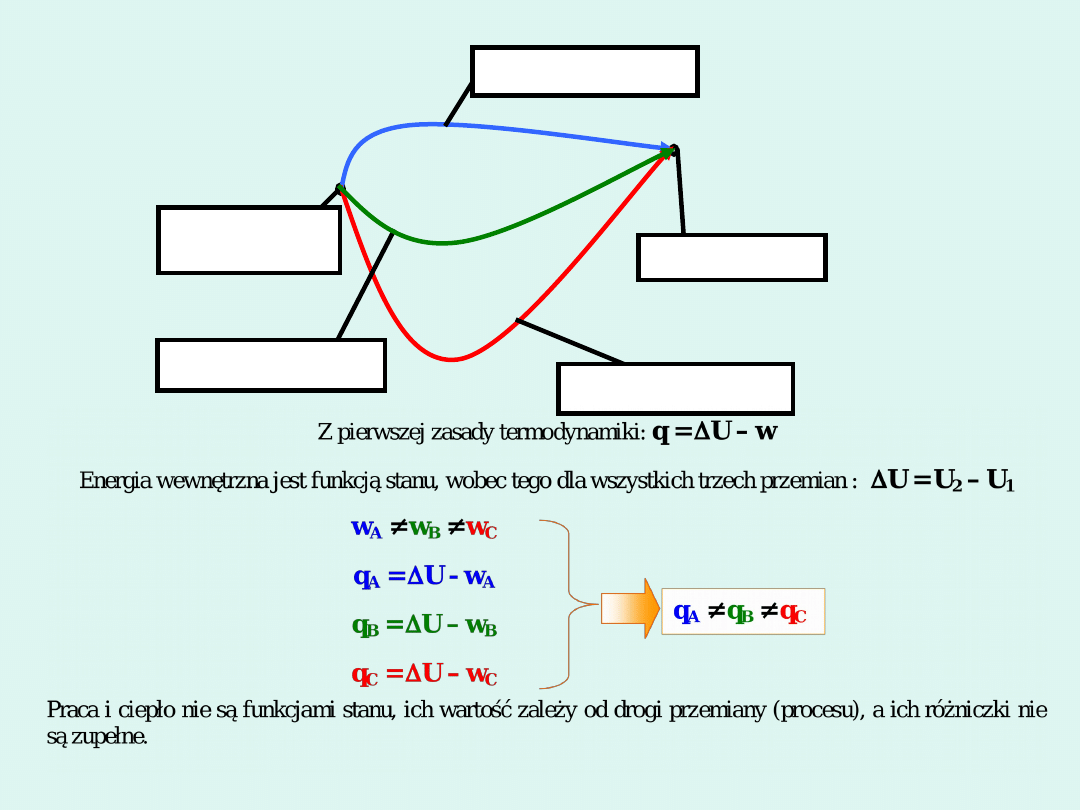
stan
początkowy
U
1
stan końcowy
U
2
przemiana
A, w
A
,
q
A
przemiana
B,
w
B
, q
B
przemiana
C, w
C
,
q
C

'
dw
pdV
dq
dw
dq
dU
Jeśli nie ma pracy nieobjętościowej (dw’ =
0) i proces zachodzi w stałej objętości (jest
izochoryczny), wtedy :
0
dV
const
V
V
V
q
U
dq
dU
W procesie izochorycznym, gdy nie pracy
nieobjętościowej, zmiana energii wewnętrznej
jest równa ciepłu wymienionemu z
otoczeniem.

Pojemność cieplna izochoryczna
układu to
ilość ciepła potrzebna do ogrzania układu o 1
stopień w stałej objętości.
Ciepło molowe izochoryczne
to ilość ciepła
potrzebna do ogrzania 1 mola substancji o 1
stopień w stałej objętości.
T
T
p
p
V
U
nc
C
C
dT
dq
T
U
dT
T
U
dV
V
U
dU
V
T
V
V
V
v
V
V
T

Dla gazu doskonałego ,
toteż jego energia wewnętrzna zależy
tylko od temperatury.
Dla gazu rzeczywistego ,
więc jego energia wewnętrzna zależy
od objętości i temperatury.
0
V
U
T
0
V
U
T

Entalpia
pV
U
H
Definicja
entalpii
Entalpia jest funkcją stanu.
Oznacza to, że
Zmiana entalpii w jakimś procesie nie zależy od
jego drogi, a jedynie stanu początkowego i
końcowego.
Zmiana entalpii w procesie cyklicznym wynosi
zero.
Różniczka entalpii jest różniczką zupełną.
1
2
H
H
H
0
dH

Vdp
pdV
dw
pdV
dq
dH
dw
pdV
dq
dU
Vdp
pdV
dU
dH
'
'
Jeśli nie ma pracy nieobjętościowej (dw’ = 0) i
proces zachodzi pod stałym ciśnieniem (jest
izobaryczny), wtedy :
0
dp
const
p
p
p
q
H
dq
dH
W procesie izobarycznym, gdy nie pracy
nieobjętościowej, zmiana entalpii jest równa
ciepłu wymienionemu z otoczeniem.
Vdp
dw
dq
dH
'
Zapis pierwszej zasady termodynamiki przy użyciu
entalpii

Pojemność cieplna izobaryczna
układu to ilość
ciepła potrzebna do ogrzania układu o 1 stopień pod
stałym ciśnieniem.
Ciepło molowe izobaryczne
to ilość ciepła
potrzebna do ogrzania 1 mola substancji o 1 stopień
pod stałym ciśnieniem.
T
T
V
V
p
H
nc
C
C
dT
dq
T
H
dT
T
H
dp
p
H
dH
p
T
p
p
p
p
p
p
T

Dla gazu doskonałego ,
toteż jego entalpia zależy tylko od
temperatury.
Dla gazu rzeczywistego ,
więc jego entalpia zależy od objętości i
temperatury.
0
p
H
T
0
p
H
T

Przemiany gazu
doskonałego
-w
q
0
H
0
U
const
T
p
q
H
const
p
V
q
U
const
V
1.
Izotermiczna
2.
Izobaryczna
3.
Izochoryczna
4.
Adiabatyczna
w
U
0
q

Dla przemiany
adiabatycznej, odwracalnej
gazu doskonałego
można wykazać, że :
const
pV
v
p
c
c
gdzie
Dla
gazu doskonałego
ciepło molowe
izobaryczne i izochoryczne powiązane są
następująco :
R
c
c
V
p
– wykładnik adiabaty
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Wykład Ch F I zasada
Wykład Ch F I zasada
5 Wykład Ch F II zasada1
Wykład Ch F II zasada
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
Wykład Ch F potencjometria
10 Wykład Ch F wielkości koligatywne
więcej podobnych podstron