TOKSYCZNOŚĆ METALI I
PÓŁMETALI
Andrzej Kunt
Wykład XXII

TOKSYCZNOŚĆ METALI I PÓŁMETALI
Współczesna toksykologia największą uwagę przywiązuje nie
tylko do zatruć ostrych, lecz także do chorób, które ze względu
na zanieczyszczenie środowiska metalami toksycznymi
obejmują nieraz całe populacje lub grupy ludności
zamieszkałych na tych terenach. Przy ocenie toksyczności
spowodowanej takimi metalami należy brać pod uwagę nie
tylko dawkę wchłoniętego związku w zależności od drogi
wchłaniania (układ oddechowy, przewód pokarmowy, przez
skórę), ale również rodzaj ekspozycji narażenia (jednorazowa
lub wielokrotna).
Niektóre z nich mają ważne znaczenie dla organizmu i
nazywane są pierwiastkami niezbędnymi. Spełniają one jednak
tę funkcję w organizmie tylko w określonych stężeniach. Są
dostarczane głównie z pożywieniem i wodą.

Istotną rolę w rozwoju i funkcjonowaniu organizmu odgrywają
takie pierwiastki, jak: żelazo, cynk. miedź. wapń. magnez. Nie
można pominąć również chromu, kobaltu, manganu, molibdenu,
niklu, selenu, wanadu, których organizm wymaga w dużo
mniejszych ilościach. Inne metale, jak: rtęć, glin, kadm, ołów nie
są niezbędne dla organizmu, są przyczyną zatruć ostrych i
przewlekłych zarówno przemysłowych, jak i środowiskowych.
Zmiany w syntezie białek i zaburzenia wytwarzania ATP są
podstawowymi działaniami szkodliwymi, które powodują metale,
uszkadzając błony komórkowe oraz błony organelli komórkowych
(mitochondriów, lizosomów i jąder).
Nawet minimalne stężenie metali toksycznych w organizmie
powoduje zaburzenia metaboliczne, zmniejszenie wydolności
organizmu, osłabienie procesów immunologicznych,
enzymatycznych, co w efekcie prowadzi do wielu chorób, a nawet
może stać się przyczyną śmierci.

Najważniejszymi źródłami glinu są rudy: boksyt, kryolit, kaolin. Jako metal
bardzo lekki, miękki, plastyczny, znajduje szerokie zastosowanie do wyrobu
farb brązowych oraz tzw. termitów, używanych w pirotechnice oraz w
spawalnictwie. Wykazuje odporność na korozję oraz jest dobrym
przewodnikiem ciepła i elektryczności.
Proszek metalicznego glinu o średnicy cząstek ok. 0,6 µm jest wytwarzany
przez rozdrobnienie blachy. Chlorek glinu jest stosowany w przemyśle
kosmetycznym i chemicznym, a inne związki glinu w szerokim zakresie
używane są w lecznictwie jako leki zmniejszające kwasowość żołądka,
antyseptyczne, ściągające.
Zawodowe narażenie na glin i jego związki występuje najczęściej w krajach
uprzemysłowionych. Wchłanianie przez drogi oddechowe spowodowane jest
występowaniem glinu w postaci elementarnej w pyłach lub gazach, a także w
postaci tlenków glinu. Najbardziej szkodliwy jest fluorek glinu.
Metal ten wykorzystuje się do wyrobu naczyń kuchennych, aparatury
chemicznej, elektrycznych linii przewodowych, wielu stopów, tzw. stopów
lekkich (magnol, duraluminium, silumin i hydronal) stosowanych do produkcji
części samolotów, samochodów i rakiet, w metalurgii jako odtleniacz i w
aluminoterii do otrzymywania niektórych metali, jak np. chromu, manganu i in.,
stosuje się go również do metalizacji natryskowej.
GLIN

Tlenek glinu Al2O3 występujący w stanie rodzimym jako rubin, szafir,
korund i szmaragd, stosuje się jako środek szlifierski. Związek ten
stanowi również składnik szybko twardniejących cementów, szkła, emalii,
porcelany, cegieł ogniotrwałych i izolatorów świec zapłonowych. Tlenek
glinu stopiony z dodatkami barwiącymi służy do otrzymywania sztucznych
kamieni, jak rubiny, szafiry itd., mających znaczenie techniczne (lasery).
Uwodniony tlenek glinu jest używany do produkcji azotanu, fluorku,
fosforanu i chlorku glinu, w papiernictwie jako pigment oraz dodatek do
tworzyw uodporniający je na ścieranie i zwiększający ich twardość.
Aktywowany tlenek glinu ma zastosowanie jako absorbent gazów, par i
cieczy. Ałuny stosuje się jako zaprawę do farbowania tkanin, siarczan
glinu w farbiarstwie, papiernictwie i garbarstwie, bezwodny chlorek glinu
w przemyśle organicznym do syntez. Cement, jeden z najważniejszych
materiałów budowlanych, składa się głównie z krzemianu glinu.
Istotnym źródłem tego pierwiastka jest emisja pyłów pochodzących ze
spalania węgla, spalania odpadów, a także z przemysłu metalurgicznego,
cementowego i innych. Występujące obecnie zanieczyszczenie środowiska
spowodowane kwaśnymi deszczami prowadzi do zwiększenia zawartości
Al
3+
w glebach oraz rzekach i jeziorach.


Toksyczność przewlekła. Choroba Shavera (pylica) spotykana jest u wytapiaczy
korundu z boksytów zawierających wodorotlenek glinowy jako domieszkę
krzemionki. Notowane były przypadki „gorączki odlewników" u osób zawodowo
narażonych na dymy tlenku glinu występujące w stężeniu 15 mg/m
3
.
Zawodowe narażenie na związki glinu powoduje bronchopneumopatię, która
występuje w postaci przewlekłego nieswoistego zespołu oddechowego,
miąższowego zwłóknienia płuc oraz odmy opłucnowej. Bardzo niebezpieczne dla
zdrowia jest wdychanie par i dymów tlenku glinu oraz pyłów powstałych przy
wytwarzaniu proszku glinowego. Włókniste zmiany utkania płucnego wywołane
przez sproszkowany glin metaliczny nazywane są pylicą aluminiową
(aluminiosis).
Początkowym objawem pylicy jest suchy kaszel występujący głównie w nocy.
Stopniowo rozwija się duszność wysiłkowa. Przyczyną śmierci jest niewydolność
krążenia i niewydolność oddechowa oraz procesy odoskrzelowego zapalenia płuc.
Okres utajenia od początku narażenia na działanie glinu do ujawnienia choroby
jest różny. Może on wynosić kilka miesięcy lub kilkanaście lat. Zarówno odczyn
opadania krwinek czerwonych, jak i obraz krwi oraz temperatura ciała mogą u
chorych z bronchopneumopatią pozostawać przez długi czas w granicach
prawidłowych.


Wydobywanie, wytop i oczyszczanie ołowiu, jak również wytwarzanie
produktów zawierających ołów może powodować emisję tego metalu do
atmosfery. Narażenie na ołów występuje przy produkcji akumulatorów,
kabli, drutów, w przemyśle chemicznym, w czasie wyrobu stopów
lutowniczych, produkcji łożysk, czcionek drukarskich, osłon
zabezpieczających przed promieniowaniem radioaktywnym, przy produkcji
barwników, insektycydów. Huty ołowiu są źródłem zanieczyszczenia
otaczającego środowiska. Strefa zanieczyszczenia powietrza w otoczeniu
dużej huty może wynosić ok. 15 km.
Ołów w glebie i kurzu gromadzi się w wyniku spalania benzyny z
dodatkiem tetraetylku ołowiu oraz emisji ze źródeł przemysłowych. Ze
względu na to, że ołów nie ulega biodegradacji ani rozpadowi, gleba i kurz
stanowią istotne źródło narażenia, szczególnie dla dzieci. Stwierdzono, że
u dzieci bawiących się na terenach zanieczyszczonych stężenia ołowiu we
krwi mogą wzrastać od 30 do 70 µg/l.
Stężenia ołowiu w glebie w pobliżu autostrad wynoszą około 30-2000 ppm,
a w pobliżu domów malowanych farbami zawierającymi ołów około 10 000
ppm.
OŁÓW
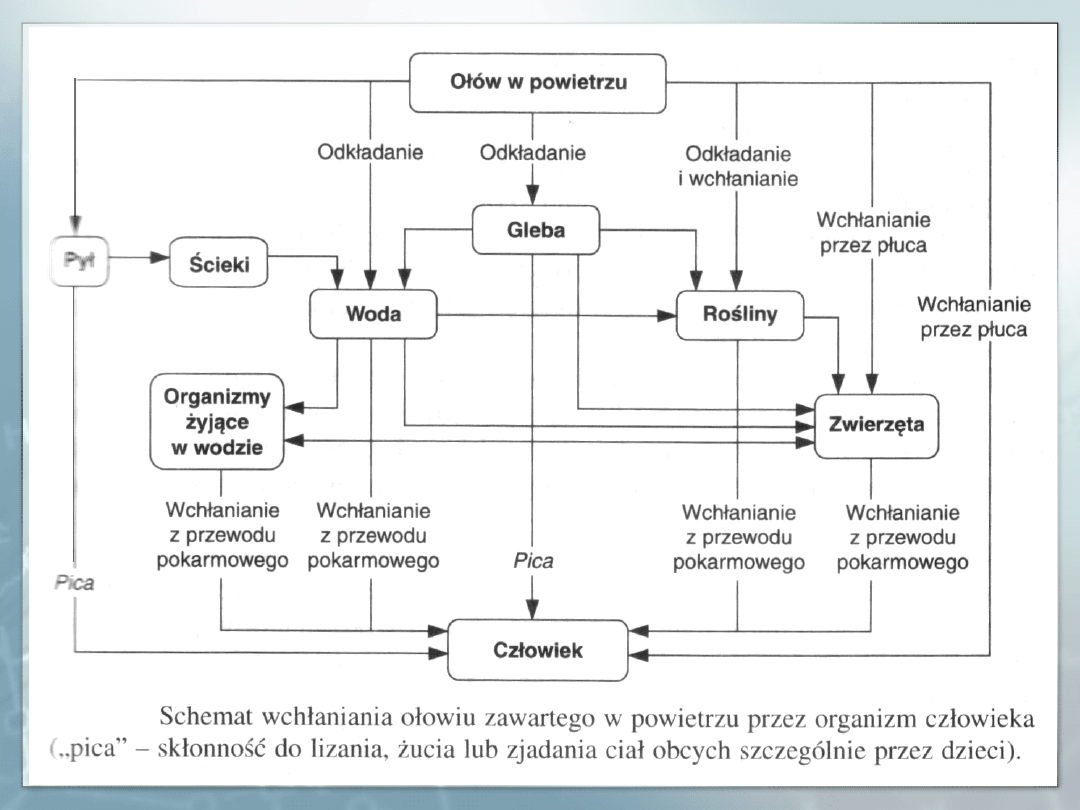

Ołów wchłonięty do organizmu przedostaje się do krwi
obwodowej, gdzie jest wiązany głównie przez błony
erytrocytarne (99%). Następnie zostaje rozmieszczony w
różnych tkankach, w zależności od ich ukrwienia. We krwi
99% ołowiu jest związana z erytrocytami.
Początkowo ołów przedostaje się z krwi do takich narządów,
jak: wątroba, płuca, serce i nerki, które wraz z krwią
obwodową stanowią tzw. pulę szybkowymienną. Później
metal ten gromadzi się w skórze i mięśniach, stanowiących
pulę o średniej szybkości wymiany. Najwolniej, ale i na
najdłuższy czas, ołów odkłada się w tkance kostnej.

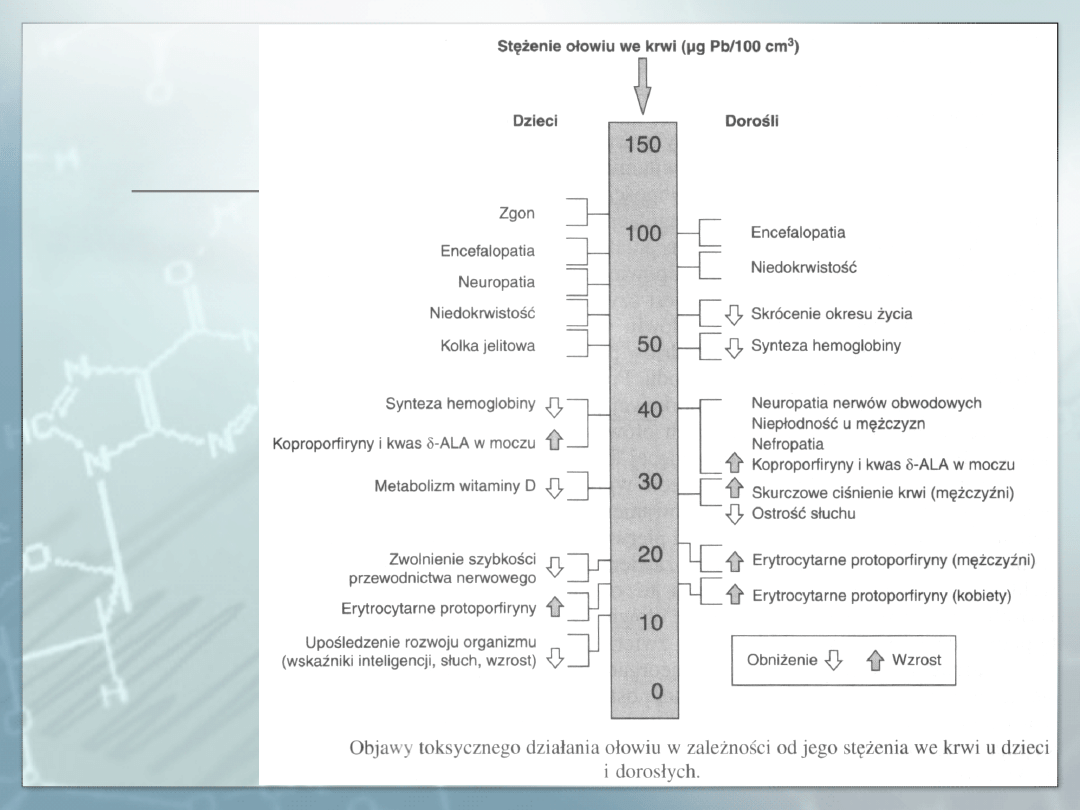
Zatrucia ostre. Zatrucia ostre nieorganicznymi związkami ołowiu
zdarzają się raczej rzadko i występują pod postacią ostrej
encefalopatii przy stężeniach ołowiu we krwi ok. 100 µg Pb/100
cm3. W przypadku ostrych zatruć u człowieka występują pieczenie
w ustach, wymioty, kolka jelitowa, biegunka przechodząca w
skurczowe zaparcie, spadek ciśnienia krwi i temperatury ciała.
Jednocześnie występuje krwiomocz, proteinuria, skąpomocz,
uszkodzenie o.u.n.
Objawami zaburzeń syntezy hemu są odbiegające od normy
fizjologicznej stężenia prekursorów hemu we krwi i w moczu.
Związki alkilortęciowe są bardziej toksyczne od nieorganicznych
połączeń ołowiu. Toksyczne działanie tetraetyloołowiu objawia się
głównie uszkodzeniem układu nerwowego. Występują wymioty,
wzmożenie odruchów, drgawek, drętwienie języka, spadek
ciśnienia tętniczego krwi, zwolnienie czynności serca. W
zatruciach ostrych tymi związkami zgon może nastąpić w ciągu
kilkunastu godzin lub kilku dni.

Występowanie, zastosowanie, narażenie. Wykorzystanie rtęci na skalę
przemysłową jest najważniejszym źródłem zanieczyszczenia
środowiska, wynosi bowiem 25 000-150 000 ton rocznie. Największe
stężenie tego pierwiastka występuje na ogół w łupkach węglowych i
bitumicznych oraz w zasadowych skałach krystalicznych.
Zawodowa ekspozycja na pary rtęci metalicznej stanowi ciągle główne
zagrożenie dla zdrowia ludzi. Ponad 50 zawodów stwarza zagrożenie
w wyniku kontaktu ze związkami rtęci. Najbardziej narażeni zawodowo
na działanie par rtęci są pracownicy zatrudnieni w przemyśle
wydobywczym, przy produkcji chloru i ługu metodami
elektrolitycznymi, przy produkcji barwników, fungicydów.
Źródłem rtęci zanieczyszczającej środowisko jest spalanie produktów
ropy naftowej i węgla, np. w sąsiedztwie elektrowni węglowej może
opadać rocznie ok. 400 g/h. W przyrodzie krążenie rtęci pochodzenia
naturalnego w postaci pary ma istotny wpływ na jej zawartość w glebie
i wodzie.
RTĘĆ
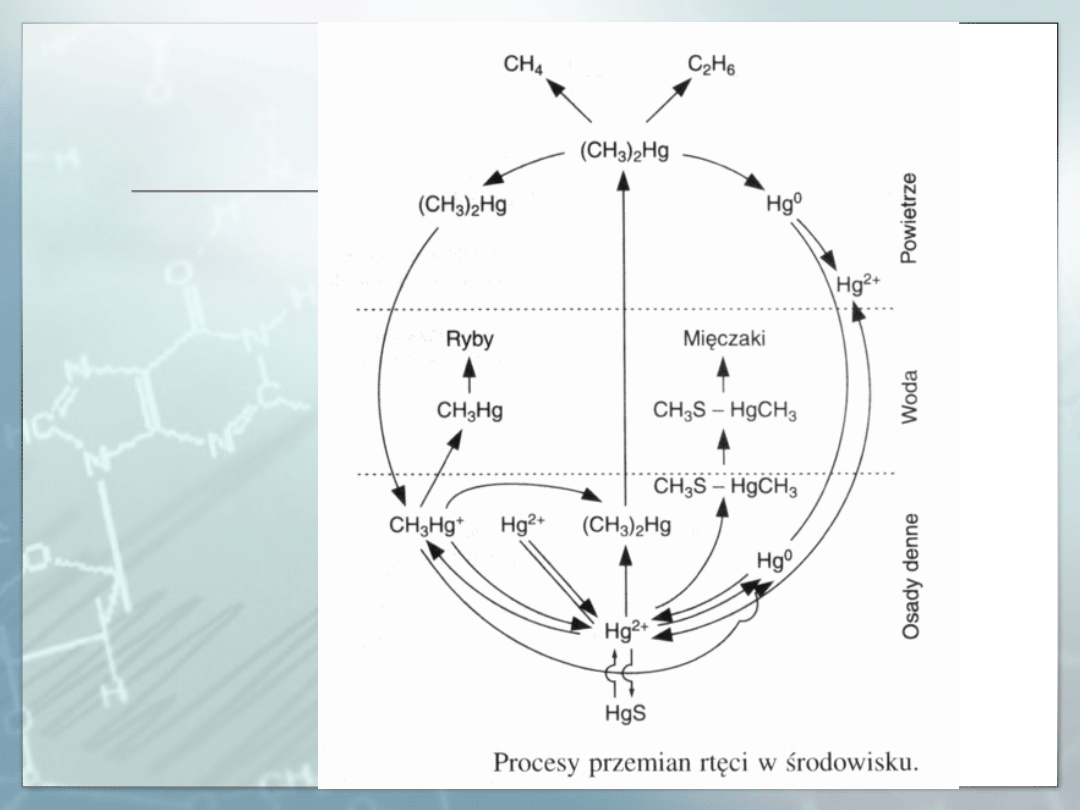
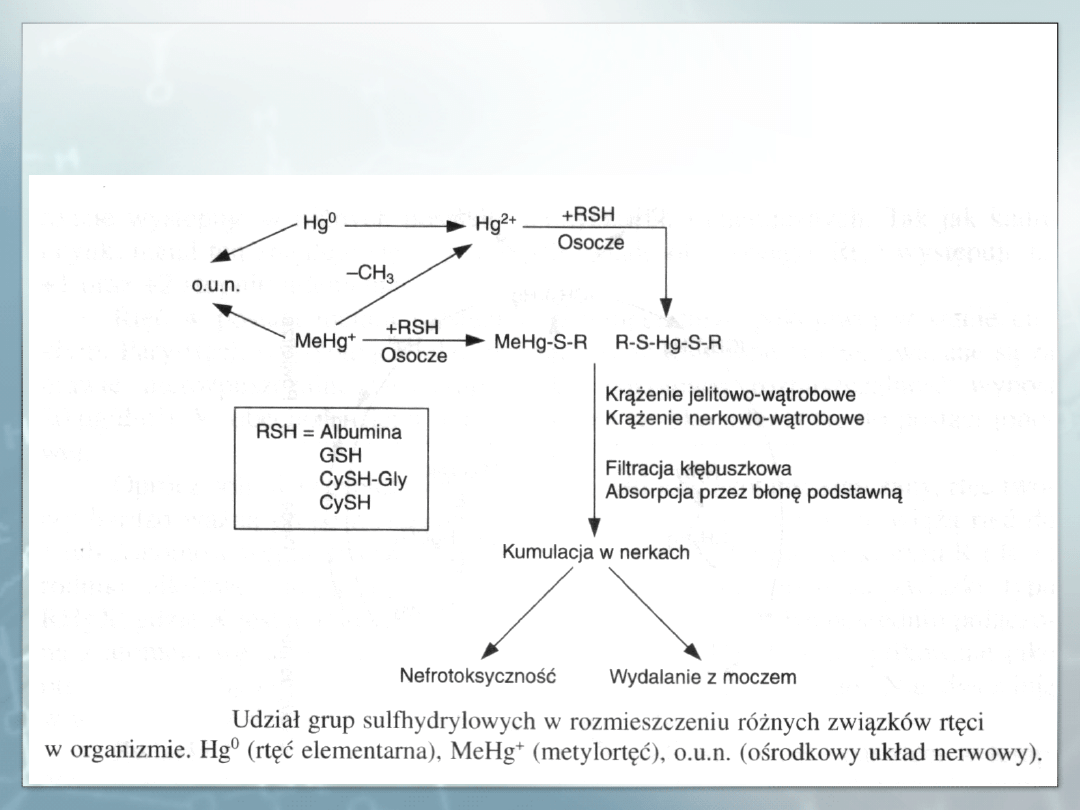

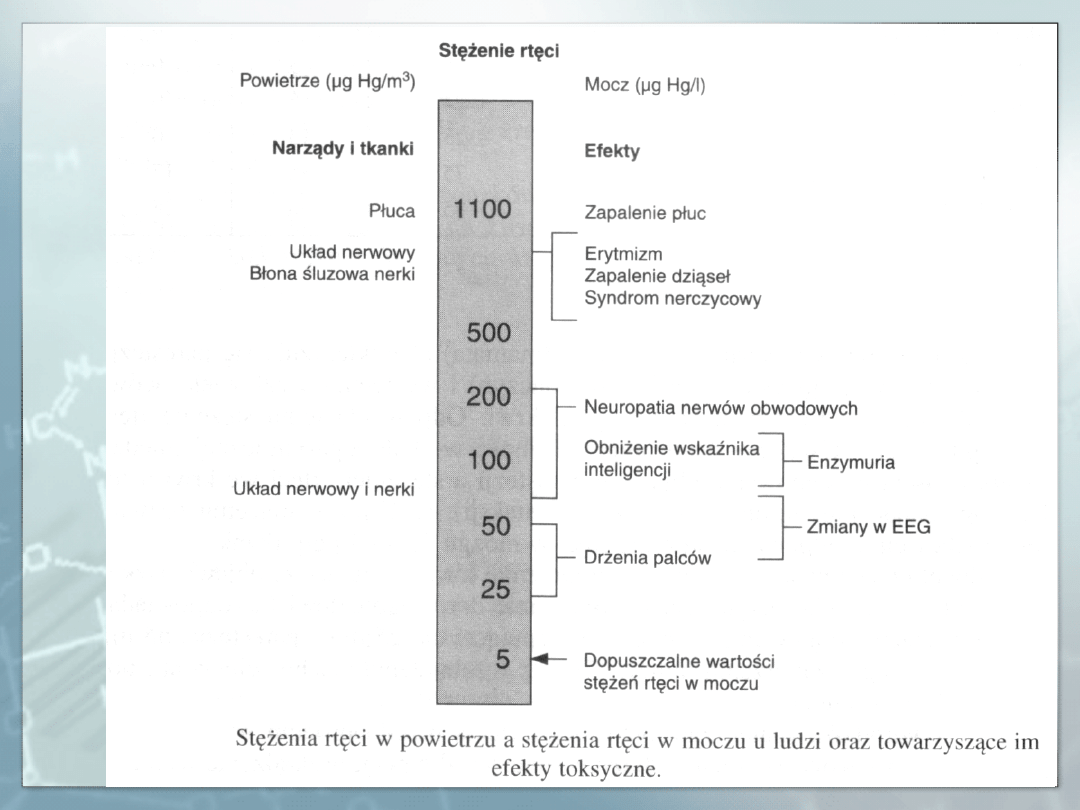
Zatrucia ostre. Narządem krytycznym w zatruciach ostrych parami rtęci są
płuca. Jako choroba zawodowa postać ostra zatrucia związkami rtęci występuje
rzadko. Pojawia się ona w następstwie dostania się do organizmu dużych ilości
rtęci przez drogi oddechowe. Może rozwinąć się ostre zapalanie oskrzeli,
oskrzelików i śródmiąższowe zapalenie płuc. Zgon następuje z powodu
niewydolności oddechowej. Może pojawić się krwotoczne zapalenie jelit z
odwodnieniem i ostrą niewydolnością krążenia, ślinotok, zapalenie błony
śluzowej jamy ustnej, objawy uszkodzenia nerek oraz uszkodzenie o.u.n. Postać
ostra może przejść w postać przewlekłą.
W przypadku spożycia nieorganicznych soli następuje ślinotok, pieczenie
w przełyku, wymioty, krwawa biegunka, martwica błony śluzowej jelit oraz
uszkodzenie czynności nerek, prowadzące do bezmoczu i uremii.
W przypadku przewlekłego narażenia na pary rtęci układem krytycznym jest
o.u.n.
Najpierw pojawiają się niecharakterystyczne objawy ogólne, jak osłabienie, ból
głowy i bóle kończyn. Pojawia się ślinotok, zapalenie błony śluzowej i dziąseł,
wypadanie zębów, wysychanie jamy ustnej. Obserwuje się występowanie
niebiesko-fioletowego rąbka na dziąsłach, skłonności do biegunek i objawy
uszkodzenia czynności nerek.

Związki metylortęciowe były przyczyną kilku epidemii zatruć
na świecie wśród ludzi spożywających ryby zawierające te
związki oraz pieczywo wypiekane z ziarna zaprawianego
fungicydem metylortęciowym.
Epidemie występowały w Japonii (Minamata Bay i Niigata) i
spowodowane były zanieczyszczeniem zbiorników wodnych
ściekami przemysłowymi zawierającymi związki rtęci.
Stężenie rtęci całkowitej w rybach sięgało 11 mg/kg. Po
spożyciu pieczywa zawierającego reszty zapraw
alkilortęciowych (metylowych i etylowych) w Iraku (1971-
1972) hospitalizowano 600 zatrutych, z których 500 zmarło.
Zawartość metylortęci w pszenicy wynosiła 3,7-14,9 mg/kg.

Stężenia rtęci
we krwi (µg/ml
(µM)
Objawy kliniczne (%)
pareste
zja
ataksja
dyzartria
(zaburzeni
e
mowy)
głuchot
a
śmierć
0,1-0,5 (0,5-
2,5)
5
0
5
0
0
0,5-1,0(2,5-5,0)
42
11
5
5
0
1-2 (5-10)
60
47
24
5
0
2-3 (10-15)
79
60
25
13
0
3-4(15-20)
82
100
75
36
17
4-5 (20-25)
100
100
85
66
28
Zależność między częstotliwością i nasileniem objawów klinicznych
a zawartością metylortęci we krwi dorosłego człowieka

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
Wykład 22
wyklad 11 toksyczno niemetali
Wyklad 7 Wlasnosci elektryczne metali
KPC Wykład (22) 09 04 2013
ćwiczenia i wykłady - 22 i 23 maja 2010r, Postępowanie cywilne
wykład 22.11.2009, NoR rok 1, Cywilne Prawo Rodzinne
GEOGRAFIA EKONOMICZNA WYKŁAD 22.01.2011, SZKOŁA, szkola 2011
kosmetologia wyklad 22 02 09(1)
Prawo finansowe wykład 22.01.2015, Studia
podstawy zarządzania wykłąd I 22 02 2013, WSM Kawęczyńska semestr II, PODSTAWY ZARZĄDZANIA WYKŁAD
Wygladzanie wykladnicze (22-58), WSE notatki, 5 sem
nanotechnologia wykłady Wykład 1 (22 03 2012)
Filozofia z etyką wykład 2 (22 10)
Podstawy organizacji i kierowania wyklad [22 11 2001]
wyklad13tt21-22, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, El
Grecja, WYKŁAD 7 22
więcej podobnych podstron