
KOMÓRKI
MACIERZYSTE
Karolina
Drążkowska

komórki macierzyste
• samoodnawialne, zdolne do
potencjalnie nieograniczonej liczby
podziałów
• możliwość różnicowania się
w wyspecjalizowane typy komórek
klasyfikacja
zdolność do różnicowania
-totipotencjalne -pluripotencjalne -multipotencjalne
-unipotencjalne
pochodzenie
-embrionalne -płodowe -dorosłe
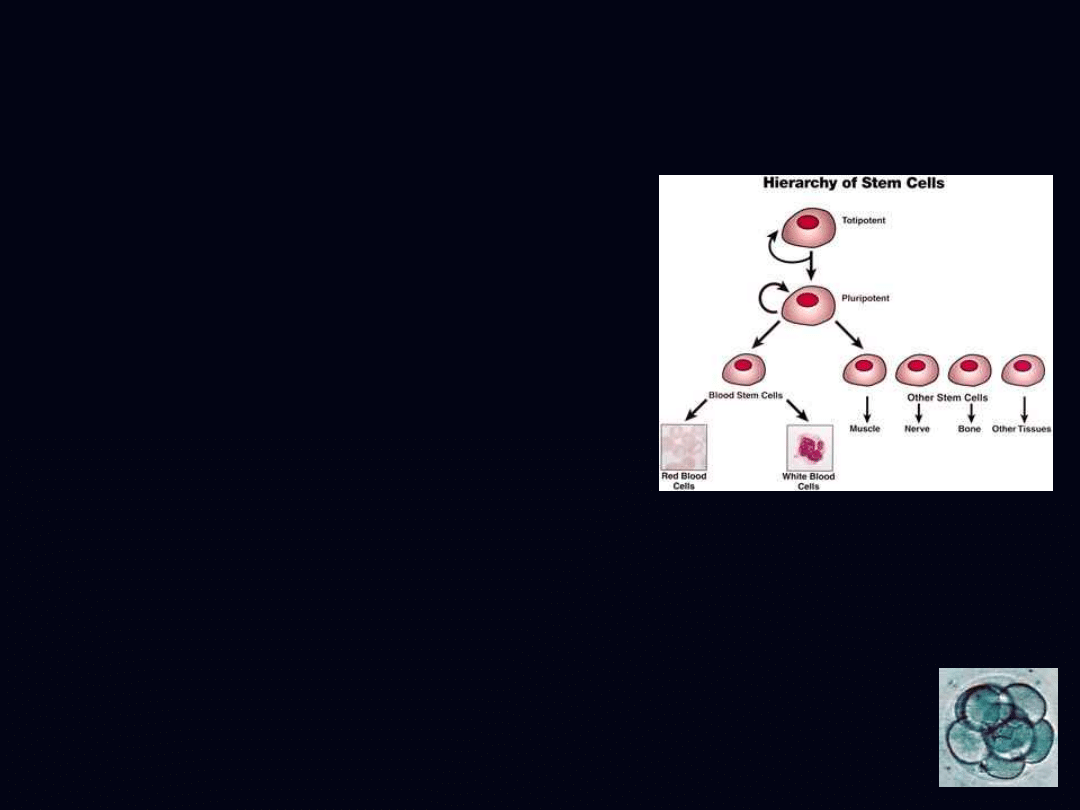
• totipotencjalne - mogą
różnicować się w każdy typ
komórek organizmu oraz komórki
łożyska
• pluripotencjalne - mogą dać
początek każdemu typowi
komórek za wyjątkiem komórek
totipotencjalnych i komórek
łożyska
• multipotencjalne - mogą dać
początek komórkom
pochodzącym z jednego listka
zarodkowego i mają mniejszy
zakres różnicowania się
• unipotencjalne - mogą
wytworzyć tylko jeden typ
komórek
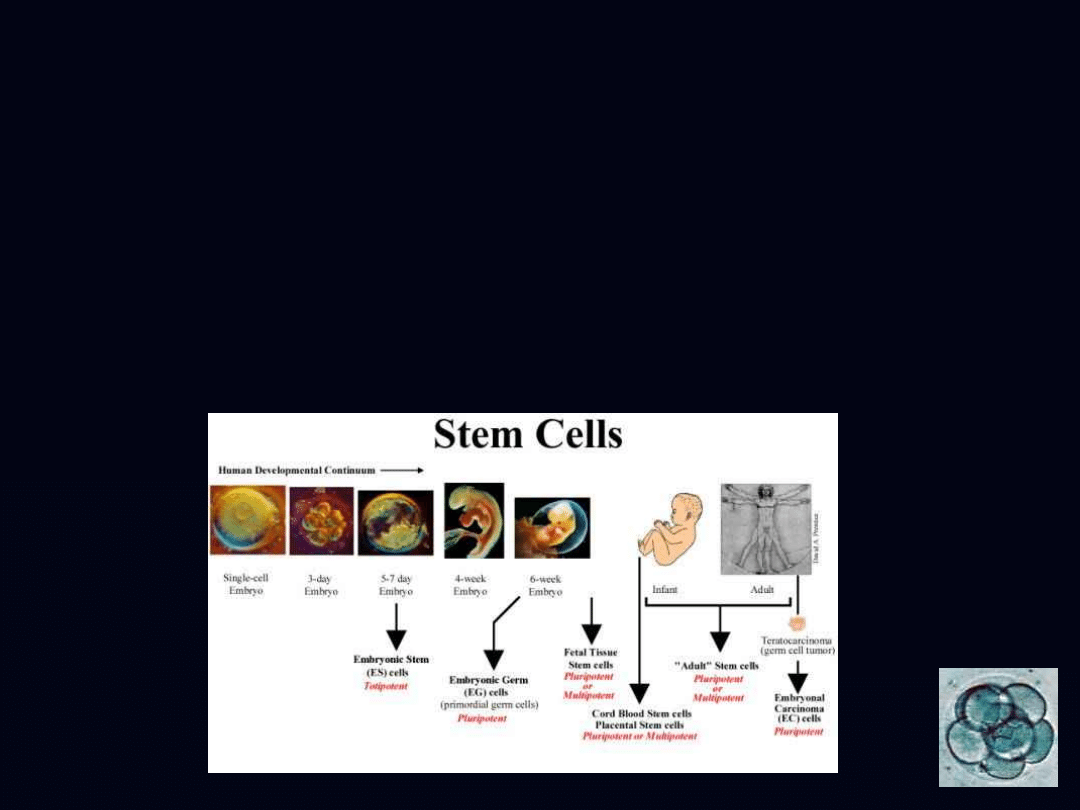
• z embrionów ludzkich uzyskiwanych metodą
zapłodnienia in vitro
• z embrionów uzyskiwanych metodą klonowania
• z tkanki płodu po poronieniu czy aborcji
• z krwi pępowinowej podczas porodu
• z organizmu ludzkiego (komórki macierzyste dorosłe)
ludzkie komórki macierzyste można otrzymywać
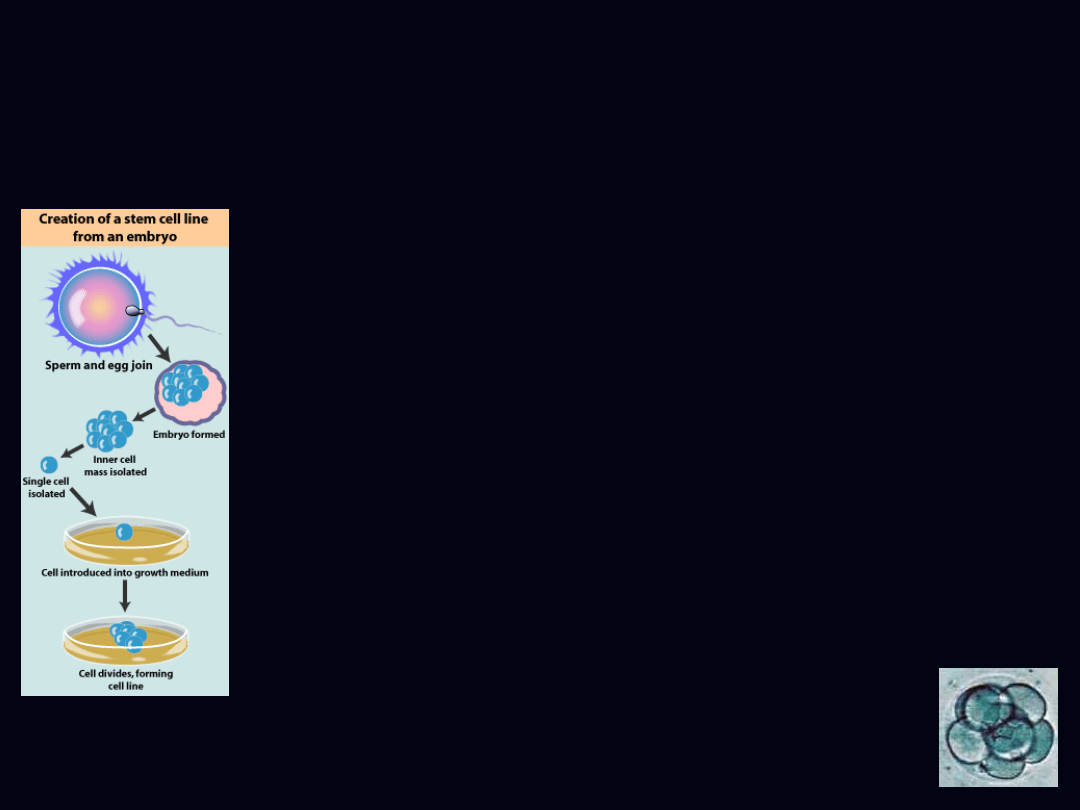
embrionalne komórki
macierzyste
ESCs (embrionic stem cells)
- kilkudniowy embrion w stadium
blastocysty
- pluripotencjalne
- łatwość uzyskania
- zapłodnienie in vitro (IVF)
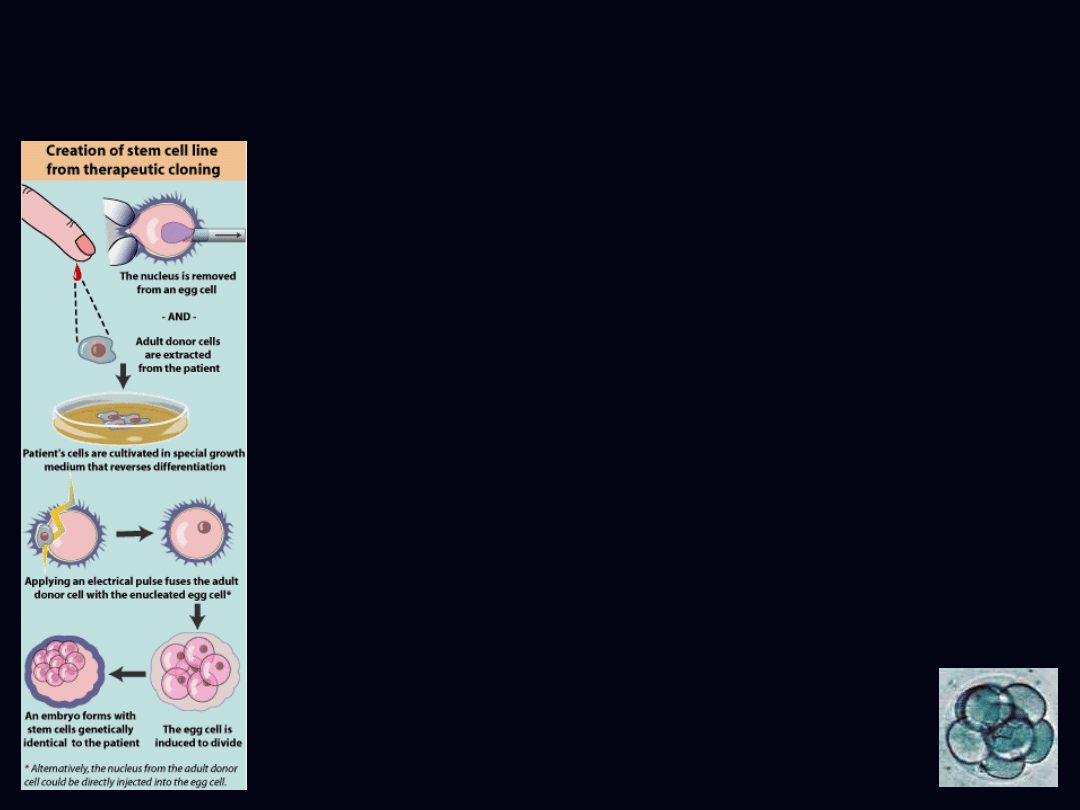
Transfer jądra komórki
somatycznej
somatic cell nuclear transfer
- źródło embrionalnych komórek
macierzystych
- ominięcie bariery zgodności
tkankowej
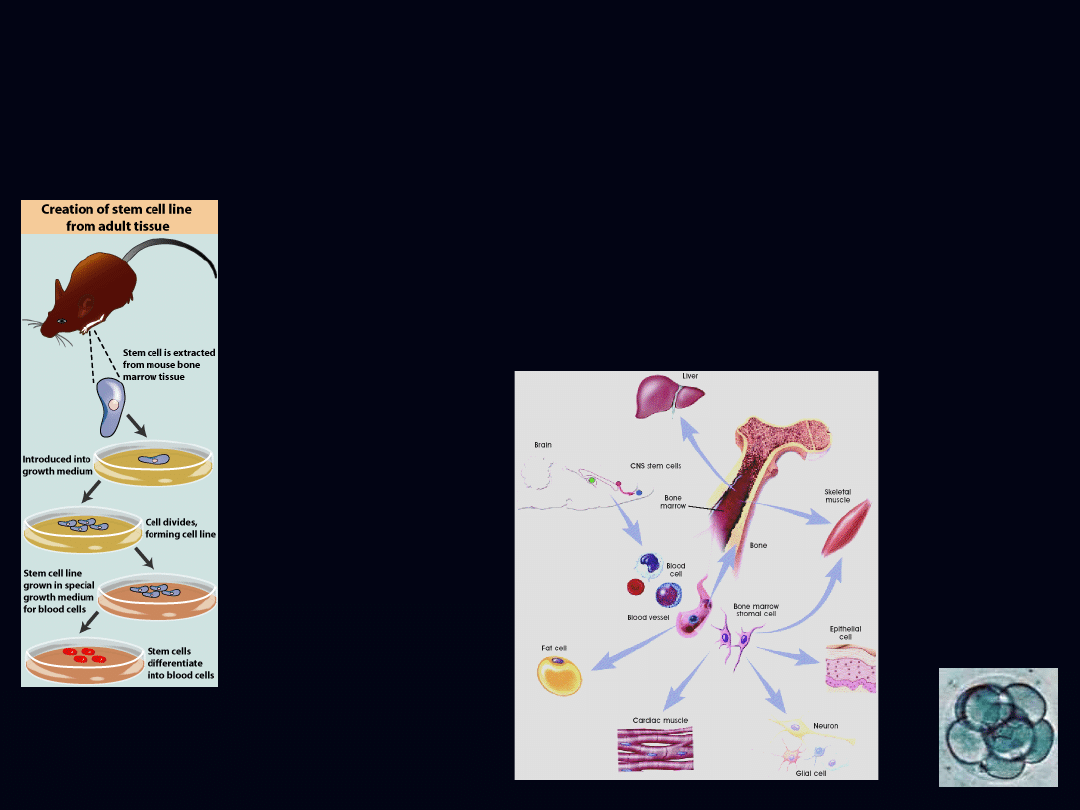
somatyczne/dorosłe komórki
macierzyste
somatic/adult stem cells
- większość dorosłych
tkanek
- krew pępowinowa
- odnowa i naprawa tkanek
- potencjał
- plastyczność

krew pępowinowa
• biologiczna polisa
• rekonstrukcja układu krwiotwórczego
• szybkie nieinwazyjne, bezbolesne pobranie
• skuteczne zastosowanie w leczeniu ponad 70
chorób
• brak zastrzeżeń natury moralnej
• przewaga nad komórkami szpiku kostnego
krew pępowinowa >> szpik
- znacznie mniejsze ryzyko wystąpienia odrzucenia przeszczepu
- duża plastyczność immunologiczna (są to komórki tzw. “naiwne”
immunologicznie)
- bardzo prosta metoda pobrania
- znacznie mniejsze ryzyko wystąpienia reakcji przeszczep przeciwko
gospodarzowi (GvHD)
- większa tolerancja pod względem antygenów zgodności tkankowej (HLA)
- zawartość komórek macierzystych w krwi pępowinowej jest dziesięciokrotnie
wyższa niż w szpiku
- większa zdolność do namnażania się komórek
- możliwość natychmiastowego użycia do przeszczepu
- mniejsze ryzyko powikłań zakaźnych

ostre białaczki
-ostra białaczka bifenotypowa
-ostra białaczka limfoblastyczna (AAL)
-ostra białaczka małozróżnicowana
-ostra białaczka szpikowa (AML)
białaczki przewlekłe
-młodzieńcza postać przewlekłej białaczki szpikowej
(JCML)
-młodzieńcza postać białaczki mielomonocytowej (JMML)
-przewlekła białaczka limfatyczna (CLL)
-przewlekła białaczka szpikowa (CML)
zespół mielodysplastyczny
-niedokrwistość oporna na leczenie (RA)
-niedokrwistość oporna na leczenie ze zwiększoną
blastozą (RAEB)
-niedokrwistość oporna na leczenie z obecnością
syderoblastów (RA-S)
-przewlekła białaczka mielomonocytowa (CMML)
choroby spowodowane defektem komórki macierzystej
-ciężka niedokrwistość aplastyczna
-napadowa hemoglobinuria nocna (PNH)
-niedokrwistość Fanconiego
zespoły mieloproliferacyjne
-agnogeniczna metaplazja szpikowa
-czerwienica prawdziwa
-ostra mielofibroza
-pierwotna nadpłytkowość
choroby fagocytów
-dysgenezja retikularna
-niedobór aktyny neutrofilowej
-przewlekła choroba ziarniniakowa
-zespół Chediaka-Higashiego
choroby związane z zaburzeniami spichrzania w
liposomach
-adrenoleukodystrofia
-choroba Gauchera
-choroba Krabba
-choroba Niemana-Picka
-choroba Wolmana
-metachromatyczna leukodystrofia
-mukolipidoza II
-mukopolisacharydoza (MPS)
-zespół Huntera (MPS-II)
-zespół Hurlera (MPS-IH)
-zespół Maroteaux-Lamy'ego (MPS-VI)
-zespół Morquio (MPS-IV)
-zespół podkradania, niedobór beta- glukoronidazy (MPS-VII)
-zespół Sanfilippa (MPS-III)
-zespół Sheiego (MPS-IS)
inne nowotwory złośliwe
-mięsak Ewinga
-nerwiak zarodkowy współczulny
-rak nerki
-rak piersi
histiocytozy
-hemofagocytoza
-histiocytoza-X
-rodzinna erytrofagocytarna limfohistiocytoza (FEL)
dziedziczne nieprawidłowości krwinek czerwonych
-aplazja czysto czerwonokrwinkowa
-b-talasemia major
-niedokrwistość sierpowatokrwinkowa
wrodzone (dziedziczne) zaburzenia układu odpornościowego
-ataksja-teleangiektazja
-ciężki złożony niedobór odporności (SCID)
-SCID z brakiem limfocytów T i B
-SCID z brakiem limfocytów T i normalną liczbą limfocytów B
-SCID z niedoborem deaminazy adenozynowej
-zaburzenia adhezji krwinek białych
-zaburzenia proliferacji limfocytów sprzężone z chromosomem X
-zespół DiGeorga
-zespół Kostmanna
-zespół nagich limfocytów
-zespół Omenna
-zespół Wiskotta-Aldicha
-zwykły zmienny niedobór odporności
inne choroby dziedziczne
-hipoplazja chrząstek i włosów
-osteopetroza Trombastenia Glanzmanna
-zespół Lesch-Nyhana
nieprawidłowości płytek krwi
-amegakariocytoza
-wrodzona trombocytopenia
nieprawidłowości komórek plazmatycznych
-białaczka plazmocytowa
-makroglobulinemia Waldenstroma
-szpiczak mnogi

banki komórek macierzystych
Activision Life
Cryo-Save Polska
Europejski Bank Krwi Pępowinowej MACIERZYNSTWO
Longa Vita
Novum
Polski Bank Komórek Macierzystych
Progenis
opłata wstępna 500
opłata podstawowa 1500
opłata za przechowywanie
1 rok 400
5 lat 1600
10 lat 2800
17 lat 4400
99 lat 9800
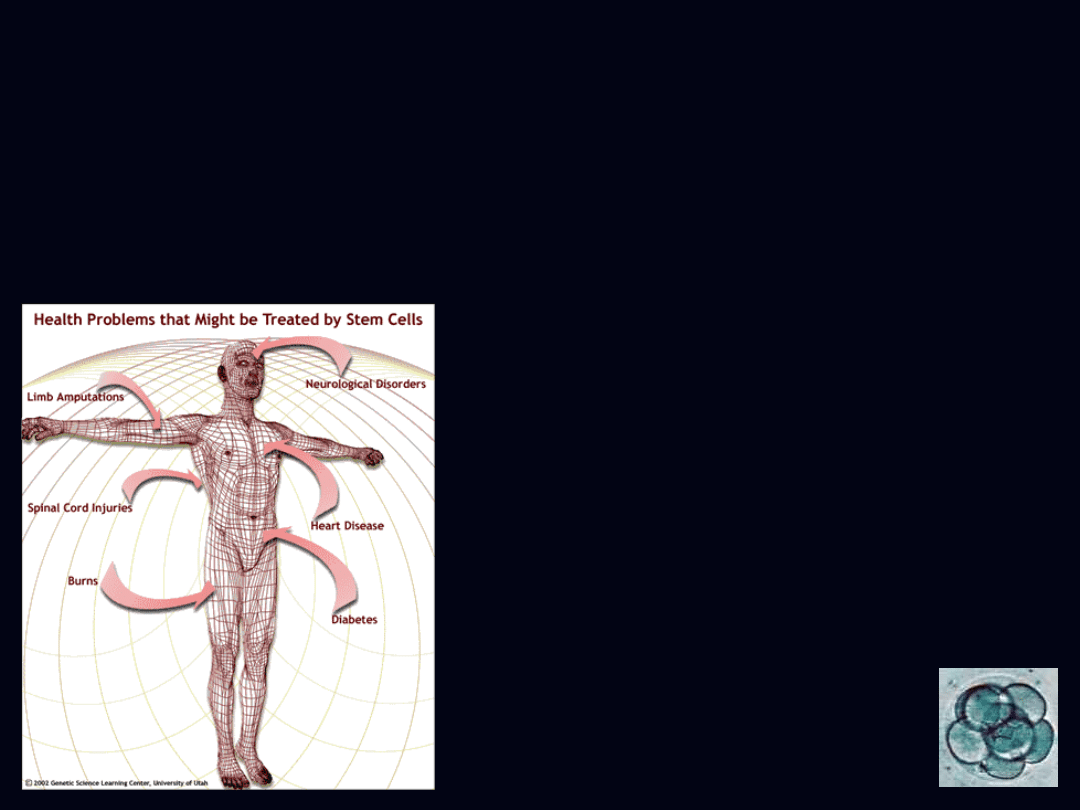
zastosowanie
• zawał mięśnia sercowego
• choroby
neurologiczne/neurodegradacyjne
• choroby autoimmunologiczne
• wady naczyń krwionośnych i zastawek
serca
• schorzenia rogówki oka
• wrodzona łamliwość kości
• dystrofia mięśniowa
• schorzenia jajników
• uszkodzenia chrząstki
• choroby wątroby
• choroby układu oddechowego
• cukrzyca
• hodowla narządów
- nowotwory i choroby układu krwionośnego i
odpornościowego
- poparzenia
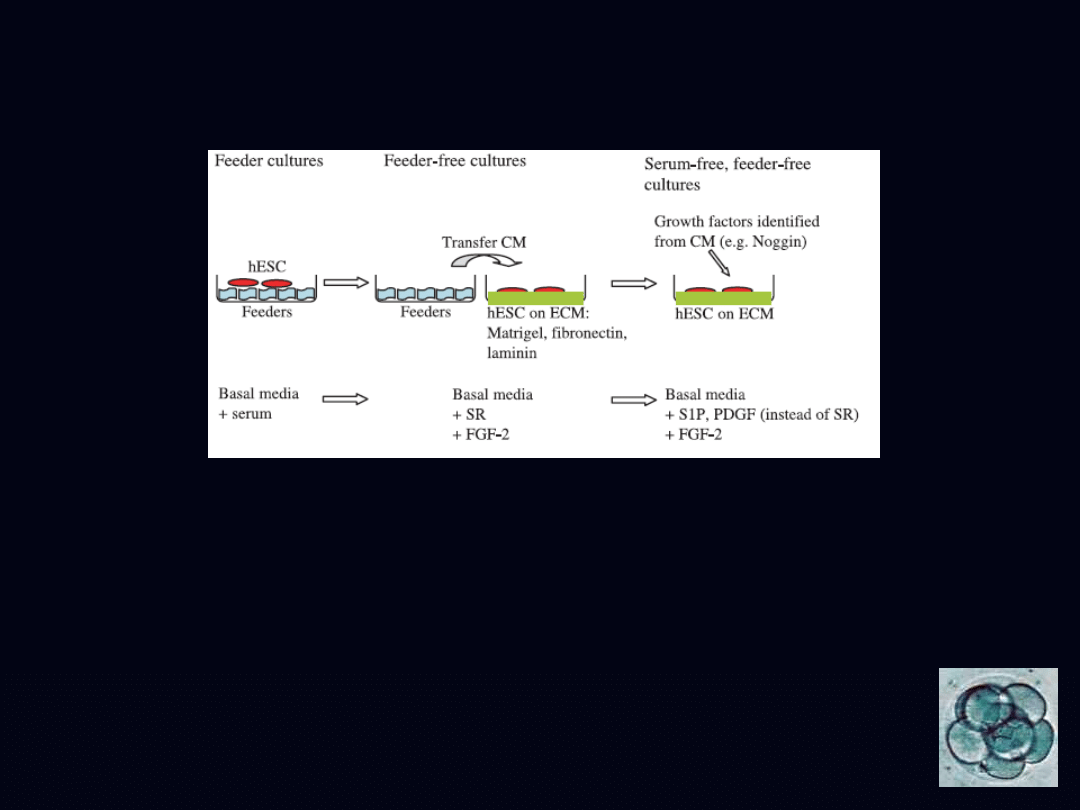
feeder-free serum-free culture system
CM conditioned media
ECM extracellular matrices
SR serum replacer
S1P sphingosine-1-phosphate
PDGF platelet-derived growth factor
FGF-2 fibroblast growth factor-2
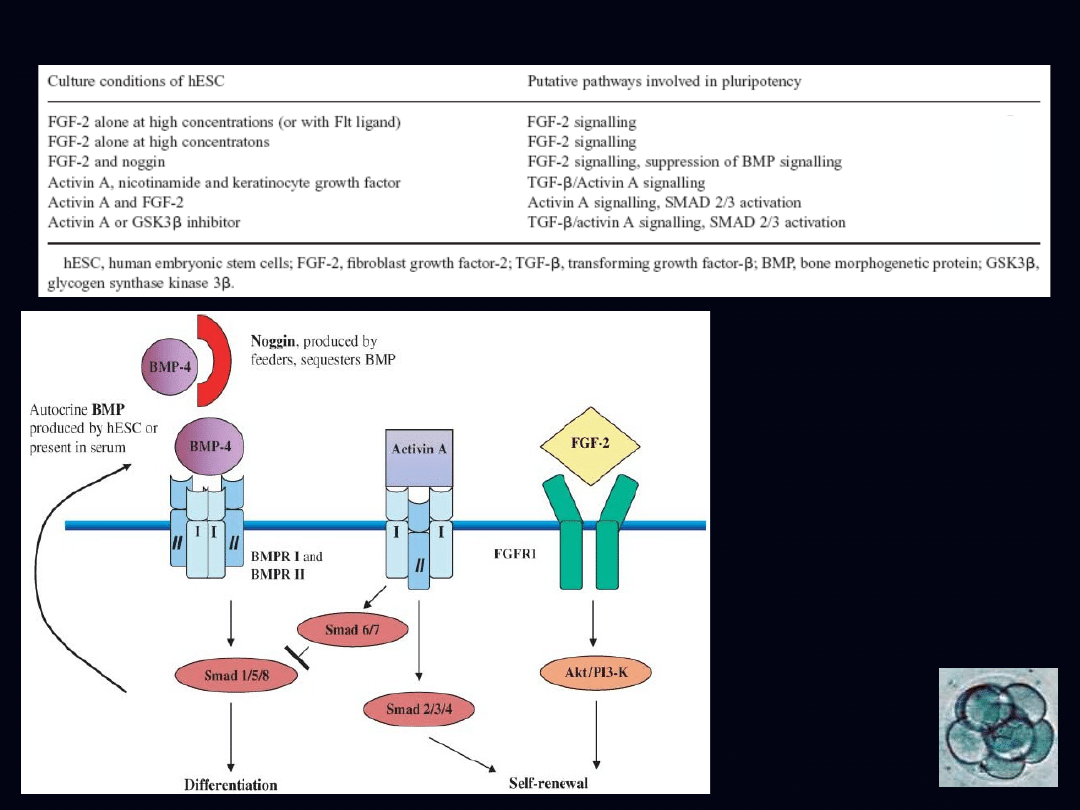
Czynniki wzrostu i potencjalne szlaki zachowania
pluripotencjalności ESC
charakterystyczne dla
hESC
- czynniki transkrypcyjne
Oct4, Nanog, Sox2
- wysoki poziom ekspresji
telomerazy i alkalicznej
fosfatazy
- markery powierzchniowe
komórek w tym SSEA-3,
SSEA-4
(StageSpecificEmbryonicAn
tigen), Tra-1-60, Tra-1-81
(TumorRejectionAntigen),
GCTM-2
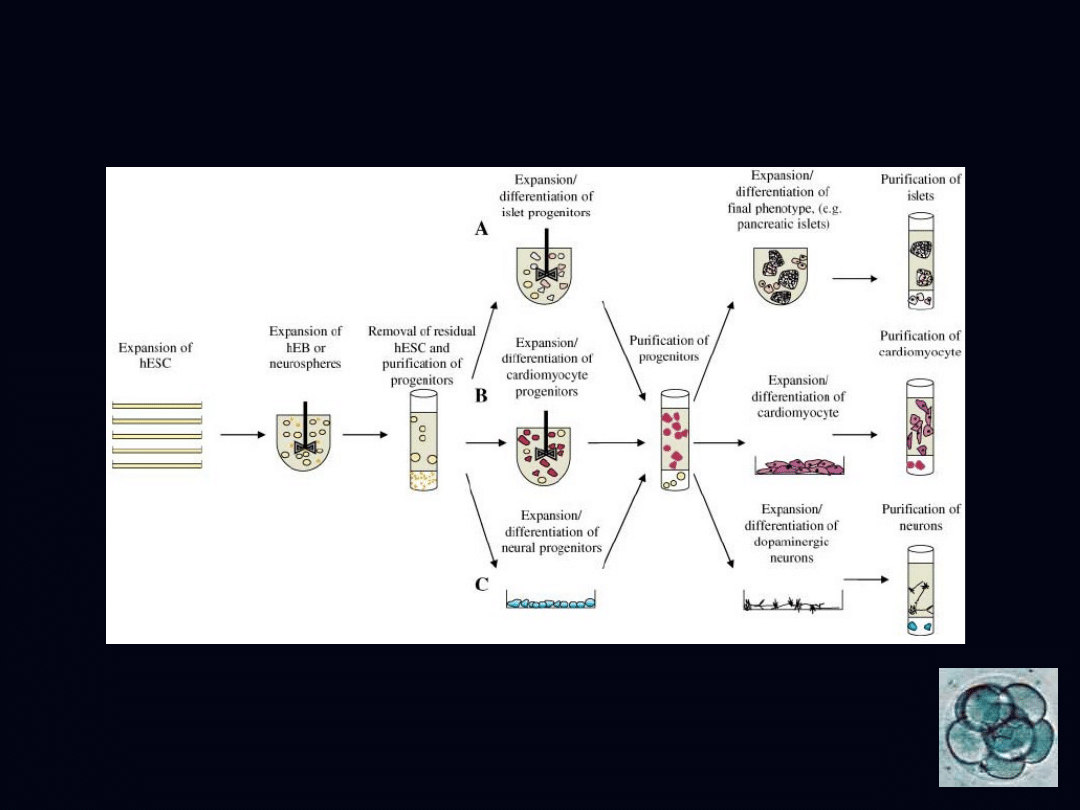
schemat produkcji

cytomatrix

etyka
• status embrionu – życie ludzkie czy wiązka
komórek
• początek życia
• klonowanie reprodukcyjne a terapeutyczne
• życie ludzkie czy użyteczność
• nadliczbowe embriony, dzieci śnieżynki

www.bcm.edu
www.brown.edu
www.mp.pl
kbn.icm.edu.pl
www.biobank.pl
www.activisionlife.com.pl
www.longavita.pl
www.novumbank.com
www.pbkm.pl
www.macierzynstwo.pl
www.progenis.pl
cordis.europa.eu
wiara.pl
www.kurierplus.com
www.racjonalista.pl
learn.genetics.utah.edu
en.wikipedia.org
www.stemcellresearchfoundat
ion.org
www.thenakedscientists.com
www.eurostemcell.org
www.iscr.ed.ac.uk
eurostemcell.org/Outreach/Film/film_eng.htm
Kogler G. et al. A new Human Somatic Stem Cell from Placental Cord Blood with Intrinsic
Pluripotent Differentiation Potential JEM 2004
Sanberg P.R. et al. Umbilical Cord Blood-Derived Stem Cells and Brain Repair. Ann. N.Y. Acad.
Sci. 2005;
Kogler G. et al. Simultaneous cord blood transplantation of ex vivo expanded together with
non-expanded cells for high pisk leukemia. Marrow Transplant 1999
Pecora A.L. et al. Prompt and durable engraftment in two older adult patient with high risk
chronic myelogenous leukemia (CML) using ex vivo expanded and unmanipulated unrelated
umbilical cord blood. Bone Marrow Transpl. 2000
Fernandez M.N. et al. Evaluation of engraftment of ex vivo expanded cord blood in humans.
Bone Marrow Transplant. 2000 Fernandez M.N. et al. Cord blood transplants: Early recovery
of neutrophils from co-transplanted sibling haploidentical progenitor cells and lack of
engraftment of cultured cord blood cells, as ascertained by analysis of DNA polymorphisms.
Marrow Transplant 2001
Shpall E.J. et al. Transplantation of Ex Vivo Expanded Cord Blood. Biol Blood Marrow
Transplant 2002
Capmany G. et al. Short-term, serum-free, static culture of cord blood – derived CD34+ cells:
Effects of FLT3-L and MIP-1 alpha on in vitro expansion of hematopoietic progenitor cells.
Haematologica 1999
Jaroscak J. et al. Augmentation of umbilical cord blood (UCB) transplantation with ex vivo–
expanded UCB cells: results of a phase 1 trial using the AastromReplicell System. Blood 2003
Chivu M. et al. The comparison of different protocols for expansion of umbilical-cord blood
hematopoietic stem cells. J Cell Mol Med 2004
Chao-Ling Yao et al. Characterization of Serum-Free Ex Vivo–Expanded Hematopoietic Stem
Cells Derived from Human Umbilical Cord Blood CD133+ Cells. Stem Cells and Development
2006
Pojda Z.: Kliniczne zastosowania komórek macierzystych - stan obecny i perspektywy:
nowotwory. J. Oncol., 2002
Morciniec P.: Ocalić (obraz) człowieka: istota dyskusji o komórkach macierzystych. W: Ocalić
cywilizacje - ocalić ludzkie życie. Kraków, 2002
Zalewski Z.: Czy istnieją granice postępu w badaniach naukowych w medycynie?: spór o
komórki macierzyste. Sztuka Leczenia, 2002
Clinical and Experimental Pharmacology and Physiology (2006) Frontiers in Research Review:
Cutting-Edge Molecular Approaches to Therapeutics
HUMAN EMBRYONIC STEM CELLS: TECHNOLOGICAL CHALLENGES TOWARDS THERAPY
Steve KW Oh and Andre BH Choo
The Stem State: Plasticity Is Essential, Whereas Self-Renewal and Hierarchy Are Optional Dov
Zipori Stem Cells 2005
Design principle of gene expression used by human
stem cells: implication for pluripotency
Michal Golan-Mashiach, Jean-Eudes Dazard, Sharon Gerecht-Nir, Ninette Amariglio, Tamar
Fisher, Jasmine Jacob-Hirsch, Bella Bielorai, Sivan Osenberg, Omer Barad, Gad Getz, Amos
Toren, Gideon Rechavi, Joseph Itskovitz-Eldor, Eytan Domany, David Givol
Gene Expression Profiling of Embryonic Stem Cells Leads to Greater Understanding of
Pluripotency and Early Developmental Events
Raj R. Rao and Steven L. Stice
Bjorson CR, Reitze RL, Reynolds BA, Magli MC, Vercovi AL (1999) Turning brain into blood: a
hematopoetic fate adopted by adult neural stem cells in vivo.
Unraveling the transcriptional network controlling ES cell
Pluripotency Sridhar Rao, Stuart H Orkin Genome Biology 2006
Abkowitz JL (2002) Can human hematopoetic stem Wells become skin, gut or liver Wells?
Svendsen CN, Rosser AE (1995) Neurones from stem Wells?
Poulsom R, Alison MR, Forbers SJ, Wright NA (2002) Adult stem cells plasticity
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Komórka macierzysta, głodzenie i cukrzyca
Mezoterapia komórkami macierzystymi MIC
Biol molek komórki macierzyste
Komorki macierzyste
Komórki macierzyste, Med Kato, Histologia
komorki macierzyste2, Biologia Komórki
Stworzono nanocząstki, które niszczą rakowe komórki macierzyste
Nanodiamenty zniszczą rakowe komórki macierzyste
Komórki macierzyste, Histologia i cytologia, mikroskopia, Kultury in vitro
Ilościowe i jakościowe zmiany białek osocza krwi + Komórki macierzyste(2), medycyna
Mezenchymalne komórki macierzyste ich biologia
Komórki macierzyste, Biologia komórki
Komorki macierzyste biologia i Nieznany
Komórki macierzyste i ich związek ze srebrem
komórki macierzyste, STUDIA, biologia komórki
Komorki macierzyste tkanek zeba Nieznany
więcej podobnych podstron