
Układ okresowy
W 4

Układ okresowy
Analiza okresowości właściwości
fizycznych i chemicznych
Czyli: co w układzie okresowym
piszczy

Efektywny ładunek jądra
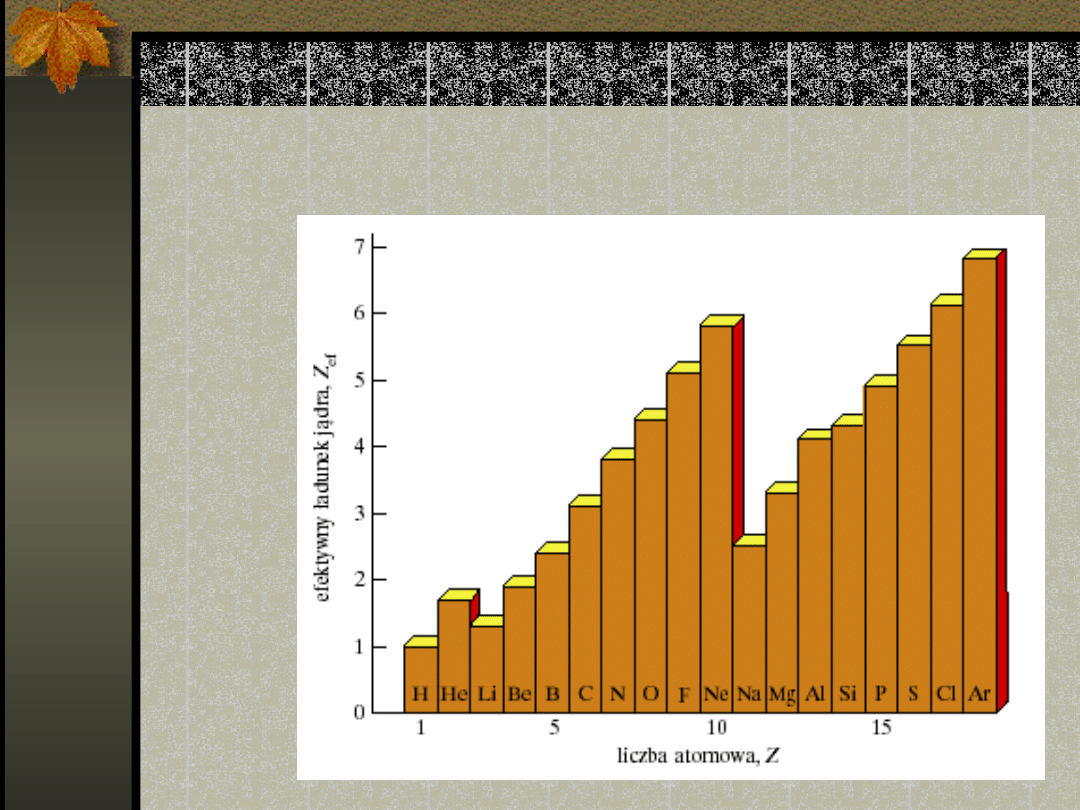
Efektywny ładunek jądra

Efektywny ładunek
Efektywny ładunek jądra wzrasta
w okresie od strony lewej ku
prawej,
maleje jednak, gdy elektrony
osiągają
większą główną liczbę kwantową
DLACZEGO?

Związek efektywnego
ładunku i wielkością atomu
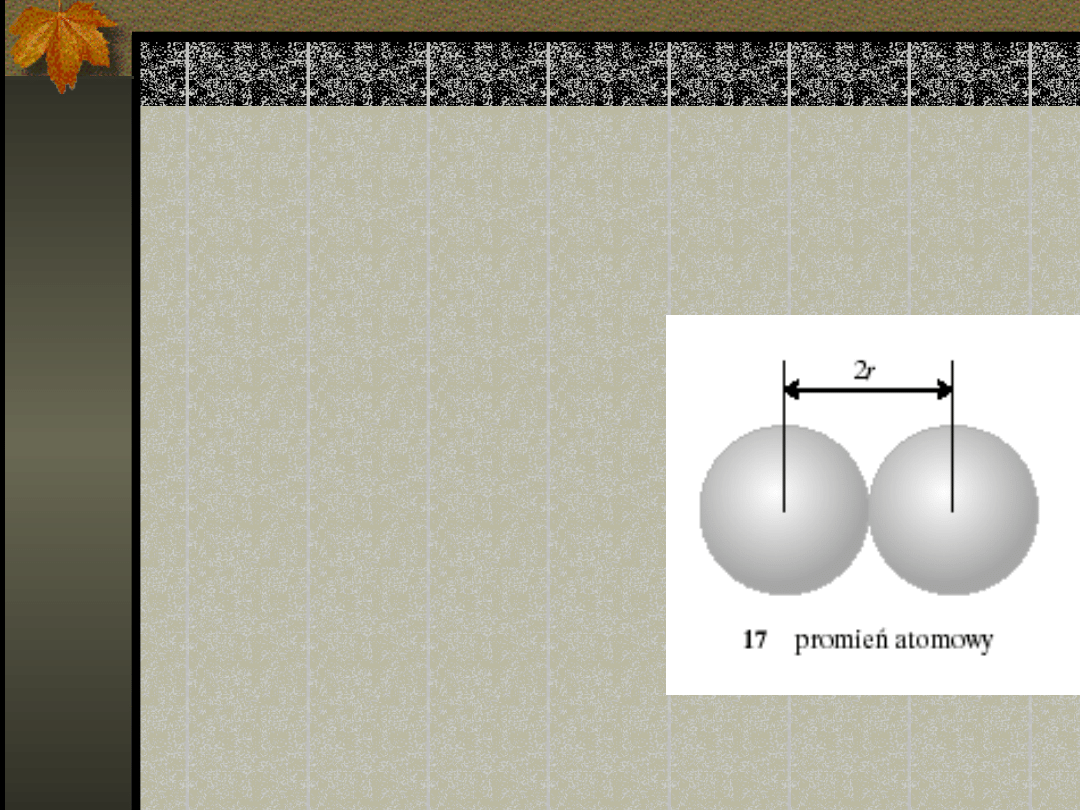
Promienie atomowe
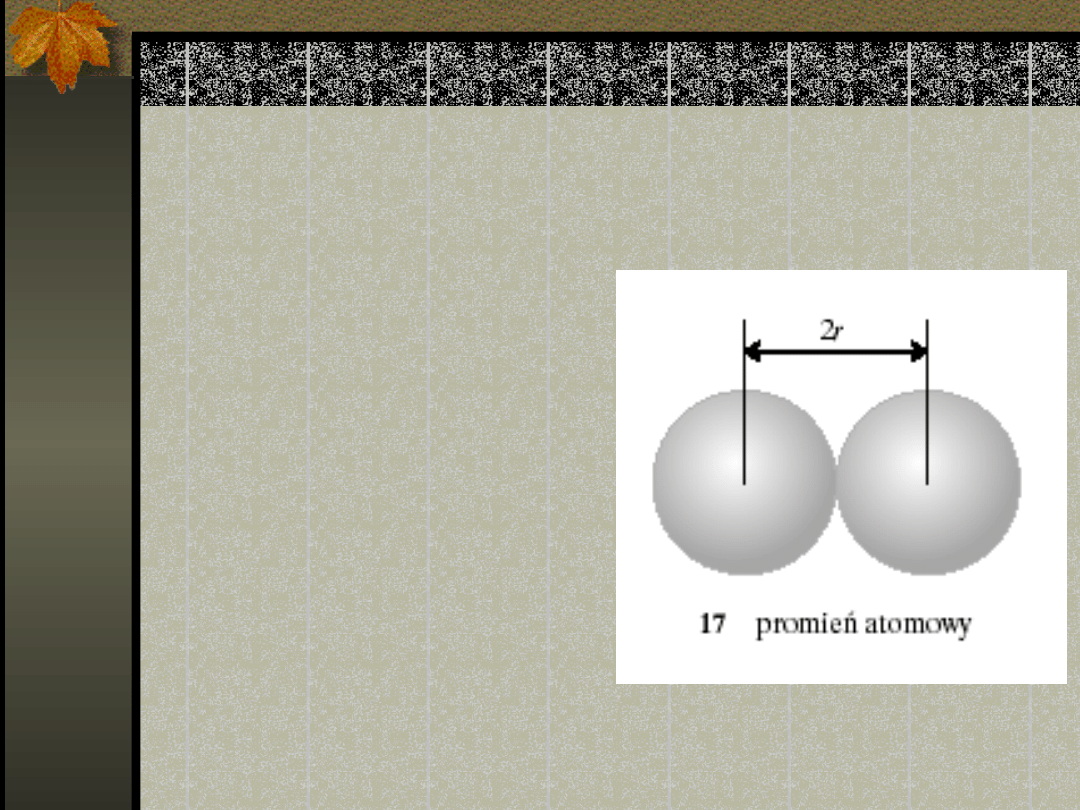
Promień atomowy -
definicja
Faza stała ; połowa
odległości
pomiędzy środkami
sąsiednich atomów.
Dla miedzi:
256 pm r = 128
pm
1 pm = 10
-12
m
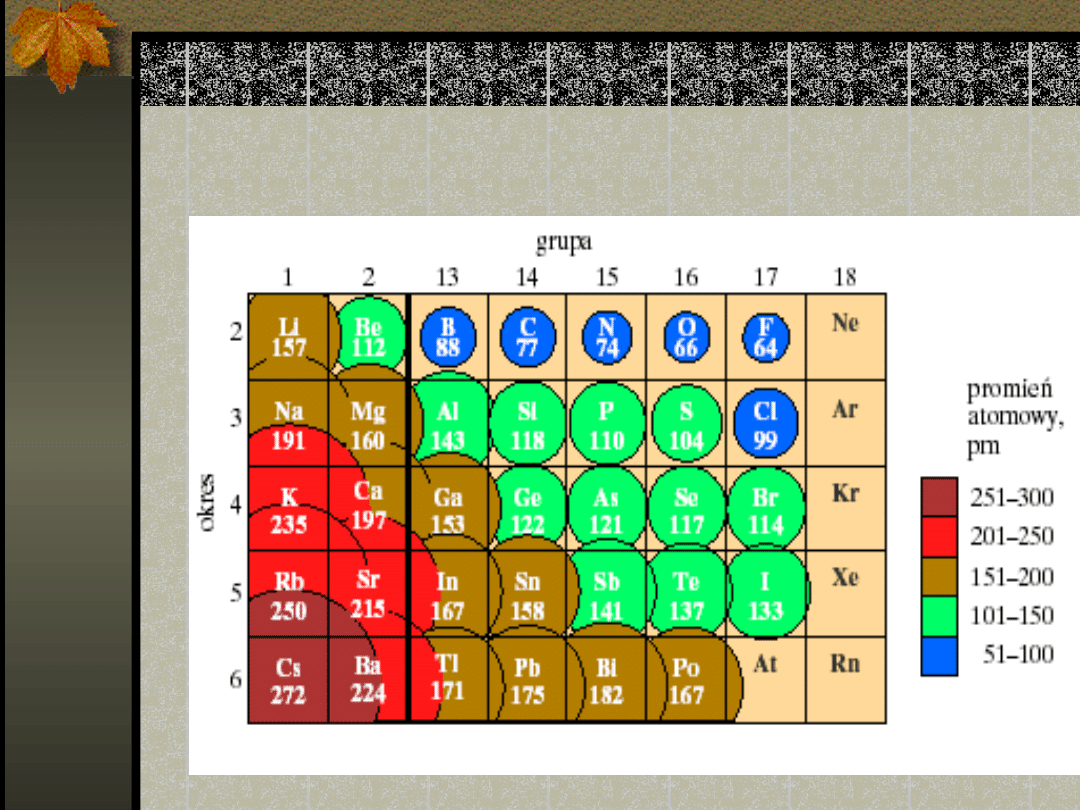
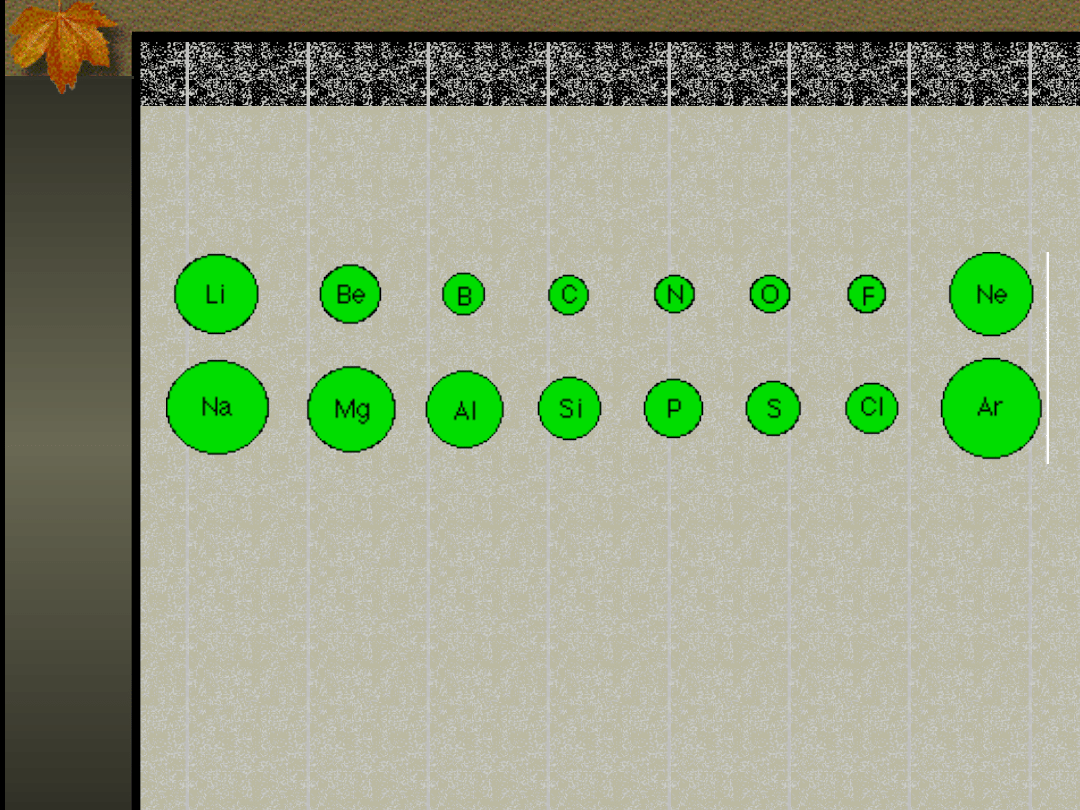
Wielkości promieni
atomowych w obrębie grup
głównych

Okresowa zmienność
promieni
atomowych
pierwiastków
Zmienność tę można wyjaśnić,
biorąc pod uwagę wzrost
efektywnego ładunku jądra
związany ze wzrostem liczby
atomowej
w okresie i wzrostem głównej liczby
kwantowej ku dołowi grupy.
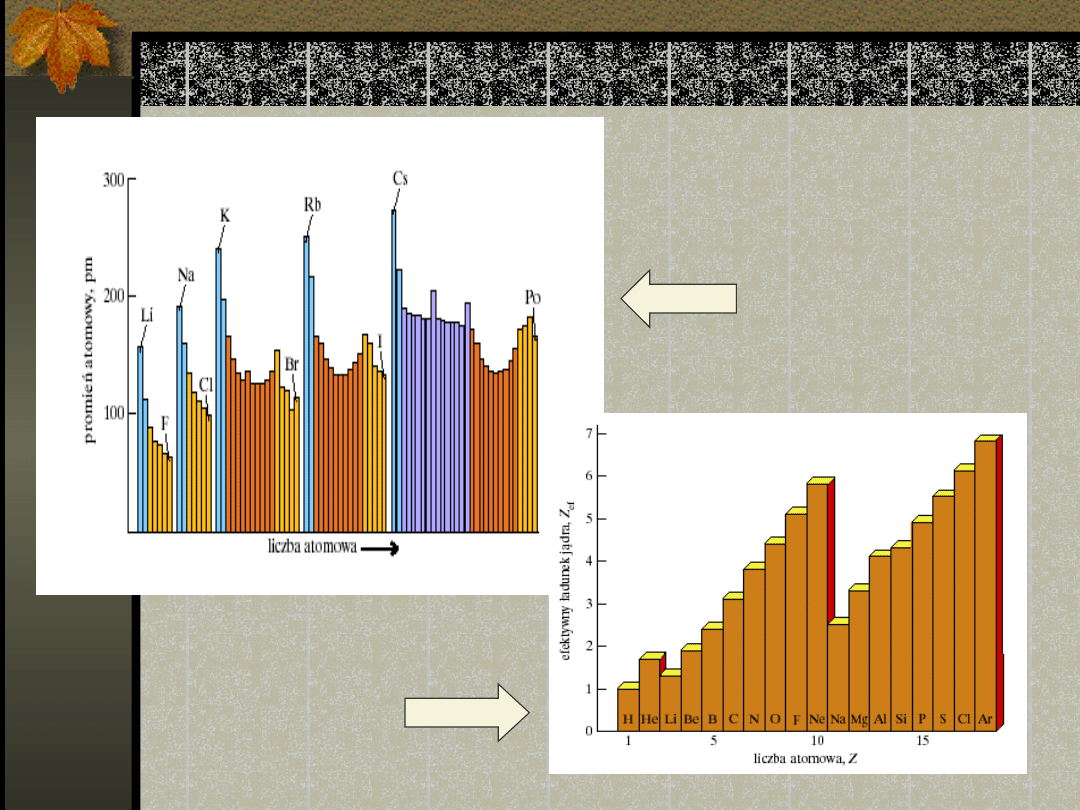
porównanie
Promień
atomowy
Ładunek
efektywny

Ogólnie, promienie
atomowe wzrastają ku
dołowi grupy i maleją
w okresie od strony
lewej ku prawej.
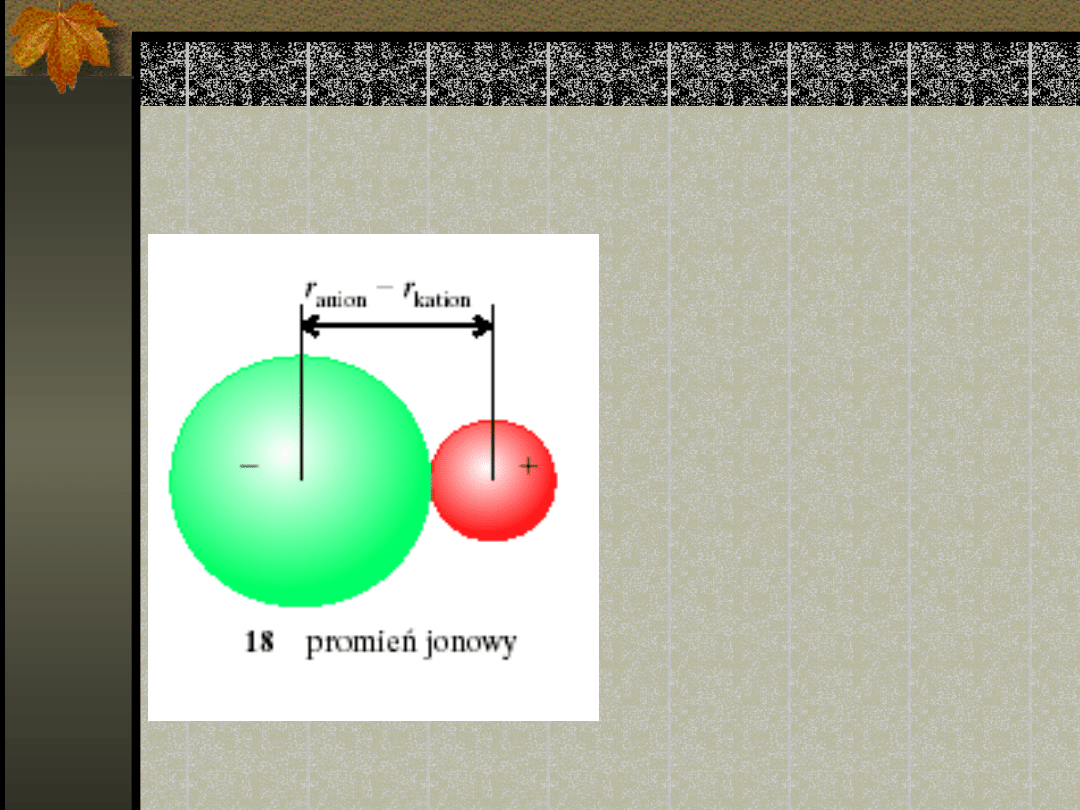
Promień jonowy
Promień jonowy
pierwiastka jest to
udział pierwiastka w
odległości między
sąsiednimi jonami w
jonowej substancji
stałej ( Odległość
między jądrami kationu
i sąsiadującego z nim
anionu jest sumą
dwóch promieni
jonowych.
Promień kowalencyjny -
gazy
Połowa odległości
pomiędzy środkami
sąsiednich atomów w
cząsteczce gazu; np.
Cl
2
Odległość pomiędzy
jądrami chloru w
cząsteczce
dwuatomowej chloru
wynosi 198 pm.
Promień tutaj
nazywany promieniem
kowalencyjnym i
wynosi 99 pm

Promień jonowy
W praktyce wykorzystujemy
promień jonu tlenkowego, 140 pm,
do obliczania promieni innych
jonów. Znając odległości na
przykład między jądrami Mg i O w
tlenku magnezu, która wynosi 212
pm, możemy obliczyć promień jonu
Mg
2+
; jest on równy :
212 pm - 140 pm = 72 pm.
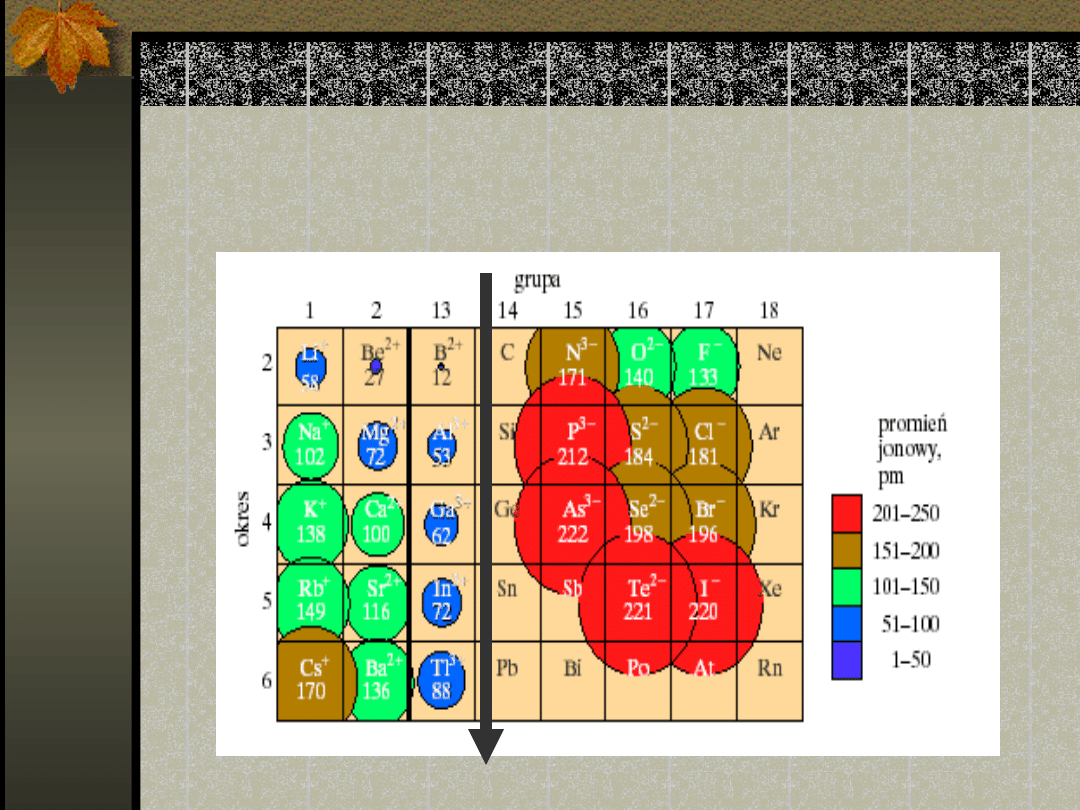
Zmiany promienia
jonowego

Promień jonowy w
metalach przejściowych
Rozmiar determinuje
orbital 4s. W zasadzie
promienie niewiele się
różnią pomiędzy sobą
Promień jonowy –
różnica pomiędzy
anionami a kationami
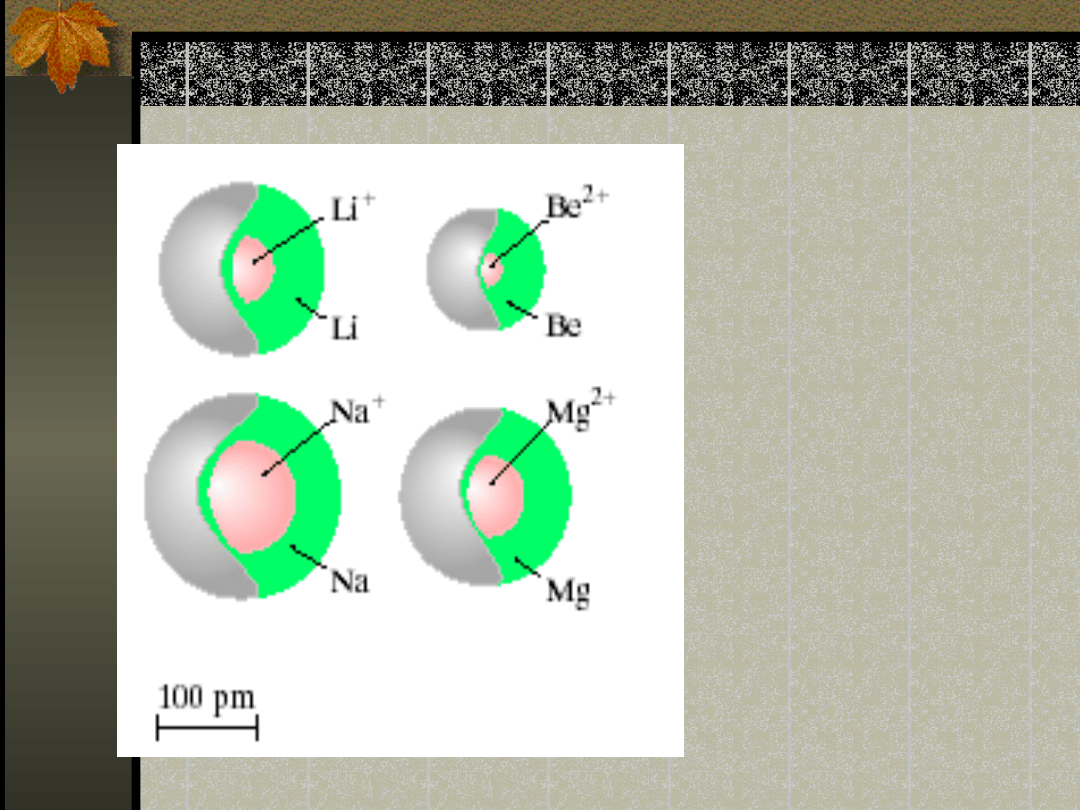
Promień jonowy
Zauważcie: kation
jest mniejszy od
atomu
macierzystego
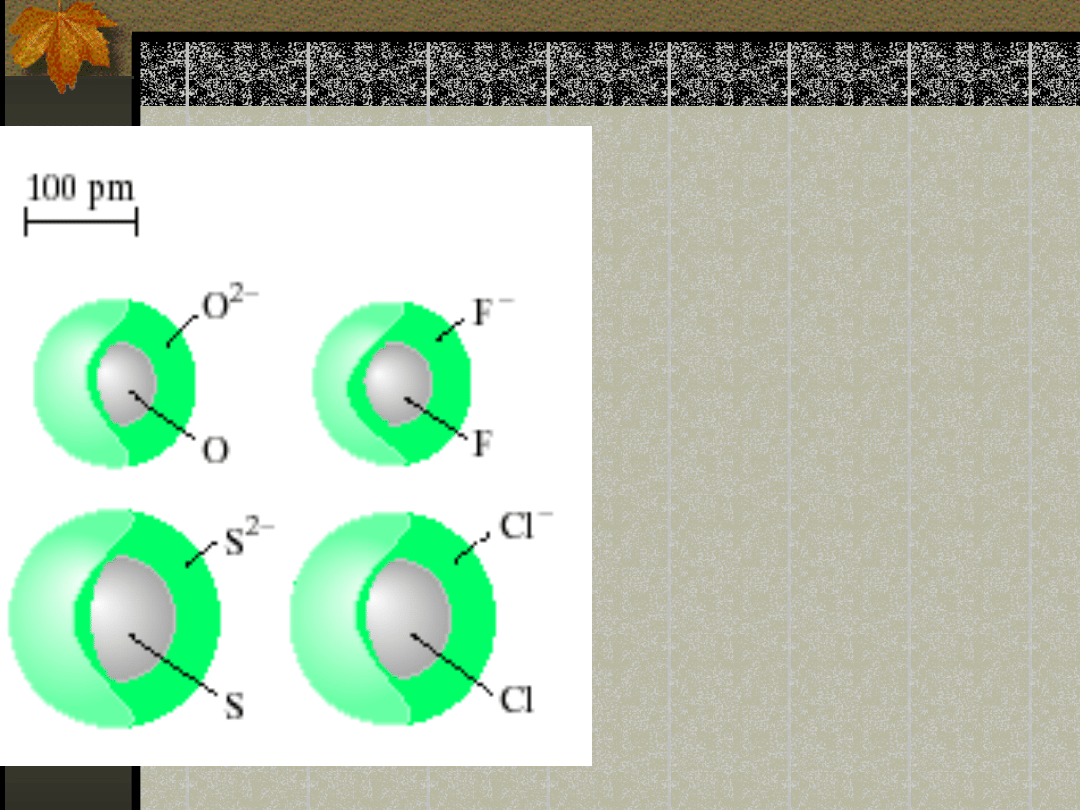
Promień jonowy
Anion jest większy
od atomu
macierzystego

Na ogół promienie jonowe
wzrastają ku dołowi grupy
i maleją w okresie od
strony lewej ku prawej.
Kationy są mniejsze, a
aniony — większe od swych
macierzystych atomów.

Porównaj promienie jonów: a)
Mg
2+
i Ca
2+
; b) O
2-
i F-.
Strategia
Z dwóch jonów o tej samej
liczbie elektronów mniejszy jest jon
pierwiastka położonego bardziej na
prawo w okresie, gdyż ten pierwiastek
ma większy ładunek jądra. Jeżeli dwa
jony znajdują się w tej samej grupie,
mniejszy jest jon pierwiastka położonego
wyżej w grupie, gdyż jego elektrony
znajdują się w powłoce o mniejszej
liczbie kwantowej, bliżej jądra.

Rozwiązanie
Ponieważ Mg znajduje się nad Ca w
grupie 2, ma mniejszy promień jonowy;
rzeczywiste promienie jonów Mg
2+
i Ca
2+
wynoszą odpowiednio 72 pm i 100 pm.
Ponieważ F znajduje się na prawo od O w
okresie 2, ma mniejszy promień jonowy.
Rzeczywiste promienie jonów F
-
i O
2+
wynoszą odpowiednio133 pm i 140 pm.

Energia jonizacji
Związek z efektywnym
ładunkiem

Energia jonizacji
Energia potrzebna do oderwania elektronu od atomu
pierwiastka w fazie gazowej. W przypadku
pierwszej (I
1
) energii jonizacji, chodzi o atom
obojętny. Na przykład miedź:
Cu(g) Cu
+
(g) + e(g)
I
1
= (energia Cu
+
+ e
-
) - (energia Cu
0
)
Wartość doświadczalna dla miedzi wynosi 785 kJ/mol.
Druga energia jonizacji, I
2
, jest energią potrzebną
do oderwania elektronu od pojedynczo
naładowanego kationu w fazie gazowej. Dla miedzi:
I
2
wynosi 1958 kJ/mol.

Wszystkie energie jonizacji
są dodatnie:
Oderwanie elektronu od
atomu lub kationu zawsze
wymaga nakładu energii.
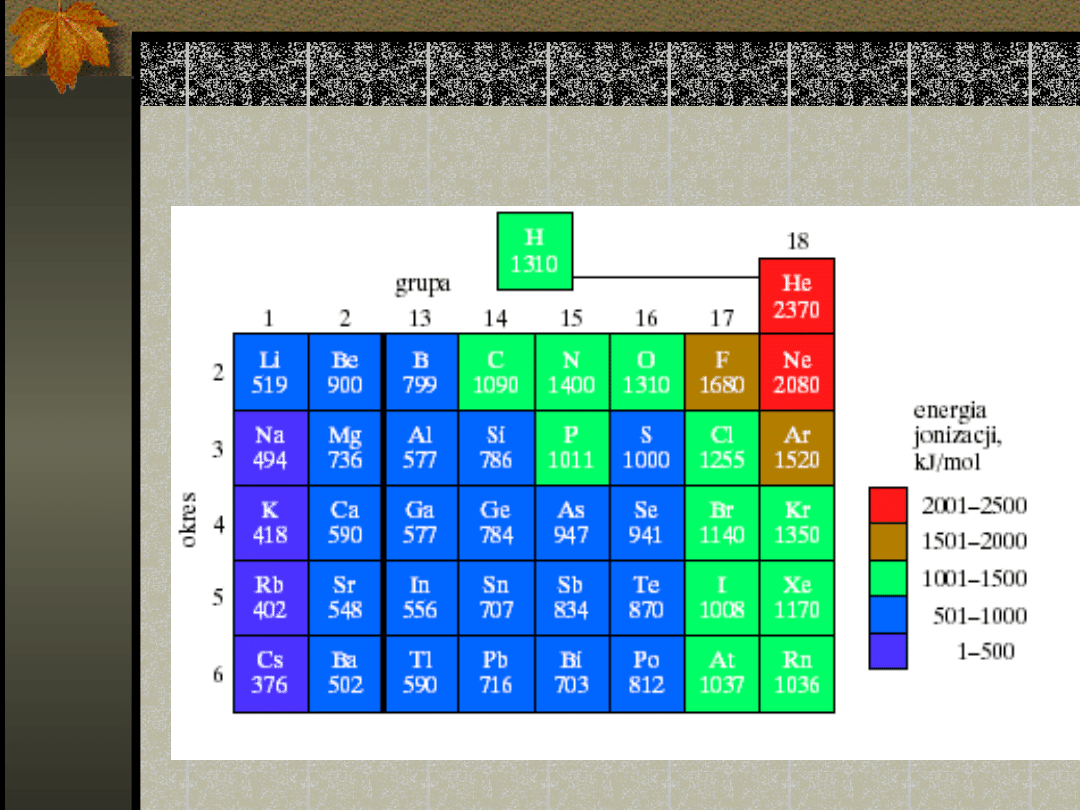
Wartości I energii jonizacji
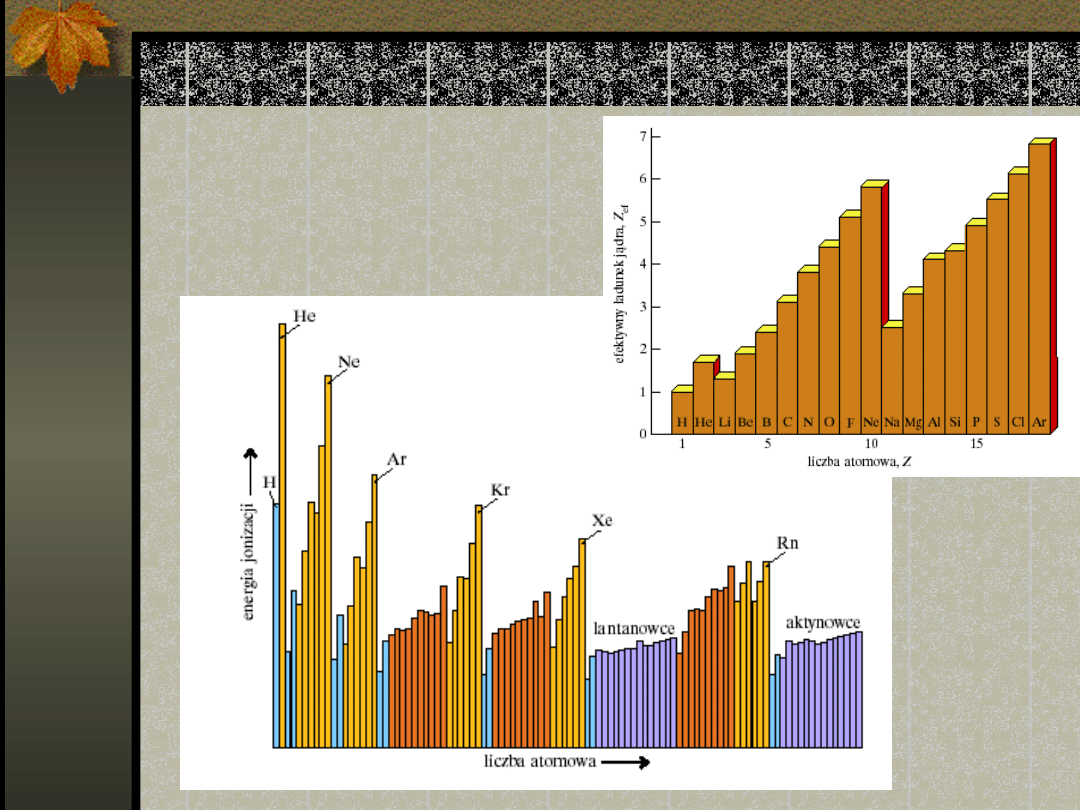
Pierwsze energie jonizacji

Energia jonizacji – układ
okresowy
Energie jonizacji maleją ku dołowi grupy – w
każdym nowym okresie zewnętrzny elektron
obsadza powłokę położoną coraz dalej od
jądra
Pierwsze energie jonizacji wzrastają w
okresie od lewej ku prawej
Najmniejsze wartości energii jonizacji
występują w dolnej lewej części układu
okresowego – te pierwiastki łatwo oddają
elektron w przeciwieństwie do tych
położonych w sąsiedztwie helu

Energia jonizacji
Druga energia jonizacji jest zawsze większa
od pierwszej a trzecia jeszcze większa.
Oderwanie elektronu od dodatnio
naładowanego jonu wymaga znacznie
większego nakładu energii niż od
obojętnego atomu.
Dla pierwiastków grupy pierwszej duże
różnice, w drugiej wartości obydwu energii
jonizacji są zbliżone za to trzecie silnie
rosną

Energie jonizacji
Niskie energie jonizacji
charakterystyczne są dla
właściwości metalicznych.
Wszystkie metale łatwo tracą
elektrony

Powinowactwo
elektronowe
Powinowactwo elektronowe, E
p.e.
,
pierwiastka jest to energia wydzielona
podczas przyłączenia elektronu do
atomu pierwiastka w stanie gazowym.
Na przykład powinowactwo elektronowe
chloru to energia uwolniona w procesie
Cl(g)+ e(g) Cl
-
(g)
E
p.e.
,=(energia Cl + e
-
)- (energia Cl
-
)
Wartości powinowactwa
elektronowego

Powinowactwo
elektronowe
Dodatnie powinowactwo elektronowe
oznacza, że energia anionu jest mniejsza od
łącznej energii obojętnego atomu i
swobodnego elektronu. Mniejsza energia
anionu świadczy o stabilności takiego
układu
Powinowactwo na ogół jest dodatnie. Duża
wartość powinowactwa oznacza, że w
trakcie przyłączania elektronu wydziela się
duża ilość energii

Powinowactwo
elektronowe
Okresowe zmiany tej wielkości
fizycznej nie są tak wyraźne jak w
przypadku energii jonizacji. Ogólna
tendencja istnieje: powinowactwa
elektronowe rosną w kierunku prawej
strony zajętej przez tlen, fluor i chlor.
Przyłączany elektron w tych
pierwiastkach zajmuje orbital p
znajdujący się blisko jądra

Powinowactwo
elektronowe
Atom może przyłączyć kilka elektronów:
pierwsze powinowactwo, drugie
powinowactwo itd. Bardzo małe w
przypadku fluoru, chloru
Tlen gdy przyłączy 1 elektron wydziela w
procesie 141 kJ/mol. Przyłączenie drugiego
elektronu wymaga nakładu energii ze
względu na odpychanie się ładunków
ujemnych. W rezultacie energia
przyłączenia dwóch elektronów wymaga
nakładu energii 703 kJ/mol

Właściwości metali i
niemetali
Metale
Dobre przewodniki
el.
Dobre przew. ciepła
Ciągliwe
Kowalne
Z reguły stałe
Wysoka temp.
topnienia
Niemetale
Źle przewodzą prąd
izolatory
Nieciągliwe
Niekowalne
Stałe, ciekłe
gazowe
Niska temp.
Topnienia

Właściwości metali i
niemetali
Metale
Reagują z
kwasami
Tworzą zasadowe
tlenki
Tworzą kationy
Tworzą jonowe
halogenki
Niemetale
Nie reagują z
kwasami
Tworzą kwasowe
tlenki
Tworzą aniony
Tworzą
kowalencyjne
halogenki
Metale i Niemetale
NIE
M
ETA
L
E
ME
TAL
E
ME
TAL
E
przejścio
we
metale
Metale i niemetale w
układzie okresowym
Półmetale
rozłożone
są
diagonalnie
metale
niemetale

Metale przejściowe

Pierwiastki grupy 16

Tlenki amfoteryczne położenie w
układzie okresowym
Periodycz-
ność
wartości
stopnia
utlenienia
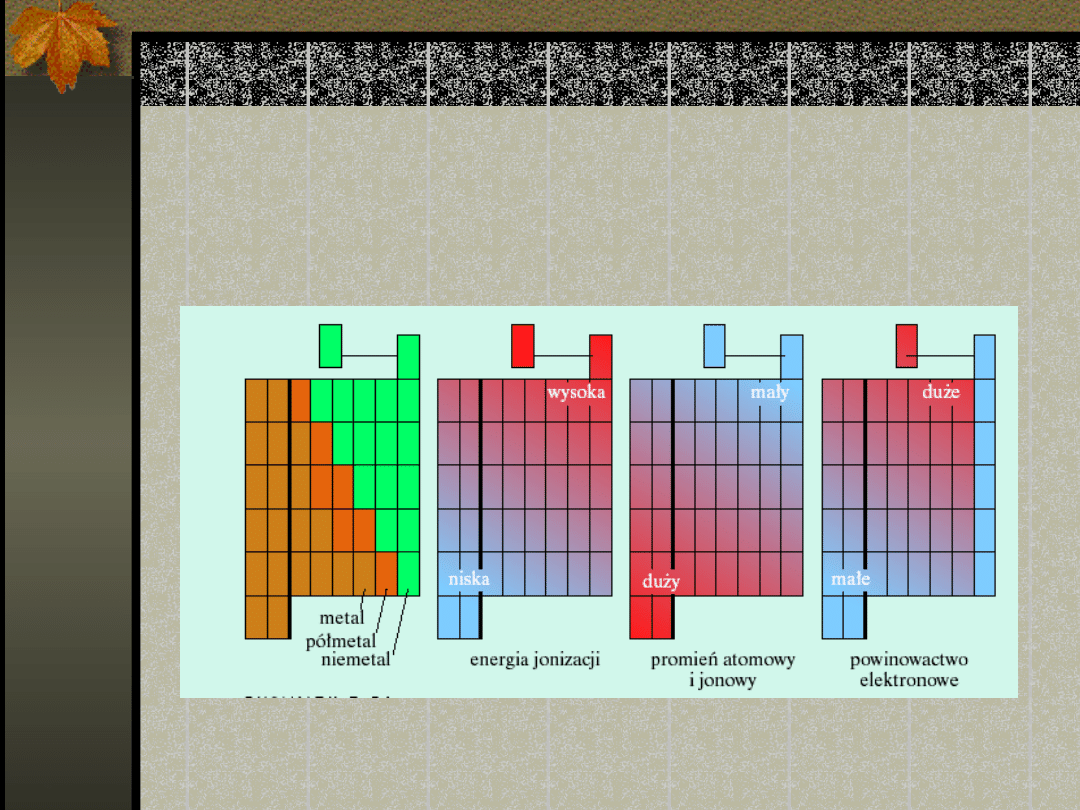
Zastosowanie układu
okresowego
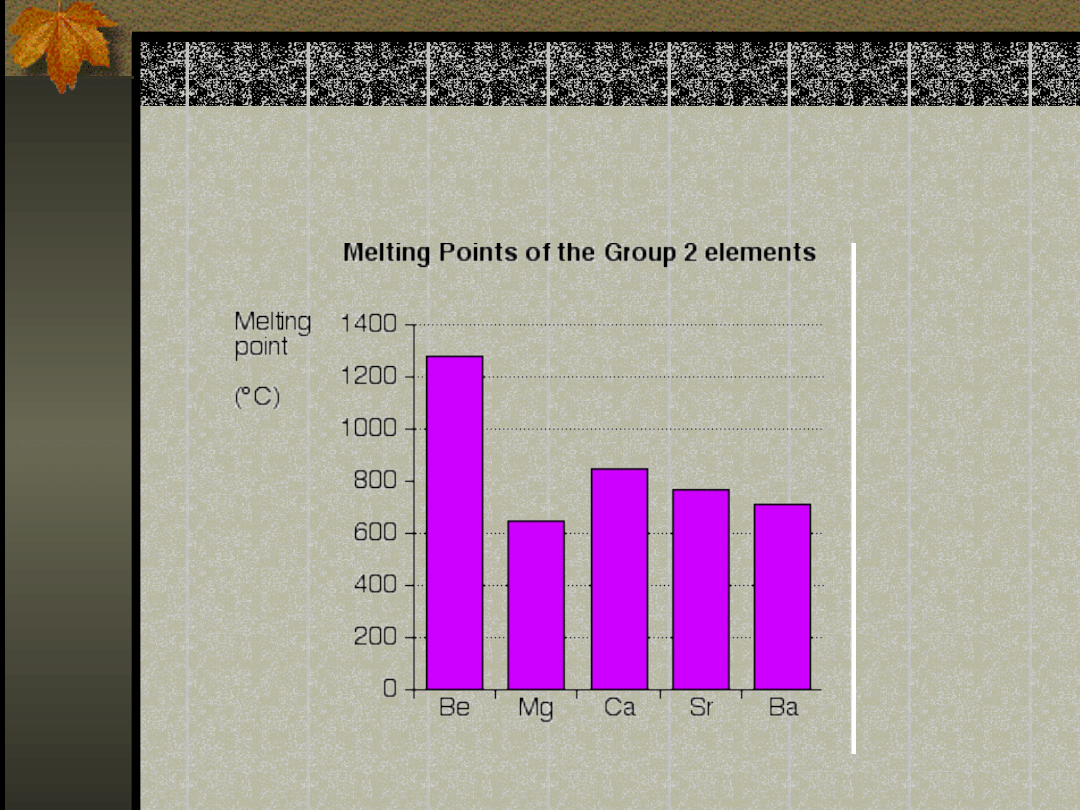
Temperatura topnienia
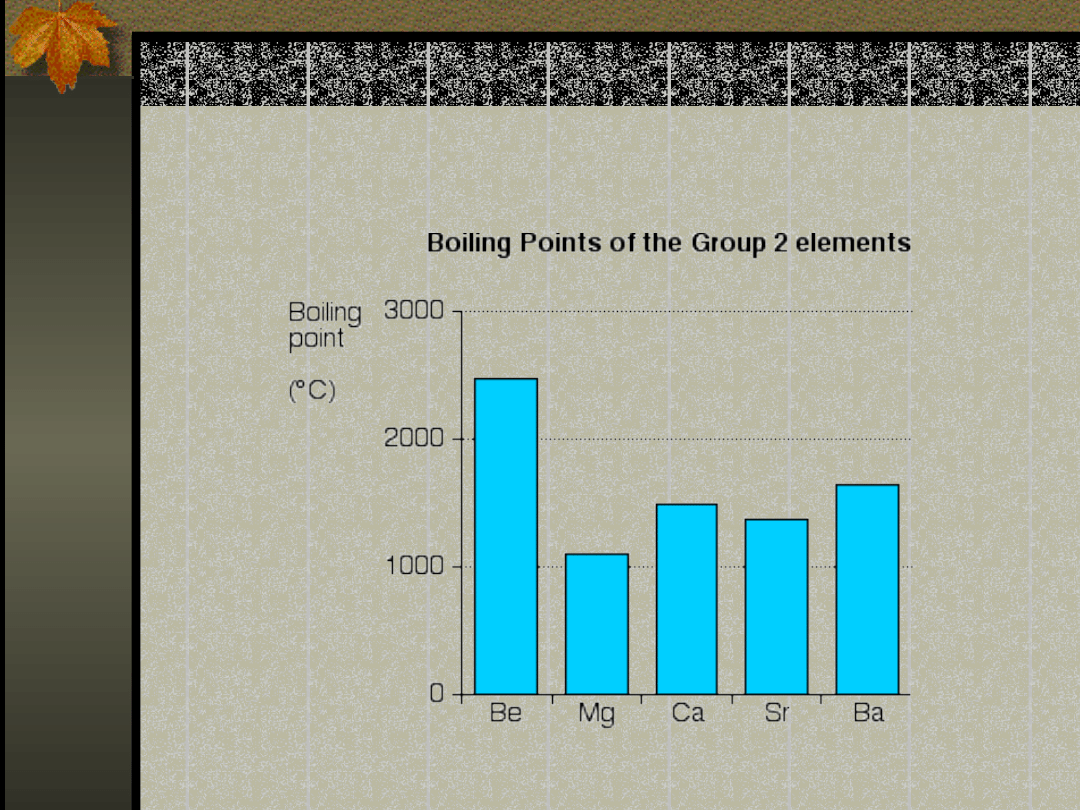
Temperatura wrzenia
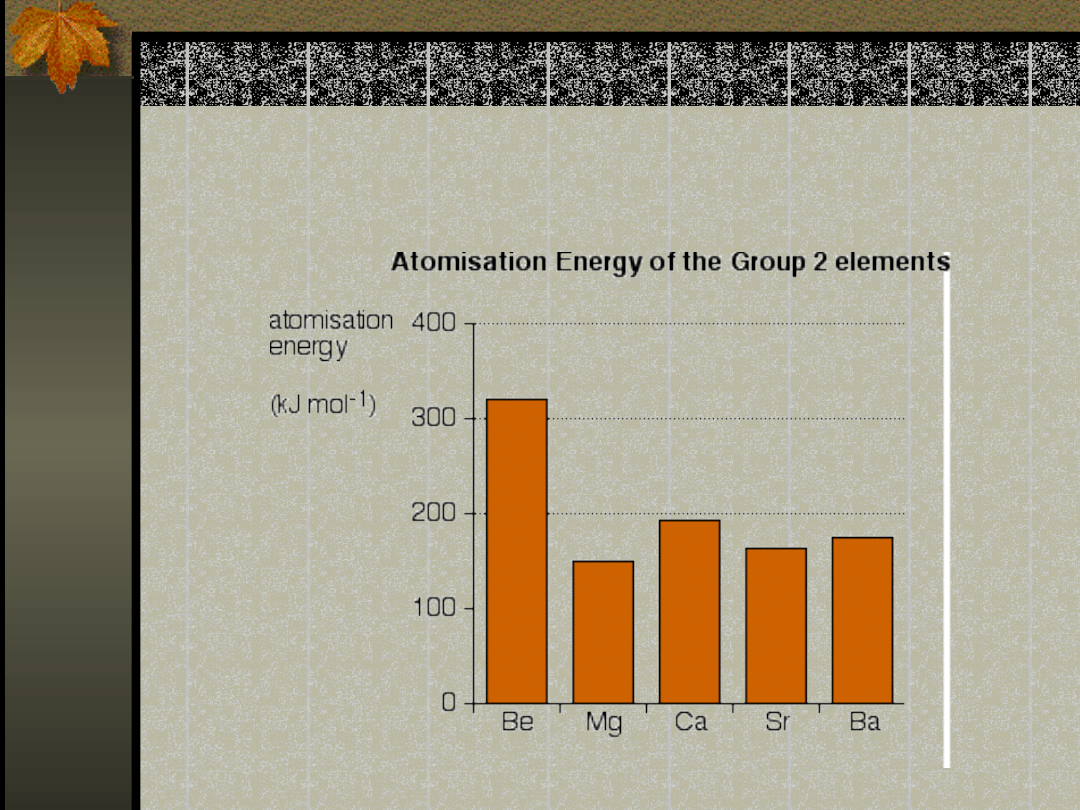
Energia atomizacji
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
Lista2, IB, I rok, Fizykochemia materiałów, Lista Zadań
odp z fizykochemii, fizykochemia materiałów 1
Fizykochemia materiałów wstęp 2008 wykład
Lista1, IB, I rok, Fizykochemia materiałów, Lista Zadań
Lista 4, IB, I rok, Fizykochemia materiałów, Lista Zadań
Fizykochemia materiałów wstęp 2007 wykład(1)
zwiazki chemiczne, IB, I rok, Fizykochemia materiałów, Lista Zadań
Lista 3, IB, I rok, Fizykochemia materiałów, Lista Zadań
mięśnie stymulacja z fizyko, Materiały 2 rok Fizjoterapi, Fizykoterapia
referat z fizykoterapii, Materiały naukowe z różnych dziedzin
fizykoterapia materialy
chemia właściwości tlenków, fizykochemia materiałów 1
Właściwości fizykochemiczne materiałów i metody ich badania (Magda Szostek)
FIZJOTERAPIA W SPORCIE OSoB NIEPElNOSPRAWNYCH, Materiały 2 rok Fizjoterapi, Fizykoterapia
Podstawowe pojęcia fizykochemiczne i podział materiałów ze względu
PYTANIA NA ZALICZENIE Z FIZYKOTERAPII, fizjoterapia materiały WSZYSTKO cz.2
więcej podobnych podstron