
Enzymy – chemiczne regulatory
reakcji cz. I

Metabolizm
Metabolizm
(gr. metabole – przemiana) całokształt przemian materii
i energii zachodzących w żywym organizmie. Wyróżnia się dwa
kierunki przemian metabolicznych:
- reakcje anaboliczne (gr. anabalein –dorzucać, podwyższać),
- reakcje kataboliczne (gr. katabalein – odrzucać, obniżać).
Przemianom chemicznym zachodzącym w komórkach towarzyszy
zawsze przemiana energii. Część tych przemian wymaga
dostarczenia energii – są to reakcje endoergiczne, zwykle wiążące
się z powstawaniem nowych, bardziej złożonych związków.
Pochłaniają one energię z otoczenia, a zatem produkty reakcji mają
wyższą energię niż substraty.
Reakcje, które uwalniają energię niezbędną do wykonywania różnego
rodzaju pracy, np. do ruchu czy syntez chemicznych, nazywane są
egzoergicznymi. Skoro energia jest uwalniana to produkty
zawierają mniej energii niż substraty.

Anabolizm
Reakcje anaboliczne
to reakcje syntez związków bardziej
złożonych z prostszych, zwykle wymagające dostarczenia
energii. Energia dostarczana do tych przemian umożliwia
podwyższenie poziomu energetycznego związków. W
wyniku
reakcji
anabolicznych
powstaje
wysokoenergetyczny produkt. Do tej grupy przemian
zalicza
się
reakcje
biosyntezy
białek,
kwasów
tłuszczowych, lipidów i innych złożonych związków
organicznych.
Przykładem reakcji anabolicznej jest wiązanie CO
2
i
wbudowywanie go w związki organiczne podczas
fotosyntezy lub chemosyntezy.

Katabolizm
Reakcje kataboliczne
to reakcje, w których następuje
obniżenie poziomu energetycznego substratów na
skutek ich rozkładu na związki prostsze. Większość
przemian katabolicznych przebiega z uwolnieniem
energii. Podstawowym procesem katabolicznym jest
oddychanie ( utlenianie biologiczne). W procesie tym
energia zawarta w cukrach lub innych związkach
organicznych uwalnia się, a powstające produkty, np.
CO
2
,H
2
O, są znów na niskim poziomie energetycznym.
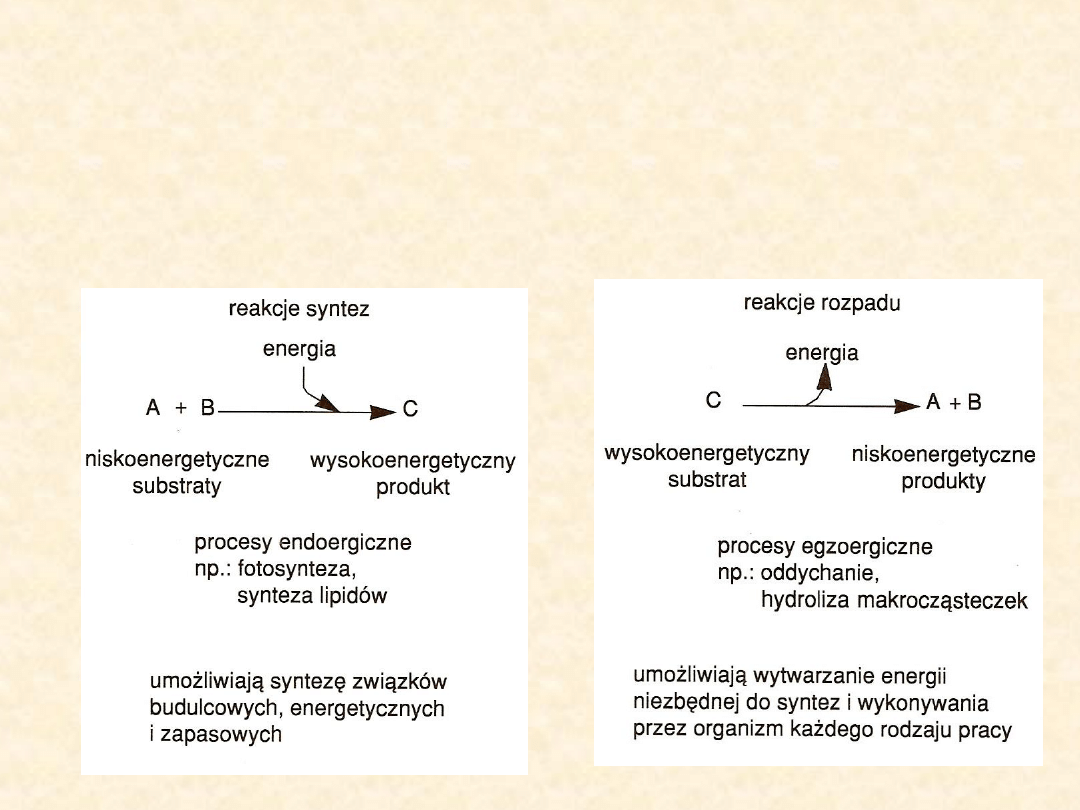
Charakterystyka głównych
przemian metabolicznych
ANABOLIZM
KATABOLIZM
Źródło: Wiśniewski H. Biologia dla klas III

Współzależność przemian
metabolicznych
Reakcje wymagające dostarczenia energii są sprzężone z
reakcjami, które tę energię dostarczają. Dlatego też reakcje
anaboliczne i kataboliczne zachodzą równocześnie, choć w
różnych strukturach komórki. Ważne jest także aby
energia, która powstała w jednym procesie, mogła zostać
dostarczona
do
miejsca,
gdzie
zachodzi
proces
energochłonny.
Możliwe
jest
to
dzięki
związkom
wysokoenergetycznym, które są nośnikami energii.
Mimo, że procesy anaboliczne i kataboliczne zachodzą
jednocześnie, to nie oznacza to, że ich intensywność jest
zawsze taka sama – zmienia się ona bowiem z wiekiem.

Energia aktywacji
Jest to ilość energii niezbędnej do zapoczątkowania procesu
chemicznego. Dodanie katalizatora do środowiska reakcji
znacznie obniżą energię aktywacji. Obniżenie energii
aktywacji jest możliwe w układach biologicznych dzięki
katalizatorom biologicznym –
enzymom
.
Jeżeli bariera aktywacji zostanie obniżona, to reakcja
przebiegnie szybciej. Skoro enzymy obniżają energię
aktywacji, w jednostce czasu może reagować znacznie więcej
cząsteczek. Enzym tworzy przejściowy, nietrwały kompleks z
substratem, czyli substancją na którą działa. Następnie
kompleks się rozpada, następuje uwolnienie produktu oraz
wolnego katalizatora, który może wejść w reakcję z następną
cząsteczką substratu. Enzymy jedynie ułatwiają reakcję –
przyśpieszają ją, nie wpływają natomiast na kierunek reakcji
chemicznej ani na końcowe stężenie reagujących cząsteczek.
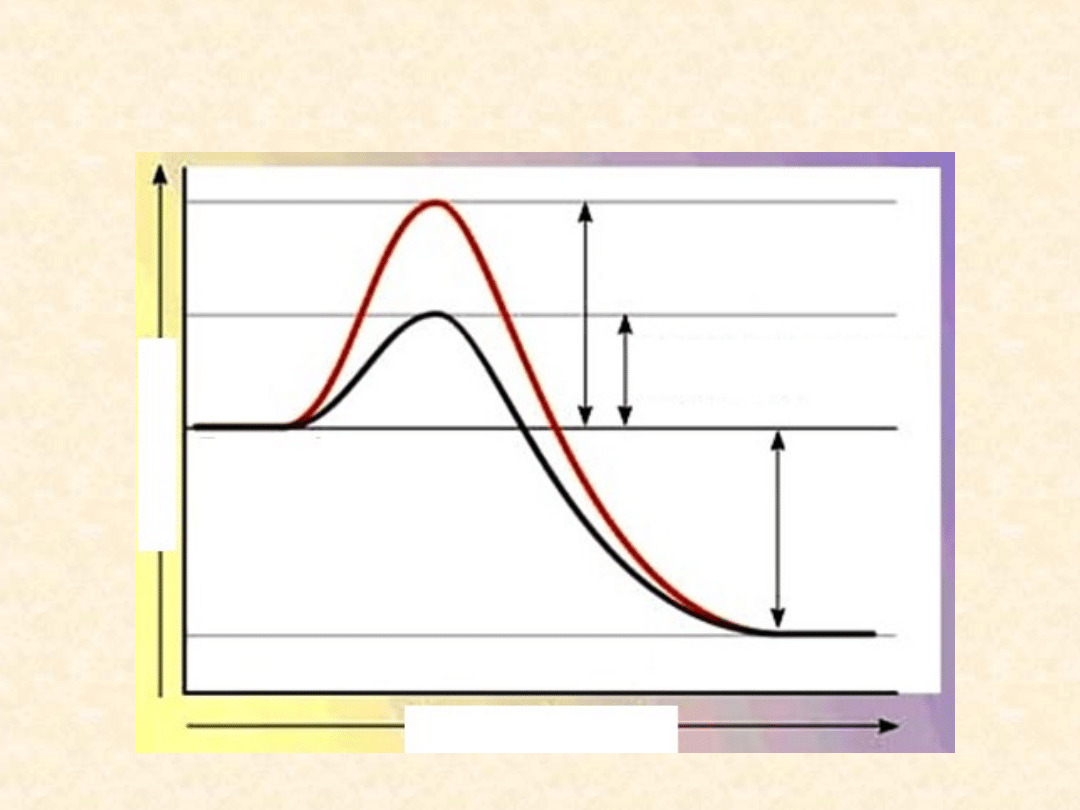
Efekt obecności biokatalizatora
w środowisku
REAKCJA NIEKATALIZOWANA
REAKCJA KATALIZOWANA
E
N
E
R
G
IA
SUBSTARTY
PRODUKTY
ENERGIA AKTYWACJI
BEZ UDZIAŁU ENZYMU
ENERGIA AKTYWACJI
Z UDZIAŁEM ENZYMU
WYDZIELONA
ENERGIA
POSTĘP REAKCJI

Enzymy
Są to czynniki umożliwiające szybkie zachodzenie procesów
życiowych. Spełniają one rolę katalizatorów, czyli
substancji regulujących szybkość przebiegu reakcji
chemicznych, nie wpływających jednak na wynik końcowy
reakcji i nie zużywające się w trakcie jej przebiegu.
Enzymy są wysoce specyficzne, a ich aktywność może
być regulowana.
Biokatalizatory (enzymy) powstają w przyrodzie w
organizmach żywych – choć mogą także oddziaływać
poza żywym organizmem, np. bakterie wydzielają
wytwarzane przez siebie enzymy trawienne do podłoża, a
wchłaniają gotowe, strawione cząstki pokarmowe.

Budowa enzymów
Niektóre enzymy, np. pepsyna (składnik soku żołądkowego),
rybonukleaza (trawiąca RNA), amylaza (rozkładająca
skrobię) czy ureaza (powodująca rozkład mocznika) są
białkami prostymi. Większość enzymów to białka złożone,
gdzie część białkową określa się nazwą apoenzymu,
natomiast część niebiałkowa daje się często oddzielić
jako tzw. koenzym. Obie części razem tworzą
holoenzym. Jeżeli koenzym jest trwale połączony z
białkiem – wówczas tworzy tzw. grupę prostetyczną.
Niektóre enzymy dla swej aktywności wymagają obecności
jonów, np. magnezu, żelaza, cynku. Prawdopodobnie te
mikroelementy wchodzą w skład niektórych koenzymów,
umożliwiając im udział w reakcjach.
Budowa enzymu
ENZYM = CZĘŚĆ BIAŁKOWA + CZĘŚĆ NIEBIAŁKOWA
APONEZYM
KOENZYM
nietrwale
związany z
apoenzyme
m
GRUPA
PROSTETYCZNA
trwale
związana z
apoenzymem

Apoenzym – warunkuje specyficzność substratową
działania enzymu, gdyż wskazuje powinowactwo do
substratu.
Koenzym – określa typ katalizowanego procesu, decyduje
o tym jakiej przemianie ulega substrat. Koenzymami lub
ważnymi ich częściami składowymi są m.in.:
• ATP
• NAD
• NADP
• NADH
• jony metali: np. żelaza, wapnia, magnezu
• witaminy, np.: B
1
, B
12
, biotyna, PP

Nomenkaltura enzymów
Nazwy wielu enzymów utworzono przez dodanie przyrostka –
aza do nazwy substratu, na który dany enzym oddziałuje.
Przykładem może być sacharaza, która katalizuje rozkład
sacharozy do glukozy i fruktozy.
Innym sposobem mianowania było dodanie końcówki –aza do
nazwy reakcji katalizowanej przez dany enzym (np.
dehydrogenacja – dehydrogenaza), zaś drugie słowo
oznaczało substrat danej reakcji. W ten sposób utworzono
dwuwyrazowe nazwy enzymów, np. dehydrogenaza
mleczanowa.
Obecnie stosuje się międzynarodowe mianownictwo enzymów,
gdzie m.in. każdemu znanemu, jak i nowo odkrytemu
enzymowi przypisuje się numer, pod którym dany enzym
jest zapisany w międzynarodowym wykazie enzymów.

Klasyfikacja enzymów
W zależności od rodzaju przeprowadzanej reakcji wyróżnia
się sześć grup enzymów:
• oksydoreduktazy
• transferazy
• hydrolazy
• liazy
• izomerazy
• ligazy

Oksydoreduktazy - są to enzymy katalizujące reakcje
utleniania i redukcji. Do tej grupy biokatalizatorów
zalicza się dehydrogenazy oraz oksydazy. Te ostatnie
przenoszą elektrony na tlen.
Transferazy – przenoszą pewne grupy chemiczne, np.
grupę metylową – CH
3
czy też grupę aminową –NH
2
pomiędzy związkami.
Hydrolazy – katalizują rozpad (hydrolizę) wiązań
chemicznych. Reakcja ta zachodzi zazwyczaj w
środowisku wodnym, a w każdym razie do jej przebiegu
konieczna jest cząsteczka wody.

Liazy – są to enzymy, które rozbijają bez udziału wody
wiązania typu: C-C, C-O, C-N, C-S. W pewnych warunkach
niektóre liazy mogą katalizować procesy syntezy.
Izomerazy – jest to grupa enzymów, dzięki którym możliwe
są
wewnątrzcząsteczkowe
przegrupowania,
umożliwiające przejście substratu w odpowiedni izomer,
tzn. związek o tym samym wzorze sumarycznym, ale
różniący się strukturą i właściwościami fizycznymi oraz
chemicznymi.
Ligazy – enzymy katalizujące wzajemne łączenie się dwóch
cząsteczek, czyli syntezę nowych wiązań. Proces ten
wymaga zazwyczaj rozbicia wiązania pirofosforanowego
w cząsteczce ATP bądź podobnego związku.

Specyficzność (swoistość)
enzymów
Większość enzymów wykazuje dużą specyficzność, która polega
na katalizowaniu kilku spokrewnionych reakcji chemicznych,
a nawet w wielu przypadkach tylko jednej, określonej
przemiany.
Przykładem może być ureaza, która katalizuje hydrolizę
mocznika do amoniaku, a nie oddziałuje na inne substraty.
Specyficzność niektórych enzymów polega także na tym, że
atakują one określony rodzaj wiązania chemicznego. Na
przykład lipaza hydrolizuje tylko wiązania estrowe, które
występują między glicerolem i kwasami tłuszczowymi w
obrębie grupy lipidów.
O specyficzności substratowej enzymu decydują właściwości i
przestrzenne ułożenie reszt aminokwasów tworzących tzw.
centrum aktywne.

Enzymy – efektywne katalizatory
Jedną z najważniejszych cech enzymów jest przyśpieszanie
reakcji chemicznych w stopniu znacznie większym niż
katalizatory nieenzymatyczne. Nadtlenek wodoru rozkładany
jest do wody w obecności opiłków żelaza (atom żelaza jest
katalizatorem).
Nadtlenek wodoru jest toksycznym produktem ubocznym wielu
reakcji enzymatycznych i jest silną trucizną dla komórki.
Jednak komórka posiada peroksysomy – organelle, które
zawierają enzym – katalazę, która wykazuje olbrzymie
zdolności katalityczne. 1 cząsteczka katalazy w temperaturze
ciała ludzkiego powoduje rozkład około 7 mln cząsteczek
nadtlenku wodoru w ciągu minuty. Aby zneutralizować taką
samą ilość nadtlenku wodoru, jaką rozszczepia jedna
cząsteczka katalazy (zawierającej jeden atom żelaza) w ciągu
jednej minuty, pojedynczy atom potrzebowałby 3000 lat.

Izoenzymy (izozymy)
Są to enzymy występujące u tego samego osobnika lub
przynajmniej gatunku, które katalizują te samą reakcję,
lecz mają odmienną budowę. Owa odmienność dotyczy
zazwyczaj apoenzymu i przekazywana jest genetycznie.
Przykładem jest enzym dehydrogenza mleczanowa,
która występuje w cytoplazmie komórek wątroby, mięśni
szkieletowych oraz mięśnia sercowego.

Literatura:
• Danowski J., 2005. Repetytorium dla maturzystów i
kandydatów na wyższe uczelnie. Tom I. Medyk,
Warszawa
• Hames B.D., Hooper N.M., 2002. Krótkie wykłady.
Biochemia. PWN, Warszawa
• Pyłka – Gutowska E., 1995. Vademecum maturzysty.
Biologia. Oświata, Warszawa
• Villee i inni, 1996. Biologia. Multico, Warszawa
• Wiśniewski H, 1998. Biologia. Agmen, Warszawa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Enzymy chemiczne regulatory reakcji część II
Enzymy chemiczne regulatory reakcji czesc II
Enzymy chemiczne regulatory reakcji czesc I
Enzymy – chemiczne regulatory
Związki chemiczne produkty reakcji tlenków z wodą
Enzymy 3 Wprowadzenie do reakcji enzymatycznych
Podstawy obliczeń chemicznych stechiometria reakcji chemicznych
regulacja reakcji enzymatycznej
mater. - PUZLE CHEMICZNEdla integracji, PUZLE CHEMICZNE - równania reakcji chemicznych
Związki chemiczne produkty reakcji tlenków z wodą
Enzymy 3 Wprowadzenie do reakcji enzymatycznych
Zasady Inżynierii Chemicznej, Mieczysław Serwiński, część II
Regulamin Kawalerii część 2de
Zasady Inżynierii Chemicznej, Mieczysław Serwiński, część I
biochemia słowniczek, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reakcje che
biochem, BIOCHEMIA- pojęcia, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reak
więcej podobnych podstron