
Reakcje
enzymatyczne-
wprowadzenie

Enzym jako katalizator
Katalizatory reakcji chemicznych w układach biologicznych
Większość enzymów to białka (jest również kilka cząsteczek RNA
aktywnych katalitycznie)
Białka o masie cząsteczkowej pojedynczego łańcucha
polipeptydowego od 9 000 do 155 000
Zwiększają szybkość reakcji same nie ulegając zmianie
Katalizują reakcje przebiegające we względnie łagodnych
warunkach
Enzymy są wysoce specyficzne względem substratów
Aktywność enzymów może być regulowana
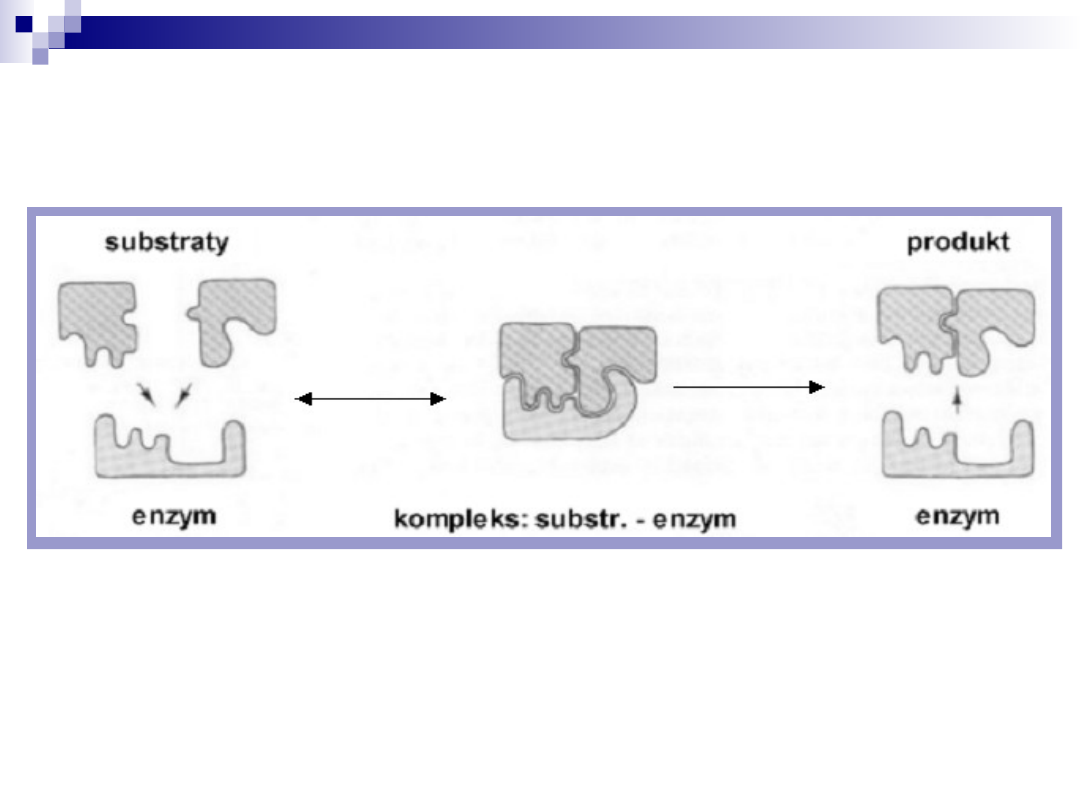
Mechanizm działania enzymów

Miejsce aktywne enzymu
Miejsce aktywne enzymu jest regionem, który wiąże
substrat i przemienia go w produkt
Istnieją dwa modele wyjaśniające oddziaływania enzym-
substrat :
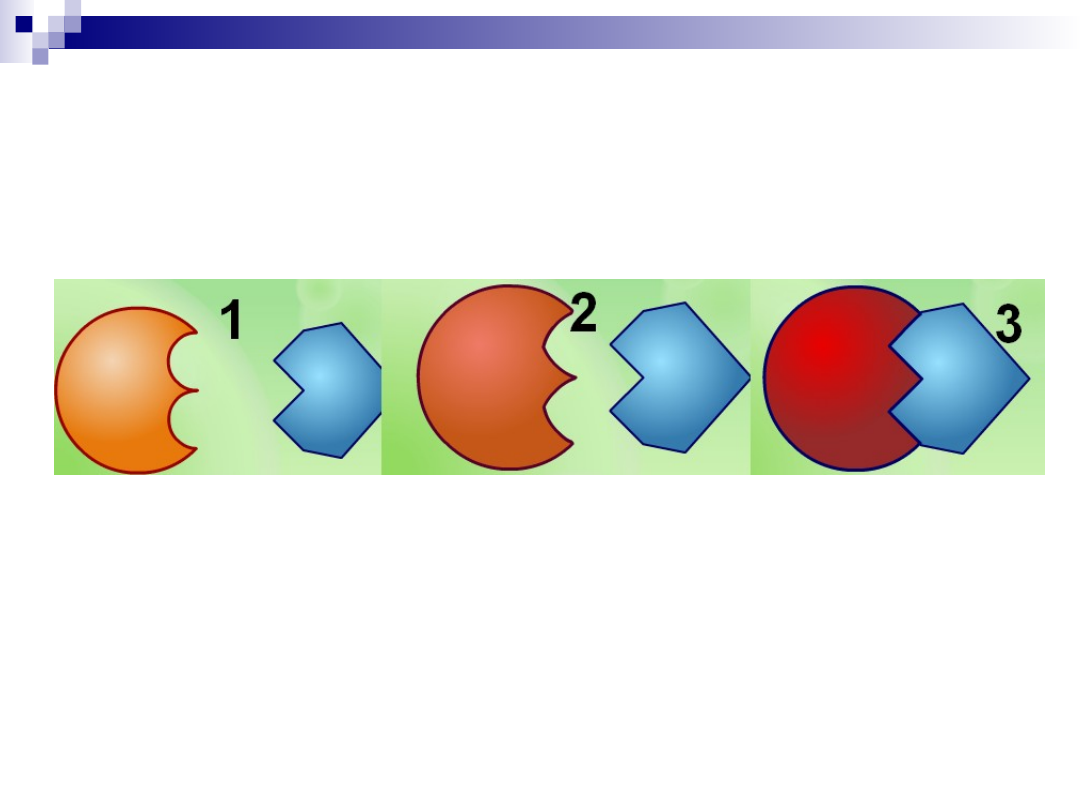
Model „zamka i klucza” opracowany w 1890 r
przez Emila Fischera
oraz
Model „indukowanego dopasowania” opracowany
w 1958 r przez
Daniela Koshlanda, Jr
Model „klucza i zamka”
enzym, tzn. jego miejsce aktywne, musi być dopasowany
swoim kształtem do substratu by móc przekształcić go w
produkt.
Model indukowanego dopasowania ,
„ręki i rękawiczki”
mechanizm opierający się na dopasowaniu kształtu enzymu do substratu
lub odpowiedniej grupy substratów i przekształceniu ich w produkty
enzym może zniekształcić substrat wymuszając w nim konformację
podobną do stanu przejściowego
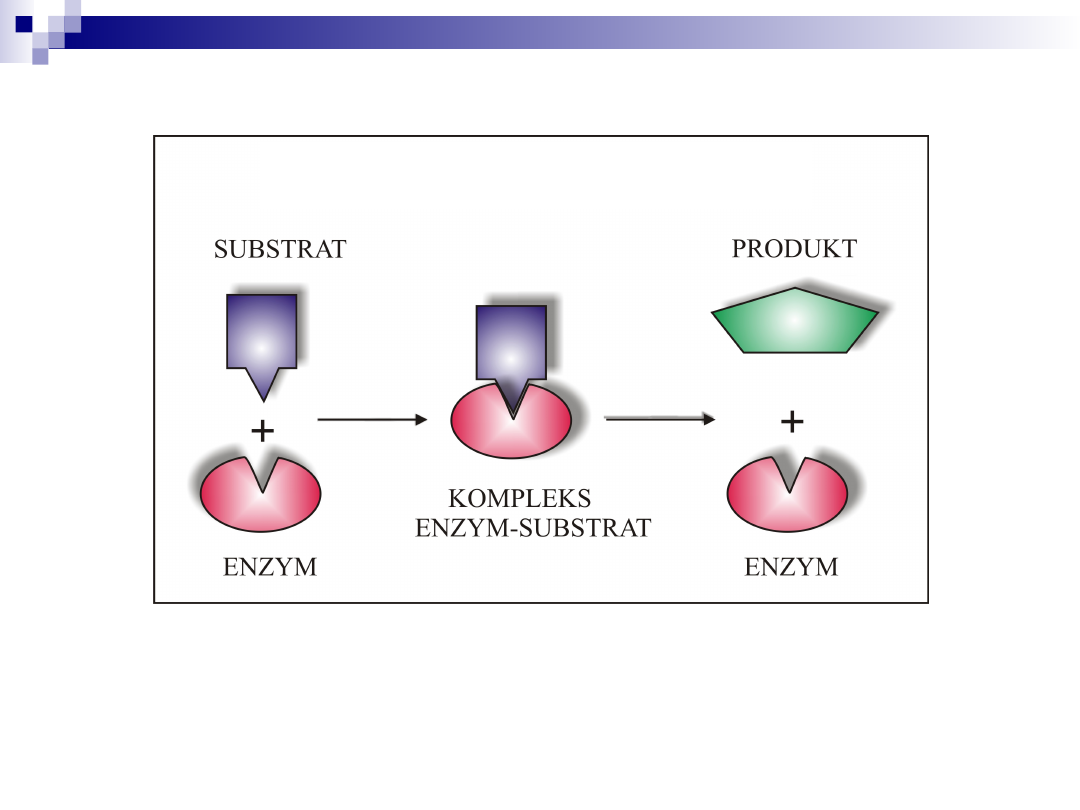
enzym
substrat
enzym substrat
Enzym-substrat
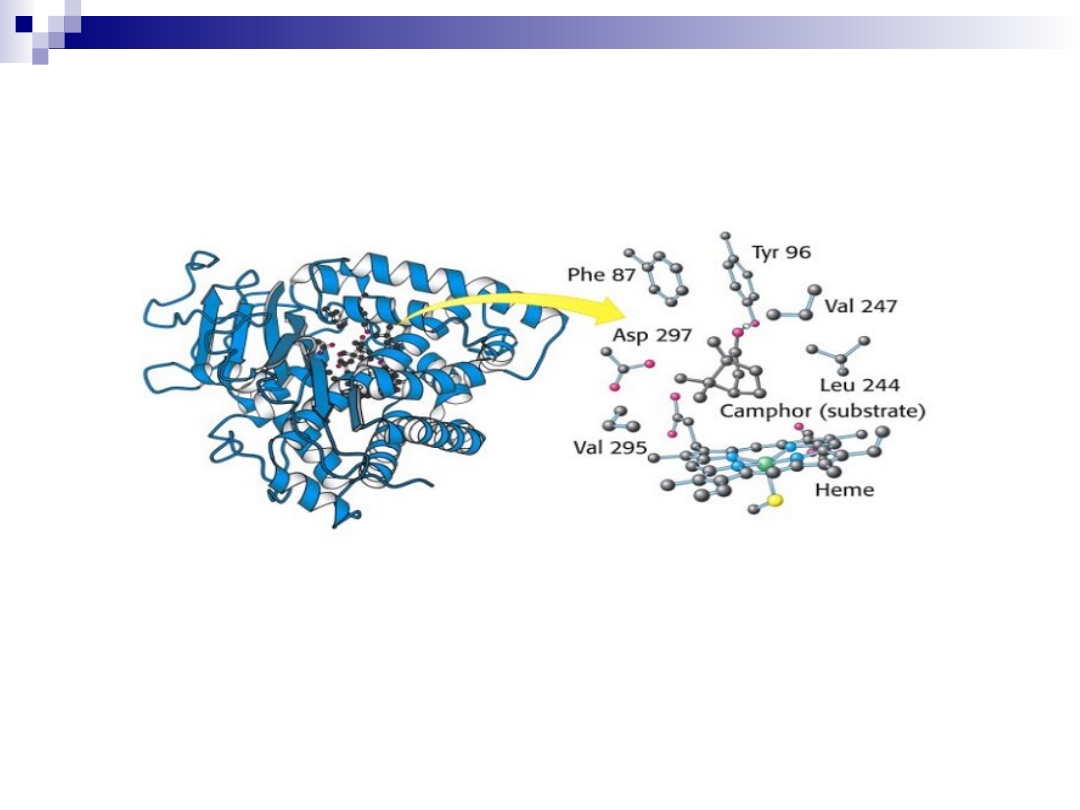
Kompleks enzym-substrat
Przykład kompleksu enzym-substrat : cytochrom P-450 z kamforą jako
substratem

Miejsce aktywne enzymu
Miejsce aktywne enzymu to obszar
wiążący substraty
Miejsce to zawiera aminokwasy
biorące udział w tworzeniu i
zrywaniu wiązań- reszty
katalityczne enzymu
Miejsce aktywne to trójwymiarowa
szczelina utworzona przez grupy
pochodzące z różnych części
sekwencji aminokwasowej
Miejsce aktywne zajmuje
stosunkowo małą część całkowitej
objętości cząsteczki enzymu
W wiązaniu enzymów z substratami
bierze udział wiele słabych
oddziaływań (elektrostatyczne,
wiązania wodorowe, siły van der
Waalsa, interakcje hydrofobowe)
Struktura lizozymu z uwidocznionymi
resztami aminokwasów tworzących miejsce
aktywne
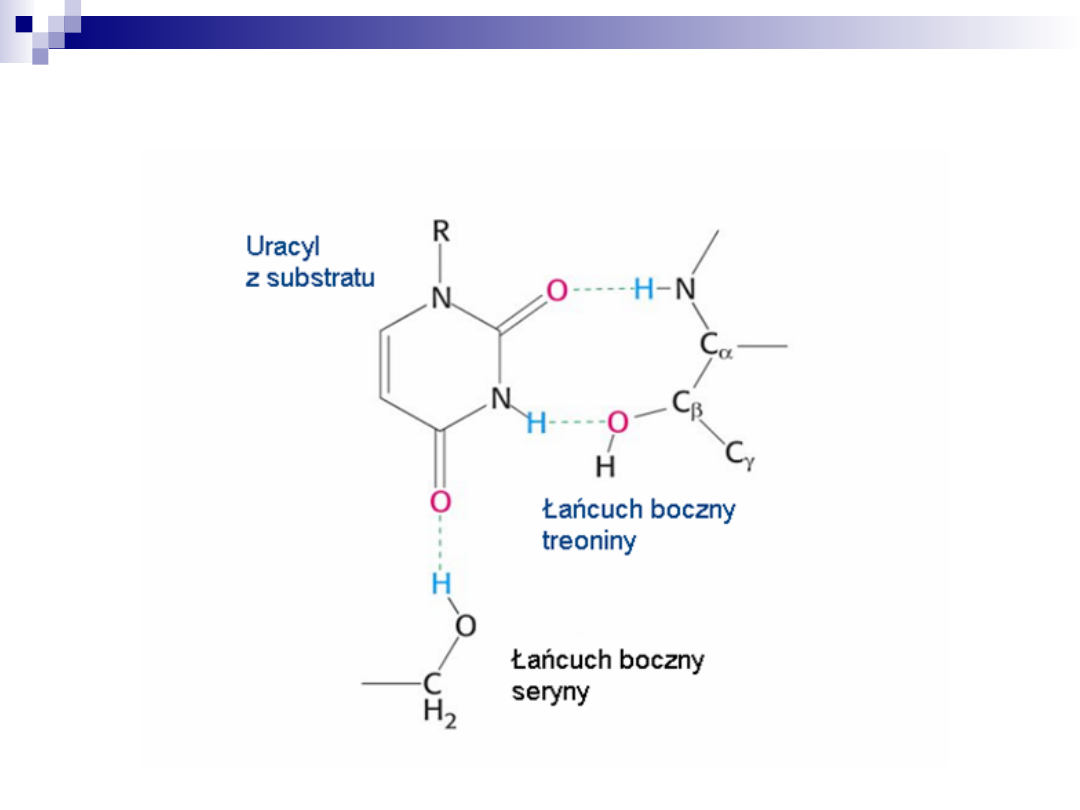
Wiązania wodorowe między enzymem i
substratem
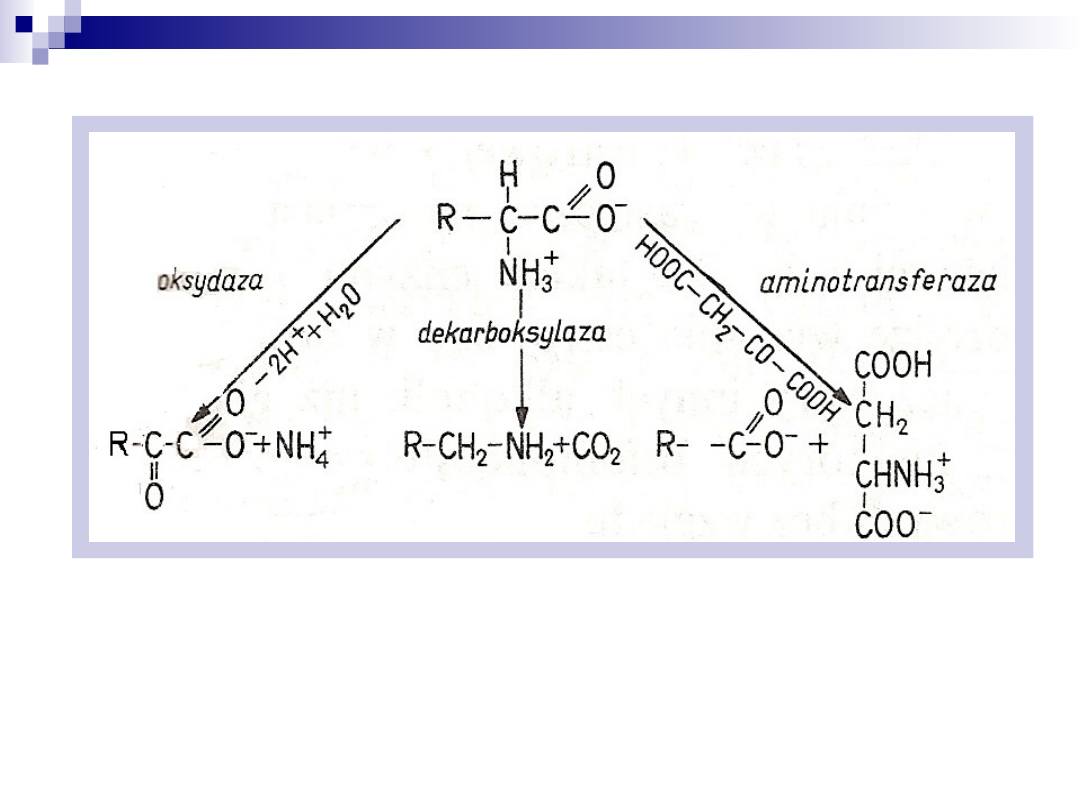
Swoistość kierunku działania
Enzym katalizuje tylko jedną z termodynamicznie możliwych
reakcji jakim może podlegać substrat
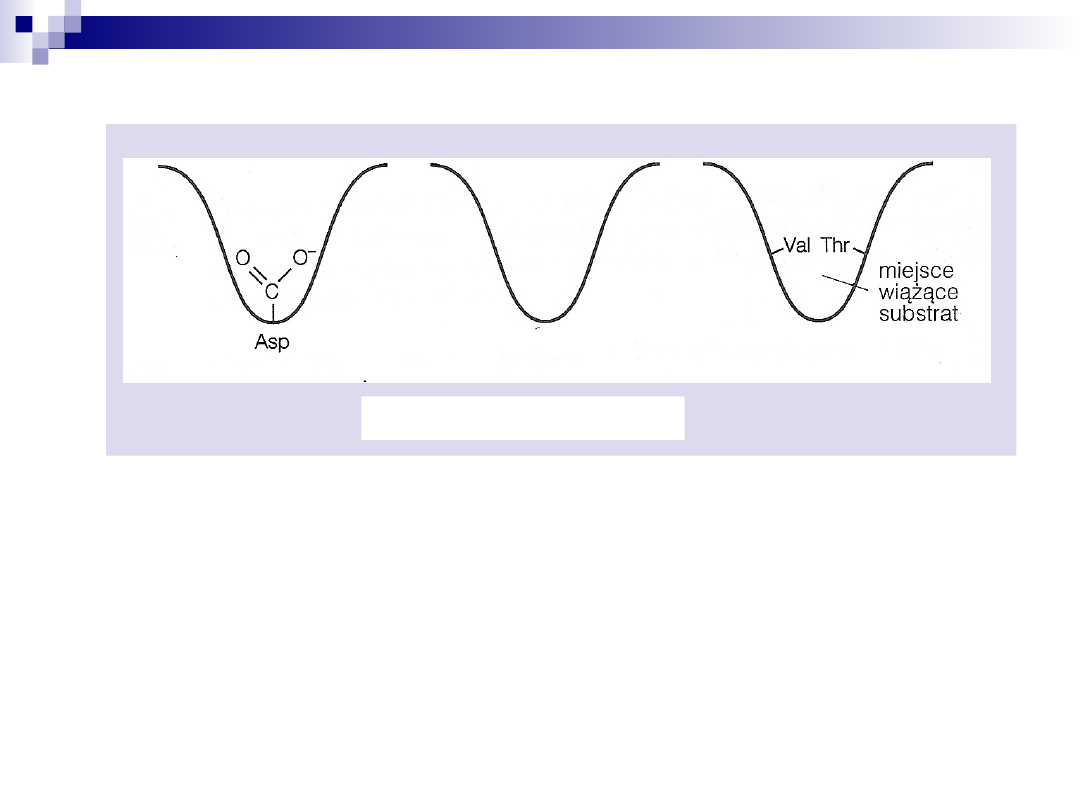
Specyficzność substratowa
Przykładem specyficzności enzymów jest działanie proteaz serynowych
Trypsyna- hydrolizuje wiązanie przy Lys bądź Arg
Chymotrypsyna- hydrolizuje wiązanie przy aminokwasach
aromatycznych i hydrofobowych
Elastaza- hydrolizuje wiązanie przy aminokwasach o krótkich, nie
naładowanych łańcuchach bocznych
O specyficzności substratowej enzymów decydują właściwości i ułożenie
przestrzenne reszt aminokwasów w centrum aktywnym enzymu
trypsyna
chymotrypsyna
elastaza
Proteazy serynowe
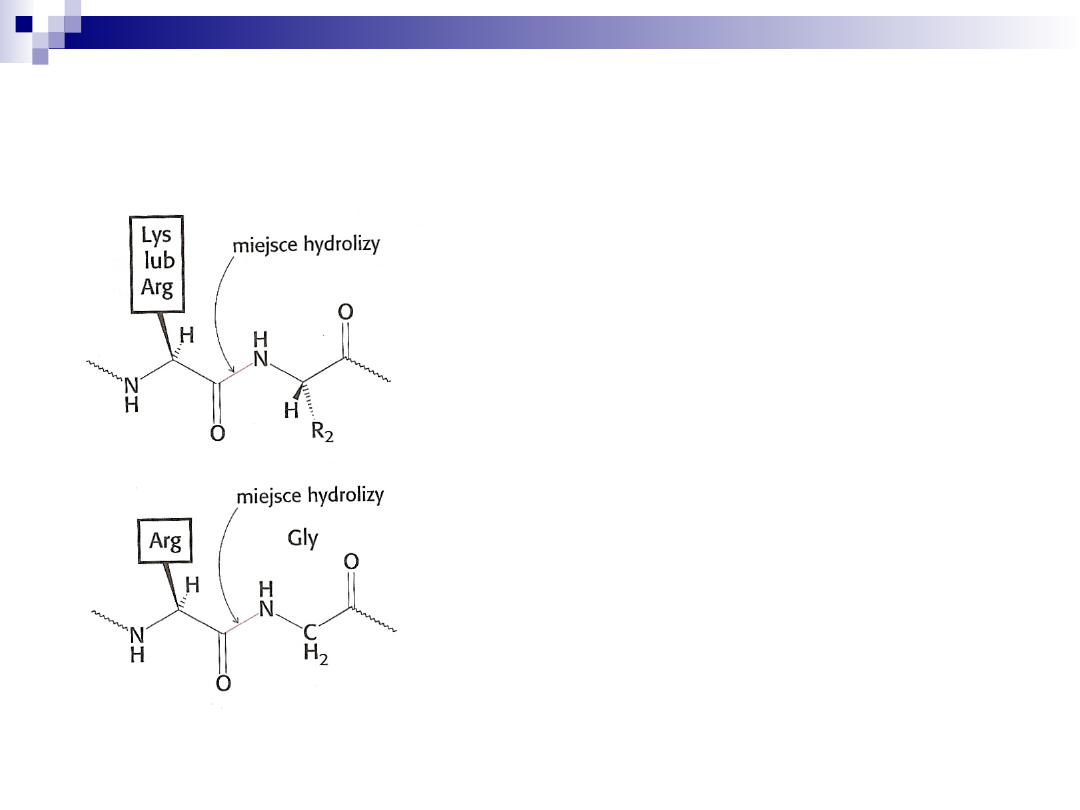
Inne enzymy proteolityczne
Stopień specyficzności enzymów może
być różny
Subtilizyna- nie rozróżnia bocznych
łańcuchów aminokwasów przy
hydrolizowanym wiązaniu
Trypsyna- hydrolizuje tylko wiązania po
karboksylowej stronie Lys i Arg
Trombina- enzym biorący udział w
procesie krzepnięcia krwi hydrolizuje
wiązania peptydowe tylko między Arg i
Gly

Budowa enzymów
Enzym zbudowany jest z:
części białkowej
części niebiałkowej
Wiele enzymów do swego działania potrzebuje kofaktorów
Kofaktorami mogą być jony nieorganiczne np. Fe
2+
lub złożone
cząsteczki organiczne
nazywane koenzymami
Metal lub koenzym kowalencyjnie związany z enzymem nazywamy
grupą prostetyczną
Całość katalitycznie aktywnego enzymu nazywamy
holoenzymem
Białkowa część enzymu bez kofaktora to apoenzym
Holoenzym = Grupa prostetyczna + Apoenzym

Przykłady koenzymów, ich witaminowych
prekursorów i chorób wywoływanych ich
niedoborem
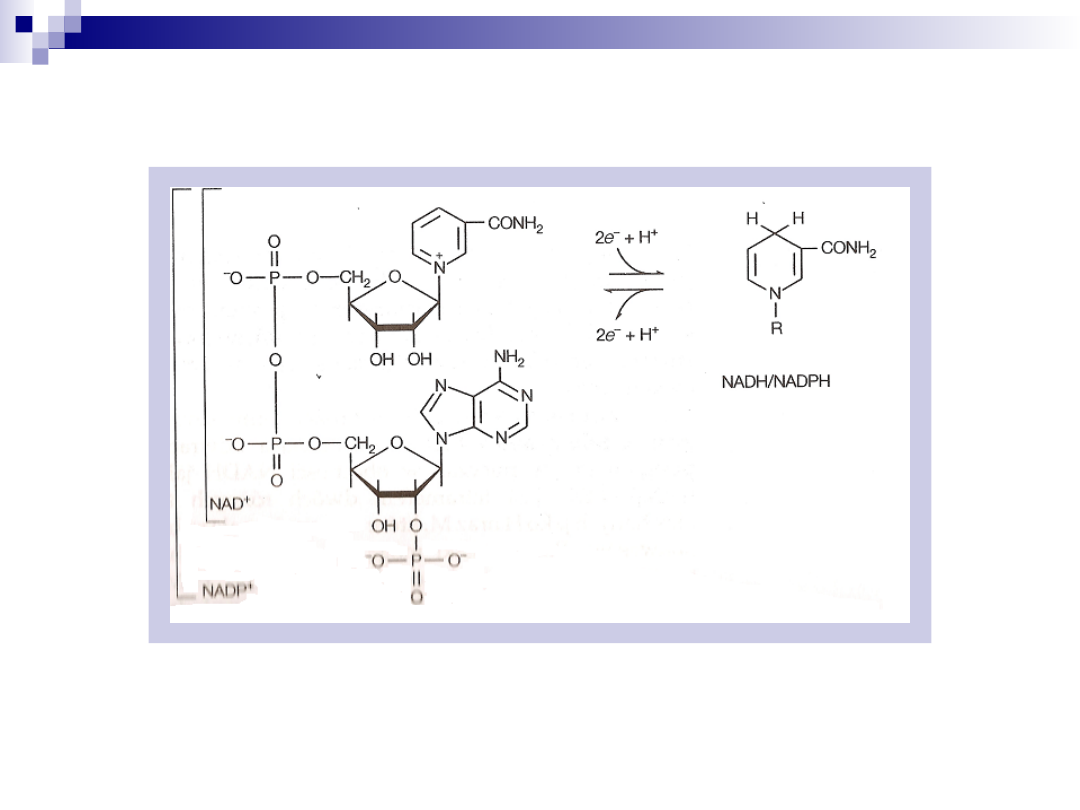
Struktura koenzymów NAD
+
i NADP
+
Dinukleotyd nikotynoamidoadeninowy (NAD
+
) oraz fosforan
dinukleotydu nikotynoamidoadeninowego (NADP
+
) biorą udział w
reakcjach oksydoredukcyjnych (przenoszą elektrony)
Pierścień nikotynoamidowy może występować w formie zredukowanej lub
utlenionej
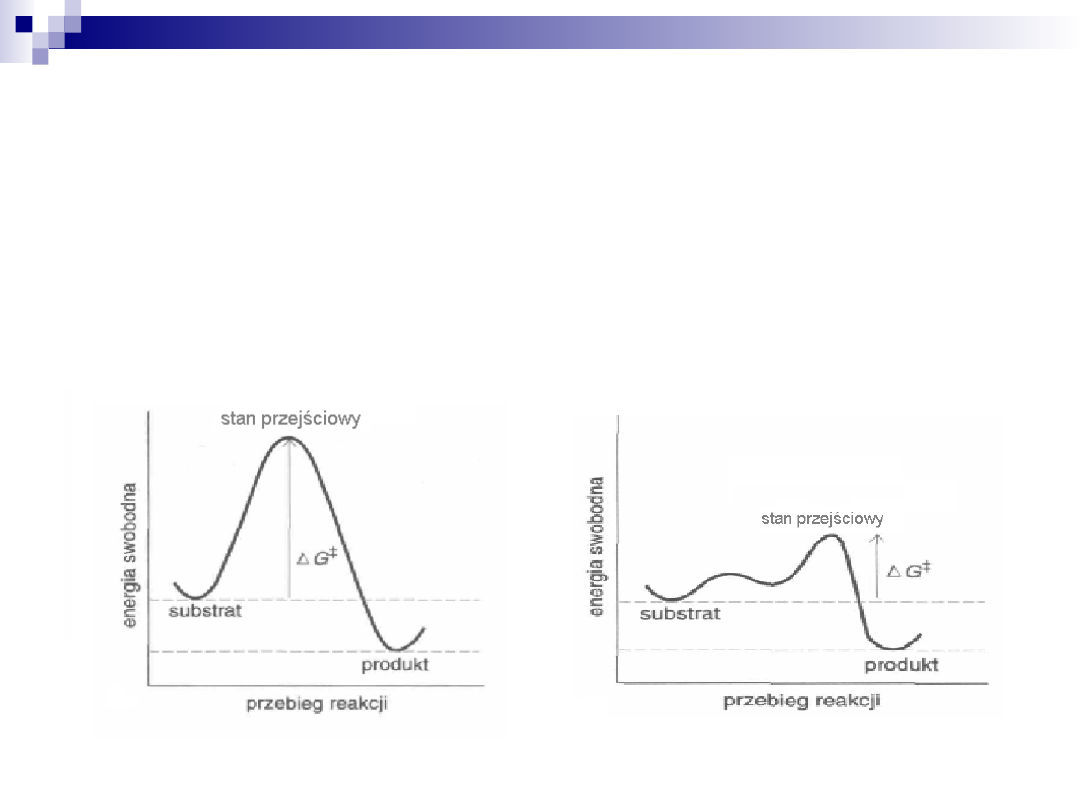
Enzym jako katalizator
Obniża energię aktywacji reakcji
Przyspiesza reakcje
Nie zmienia równowagi reakcji
Porównanie profili swobodnej energii
aktywacji Gibbsa
Reakcja niekatalizowana
Reakcja katalizowana

Przyspieszenie reakcji enzymatycznej
osiąga się przez:
Katalizę poprzez zbliżenie reagujących grup i cząsteczek
Katalizę poprzez odpowiednią deformację cząsteczki substratu
Katalizę poprzez utworzenie kowalencyjnych produktów
pośrednich w reakcji z enzymem lub koenzymem
Katalizę kwasowo-zasadową
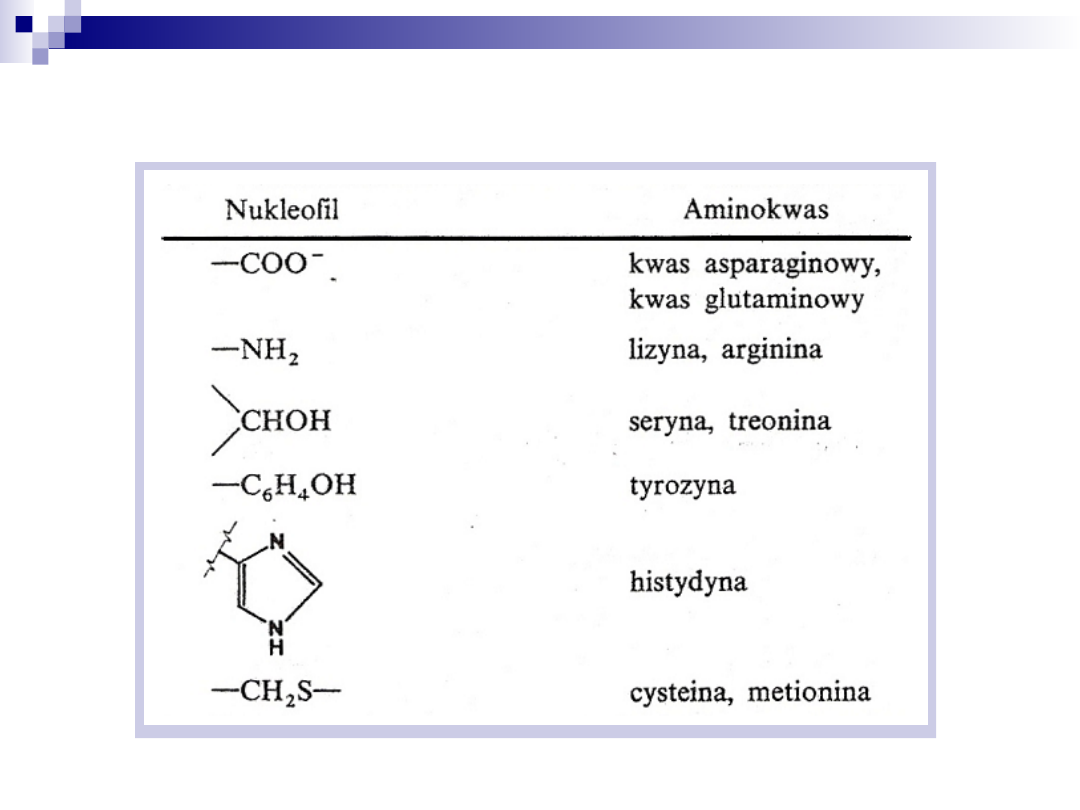
Grupy nukleofilowe łańcuchów bocznych
polipeptydu
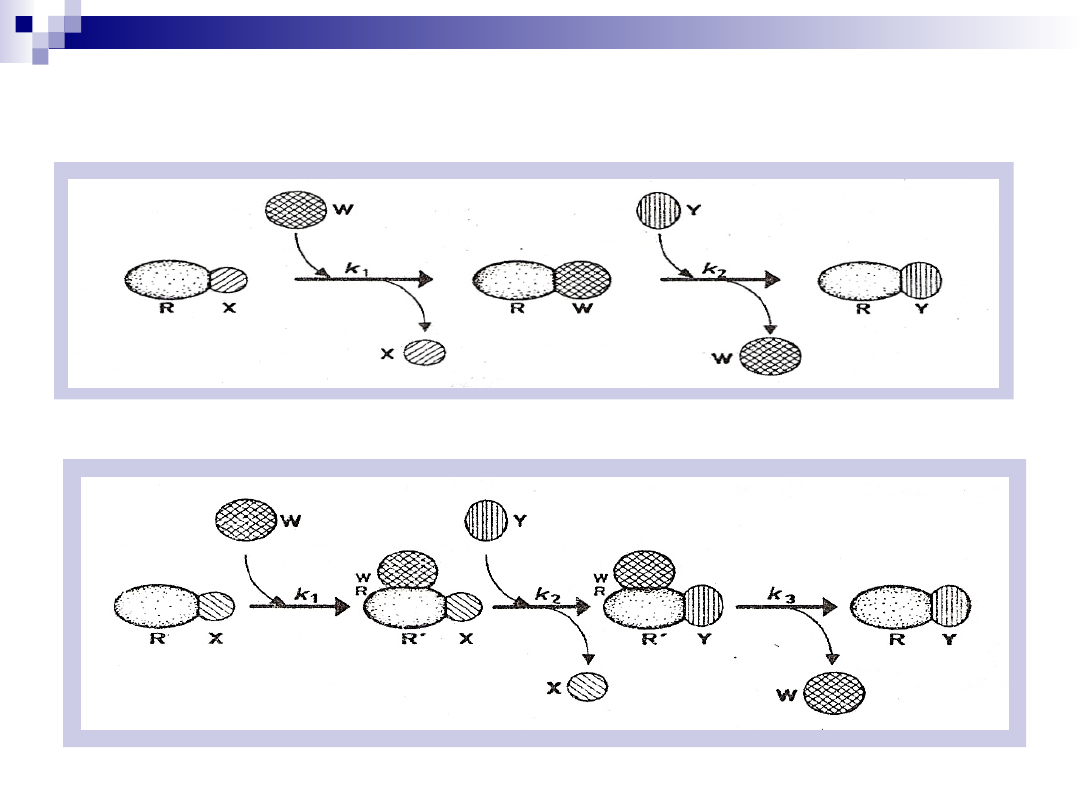
Dwa typy katalizy kowalencyjnej
Czynniki regulujące szybkość reakcji
Kinetyczne
Temperatura, pH, dyfuzja, kształt cząsteczek,
lepkość
Stężenie substratu
Obecność inhibitorów lub aktywatorów enzymów
Czynniki pośrednie (allosteryczne, sprzężenie
zwrotne, przemiana proenzymu w enzym)
Strukturalne
Połączenie enzymów z innymi strukturami
Regulowany transport przez błony
Szybkość odprowadzania produktów
Kinetyka reakcji enzymatycznych
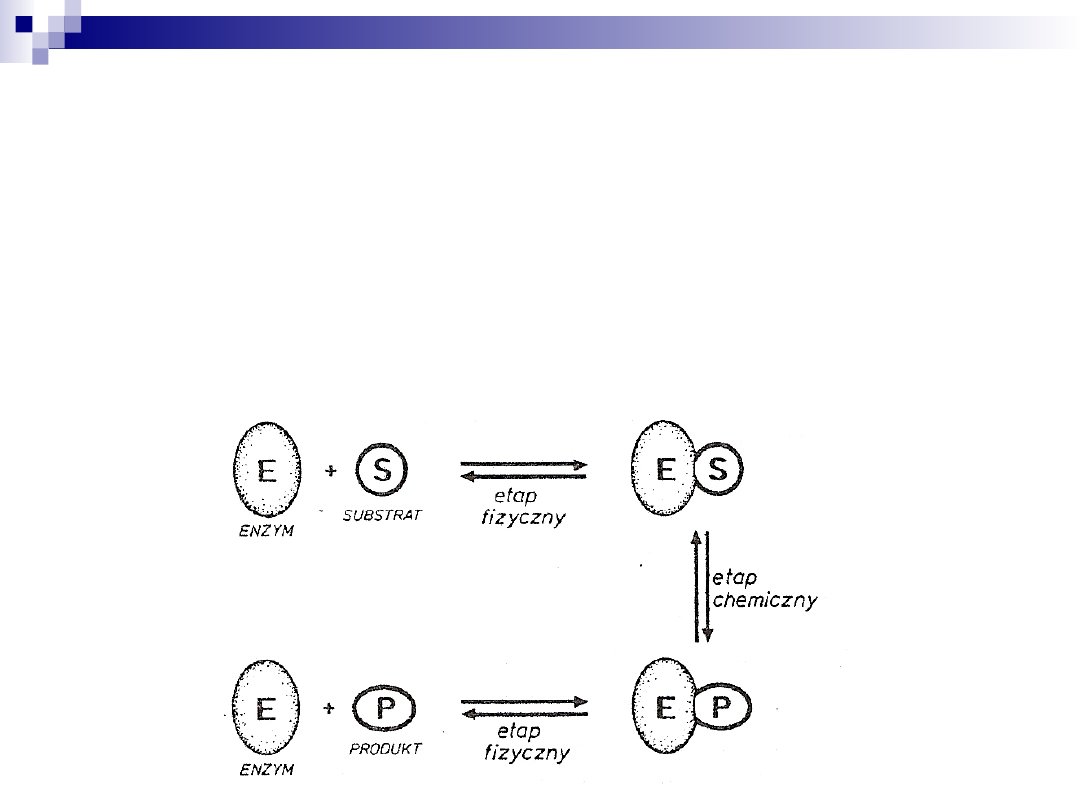
Przebieg reakcji chemicznej charakteryzowany jest przez stałą
równowagi reakcji i stałą szybkości reakcji
Wszystkie reakcje odwracalne biegną do osiągnięcia stanu
równowagi, a stała równowagi nie mówi o tym, jak szybko ten stan
zostanie osiągnięty
Na proces katalizy enzymatycznej składa się szereg etapów
fizycznych i chemicznych

Model Michaelisa-Menten
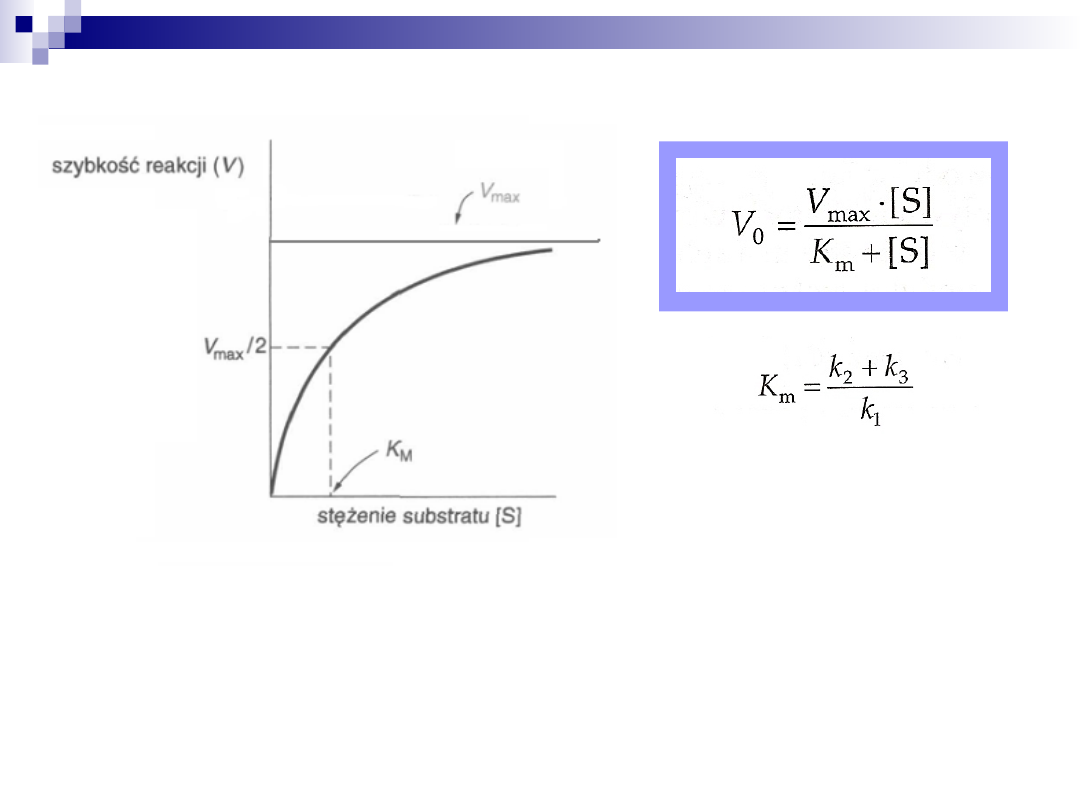
Zauważono, że przy małych stężeniach substratu początkowa
szybkość reakcji V
0
jest wprost proporcjonalna do [S]
Przy dużych stężeniach substratu szybkość staje się niezależna od [S]
Zakłada istnienie kompleksu aktywnego Enzym-
Substrat
Stała Michaelisa-Menten
Równanie Michaelisa-Menten opisuje przedstawioną krzywą hiperboliczną
Została w nim zdefiniowana nowa stała- K
m
(stała Michaelisa)
Jest ona miarą stabilności kompleksu ES
Dla wielu enzymów k
2
jest znacznie większe od k
3
i w tych warunkach K
m
staje się miarą powinowactwa enzymu do substratu
Wartość K
m
można wyznaczyć doświadczalnie
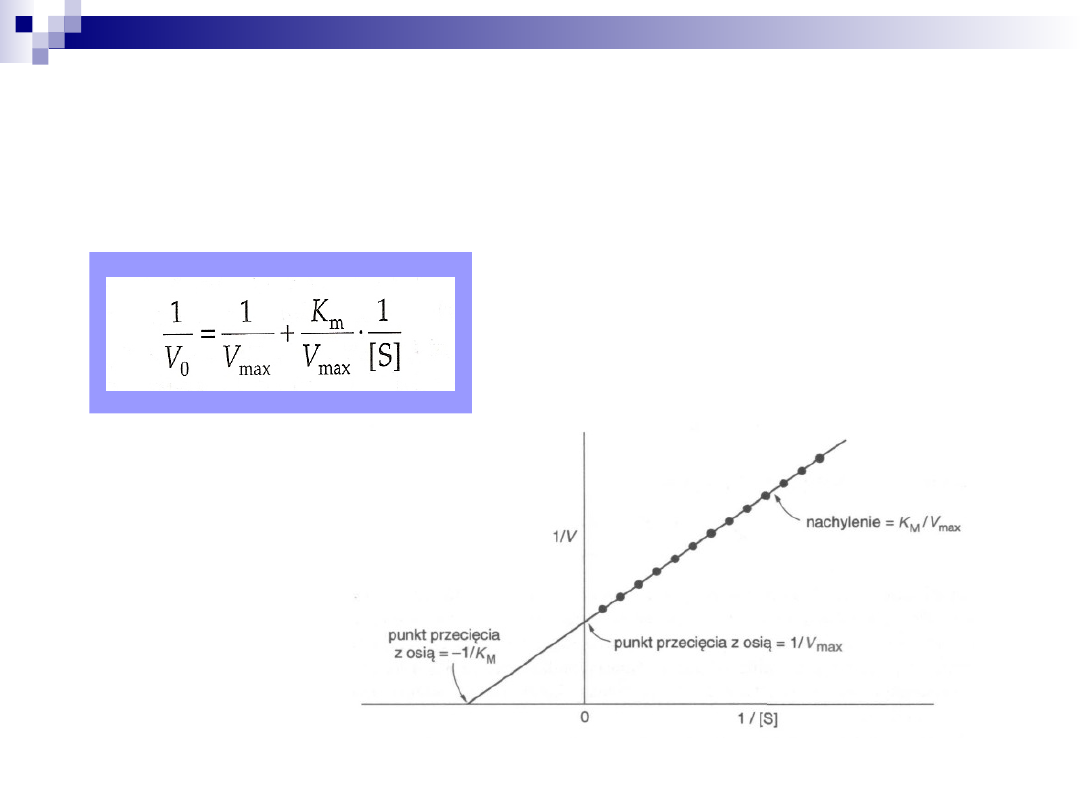
Metoda Lineweavera-Burka
Najprostsze przekształcenie równania Michaelisa-Menten
Postać liniowa równania

Hamowanie reakcji enzymatycznych
Szybkość reakcji enzymatycznej zależy od wielu czynników obecnych w
środowisku
Czynniki te dzieli się na niespecyficzne (inaktywatory) i specyficzne
(inhibitory)
Czynniki niespecyficzne: czynniki fizyczne - pH, temperatura,
czynniki chemiczne - rozpuszczalniki organiczne,
stężone roztwory soli metali ciężkich, niektóre
kwasy aromatyczne
Czynniki specyficzne: czynniki chemiczne, które działają na określony
fragment cząsteczki enzymu
Zjawisko specyficznego hamowania reakcji to inhibicja
Inhibitor blokuje współdziałanie składników biorących udział w reakcji
enzymatycznej (enzym, substrat, koenzym)

Inhibicję można podzielić na odwracalną i nieodwracalną
Inhibicję odwracalną można podzielić na kompetencyjną
(współzawodniczącą) i niekompetencyjną (niewspółzawodniczącą)
Inhibitory nieodwracalne wiążą się ściśle, często kowalencyjnie,
z resztami aminokwasów w miejscu aktywnym enzymu trwale
inaktywując enzym,
Inhibitory odwracalne kompetencyjne współzawodniczą o
wiązanie z miejscem aktywnym enzymu z cząsteczkami substratu,
ten typ inhibicji można przezwyciężyć przez zwiększenie stężenia
substratu
Inhibitory odwracalne niekompetencyjne wiążą się z innymi
miejscami niż centrum aktywne enzymu powodując zmianę
konformacyjną enzymu i obniżając szybkość katalityczną enzymu
Inhibicja enzymów
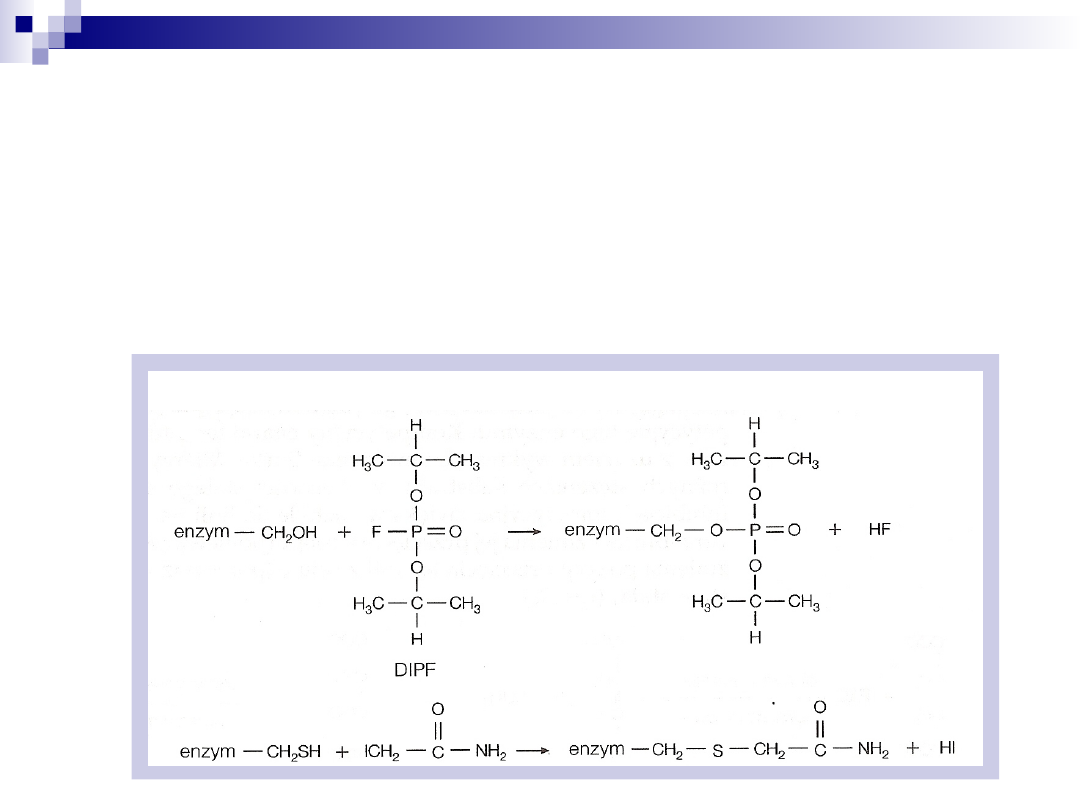
Inhibicja nieodwracalna
Przykładowe inhibitory tego typu to:
DIPF –diizopropylofluorofosforan (składnik gazów bojowych
działających na układ nerwowy)
Amid kwasu jodooctowego
Kwas p-chlorortęciobenzoesowy (pCMB)
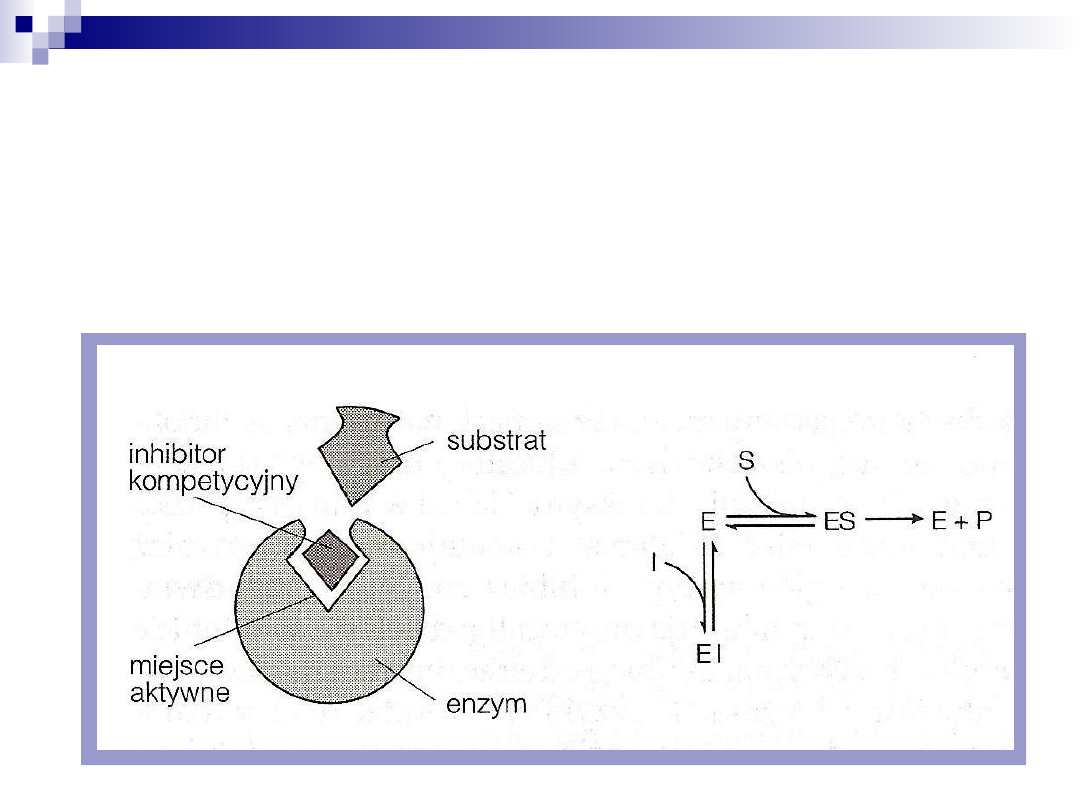
Inhibicja odwracalna
Inhibitory kompetencyjne są zazwyczaj strukturalnie podobne
do naturalnego substratu enzymu przez co konkurują z naturalnym
substratem o miejsce w centrum aktywnym enzymu
Duże stężenie substratu niweluje działanie inhibitora
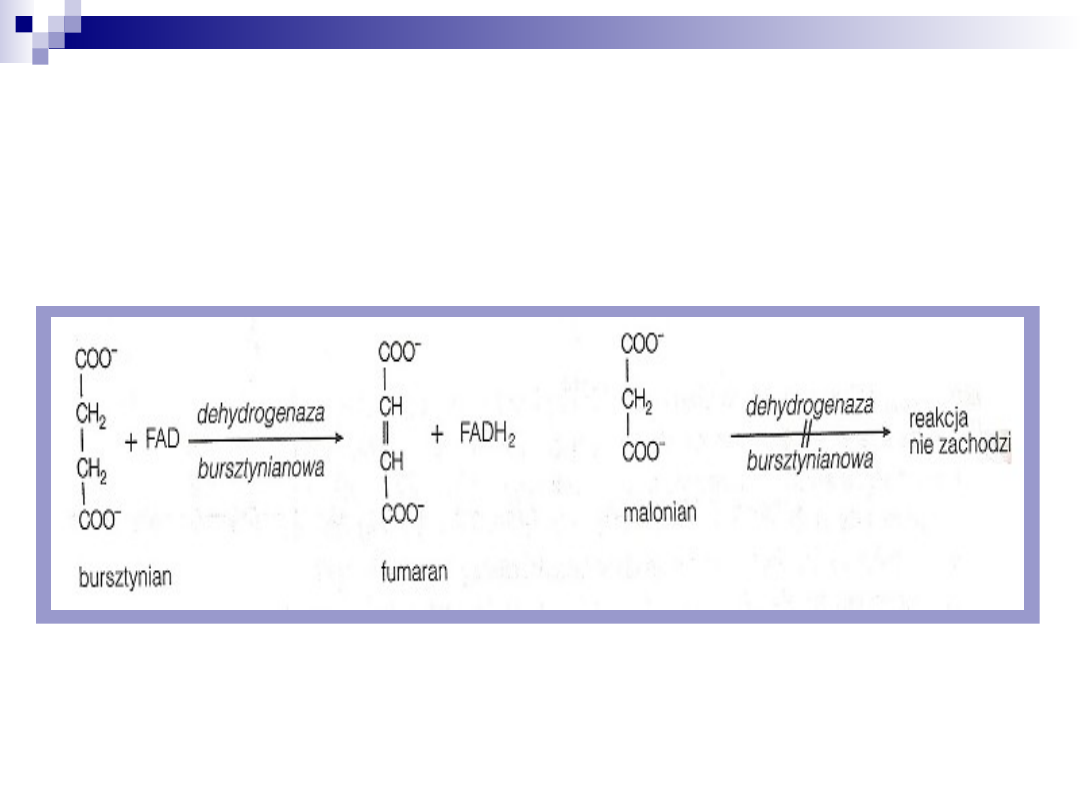
Przykład inhibicji kompetencyjnej
Hamowanie przemiany bursztynianu do fumaranu katalizowanej
przez dehydrogenazę bursztynianową
FAD- dinukleotyd flawinoadeninowy
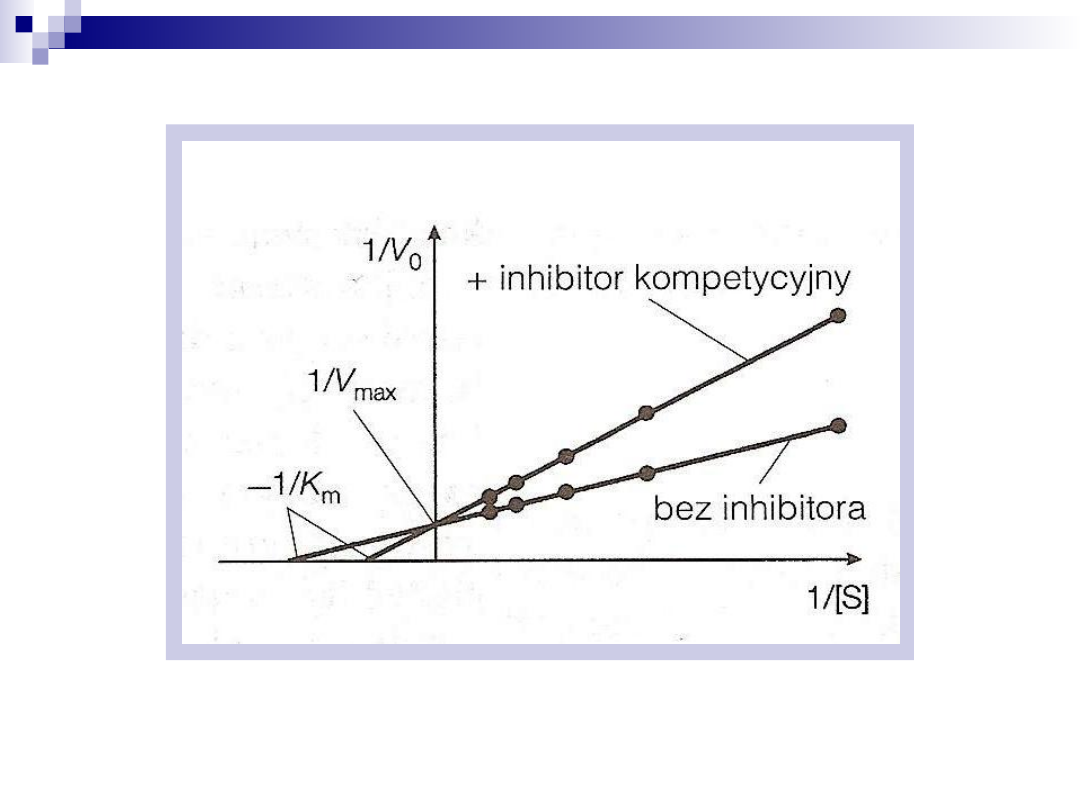
Wpływ inhibitora kompetencyjnego na V
max
i
K
m
Inhibitory kompetencyjne nie wpływają na wartość V
max
, a jedynie zwiększają
wartość K
m
, która jest miarą powinowactwa enzymu do substratu
Obecność inhibitora jedynie pozornie zmniejsza powinowactwo enzymu do
substratu
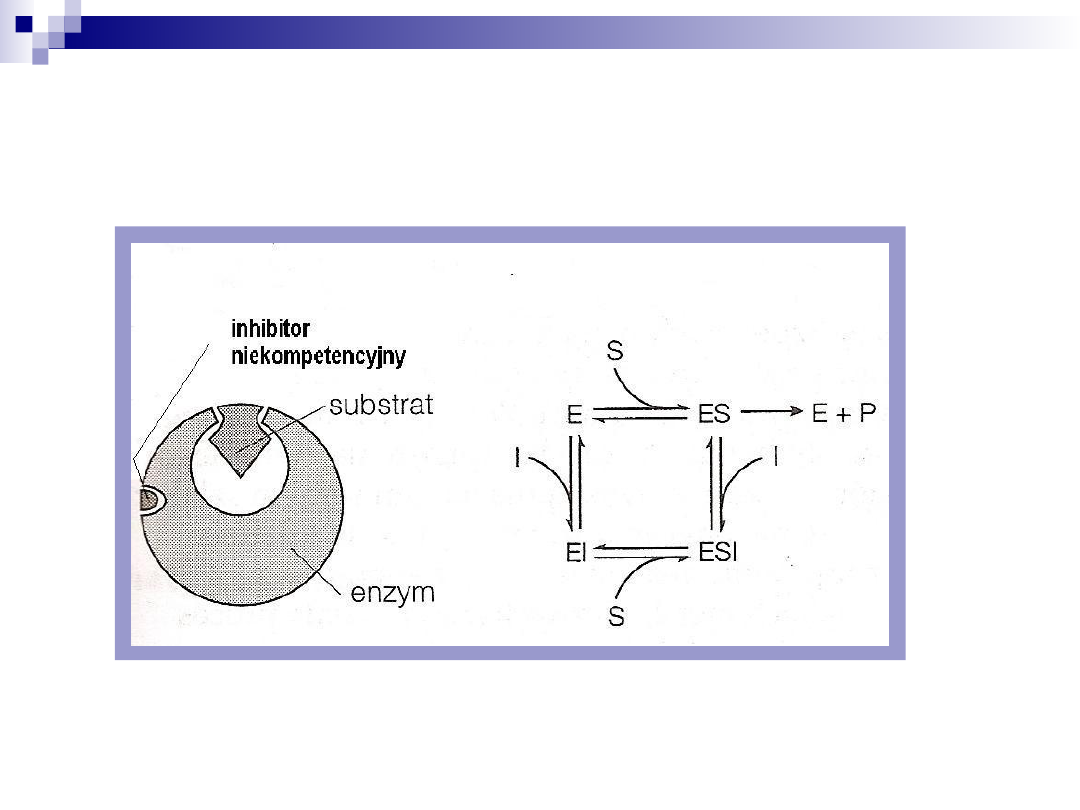
Inhibitory niekompetencyjne wiążą się w innym miejscu
enzymu niż jego centrum aktywne
Enzym wiąże inhibitor albo substrat lub też inhibitor i substrat
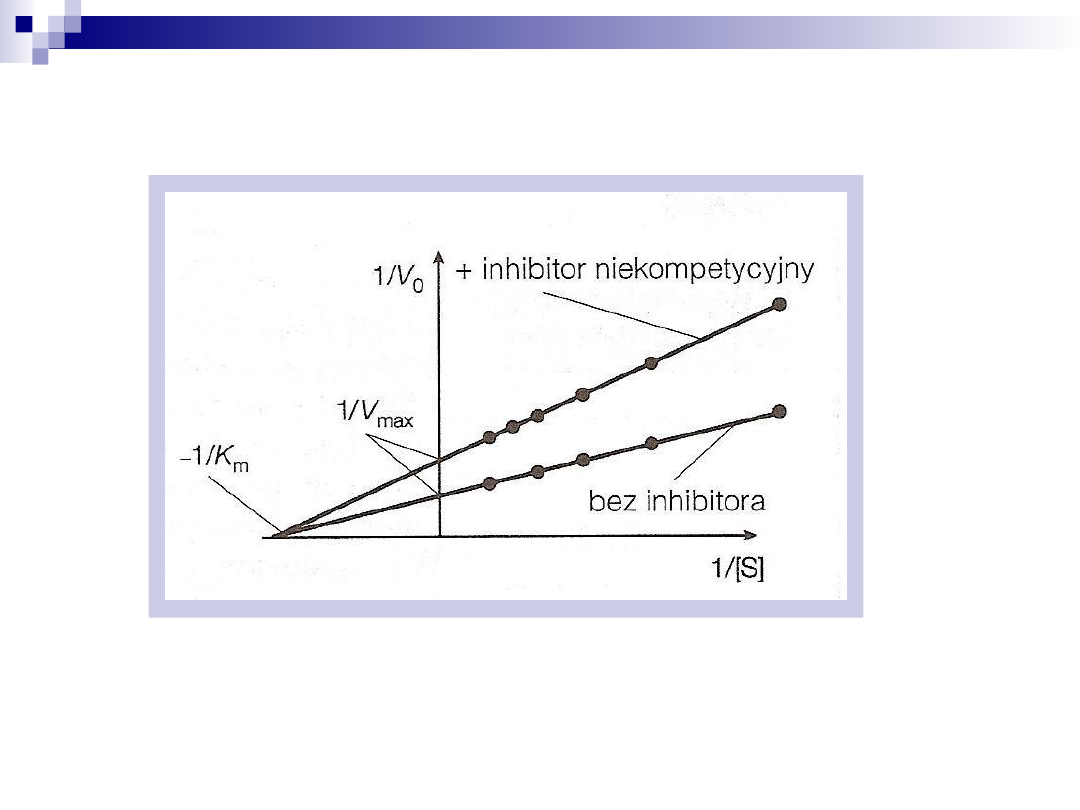
Wpływ inhibitora niekompetencyjnego na
V
max
i K
m
Inhibitory niekompetencyjne wpływają na wartość V
max
, ale nie
zmieniają wartości K
m
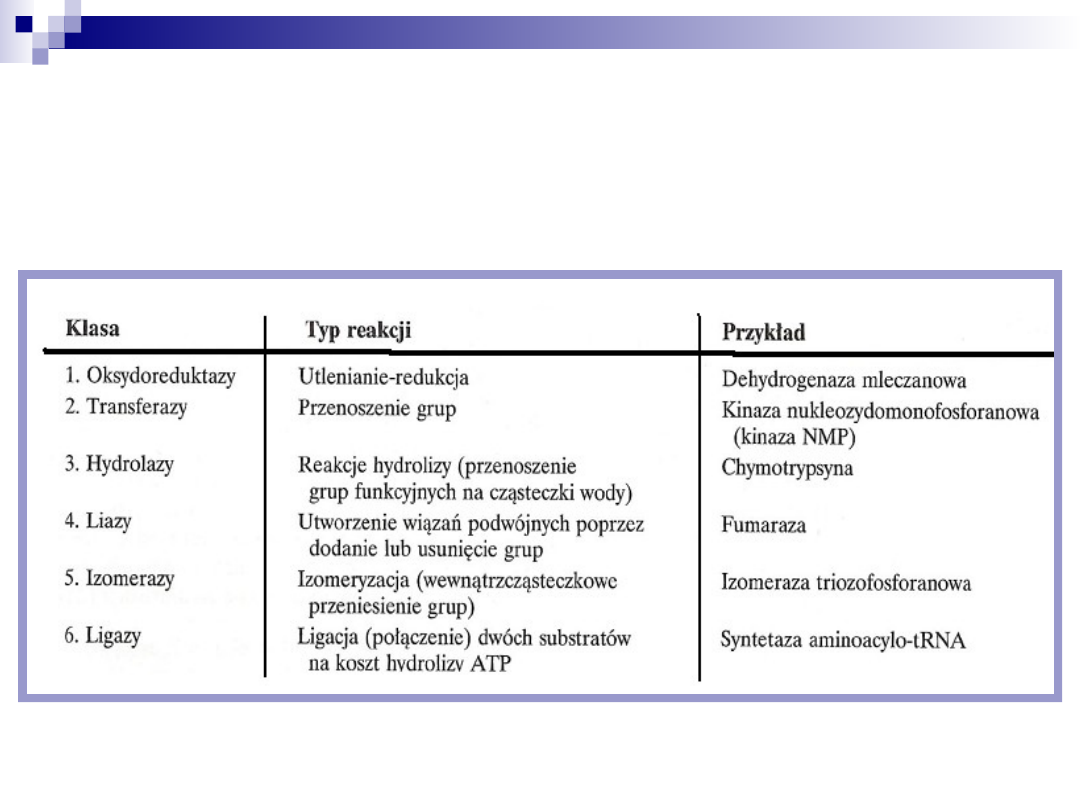
Klasyfikacja enzymów
Dla ujednolicenia klasyfikacji enzymów w 1964 r Międzynarodowa
Unia Biochemiczna powołała Komisję Enzymatyczną, która
opracowała system nazewnictwa enzymów
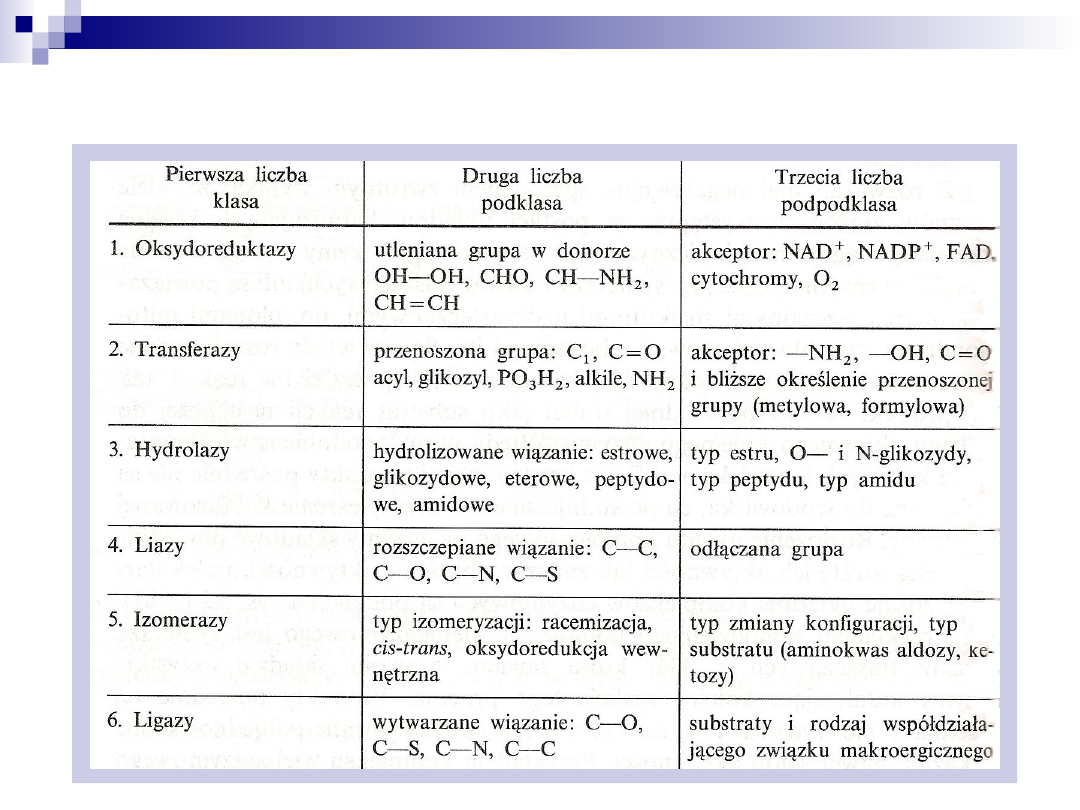
Szczegóły klasyfikacji enzymów

Kontrola aktywności enzymatycznej
Regulacja aktywności enzymatycznej może zachodzić poprzez
sprzężenie zwrotne (produkt końcowy hamuje decydujący etap
syntezy aby zapobiec nagromadzeniu się półproduktów,
niepotrzebnemu zużywaniu substratów i energii)
Regulacja allosteryczna w przypadku enzymów z więcej niż
jednym miejscem aktywnym (związanie substratu w jednym
miejscu aktywnym zmienia konformację enzymu i indukuje
powinowactwo do substratu w innych miejscach aktywnych)
Odwracalne modyfikacje kowalencyjne pozwalają na czasową
zmianę aktywności enzymatycznej poprzez tworzenie lub
rozrywanie wiązań kowalencyjnych pomiędzy enzymem a grupą
niebiałkową (np. fosforylacja)
Nieaktywne prekursory enzymów (proenzymy, zymogeny)
mogą być aktywowane poprzez hydrolizę wiązań peptydowych
Zmiana szybkości rozpadu białka enzymatycznego oraz
jego ilości (poprzez indukcję bądź represję genu kodującego
enzym) pozwala na regulowanie aktywności enzymatycznej
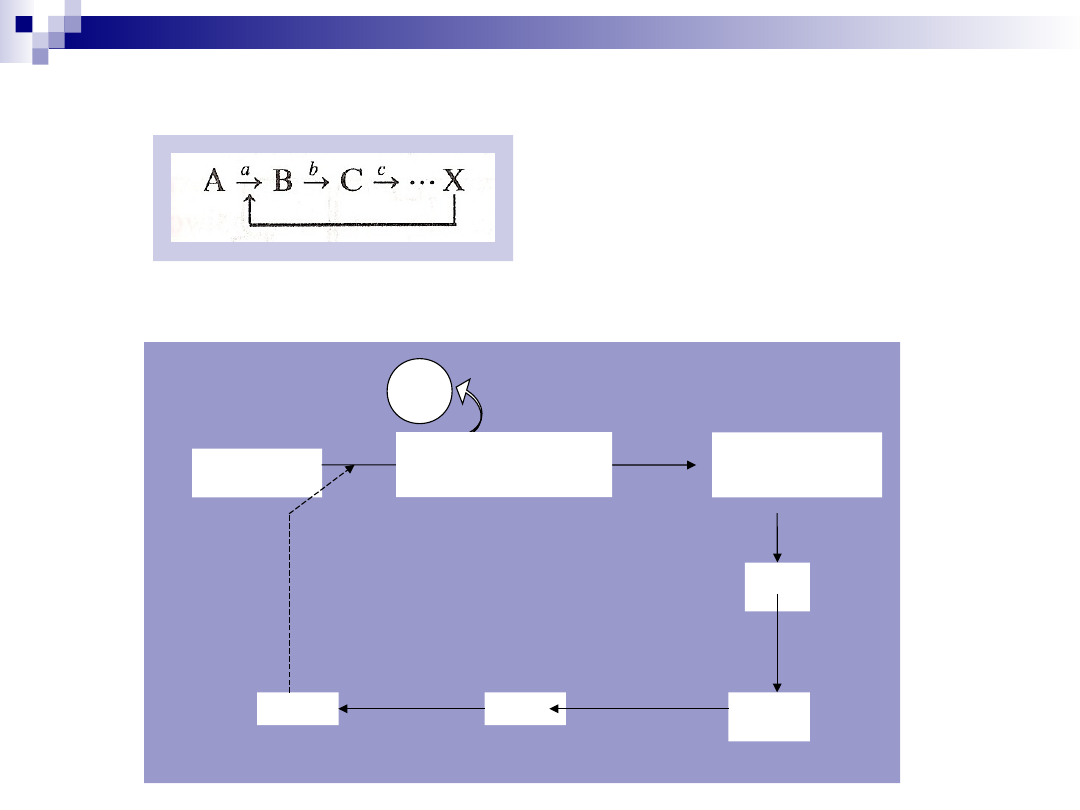
Regulacja przez sprzężenie zwrotne
Asp +
CP
Karbamoil
o-
asparagini
an
P
OA
OM
P
UM
P
CMP
Karbamoilo-
transferazaAs
p
CP- karbamoilofosforan
OA- kwas orotowy
OMP-
orotydynomonofosforan
UMP-
urydynomonofosforan
CMP-
cytydynomonofosforan
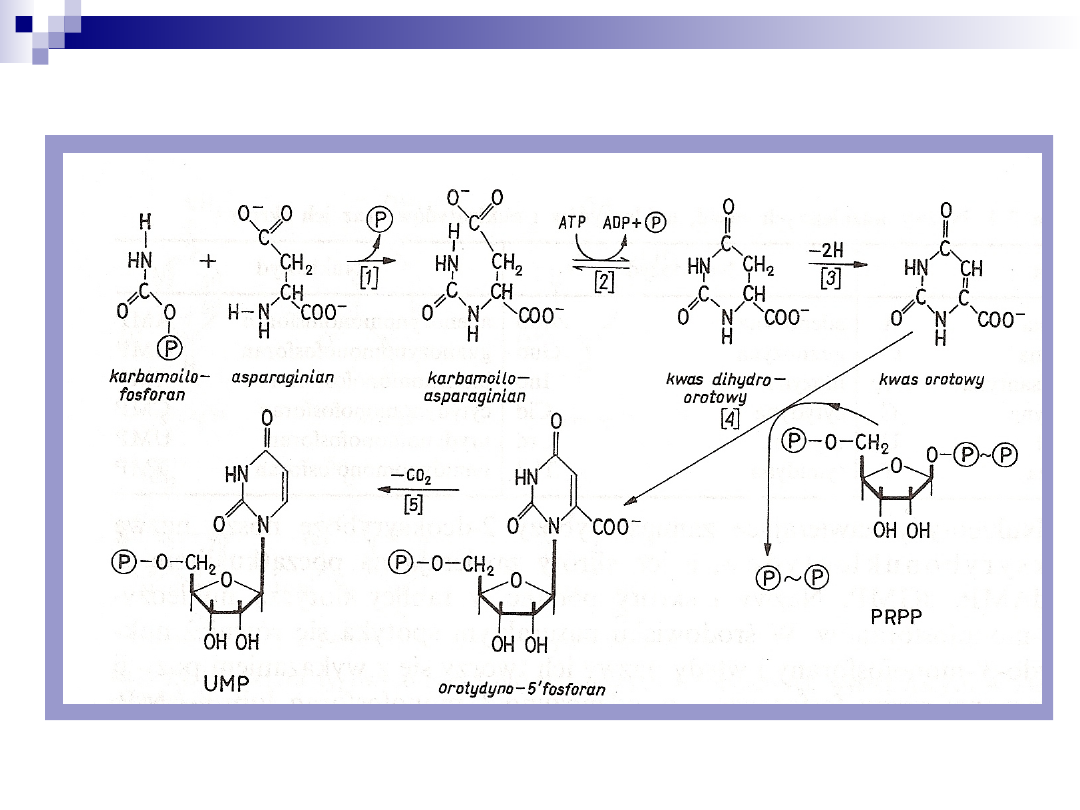
Synteza UMP- urydynomonofosforanu
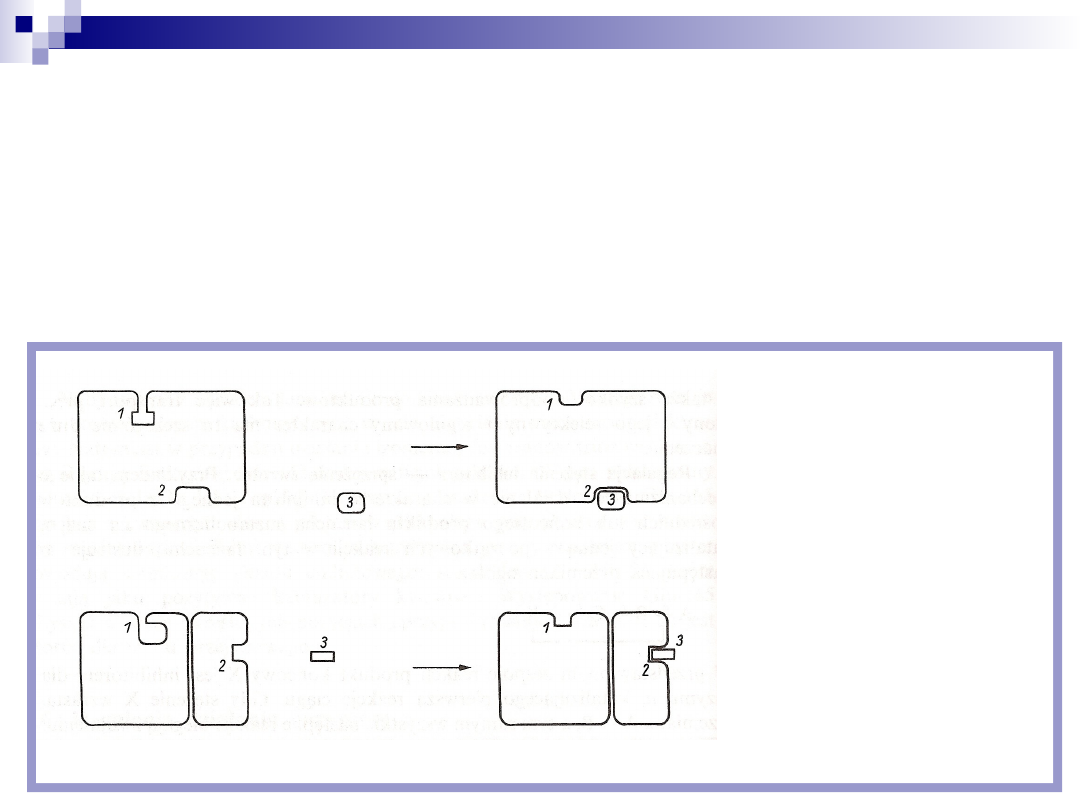
Regulacja allosteryczna
Mechanizm ten wykorzystuje efekt allosteryczny w przypadku gdy
regulowany enzym jest białkiem allosterycznym
Efektor allosteryczny łączy się z białkiem i tym samym powoduje jego
modyfikację
Efektory allosteryczne mogą działać na enzym aktywująco (pozytywne
sprzężenie zwrotne) lub dezaktywująco (negatywne sprzężenie zwrotne)
1- centrum aktywne
enzymu
2- centrum allosteryczne
3- efektor allosteryczny
Białko enzymowe w postaci
monomeru
Białko enzymowe w postaci dimeru
Odwracalne modyfikacje kowalencyjne
Wiele grup niebiałkowych może być odwracalnie dołączanych do
enzymów jednak najczęstszą modyfikacją jest wprowadzanie lub
usuwanie grupy fosforanowej
H
2
O
P
i
białko - OH
białko - O - P = O
O
O
ATP
ADP
fosfataza
białkowa
kinaza
białkowa
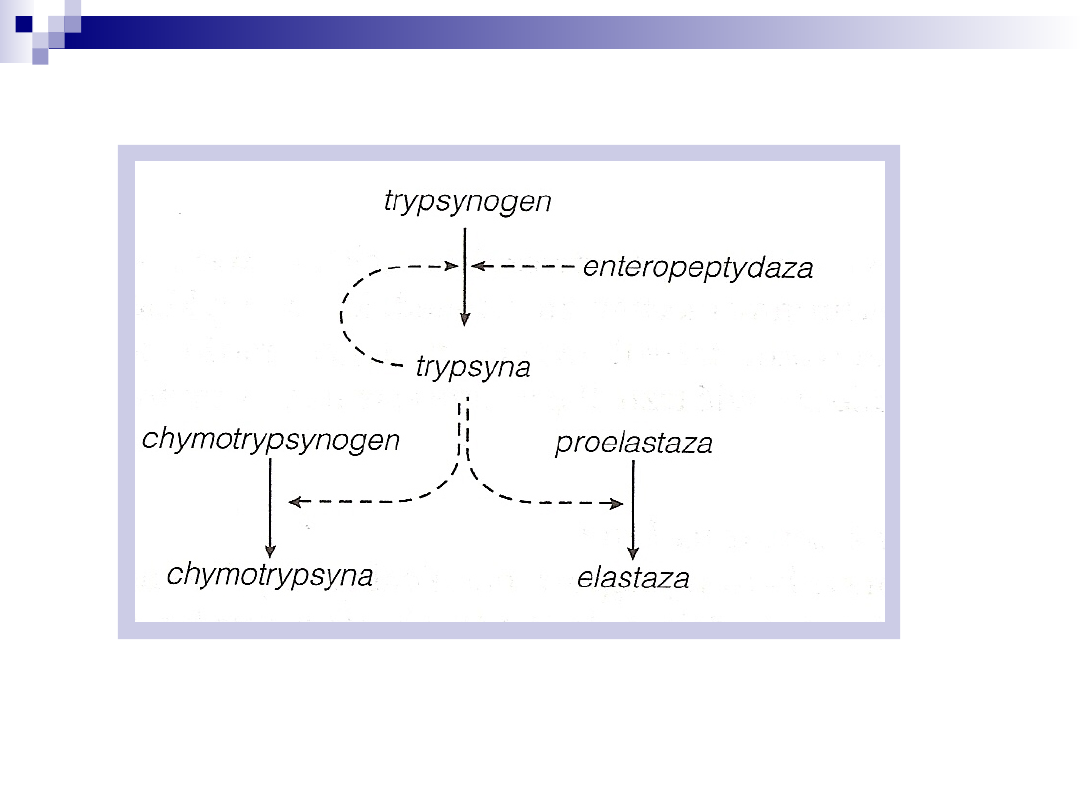
Aktywacja proteolityczna
Proteazy trzustkowe (trypsyna, chymotrypsyna i elastaza) powstają jako tzw.
zymogeny
Aktywacja zymogenów polega na nieodwracalnej hydrolizie wiązań peptydowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
ENZYMY KINETYKA REAKCJI ENZYMATYCZNYCH
Wykład 1 inżynierskie Wprowadzenie do zarządzania operacyjnego
Wprowadzenie do medycyny rozwojowej 1
PD W1 Wprowadzenie do PD(2010 10 02) 1 1
Wprowadzenie do psychologii
Wprowadzenie do filozofii
(1) Wprowadzenie do nauki o finansach 1id 778 ppt
wprowadzenie do systemu win i podst sieci
wprowadzenie do psychologii społecznej
06 Kinetyka reakcji enzymatycznych
Wprowadzenie do cw1A
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
MWB 1 Wprowadzenie do modelowania wymagań w bezpieczeństwie
Wprowadzenie do Kryptografii
Wprowadzenie do pomocy społecznej
więcej podobnych podstron