1
Ćwiczenie 7
ENZYMY. KINETYKA REAKCJI ENZYMATYCZNYCH
Część doświadczalna obejmuje:
− wyznaczenie optimum pH dla reakcji katalizowanej przez kwaśną fosfatazę
− wyznaczenie szybkości początkowej reakcji katalizowanej przez kwaśną fosfatazę
WPROWADZENIE
Fosfataza kwaśna (EC 3.1.3.2) – „enzym znacznikowy” lizosomów, głównego miejsca
trawienia wewnątrzkomórkowego
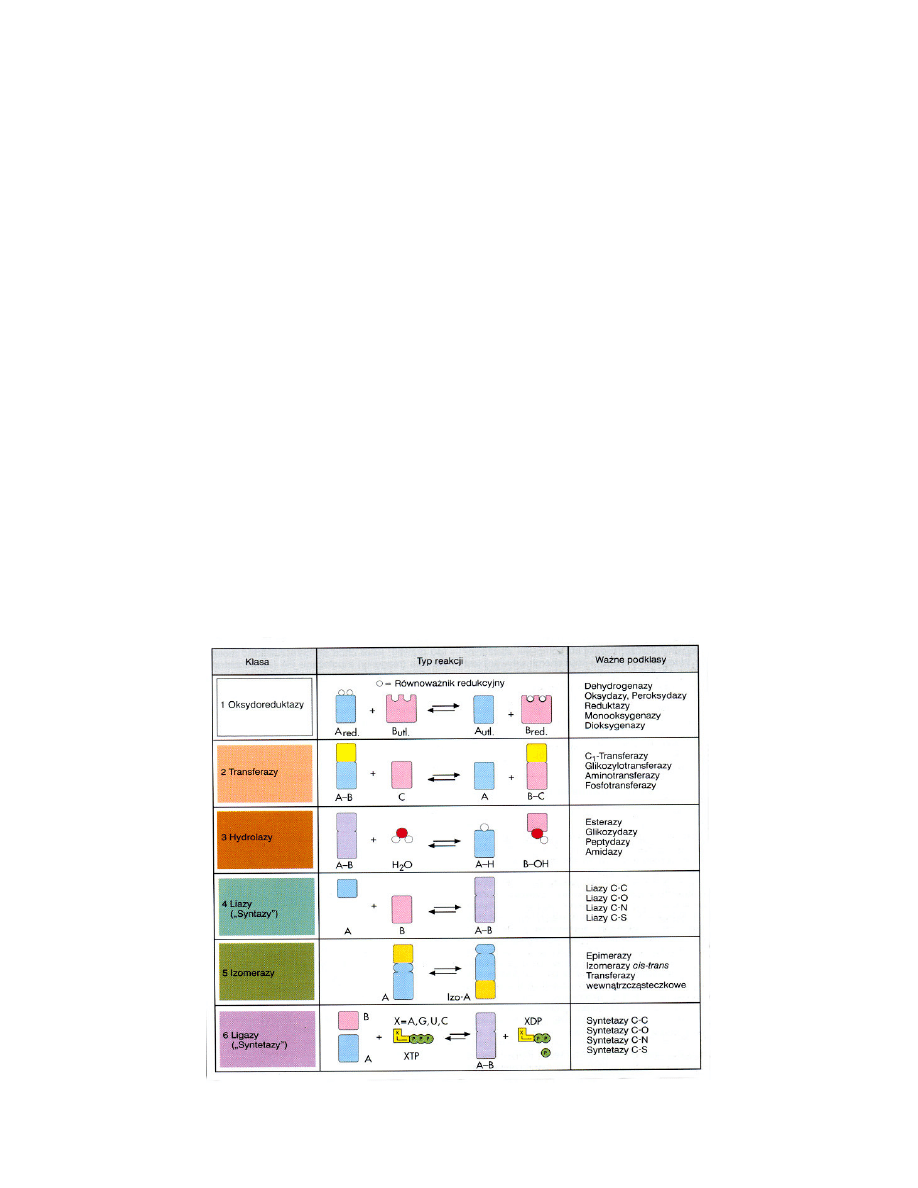
Fosfatazy to grupa enzymów należących do klasy hydrolaz (klasa 3 – obejmuje en-
zymy rozszczepiające wiązania z udziałem cząsteczki wody, Tabela 1), podklasy enzymów
hydrolizujących wiązania estrowe (esterazy), podpodklasy hydrolaz monoestrów fosforano-
wych.
Tabela 1. Klasy enzymów (Koolman i Röhm 2005)

2
Fosfatazy katalizują odszczepienie reszty fosforanowej od cukrowców, białek, tłuszczowców,
nukleotydów i wielu innych naturalnych estrów kwasu fosforowego według poniższej reakcji:
R-O-PO
3
H¯ + H
2
O R-OH + H
2
PO
4
¯
Poza naturalnymi substratami, hydrolazy monoestrów fosforanowych rozszczepiają także
estry fosforanowe fenoli, np. p-nitrofenylofosforan.
Fosfatazy działają w pH alkalicznym, z optymalnym pH w zakresie 9,0 – 11,0, jak
również w pH kwaśnym i obojętnym, w zakresie 4,5 – 7,0. Te ostatnie są typowe dla komórek
roślinnych, chociaż nie brakuje ich także w komórkach zwierzęcych, gdzie występują przede
wszystkim w lizosomach, niewielkich błonowych pęcherzykach będących głównym miej-
scem trawienia wewnątrzkomórkowego. Lizosomy zawierają specyficzny zestaw hydrolaz,
optymalnie aktywnych w środowisku kwaśnym, uczestniczących w rozkładzie organelli ko-
mórkowych i wszystkich rodzajów makrocząsteczek dostarczanych do komórki różnymi dro-
gami. Wiodącym enzymem jest tu kwaśna fosfataza uznawana za tzw. „enzym znaczniko-
wy” lizosomów. Kwaśne środowisko światła lizosomu (pH ~ 5) jest utrzymywane dzięki
działaniu błonowej H
+
-ATPazy, pompującej H
+
z cytozolu do wnętrza lizosomu (Ryc. 1).
Ryc. 1. Schemat lizosomu (Alberts i wsp. 1999)
W obojętnym pH cytoplazmy (pH 7 – 7,3), hydrolityczne enzymy lizosomalne wykazują ni-
ską aktywność. Jest to przypuszczalnie mechanizm obronny przed samoistnym strawieniem
fosfataza
3
komórki, w przypadku, gdyby enzymy dostały się do cytoplazmy. W komórkach roślin i
grzybów rolę lizosomów pełni wakuola komórkowa. Kwaśny odczyn wnętrza wakuoli, istot-
ny dla aktywności występujących tam enzymów hydrolitycznych, jest utrzymywany dzięki
działaniu dwóch pomp protonowych (H
+
-ATPazy i H
+
-PPazy) zlokalizowanych w błonie ota-
czającej wakuolę, tzw. tonoplaście.
Podstawy kinetyki enzymatycznej
Kinetyka enzymatyczna stanowi dział enzymologii zajmujący się zagadnieniami zwią-
zanymi z szybkością reakcji katalizowanych enzymatycznie. Szybkość reakcji enzymatycz-
nej (V), która jest miarą aktywności, czyli katalitycznego działania enzymu, mierzy się
podobnie jak szybkość reakcji chemicznych. Jest ona w pewnym zakresie proporcjonalna do
stężenia substancji reagujących; wyznacza ją przyrost stężenia produktu reakcji w czasie.
Miarą szybkości reakcji w danym momencie jest więc wzrost stężenia produktu, jaki następu-
je w jednostce czasu.
Aktywność enzymatyczną wyrażamy w dwóch standardowych jednostkach. Są to:
jednostka enzymatyczna (U) oraz katal (kat). Jednostka enzymatyczna (U) jest to taka
ilość enzymu, która katalizuje przekształcenie 1
µmola substratu w ciągu 1 minuty, w warun-
kach optymalnych dla danego enzymu. Katal (kat) jest jednostką aktywności enzymatycznej
obowiązującą w układzie SI i jest definiowany jako aktywność katalityczna, która zwiększa
szybkość reakcji o 1 mol na sekundę, w warunkach optymalnych.
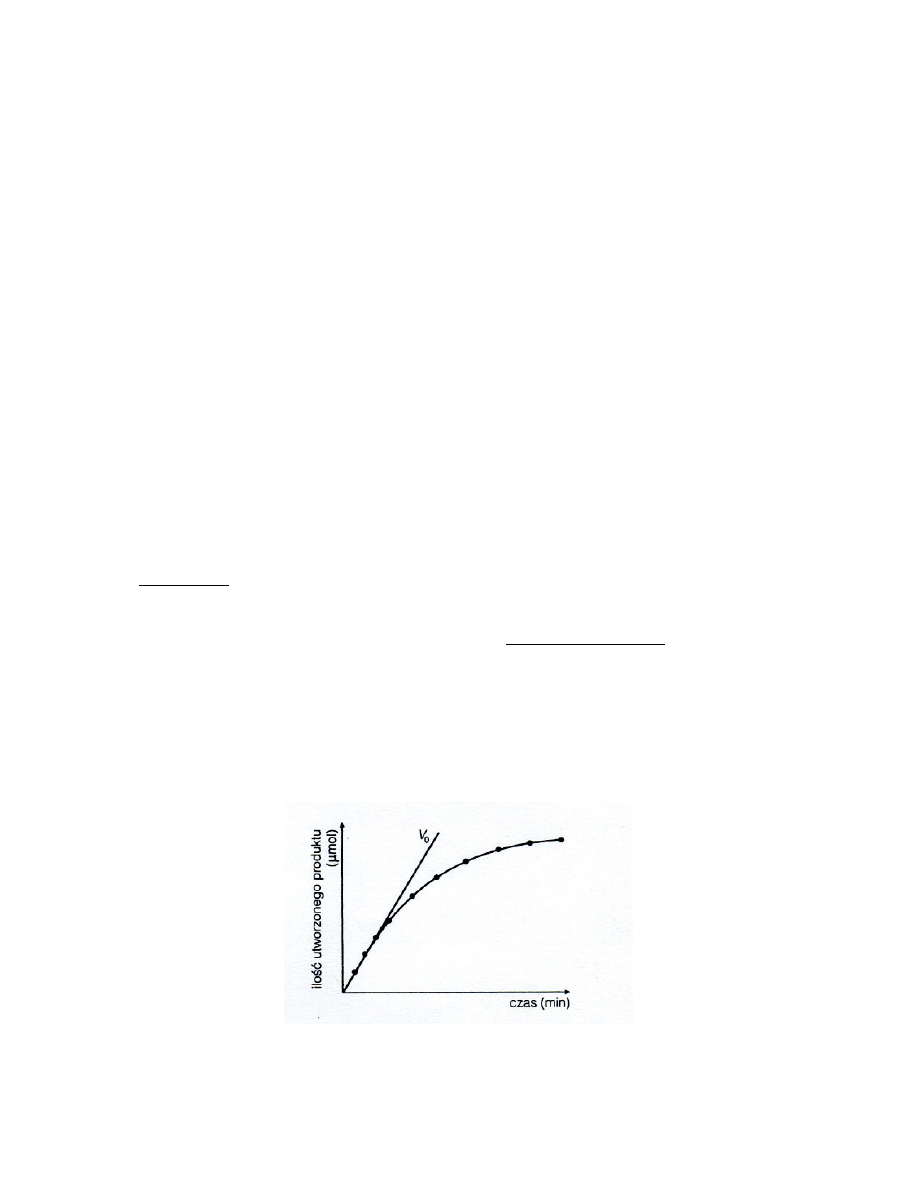
Przy stałym stężeniu enzymu i substratu szybkość powstawania produktu reakcji powinna być
wprost proporcjonalna do czasu reakcji. W rzeczywistości tylko w początkowej fazie reakcja
ta jest reakcją pierwszego rzędu (Ryc. 2), co znaczy, że szybkość działania enzymu jest li-
niową funkcją czasu – jest to tzw. szybkość początkowa reakcji enzymatycznej (V
0
).
Ryc. 2. Wzrost ilości produktu reakcji enzymatycznej w czasie

4
Należy pamiętać, że w analizach in vitro stężenie substratu maleje w czasie reakcji i przy
dłuższym czasie inkubacji zależność pomiędzy przyrostem produktu, a czasem reakcji nie
będzie funkcją liniową (Ryc. 2). Również enzym w trakcie wykonywania oznaczeń może
ulegać denaturacji, co pogłębia powyższy efekt. Wartość V
0
uzyskuje się przez wykreślenie
linii prostej stycznej do początkowego odcinka krzywej, poczynając od czasu zerowego
(Ryc. 2). Nachylenie tej prostej ma wartość V
0
. Dla badań kinetyki enzymów in vitro niezwy-
kle ważne jest więc określenie czasu reakcji, w którym przyrost produktu reakcji enzyma-
tycznej jest wprost proporcjonalny do czasu.
V
0
=
Szybkość reakcji enzymatycznej zależy od wielu czynników fizycznych i chemicznych, ta-
kich jak: stężenie enzymu, stężenie substratu, temperatura, pH, stężenie aktywatorów i inhibi-
torów. Większość enzymów wykazuje maksymalną aktywność w środowisku o określonym
stężeniu jonów wodorowych (w określonym pH). Wynika to stąd, że w katalizie enzymatycz-
nej biorą udział, między innymi, zjonizowane grupy funkcyjne centrum aktywnego. Odsetek
cząsteczek enzymu, w których grupy kwasowe lub zasadowe znajdują się w formie jonowej,
zależy od pK tych grup i stężenia jonów wodorowych w roztworze. Zależność aktywności
enzymatycznej od pH przyjmuje najczęściej postać krzywej w kształcie dzwonu (Ryc. 3).
Ryc. 3. Zależność aktywności enzymu od pH (Koolman i Röhm 2005)
produkt (
µmole)
czas (min)
5
Rozpiętość optimum pH, czyli takiej wartość pH, przy której aktywność jest maksymalna,
jest bardzo duża. Dla wielu enzymów optimum pH znajduje się w pobliżu pH komórki (pH
7,0), ale np. pepsyna (EC 3.4.23.1) występująca w kwaśnym środowisku żołądka wykazuje
najwyższą aktywność w pH około 2,0, a arginaza (EC 3.5.3.1.) w pH powyżej 10,0. Optymal-
ną wartość pH, która jest jedną z wartości liczbowych charakteryzujących dany enzym, wy-
znacza się z wykresu zależności aktywności od pH.
WYKONANIE
Zasada metody
W ćwiczeniu, do wyznaczenia optimum pH, podobnie jak w wyznaczaniu szybkości
początkowej reakcji, stosuje się metodę, w której naturalny substrat kwaśnej fosfatazy zo-
staje zastąpiony sztucznym substratem – p-nitrofenylofosforanem (analogiem naturalnego
substratu). Enzym hydrolizując p-nitrofenylofosforan, uwalnia p-nitrofenol, który w środowi-
sku zasadowym tworzy żółto zabarwiony anion p-nitrofenolanowy.
fosfataza
4
3
2
PO
H
O
H
O N
2
2
P
N
O
O
O
OH
OH
OH
+
+
p-nitrofenylofosforan (pNPP) p-nitrofenol (pNP)
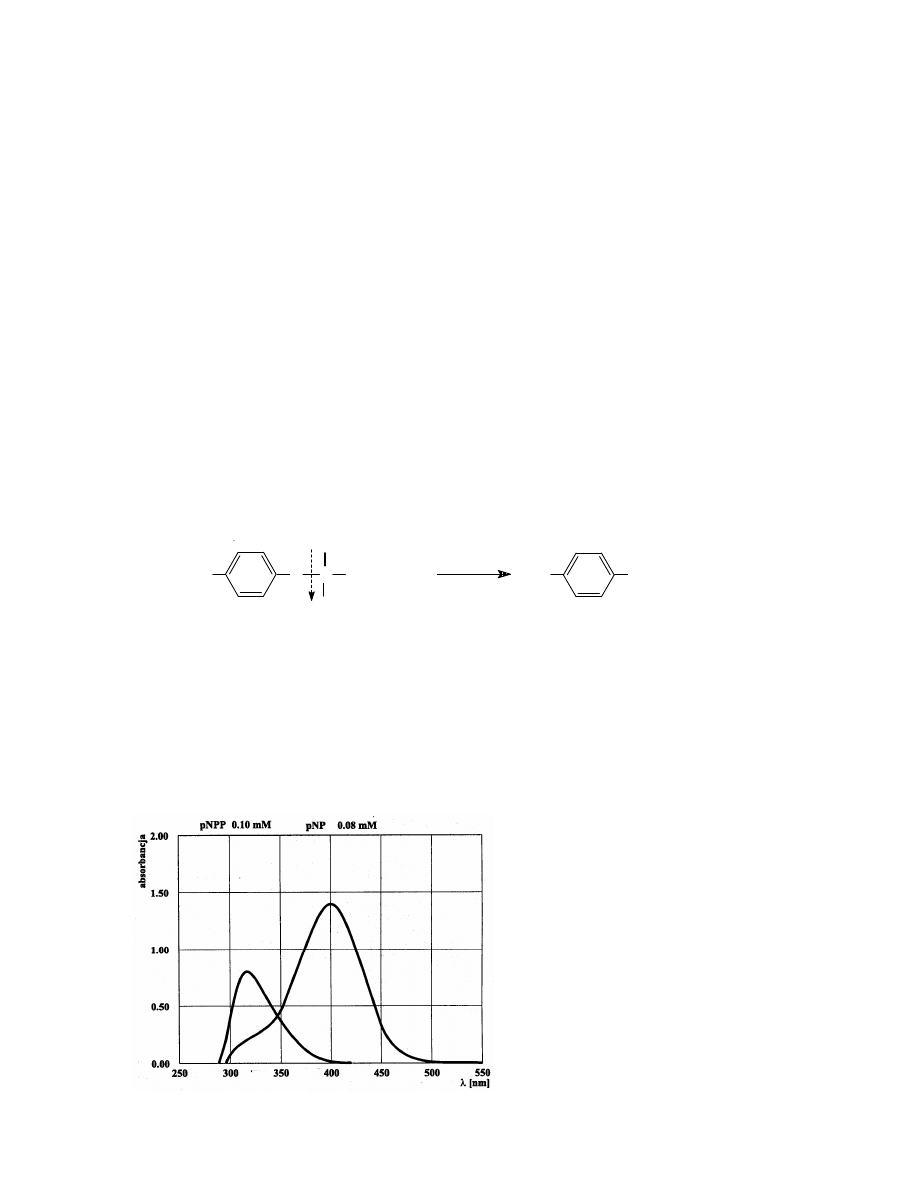
Natężenie barwy mierzone przy
λ = 405 nm jest proporcjonalne do ilości zhydrolizowanego
substratu. Ryc. 4 przedstawia widmo absorpcyjne p-nitrofenylofosforanu (pNPP) i p-
nitrofenolu (pNP).
Ryc. 4. Widmo absorpcyjne pNPP i
pNP w środowisku alkalicznym

6
Odczynniki:
1. 8 mM p-nitrofenylofosforan w H
2
O
2. 0,1M NaOH
3. 0,9% NaCl
4. 0,5 M bufory Tris-octan o pH 4,0; 4,5; 5,0; 5,5; 6,0; 6,5
Materiał:
Wyciąg z ziemniaka: obrany i umyty ziemniak zetrzeć na tarce, przesączyć przez warstwę
nylonu. Odstawić do lodówki.
Wyznaczanie optimum pH kwaśnej fosfatazy
Do probówek napipetować po: 0,25 ml 8 mM p-nitrofenylofosforanu i 0,25 ml odpo-
wiedniego buforu, kolejno od pH 4,0 do 6,5. Próby wykonać w dwóch powtórzeniach dla
każdego pH. Starannie wymieszać zawartość probówek i wstawić je do łaźni wodnej o temp.
30
0
C (preinkubacja). Wyciąg z ziemniaka zawierający kwaśną fosfatazę rozcieńczyć 250x
używając 0,9% roztworu NaCl (w cylinderku miarowym na 25 ml).
Do preinkubowanych prób zawierających napipetowany substrat i bufor dodawać, w
odstępach co 30 sekund, po 0,5 ml rozcieńczonego roztworu enzymu. Próby inkubować 15
minut w temperaturze 30
0
C, po czym reakcję przerwać dodając do każdej z nich po 5 ml
0,1M roztworu NaOH, w odstępach co 30 sekund i w kolejności takiej jak dodawano enzym.
Próbę kontrolną (zerową) wykonać równolegle z próbami badanymi postępując na-
stępująco: do probówki napipetować 0,25 ml buforu o pH 5,0 oraz 0,25 ml roztworu p-
nitrofenylofosforanu. Mieszaninę inkubować 15 minut w łaźni wodnej razem z próbami ba-
danymi, po czym dodać 5 ml 0,1 M roztworu NaOH, a na końcu dodać 0,5 ml enzymu (en-
zym w takich warunkach nie będzie już działał, ponieważ roztwór zawiera wysokie stężenie
NaOH).
Natężenie barwy zmierzyć wobec próby zerowej przy
λ = 405 nm. Wykreślić krzywą
zależności szybkości hydrolizy p-nitrofenylofosforanu (wyrażoną jako absorbancja przy
405nm) od pH.
Wyznaczanie szybkości początkowej reakcji
Wyznaczanie szybkości początkowej reakcji hydrolizy p-nitrofenylofosforanu należy
wykonać używając 4 lub 5 różnych rozcieńczeń wyciągu z ziemniaka (różne stężenie enzy-
mu). Każda para ćwiczeniowa przygotowuje jedno z wybranych rozcieńczeń wyciągu, np.

7
10x, 50x, 100x lub 250x (wyciąg należy rozcieńczyć 0,9% roztworem NaCl w cylindrze mia-
rowym na 25 ml) i wykonuje oznaczenie szybkości początkowej dodając do mieszaniny reak-
cyjnej wyciąg o określonym rozcieńczeniu (każda para inne rozcieńczenie!).
Do suchych probówek napipetować po 0,25 ml buforu octanowego o pH optymalnym
dla aktywności kwaśnej fosfatazy (zwykle jest to pH 5,5) i 0,25 ml roztworu substratu (próby
wykonać w dwóch powtórzeniach). Każda próba zawiera zatem po 0,5 ml mieszaniny inku-
bacyjnej o pH optymalnym dla fosfatazy kwaśnej. Próby wstawić do łaźni wodnej o tempera-
turze 30
0
C. Reakcję enzymatyczną rozpocząć dodając do każdej próby, w odstępach co 30
sekund, po 0,5 ml ekstraktu ziemniaczanego o odpowiednim rozcieńczeniu (10x, 50x,
100x lub 250x). Próby inkubować: 2, 4, 6, 8, 10 i 12 minut. Reakcję przerwać dodając, w
30-sekundowych odstępach, po 5 ml 0,1M roztworu NaOH w kolejności takiej jak dodawa-
no enzym.
Próby zerowe należy przygotować następująco: do probówki napipetować 0,25 ml
buforu o pH 5,5 oraz 0,25 ml p-nitrofenylofosforanu. Mieszaninę inkubować 12 minut w łaź-
ni wodnej razem z próbami badanymi, po czym dodać 5 ml 0,1M roztworu NaOH i na koniec
0,5 ml enzymu o danym rozcieńczeniu.
Dokonać pomiaru absorbancji przy
λ = 405 nm wobec próby zerowej. Na podstawie
otrzymanych wyników należy wykreślić zależność szybkości hydrolizy p-nitrofenylofos-
foranu (wyrażonej jako wartości absorbancji przy 405 nm) od czasu inkubacji, dla odpowied-
niego rozcieńczenia enzymu. Wszystkie pary ćwiczeniowe wymienią się wynikami, a następ-
nie każda osoba wykona jeden wykres, który będzie przedstawiał wyniki uzyskane przez całą
grupę ćwiczeniową. Należy przeanalizować przebieg krzywych zależności dla poszczegól-
nych rozcieńczeń enzymu!
Zagadnienia do przygotowania:
− podstawy katalizy enzymatycznej (zbliżenie i orientacja substratu, eliminacja wody, stabi-
lizacja stanu przejściowego, przenoszenie grup funkcyjnych)
− kinetyka reakcji enzymatycznych (aktywność enzymatyczna, jednostki aktywności, teoria
wysyceniowa Michaelisa-Menten, szybkość początkowa, szybkość maksymalna )
− enzymy izosteryczne i allosteryczne
− klasyfikacja i nomenklatura enzymów

8
Literatura:
Biochemia – JM Berg, JL Tymoczko, L Stryer PWN, Warszawa, 2005
Biochemia. Ilustrowany przewodnik – J Koolman, K-H Röhm, PZWL, Warszawa 2005
Elementy enzymologii – J Witwicki, W Ardelt, PWN, Warszawa 1984
Podstawy biologii komórki – B Alberts i wsp., PWN, Warszawa 1999
Wyszukiwarka
Podobne podstrony:
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka reakcji enzymatycznej m poteraj
Kinetyka reakcji enzymatycznych Nieznany
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
5 Kinetyka reakcji enzymatycznych
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka Reakcji Enzymatycznych
ĆWICZENIE 4 kinetyka reakcji enzymatycznej
Kinetyka reakcji enzymatycznych
I Wyznaczanie parametrow kinetyki reakcji enzymatycznej polarymetr
kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych
rybiak,biologia i ekologia, Kinetyka reakcji enzymatycznych
06 Kinetyka reakcji enzymatycznych
więcej podobnych podstron