
61
KINETYKA REAKCJI
ENZYMATYCZNEJ
ĆWICZENIE 4

62
Ćwiczenie 4
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
4. KINETYKA REAKCJI ENZYMATYCZNEJ – STAŁA MICHAELISA
4.1. Podstawy teoretyczne
4.2. Wykonanie ćwiczenia
Podczas wykonywania poniższego ćwiczenia zamiast kolb miarowych stosujemy
probówki. Wykorzystując rozcieńczone roztwory można zaniedbać zjawisko kontrakcji
(popełniany błąd jest minimalny) i przyjąć, że suma objętości poszczególnych
roztworów stanowi całkowitą objętość roztworu.
Przed rozpoczęciem ćwiczenia studenci w grupie ustalają zakres czynności które będzie
wykonywał każdy z nich, ponieważ w trakcie wykonywania ćwiczenia należy dokładnie
kontrolować czas, którym wykonywane są poszczególne czynności.
A. Czynności wstępne
Student 1: Roztwór inwertazy
Drożdże świeże (0.5g) rozetrzeć w moździerzu z piaskiem, dodać 100ml wody
destylowanej, następnie przesączyć przez lejek zawierający niewielką ilość Celitu.
Pozostałość w zlewce i na lejku przemyć 100ml wody destylowanej. Supernatant,
zawierający inwertazę, stanowi materiał do ćwiczeń.
Student 2: Roztwory sacharozy o różnych stężeniach
Przygotować 100ml 0.2M roztworu sacharozy (M = 342 g/mol) w buforze octanowym.
Następnie należy przygotowany roztwór rozcieńczyć w krótkich probówkach według
poniższego schematu.
Rysunek 1
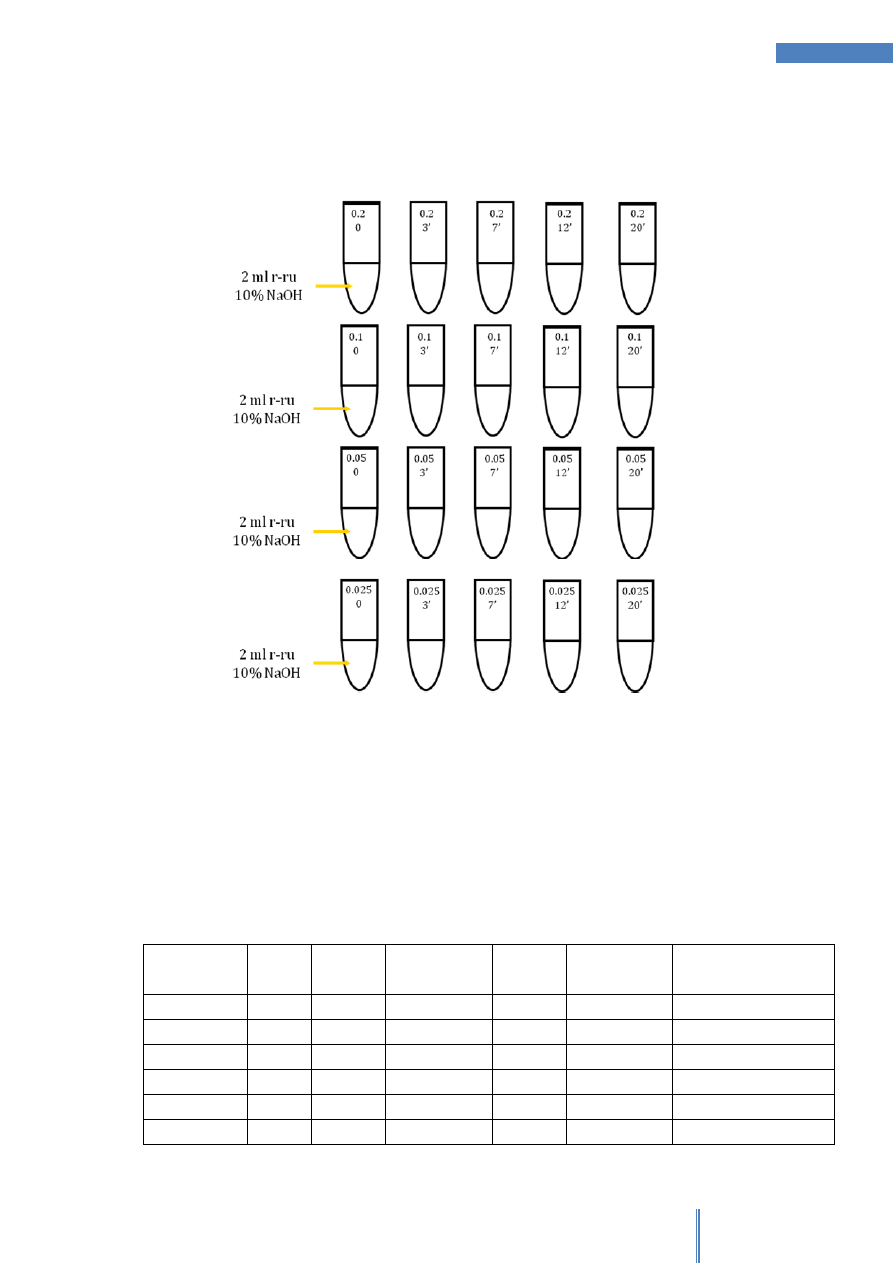
63
Ćwiczenie 4
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Student 3: przygotowanie probówek z 10% roztworem NaOH (do zakończenia reakcji)
Przygotować 20 suchych, długich probówek i do każdej wprowadzić 2ml 10% r-ru
NaOH. Probówki opisać zgodnie z poniższym schematem:
Rysunek 2
B. Badanie kinetyki reakcji enzymatycznej
Student 1: Krzywa kalibracji
Do 5 długich probówek wprowadzić podane niżej objętości poszczególnych roztworów,
a następnie każdą probówkę poddać inkubacji przez 5 minut we wrzącej łaźni wodnej.
Po tym czasie zmierzyć wartość absorbancji (A) przy λ = 530nm wobec próby kontrolnej
(nr 0) (pomoc asystenta). Wyniki pomiarów zamieścić w tabeli.
Tabela 1
Nr
probówki
V
wz
[ml]
V
buforu
[ml]
V
NaOH
(10%)
[ml]
V
kw.pikr.
[ml]
A
530
C
glukozy-fruktozy
[g*dm
-3
]
0
0.0
1.0
2.0
2.0
1
0.2
0.8
2.0
2.0
2
0.4
0.6
2.0
2.0
3
0.6
0.4
2.0
2.0
4
0.8
0.2
2.0
2.0
5
1.0
0.0
2.0
2.0
64
Ćwiczenie 4
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
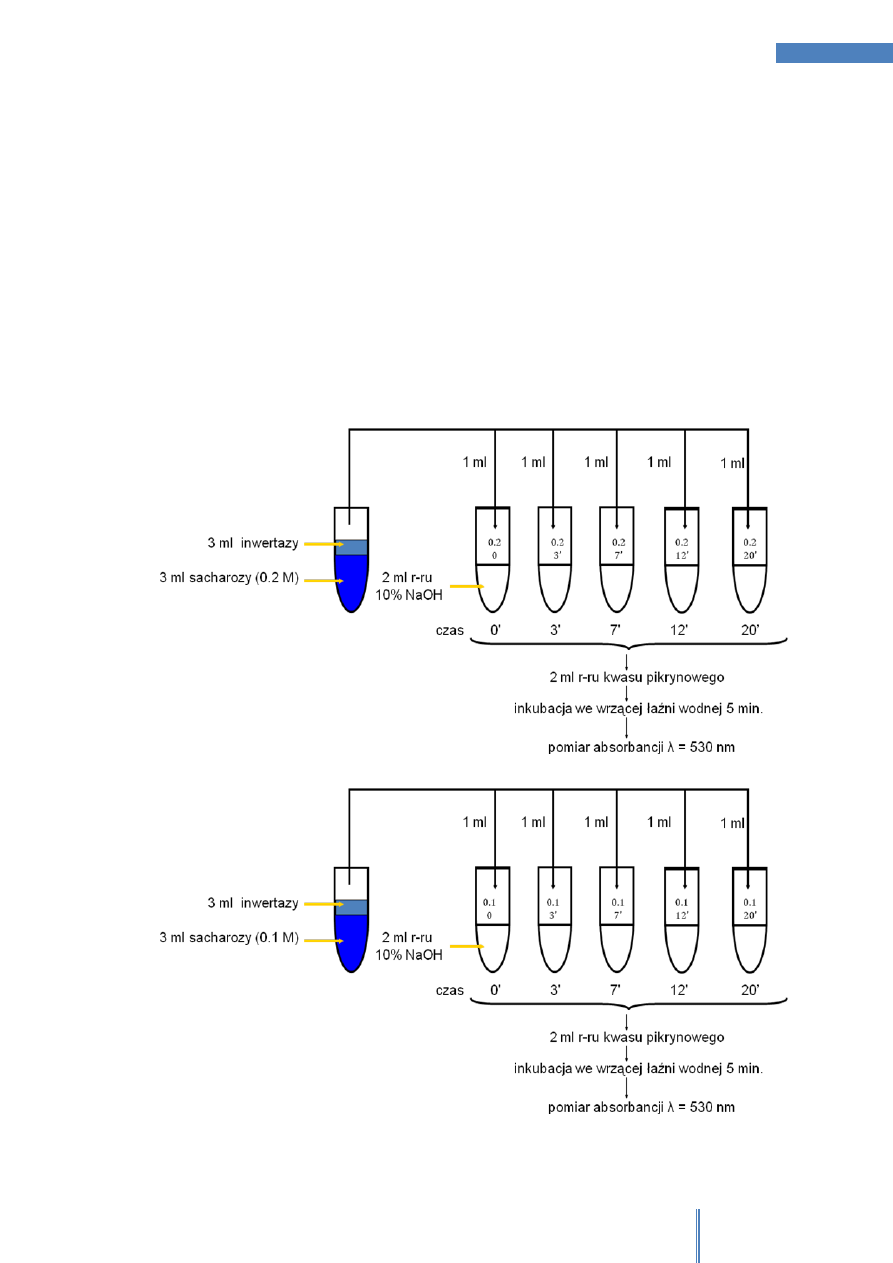
Student 2 i Student 3: Badanie kinetyki reakcji (wykonanie doświadczenia)
Każdy ze studentów wykonuje pomiar dla dwóch stężeń sacharozy (roztwory wcześniej
przygotowane przez Studenta 2)
Do 4 probówek należy odmierzyć po 3ml wcześniej przygotowanych roztworów
sacharozy o różnym stężeniu (przygotowanych wcześniej przez Studenta 2) dodać 3ml
supernatantu zawierającego enzym (przygotowanego przez Studenta 1). Natychmiast
po wymieszaniu pobrać 1 ml roztworu z każdej probówki i dodać do odpowiednio
oznaczonej probówki zawierającej 2ml 10% r-ru NaOH (t = 0) oraz dokładnie
wymieszać. Kolejne próbki należy pobrać po upływie 3, 7, 12 i 20 minut. Następnie do
wszystkich roztworów należy dodać 2ml r-ru kwasu pikrynowego. Wszystkie probówki
poddać inkubacji 5 minut we wrzącej łaźni wodnej.
Rysunek 3
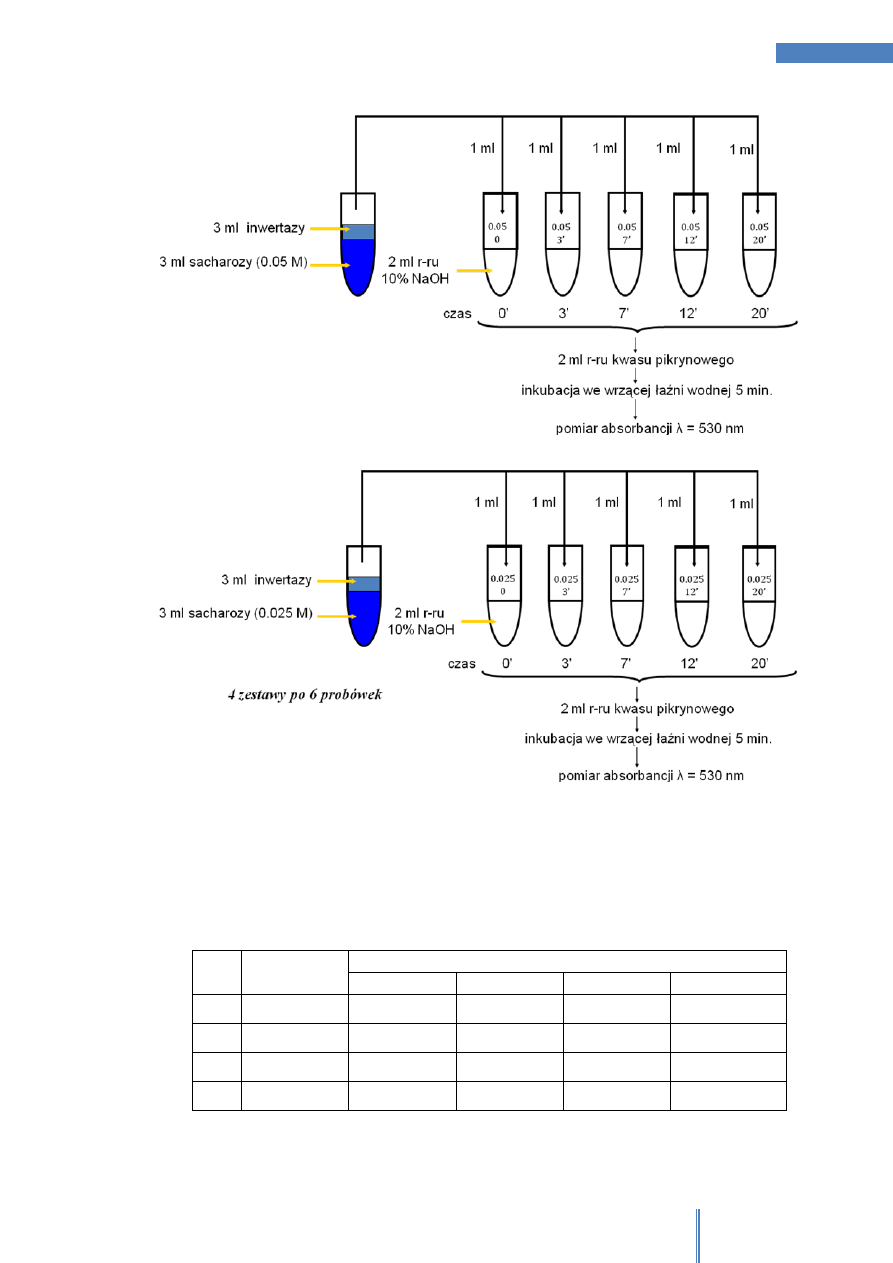
65
Ćwiczenie 4
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Rysunek 3 – cd
Pomiar absorbancji dla poszczególnych próbek wykonuje Student 1 zaraz po tym gdy
cała seria dla danego stężenia jest gotowa.
Dla każdej próby wykonać pomiar absorbancji (A) przy λ = 530nm wobec próby
kontrolnej (t = 0). Wyniki pomiarów zamieścić w poniższej tabeli.
Tabela 2
nr.
r-ru
C
n
[mol*dm
-3
]
Absorbancja (A) po czasie t [min]
3’
7’
12’
20’
1
0.2
2
0.1
3
0.05
4
0.025
66
Ćwiczenie 4
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Po zakończeniu swoich czynności należy dokładnie umyć sprzęt wielokrotnego użytku
umyć wodą z płynem do mycia (zmazać oznaczenia), wodą oraz acetonem i wysuszyć w
suszarce.
4.3.
Wyznaczenie
parametrów
kinetycznych
reakcji
enzymatycznej
(przygotowanie sprawozdania)
Napisanie równań reakcji przeprowadzanych podczas doświadczenia (hydroliza
sacharozy, reakcja glukozyz kwasem pikrynowym: bilans jonowo-elektronowy
reakcji redoks).
Zamieszczenie uzupełnionych tabel 1-3. Z krzywej wzorcowej należy odczytać
stężenie [g*dm
-3
] glukozy-fruktozy odpowiadających poszczególnym wartościom
absorbancji.
Tabela 3
nr.
r-ru
C
n
[mol*dm
-3
]
C
glukozy-fruktozy
[g*dm
-3
]
3’
7’
12’
20’
1
0.2
2
0.1
3
0.05
4
0.025
Sporządzenie wykresów dla każdego ze stężeń: C
glukozy-fruktozy
= f(t) (4 wykresy).
Wyznaczenie v
0
dla każdego ze stężeń (tangens kąta nachylenia stycznej do wykresu
C
glukozy-fruktozy
= f(t) w punkcie t = 0).
v
0
= tg α = x/y = c/t [g*dm
-3
*min
-1
]
Wykreślenie krzywej Michaelisa- Menten (zależność v
0
= f(C
substratu
) ).
Wyznaczenie z wykresu Michaelisa-Menten stałej K
m
(stężenie substratu, przy którym
szybkość reakcji enzymatycznej osiąga połowę wartości szybkości maksymalnej
½*v
max
).
Wykreślanie prostej Lineweavera- Burka (1/v
0
= f(1/C
substratu
) ).
Wyznaczenie
stałej
Miachaelisa
(K
m
)
z
prostej
Lineweavera–Burka
(tg α = K
m
/v
max
; w punkcie przecięcia prostej z osią rzędnych można odczytać wartość
1/ v
max
, natomiast w punkcie przecięcia z osią odciętych wartość –1/K
m
).
Uwaga:
W sprawozdaniu należy umieścić wszystkie wzory wykorzystywane podczas obliczeń,
obliczenia itp.
Wyszukiwarka
Podobne podstrony:
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka reakcji enzymatycznej m poteraj
Kinetyka reakcji enzymatycznych Nieznany
5 Kinetyka reakcji enzymatycznych
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
ENZYMY KINETYKA REAKCJI ENZYMATYCZNYCH
Kinetyka Reakcji Enzymatycznych
Kinetyka reakcji enzymatycznych
I Wyznaczanie parametrow kinetyki reakcji enzymatycznej polarymetr
kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych
rybiak,biologia i ekologia, Kinetyka reakcji enzymatycznych
więcej podobnych podstron