
Energy Conversion and Management 49 (2008) 2440–2446
Jan M. Skowroński, Piotr Krawczyk, Tomasz Rozmanowski, Jan
Urbaniak
Autor: Aneta Radziejewska

Wstęp
Wodór jako materiał paliwowy
Wodór znalazł szerokie zastosowanie w wielu dziedzinach
przemysłu między innymi jako paliwo pojazdów mechanicznych.
Wiąże się z tym problem przechowywania go, dlatego w ostatnich
latach skupiono się na sposobach jego magazynowania.
Dotychczasowe metody magazynowania opierają się na użyciu
wysokiego ciśnienia i zamknięciu gazu w metalowych butlach.
Nowe techniki magazynowania wodoru związane są z procesami
absorpcji fizycznej, chemicznej oraz elektrochemicznej bez udziału
ciśnienia.
2

Wstęp
Elektrochemiczna sorpcja wodoru
Metoda ta pozwala na zaabsorbowanie wodoru w procesach
elektrochemicznych bez użycia wysokiego ciśnienia w elektrodzie
badanej w warunkach otoczenia. Zdolności magazynowania
wodoru uzależnione są od właściwości elektrody badanej –
porowatość, skład chemiczny, właściwości katalityczne w reakcji
sorpcji wodoru. Specjalną grupą materiałów do tego typu
magazynowania są różne formy węgla: węgle aktywne,
nanowłókna węglowe, nanorurki węglowe. W celu zwiększenia
aktywności węgla dodaje się metale przejściowe (Ni, Pt, Pd) i stopy
między metaliczne.
3

Wstęp
Materiał węglowy i jego modyfikacja
W celu wzbogacenia grafitu przeprowadza się proces interkalacji i
eksfoliacji.
Pierwszy
proces
prowadzi
do
wprowadzenia
odpowiedniego interkalatu pomiędzy warstwy grafenowe i
wytworzenie związku interkalacyjnego. Natomiast w drugim
procesie dochodzi do uwolnienia interkalatu całkowicie (EZG) lub
częściowo (EIZG), a struktura grafitu zostaje zmieniona –
pofałdowane płytki o rozdartych krawędziach. Eksfoliacje
przeprowadza się następującymi metodami:
termiczna,
chemiczna,
elektrochemiczna.
4

Cel pracy
Zbadanie elektrochemicznych właściwości elektrod z materiałem:
IZG z NiCl
2
,
EIZG z NiCl
2
,
przed i po potencjostatycznej elektrosorpcji wodoru.
5

Część doświadczalna
Aparatura i substraty:
materiał badany: NiCl
2
– IZG, NiCl
2
– EIZG
kolektor prądowy: Au
elektroda odniesienia: Hg\HgO\6M KOH
elektroda przeciwna: Pt
Warunki prowadzenia procesu:
granice potencjałów : -1,2 V 0,0 V
szybkość skanowania: 10 mV/s
sorpcja wodoru przy potencjale -1,2 V: 12 cykl – 1 h, 18 cykl – 2
h, 22 cykl – 15 h
6
Wyniki i ich omówienie
7
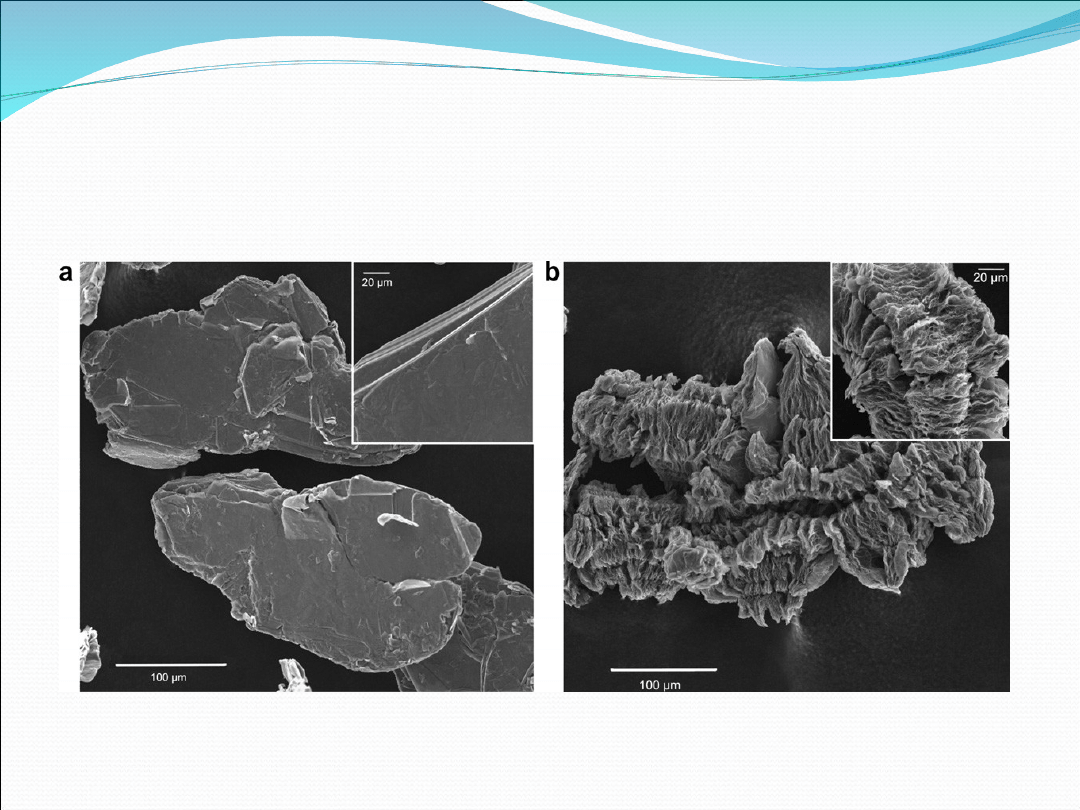
Fig 1. SEM micrographs for NiCl
2
–GIC (a) and NiCl
2
–
EGIC (b).
Wyniki i ich omówienie
8
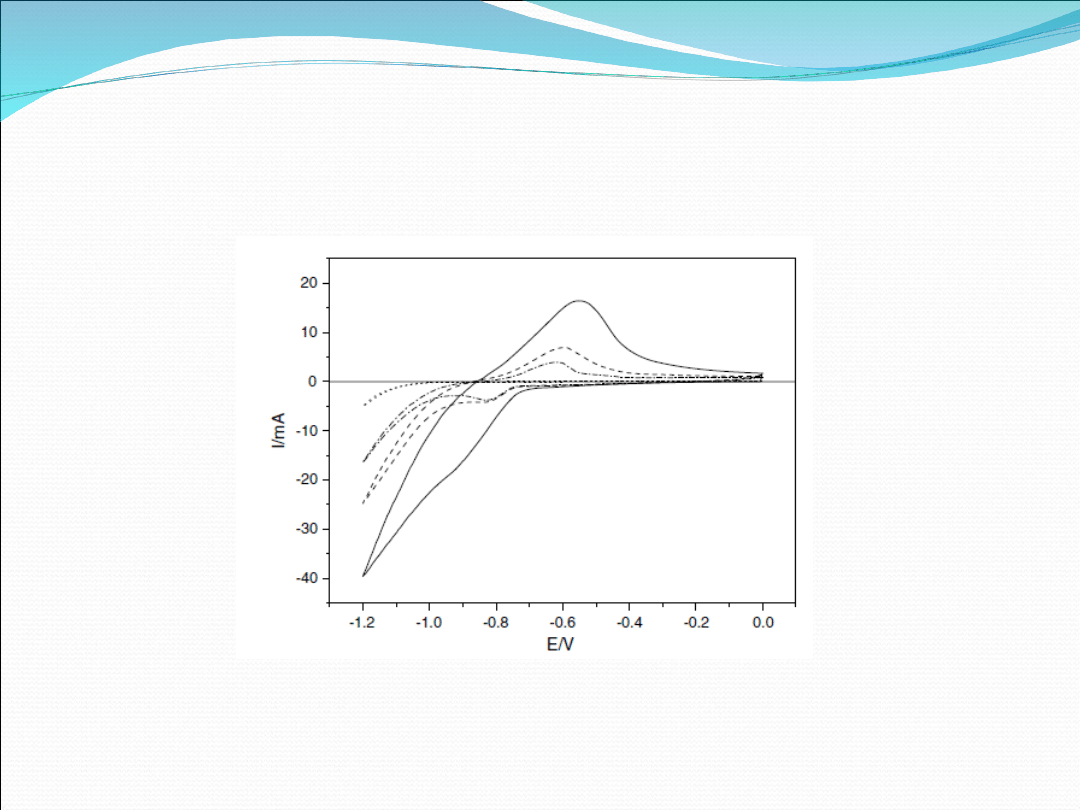
Fig 2. Cyclic voltammograms recorded for NiCl2–GIC in the
potential range of - 1.20.0 V. (—) cycle 1, (- - -) cycle 2,
(- .-) cycle 3, ( … ) Au.
Wyniki i ich omówienie
9
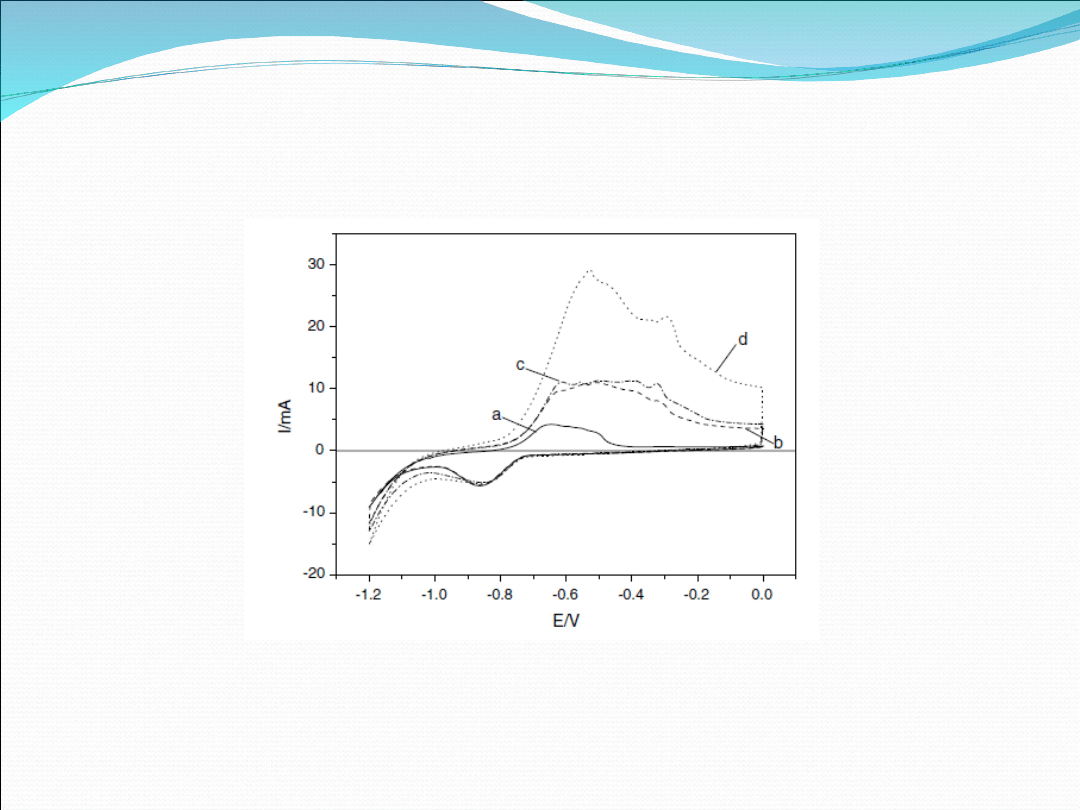
Fig 3. Cyclic voltammograms recorded for NiCl2–GIC in the
potential range of - 1.20.0 V. (—) cycle 11, (- - -) cycle 12
(including potentiostatic saturation of electrodewith hydrogen
for 1 h), (-. -) cycle 18 (2 h), ( … ) cycle 22 (15 h).
Wyniki i ich omówienie
10
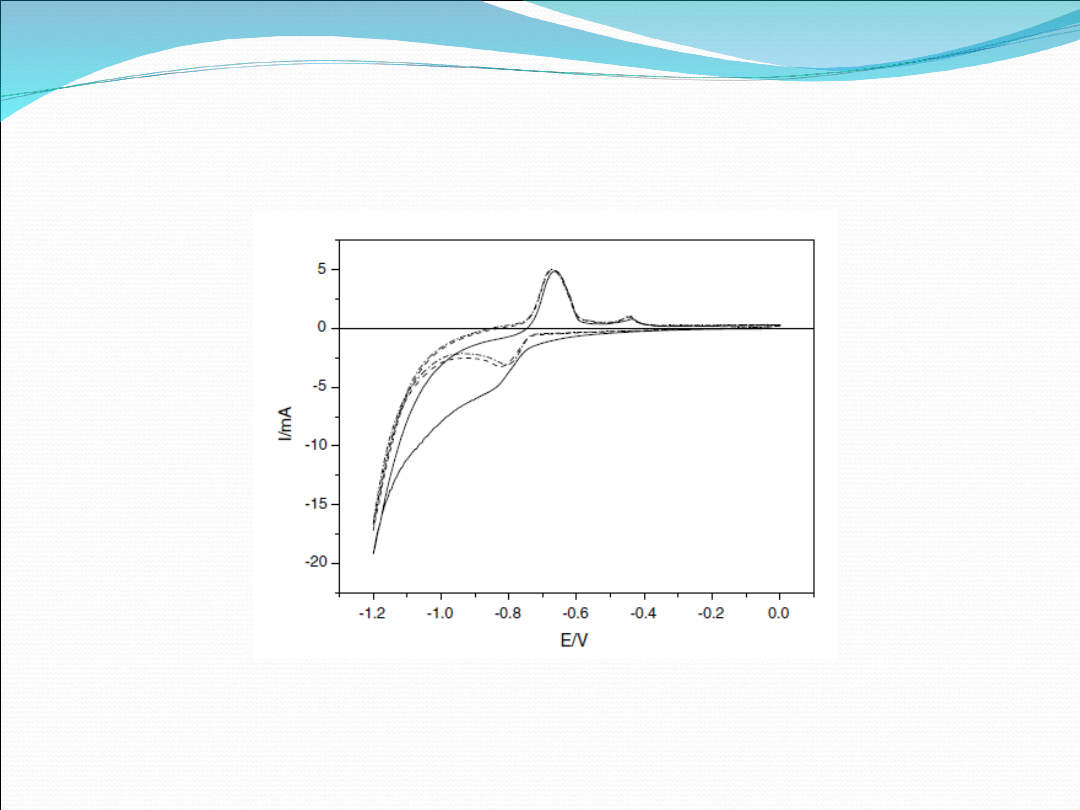
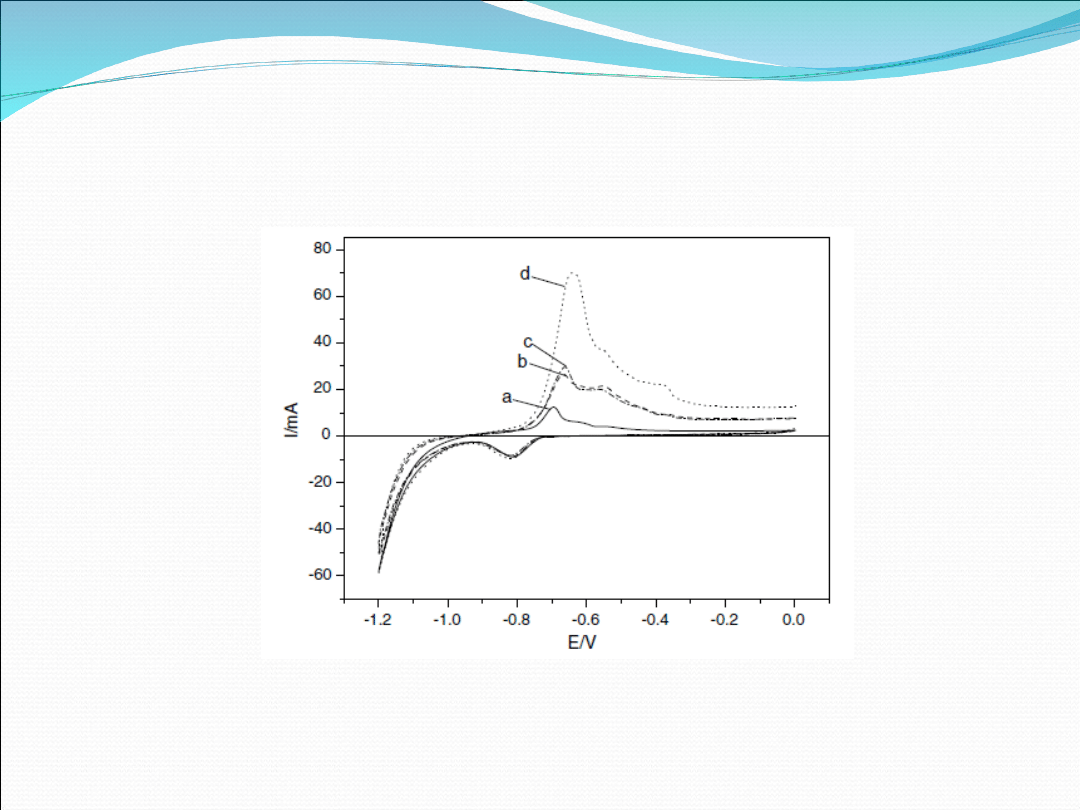
Fig 4. Cyclic voltammograms recorded for NiCl2–EGIC in the
potential range of 1.20.0 V. (—) cycle 1, (- - -) cycle 2, (- .-)
cycle 3.
Wyniki i ich omówienie
11
Fig 5. Cyclic voltammograms recorded for NiCl2–EGIC in the
potential range of 1.20.0 V. (—) cycle 11, (- - -) cycle 12
(including potentiostatic saturation of electrode with hydrogen
for 1 h), (- .-) cycle 18 (2 h), ( … ) cycle 22 (15 h).

Wnioski
12
Zaobserwowane na wykresach katodowy pik przy potencjale ok
-0,8V podczas skanowania w kierunku ujemnych potencjałów i
pik anodowy przy -0,6V podczas skanowania w kierunku
potencjału dodatniego odpowiadają powstaniu metalicznego Ni
i utleniania Ni do Ni(OH)
2
Zatrzymanie skanowania w dolnej granicy przez pewien czas
spowodowało wyraźny wzrost pików anodowych oraz powstanie
serii małych pików pojawiających sie przy bardziej dodatnich
potencjałach
Nadwyżka ładunku mierzonego podczas anodowego skanowania
po potencjostatycznym zatrzymaniu połączona jest z reakcja
utleniania wodoru przechowywanego w elektrodzie zwierającej
elektrochemicznie aktywny nikiel wytworzony w strukturze IZG
podczas reakcji redukcji Ni(OH)
2

Wnioski
13
Magazynowanie wodoru w dużej mierze zależy od rodzaju
elektrody, zdolności magazynowania wodoru okazały sie wyższe
dla NiCl
2
-EIZG
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
The electrochemical and mechanical behavior of passivated an
16 197 208 Material Behaviour of Powder Metall Tool Steels in Tensile
36 495 507 Unit Cell Models for Thermomechanical Behaviour of Tool Steels
43 597 609 Comparison of Thermal Fatique Behaviour of Plasma Nitriding
50 707 719 Thermal Fatique and Softening Behaviour of Hot Work Steels
44 611 624 Behaviour of Two New Steels Regarding Dimensional Changes
DYNAMIC BEHAVIOUR OF THE SOUTH Nieznany
49 687 706 Tempering Effect on Cyclic Behaviour of a Martensitic Tool Steel
Ecology and behaviour of the tarantulas
Fatigue Behavior of Polymers
67 961 977 Investigating Tribochemical Behaviour of Nitrided Die Casting Die Surfaces
US Patent 382,281 Electrical Transmission Of Power
Determination of trace levels of taste and odor compounds in
Behaviour of precast concrete floor slabs exposed to standar
[Elsevier] Corrosion Behaviuor Of Stressed Magnesium Alloys
11 Fatigue behaviour of misaligned butt welded joints in the bottom flange
Internet behaviors of active publics
US Patent 382,280 Electrical Transmission Of Power
więcej podobnych podstron