


Elektrolizę stosuje się głównie do otrzymywania metali w bardzo
czystej postaci, oraz stopów różnych metali. W zależności od tego
czy naszym celem jest tylko wyodrębnienie metalu z roztworu,czy
też równoczesne jego oczyszczenie, mówimy o elektroekstrakcji
bądź też o elektrorafinacji. Elektroliza wykorzystywana jest też do
otrzymywania powłok galwanicznych
Elektroliza jest procesem stosowanym na skalę przemysłową
m.in. do:
produkcji metali:
,
,
,
produkcji rozmaitych związków chemicznych, w tym
,
kwasu trifluorooctowego, wodorotlenku sodu, potasu, chloranu
sodu i chloranu potasu
produkcji gazów: wodoru, chloru i tlenu
.
galwanizacji - pokrywanie cienką warstwą metalu innego
metalu

• W metodzie elektrolitycznej reduktorem
(dostarczycielem elektronów) jest prąd
elektryczny. Następuje rozkład wodnych
roztworów związków metali lub ich soli pod
wpływem prądu stałego następnie
następuje ukierunkowany ruch jonów
metalu i ich redukcja na katodzie zgodnie z
zależnością :
Me n+ + ne → Me


mrz –masa wydzielonego osadu na katodzie, zależna od: natężenia
prądu i czasu trwania elektrolizy, koncentracji jonów w elektrolicie,
temperatury, lepkości i przewodności elektrolitu, intensywności
mieszania elektrolitu, odległości między elektrodami,
mt – masa teoretyczna produktu wydzielonego w czasie elektrolizy z
II prawa Faradaya,
k – równoważnik
elektrochemiczny wydzielanego metalu,
I – natężenie prądu elektrolizy,
t – czas trwania elektrolizy
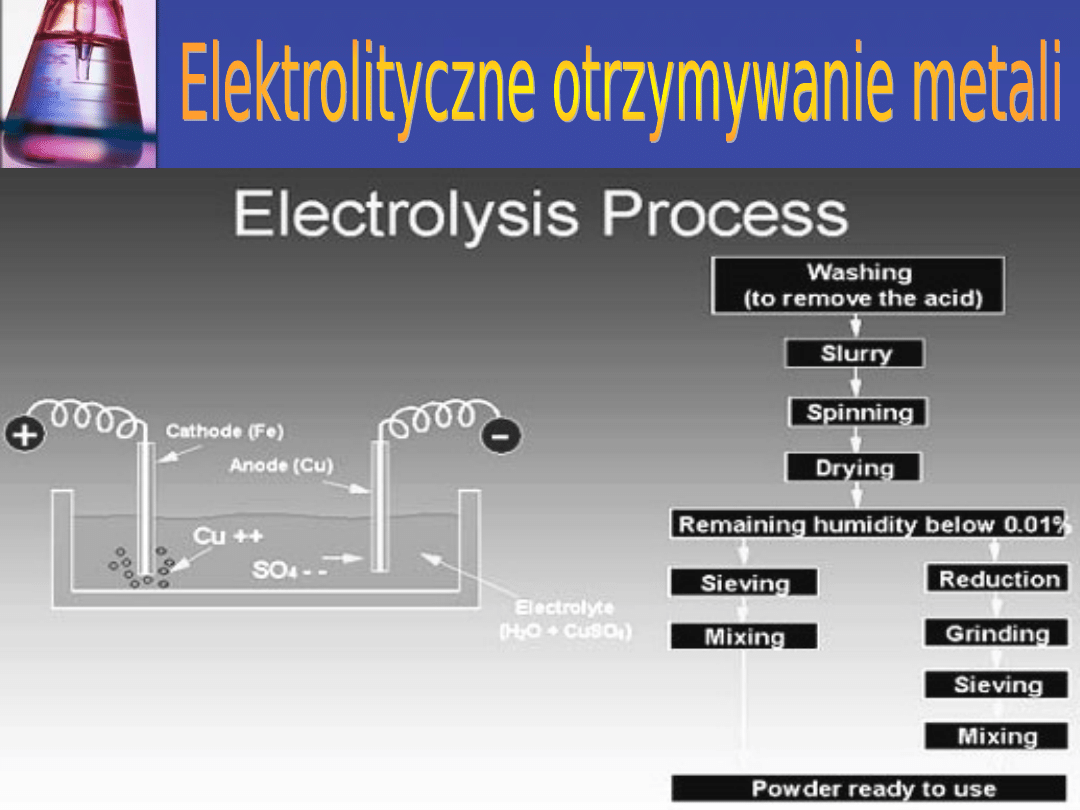

Wytwarzanie Cu
• elektrolit – CuSO4 × 5H2O + H2SO4;
• koncentracja miedzi w elektrolicie – od 10g/l do 12 g/l;
• koncentracja H2SO4 – od 130 g/l do 150 g/l;
• katodowa gęstość prądu – od 35 A/dm2 do 45 A/dm2
• napięcie – od 1,5 V do 2 V;
• temperatura elektrolitu – od 35°C do 40°C;
• anoda: miedziana (rozpuszczalna) lub 99% Pb+1% Ag
(nierozpuszczalna);
• sprawność – 80%;
Powstający osad na katodzie strąca się do wanien, a po
wybraniu z dna wanny poddaje się go płukaniu w wodzie z
amoniakiem, suszy w suszarkach próżniowych i redukuje
wodorem. W rezultacie uzyskuje się proszek o kształcie
dendrytycznym i wielkości poniżej 45 μm i zawartości Cu powyżej
99,9%.

Uzyskane w procesie
elektrolizy proszki
metali
charakteryzują się
bardzo dobrą
formowalnością i
aktywnie się
spiekają. Na rysunku
zamieszczono
cząstki proszku
miedzi
wytworzonego w
procesie elektrolizy.

W roztworach wodnych nie następuje
rozładowanie metali lekkich do glinu
włącznie. Metale te otrzymuje się więc z
roztworów stopionych. Wyjątkiem jest
otrzymywanie sodu z roztworu NaCl na
elektrodzie Hg jako katodzie (anodą jest
pręt grafitowy). Wydzielający się Na
rozpuszcza się w rtęci tworząc
amalgamat, który jest
przepompowywany do innego pojemnika.

Sód otrzymuje się też przez elektrolizę
stopionego NaCl na elektrodach grafitowych.
Na katodzie wydziela się sód - na anodzie chlor.
Produkty reakcji katodowej i anodowej należy
oddzielać, ponieważ gwałtownie reagują ze sobą.

Powłoki niklowe sa powszechnie stosowane jako pokrycia dekoracyjno-ochronne na
stali. Cechuje je dobra przyczepność do podłoża, duży połysk, estetyczny wygląd oraz
dobra odporność korozyjna w warunkach atmosferycznych. Osadza się je z kąpieli
kwaśnych zawierających siarczan i chlorek niklu oraz dodatki buforujące,
wybłyszczające i zwilżające. Podczas osadzania niklu wydziela się wodór.
Typowe warunki nakładania powłok niklowych:
Skład kąpieli
NiSO4 250 g dm-3
NiCl2 45 g dm-3
H3BO3 30 g dm-3
Dodatki polepszające jakość powłoki: sacharyna, kwas paratoluenosulfonowy itp.
pH 4-5
Parametry procesu:
Temperatura 40-70 oC
Gestosc pradu 200-500 A m-2
Wydajnosc pradowa 95%
Anoda wykonana z niklu technicznego, ca. 95% Ni.

Warunki współosadzania
metali
Warunkiem osadzenia stopu galwanicznego
jest prowadzenie procesu dla potencjału
katody Ek
Ek = E01 + η1 = E02 + η2 = = E0n + ηk
Gdzie: E01,E02,E0n - potencjały równowagowe
dla metali Me1,Me2,Men ; η1,η2,ηn -
nadnapięcia osadzania metali Me1,Me2,Men.

Podstawowym warunkiem współosadzania
stopów galwanicznych o określonym składzie
jest przebieg w stanie ustalonym wszystkich
cząstkowych procesów elektrokrystalizacji.
Przy potencjale katody wg powyższego
równania musi być zachowana stałość
cząstkowych gęstości prądu, przy której
osadza się metal Me1 oraz stałość stężeń
bezpośrednio przy powierzchni katody jonów
wszystkich osadzanych metali.
Warunki współosadzania
metali

W praktyce spełnienie tych warunków
uzyskuje się przez:
• zbliżenie potencjałów równowagowych np. w
wyniku kompleksowania jednego ze
składników,
• odpowiednie zróżnicowanie nadnapięcia
osadzania poszczególnych składników zwykle
przez zwiększenie nadnapięcia bardziej
elektrododatniego metalu w wyniku
kompleksowania, inhibitowania jednego z
etapów wydzielania, zwiększenia katodowej
gęstości prądu lub też osadzanie w zakresie
prądu granicznego.

Elektrolityczne otrzymywania stopu srebro-cynk w
Sposób polega na elektrolitycznym wydzielaniu proszków stopów
metali srebra i cynku z roztworów soli kompleksowych tych metali,
najkorzystniej z cyjanków sodowo-srebrowego i sodowo-cynkowego
w roztworach wodnych. Najkorzystniej poddawać elektrolizie
mieszaniny zawierające cyjanek sodowo-srebrowy Na/Ag/Cn/2 w
ilości 0,05 do 0,25 mola, cyjanek sodowo-cynkowy Na2/Zn/CN/4 w
ilości do 1 mola, cynkan sodu Na2Zn02 w ilości do 0,5 mola,
cyjanek sodu NaCN w ilości do 2 moli i wodorotlenek sodu NaOH w
ilości do 2,5 moli.

Całość mieszaniny dopełnia się wodą do 1 litra. Elektrolizę
prowadzi się w naczyniu wykonanym z materiału, który nie reaguje
z substratami reakcji i otrzymywanymi w jej wyniku produktami,
najkorzystniej w naczyniu polietylenowym. Przestrzeń katodową
od anodowej oddziela się przegrodą półprzepuszczalną
najkorzystniej z materiałów ceramicznych. Katodę stosuje się
wykonaną w kształcie walca, kuli lub prostopadłościanu ze srebra
lub cynku a anodę z prętów grafitowych. Elektrolizę najkorzystniej
prowadzi się w temperaturze 20—70°C prądem stałym o gęstości
od 5 do 100A/dcm2. W wyniku prowadzonego procesu otrzymuje
się proszek metaliczny na katodzie o składzie od 20 do 80%
wagowych cynku, a resztę do 100% stanowi srebro.

1. J. Socha, J. Weber, „Podstawy Elektrolitycznego Osadzania Stopów
Metali”, wyd.
Instytut Mechaniki Precyzyjnej, Warszawa 2001
2. H. Sholl, T. Błaszczyk, P Błaszczyk „Elektrochemia: zarys teorii i
praktyki” wyd. Uniwersytetu Łódzkiego 1998
3. F. Łetowski " Podstawy Hydrometalurgii" WNT, Warszawa 1975

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
Zastosowanie elektrycznych mierników wskazówkowych sprawko 1
Zastosowanie elektrycznych mierników wskazówkowych Rev
Zastosowanie elektrycznych mierników wskazówkowych, sprawozdanie z mierników, 27
Praktyczne zastosowanie elektrostymulacji LESS w leczeniu niskostopniowej skoliozy idiopatycznej
zastosowanie elektrycznych mierników analogowych123
14 Miedz i aluminium w zastosowaniach elektrotechnicznych
Zastosowanie elektrycznych mierników wskazówkowych moje
jerzyk,eksploatacja odkrywkowa, Zastosowanie elektrohydraulicznego sposobu kruszenia skał
zastosowanie elektrycznych mierników analogowych
Zastosowanie elektrycznych mierników wskazówkowych Rev
Zastosowanie elektrycznych mierników wskazówkowych
Zastosowanie elektrycznych mierników wskazówkowych
zastosowanie elektrolizy
Zastosowanie elektrycznych mierników wskazówkowych sprawko 1
Zastosowanie elektrycznych mierników wskazówkowych moje
06 Zastosowanie elektrotechniki i elektroniki
więcej podobnych podstron