
Pierwiastki budujące białka:
COHN S

Wiadomości ogólne
Białka odkrył w 1839r MULDER, nazwa pochodzi od
greckiego słowa PROTOS = pierwszy element.
Funkcje białek:
są głównym składnikiem budulcowym organizmu,
stanowią ok. 15 - 20% masy człowieka, w tym głównie
układu mięśniowego
Są składnikiem enzymów, hormonów, receptorów,
neurotransmiterów oraz ciał odpornościowych
biorą udział w odtruwaniu organizmu
mogą być także substratem energetycznym.

Wiadomości ogólne
Z uwagi na znaczenie białka ważne jest aby spożywane
białko było odpowiedniej jakości i służyło do budowy
organizmu, a nie jako źródło energii.
W stanach niedostatecznego pokrycia zapotrzebowania
na energię przez tłuszcze i węglowodany lub
nadmiernego spożycia białka wykorzystywane jest ono
jako źródło energii, dostarczając
4 kcal/g (17kJ/g)
.
Organizm człowieka nie ma możliwości magazynowania
większych ilości białka. Utrata ponad 14% białka
prowadzi do schorzeń.

Biologiczna funkcja
białek
Katalityczna (enzymy),
Strukturalna (składnik skóry, ścięgien),
Ochronna ( przeciwciała),
Hormonalna (insulina, glukagon),
Motoryczna (białka kurczliwe mięśni),
Transportowa (hemoglobina, globuliny
osocza),
Regulatorowa (odpowiedzialne za odczyt
informacji genetycznej – histony)

Budowa białek
Białka to wielkocząsteczkowe polimery, których monomerami
są aminokwasy, związki amfoteryczne zawierające grupę
aminową –NH
2
i karboksylową –COOH.
Zdolność aminokwasów do tworzenia białek wynika z
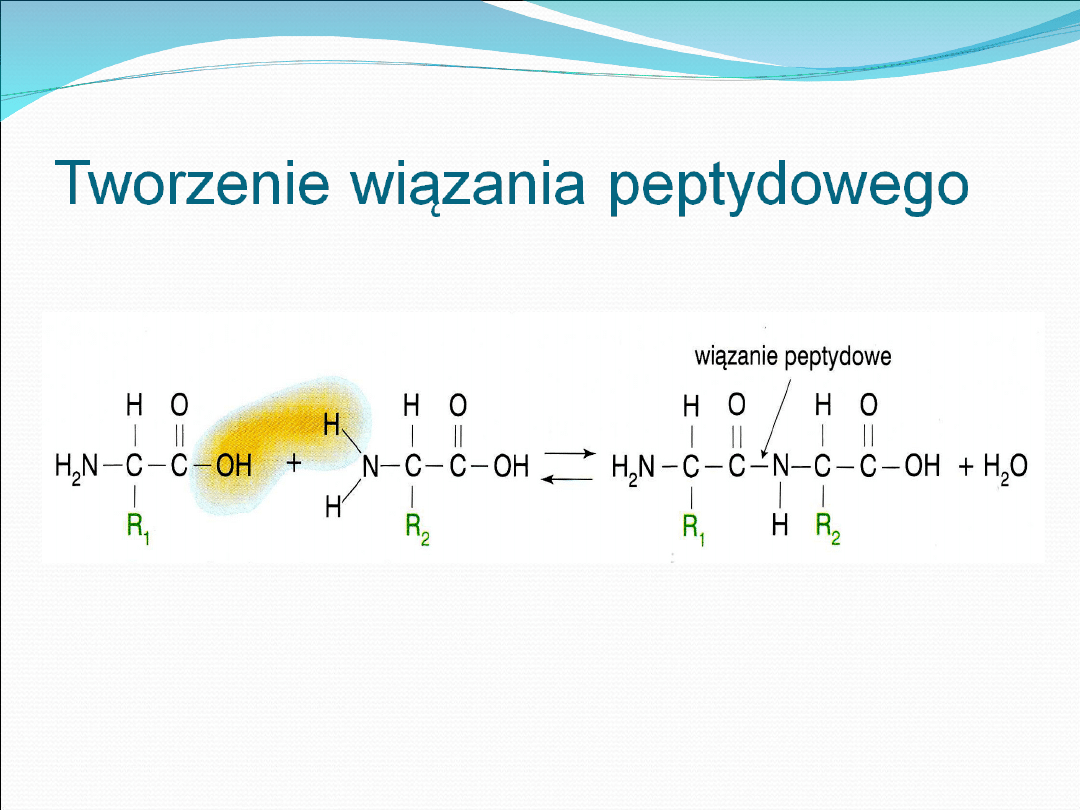
równoczesnego posiadania obu grup, gdyż grupa aminowa
jednego aminokwasu może łączyć się z grupą karboksylową
innego, tworząc tzw. wiązanie peptydowe.
Poszczególne białka różnią się liczbą i rodzajem aminokwasów
oraz kolejnością ich ułożenia. Stąd ogromna różnorodność
białek w przyrodzie, każdy organizm posiada białka swoiste
dla siebie (trudności w transplantacji).

Ogólny schemat budowy
aminokwasu
H
R C NH
2
COOH

Podział aminokwasów ze względu na budowę
chemiczną
grupa
aminokwasy
obojętne
Alanina, glicyna, walina leucyna,
izoleucyna, fenyloalanina, prolina
Z polarnym łańcuchem bocznym
z aktywnymi chemicznie grupami
( SH, OH)
Tyrozyna, tryptofan, seryna,
treonina, cysteina, metionina
Kwaśne
(dodatkowa grupa karboksylowa)
Kwas asparaginowy i
glutaminowy
Zasadowe
(dodatkowa grupa aminowa)
Lizyna, arginina, histydyna

Podział aminokwasów ze względu
na to czy:
Organizm potrafi je syntetyzować – endogenne,
Funkcje aminokwasów endogennych: budowa
białek, witamin, hormonów.
Organizm nie potrafi ich syntetyzować i muszą
być dostarczane z pożywieniem – egzogenne
np.: treonina, metionina, lizyna leucyna,
izoleucyna, walina, fenyloalanina, tryptofan.
Aminokwasy egzogenne wykorzystywane są
jedynie do syntezy białek

Aminokwasy właściwości
Aminokwasy poprawiają bilans azotowy
dzięki swym właściwościom anabolicznym
(nasilają syntezę białek ustrojowych)
i antykatabolicznym (hamują katabolizm
wysiłkowy, czyli degradację białek przez
enzymy lizosomalne)

Białka – klasyfikacja ze względu na ilość reszt
aminokwasowych
Do 10 reszt aminokwasowych - oligopeptydy
Do 100 reszt aminokwasowych - polipeptydy
Od 100 reszt aminokwasowych – białka
Przykłady
Oligopeptydy: oksytocyna, wazopresyna,
amanityna
Polipeptydy: antybiotyki, insulina, endorfina,
neurotoksyny (jad pszczeli, węży).

Budowa białek
Łańcuchy białkowe wykazują uporządkowanie określane
mianem struktur białkowych.
Wyróżnia się cztery struktury rzędowe białek:
I-rzędowa s. – kodowana genetycznie, decyduje o
swoistości białka i determinuje wszystkie pozostałe
struktury (wtórne)
II-rzędowa
s.
–
sposób
skręcenia
łańcucha
aminokwasów, wyróżnia się tu strukturę spirali (α) oraz
strukturę dywanową (β)
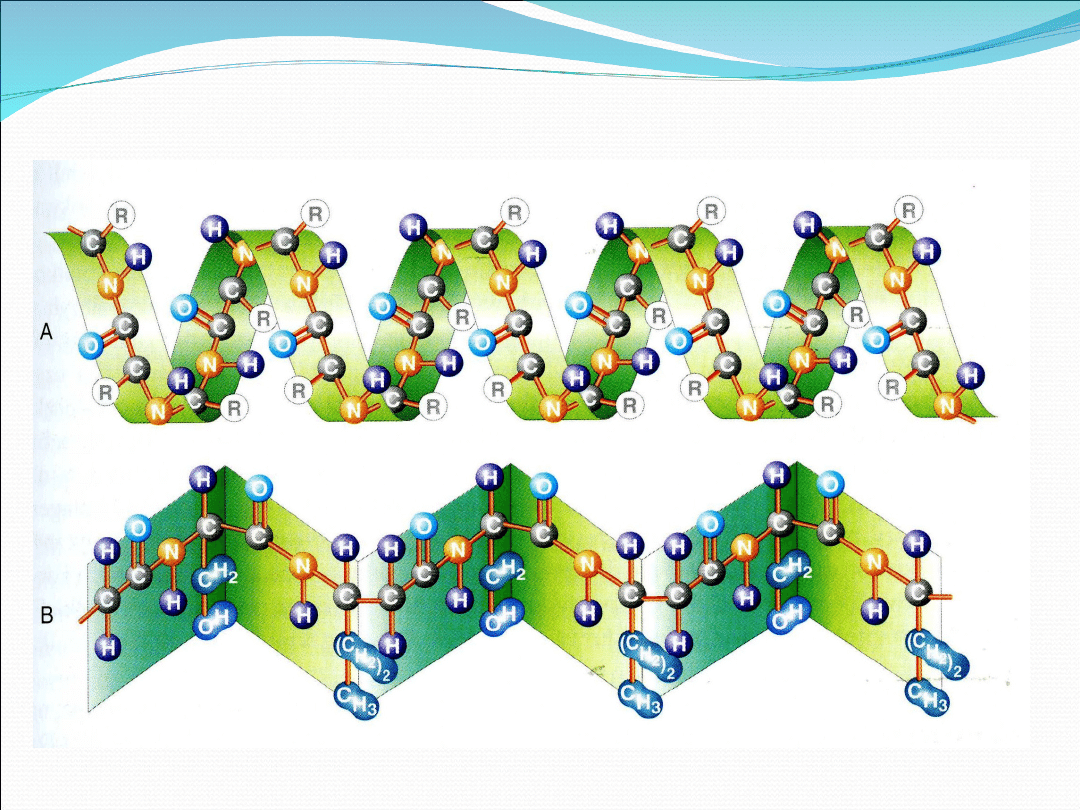
II-rzędowa struktura białka: A – spirala, B - dywanowa

Budowa białek
Struktura III rzędowa. Dotyczy przestrzennego ułożenia
łancucha białkowego i odzwierciedla wzajemne usytuowanie
aminokwasów położonych daleko od siebie
(ulega zniszczeniu
pod wpływem m.in. temperatury, soli metali ciężkich,
formaliny, alkoholi), jej zniszczenie to tzw. DENATURACJA
białka
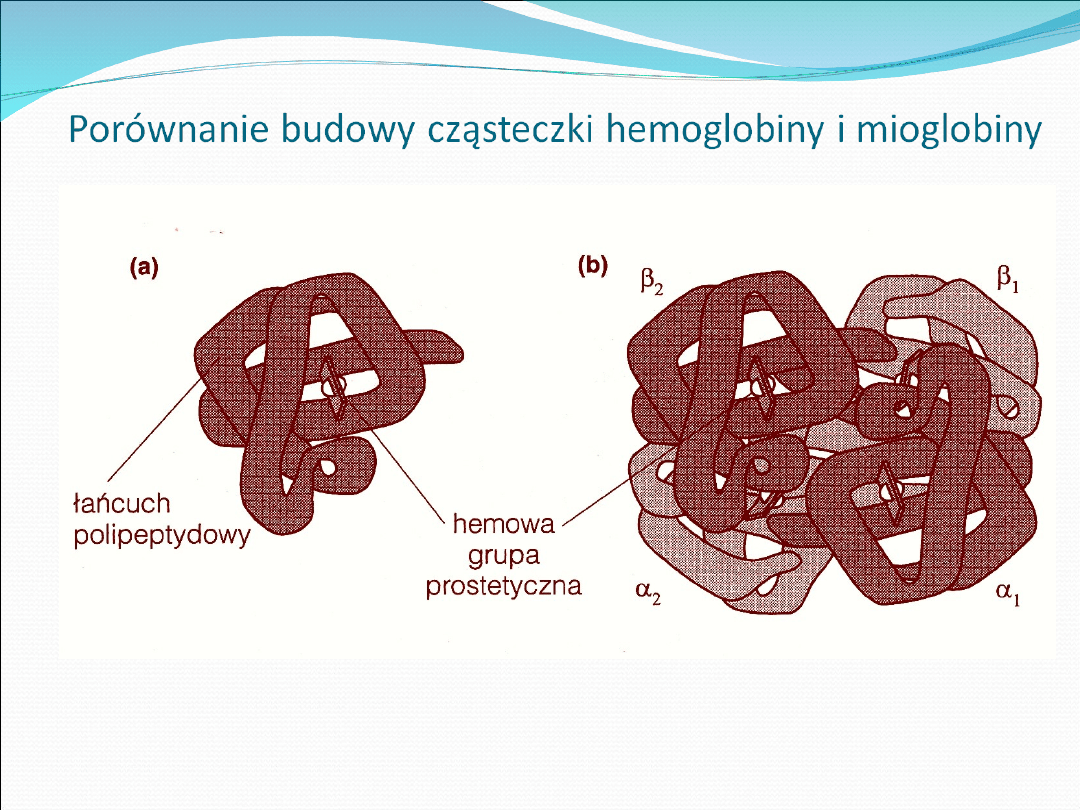
Struktura IV rzędowa. Jest charakterystyczna dla białek
zbudowanych z podjednostek (2,3,4 i więcej) Białko takie
zachowuje swoje właściwości gdy jednostki są połączone ze
sobą
(np. hemoglobiny), powstaje na skutek połączenia
struktur trzeciorzędowych.

Rodzaje białek
Proste
Fibrylarne ( nie
rozpuszczalne w wodzie i
słabych roztworach soli)
-
Keratyna
-
Kolagen
-
Elastyna
Globularne (dobrze
rozpuszczalne w wodzie i
słabych roztworach soli
kwasów i zasad
-
albuminy, globuliny
Złożone
-
Fosfoproteidy (żółtko jaja-
fosfityna)
-
Glikoproteidy
(przeciwciała
-
Chromoproteidy
(mioglobina,
hemoglobina)
-
Nukleioproteidy (histony)
-
Lipoproteiny (białka błony
komórkowej)
-
Metaloproteiny
(dehydrogenaza)

Hemoglobina i
mioglobina
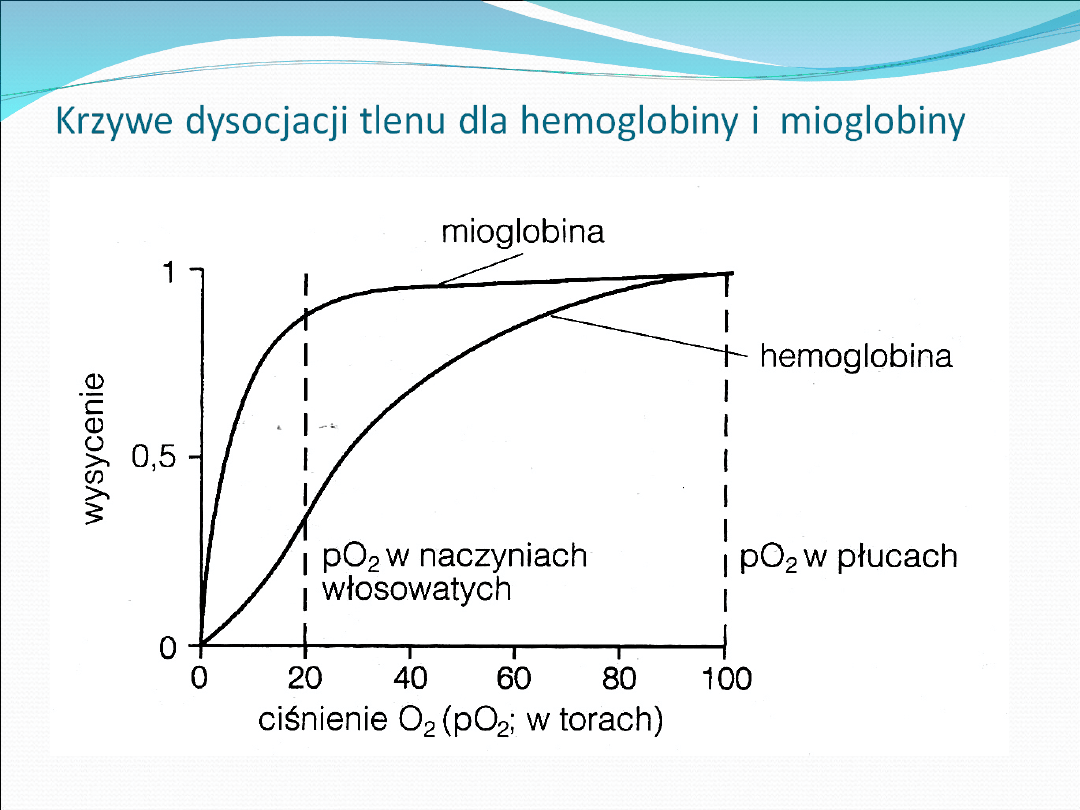
To białka wiążące tlen
Hemoglobina transportuje tlen z pęcherzyków
płucnych do tkanek, występuje w czerwonych
krwinkach , - erytrocytach
Mioglobina wiąże tlen w komórkach
mięśniowych (szkieletowych i serca)

Hemoglobina i mioglobina są
przykładami IV rzędowej struktury
białka
Hemoglobina
Zbudowana z Hemu (grupy prostetycznej) i
globiny (białka)
Główny składnik czerwonych krwinek
(erytrocytów), 94% masy ciała.
Hem: nadaje kolor czerwony, łączy się z każdą
z czterech podjednostek globiny trwałym
połączeniem, wytwarzany w wątrobie i
układzie erytrocytotwórczym,
Rola – wiązanie czterech atomów tlenu

Budowa cząsteczki
hemoglobiny

19
Różne postaci hemoglobiny
hemoglobina (Hb) – zdolna do wiązania tlenu
oksyhemoglobina (Hb
4
O
2
) – Hb utlenowana
methemoglobina – powstaje, gdy pod wpływem
związków utleniających Fe
2+
zostanie
zamieniony na Fe
3+
. Nie ma zdolności wiązania
O
2
karboksyhemoglobina – gdy miejsce O
2
zajmie
CO
karbaminohemoglobina (HbCO
2
) – gdy miejsce
O
2
zajmie CO
2

Czynniki wpływające na stężenie
hemoglobiny we krwi
Zawartość żelaza w diecie,
Anemia sportowa
Odwodnienie organizmu
Zmniejszona zawartość O
2
w powietrzu
wdychanym (hipoksja)
Doping erytropoetyną lub krwią

Mioglobina
Pierwsze białko którego strukturę
przestrzenną poznano dzięki wykorzystaniu
rentgenografii.
Białko globularne (153 aminokwasy) fałdujące
się w 8
α helis
Grupa prostetyczna w postaci hemu
umiejscowiona w hydrofobowym zagłębieniu
Rola – magazynowanie tlenu w mięśniach i
przenoszenie tlenu w samej komórce.

Kolagen
Kolagen to nazwa nadana całej rodzinie
strukturalnie podobnych białek, które tworzą
mocne nierozpuszczalne włókna.
Kolageny składają się z trzech łańcuchów
polipeptydowych , których charakter i
rozmieszczenie różnią się w zależności od typu
kolagenu.
Kolagen jest białkiem bardzo powszechnie
występującym i służy do łączenia komórek w
odrębne grupy.

Typy i miejsca występowanie kolagenu
typ
rozmieszczenie
I
Skóra , kości ścięgna, rogówka, naczynia krwionośne
II
Chrząstka, krążki międzykręgowe
III
Skóra płodu, naczynia krwionośne
IV
Błona podstawna
V
Łożysko, skóra

Białka osocza
Albuminy
Globuliny
Fibrynogen
Stężenie białek osocza zależy od:
Stanu odżywienia organizmu
Czynności wątroby
Nawodnienia organizmu

Trawienie białek
Białka znajdują się w pokarmach pochodzenia roślinnego i
zwierzęcego i są niezbędnym źródłem aminokwasów do
budowy nowych tkanek i odnowy starych.
Białko z pożywienia jest rozkładane (trawione) na 20
różnych aminokwasów, które wchłaniane do krwi
docierają do wątroby, gdzie są metabolizowane.
Trawienie białek jest procesem skomplikowanym z racji
dużych rozmiarów cząsteczek i złożoności budowy
chemicznej tych związków. Wiązania peptydowe są
rozszczepiane
wewnątrzkomórkowo
i
zewnątrzkomórkowo przez enzymy proteolityczne.

Trawienie białek
Trawienie białek odbywa się w żołądku i dwunastnicy.
W silnie kwaśnym środowisku żołądka działa pepsyna, natomiast
w lekko zasadowym środowisku dwunastnicy działają enzymy
trzustki trypsyna i chymotrypsyna oraz liczne enzymy soku
jelitowego (amino- i karboksypeptydazy).
Enzymy trawiące białka uwalniane są w postaci nieczynnych
proenzymów, uaktywnianych dopiero w świetle jelita.
Schemat trawienia białek:
białka – peptydy – oligopeptydy – trójpeptydy – dwupeptydy –
aminokwasy

Trawienie białek
Prawidłowy przebieg procesów trawienia białek zależy
od właściwej podaży energii i białka.
Wykorzystanie białka do resyntezy i budowy białek
organizmu zależy od:
jego ilości (N x współczynnik)
strawności
jakości
(zawartość
i
wzajemne
proporcje
aminokwasów).

Strawność białek
Strawność białka to ilość azotu wchłoniętego w stosunku do
azotu spożytego wyrażona w %.
D = N wchłonięty/N spożyty x 100%
Strawność b. zwierzęcych = 90%, zaś b. roślinnych = 60-70%.
Ograniczenia strawności białek:
- konformacja
- wielkość i właściwości powierzchniowe
- interakcje z jonami metali czy tłuszczami
- obecność czynników anty żywieniowych
- brak lub zbyt wysoka obróbka termiczna
- biologiczna zmienność budowy białek.

Jakość białek
Białko
zawierające
aminokwasy
egzogenne
w
proporcjach niezbędnych dla organizmu ludzkiego
nazywane jest
pełnowartościowym
. Brak lub niedobór
któregokolwiek z tych aminokwasów klasyfikuje białko
jako
niepełnowartościowe
.
Tylko pokarmy pochodzenia zwierzęcego zawierają
białka
pełnowartościowe.
Największą
wartość
biologiczną mają białka jaj i mleka.
Największą
wartość
biologiczną
spośród
białek
roślinnych wykazują białka soi.

Źródła białka
Białka z uwagi na ich pochodzenie dzielimy na zwierzęce i
roślinne.
Białko zwierzęce zawarte w mięsie, drobiu, rybach, jajach,
mleku, serach, jogurtach jest źródłem pełnowartościowego
białka.
Natomiast białko roślinne, znajdujące się w warzywach i
owocach, roślinach strączkowych, orzechach, nasionach,
ziarnach zbóż jest źródłem białka niepełnowartościowego.
Różnorodna
dieta,
zawierająca
produkty
pochodzenia
zwierzęcego i roślinnego zapewnia właściwą ilość białka.

Źródła białka
Produkty zbożowe – dość duża (10 – 15%) zawartość białka o
niepełnej zawartości biologicznej (niedobór Lys i Trp);
produkty te dostarczają Polakom około 30% białka
roślinnego.
Nasiona roślin strączkowych (fasola, groch, soja) – zawierają
bardzo cenne białko roślinne, które swym składem zbliża
się do białek zwierzęcych.
Mleko i przetwory mleczne – źródło pełnowartościowego
białka (wzorcowy skład aminokwasów egzogennych).
Mięso, wędliny, drób, ryby, jaja – źródło pełnowartościowego
białka (15 – 20%).

Zalecane spożycie białka
Dla
zapewnienia
właściwego
funkcjonowania
organizmu, prawidłowego wzrostu i odbudowy
komórek, białko powinno stanowić
10 – 15%
dziennej
energii, co odpowiada około 0,75g na 1 kg masy ciała
dziennie.
W celu zapewnienia odpowiedniego poziomu spożycia
białka należy przyjmować 2-3 porcje pożywienia
zawierającego pełnowartościowe białko zwierzęce lub
4 porcje pożywienia zawierającego białko roślinne
pochodzące z różnych produktów.

Niedostateczne spożycie
białka
Istnieją dwa rodzaje niedoborów białkowych:
typu MARASMUS – łagodne, objawiające się spadkiem
masy ciała, spadkiem siły mięśni, anemią, spadkiem
odporności,
upośledzeniem
funkcji
układu
oddechowego, krążenia i wchłaniania
typu KWASHIORKOR – pogłębione, objawiające się
nasilonym katabolizmem, spadkiem masy ciała, siły
mięśni, stężenia albumin.

Nadmierne spożycie
białka
Wiąże się zazwyczaj z nadmierną konsumpcją mięsa, wędlin i
serów zawierających wysoki odsetek tłuszczu. Dieta
wysokobiałkowa staje się wówczas dietą wysokotłuszczową,
co może prowadzić do rozwoju otyłości i dyslipidemii z ich
konsekwencjami (tj. rozwojem miażdżycy oraz nadciśnienia
tętniczego).
U
niemowląt
objawia
się
występowaniem
biegunek,
odwodnienia, kwasicy i gorączki.
U dorosłych
nieprawidłowo funkcjonują
nerki i wątroba. Ponadto przy
niedoborach witaminy B6 przy diecie wysokobiałkowej wzrasta
produkcja homocysteiny.
Dieta wysokobiałkowa winna być stosowana jedynie w stanach
wyniszczenia.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
Biochemia TZ wyklad 5 bialka kon low id 86518
Wyklad bialka
wykład 2 - białka, DIETETYKA, ŻYWIENIE CZŁOWIEKA ROK II
0 7 tłumaczenie wykładu białka 2
Biochemia TZ wyklad 2 bialka low
Wykład Białka mięsa, Wykład 15
Biochemia TZ wyklad 5 bialka kon low
0 7 tłumaczenie wykładu białka 2
Biochemia TZ wyklad 5 bialka kon low
04) Kod genetyczny i białka (wykład 4)
Wyklad 03 Białka3
SKROT BIALKA WYKLAD IIC DLA STUDENTOW
aminokwacy cd, białka wyklad2
Białka NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, Białka aminokwasy DNA
Bialka i weglowodany wyklad 4 id 84885 (2)
więcej podobnych podstron