
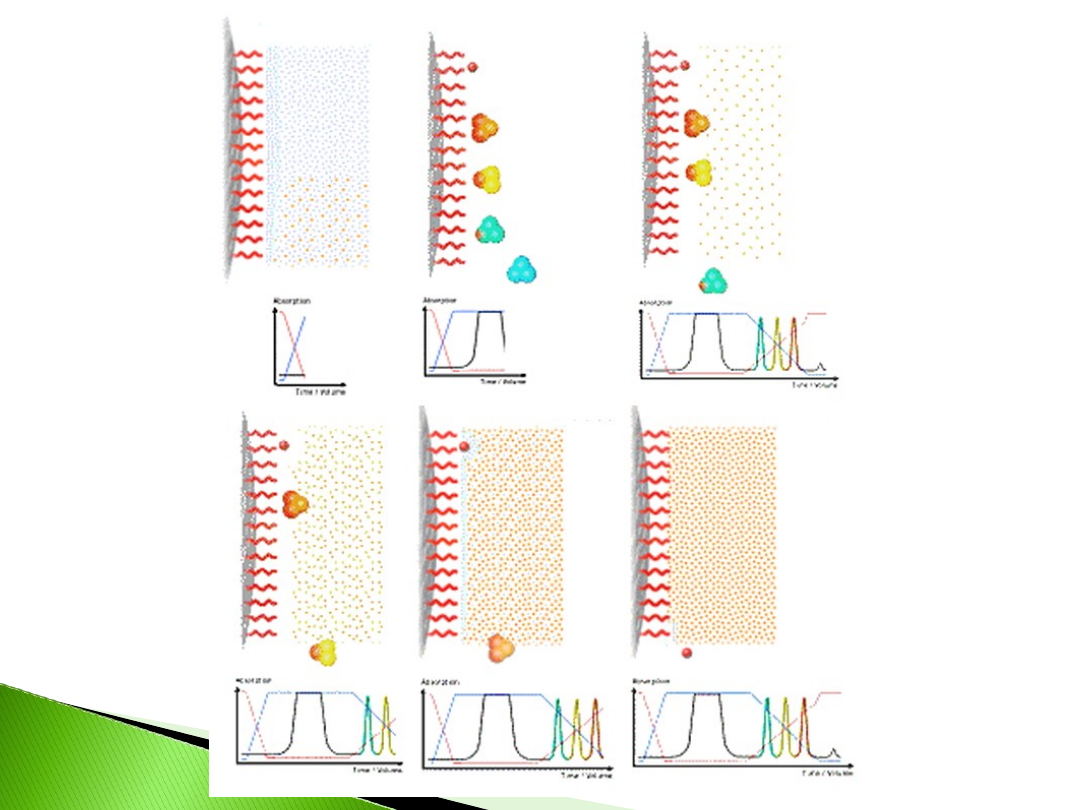
FILTRACJA ŻELOWA, CHROMATOGRAFIA JONWYMIENNA,
CHROMATOGRAFIA ODDZIAŁYWAŃ HYDROFOBOWYCH,
CHROMATOGRAFIA POWINOWACTWA
Karolina Boik
Małgorzata Gałdyszyńska
Marta Owczarek

Czym jest?
Faza stacjonarna
Faza ruchoma
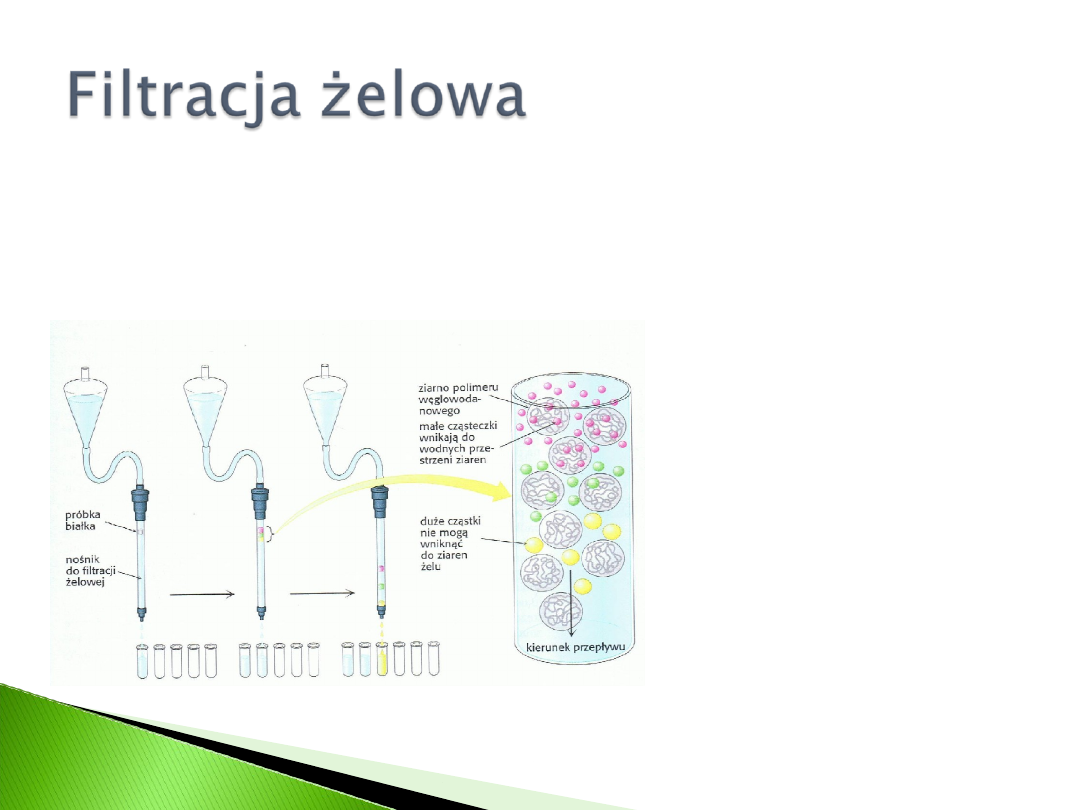
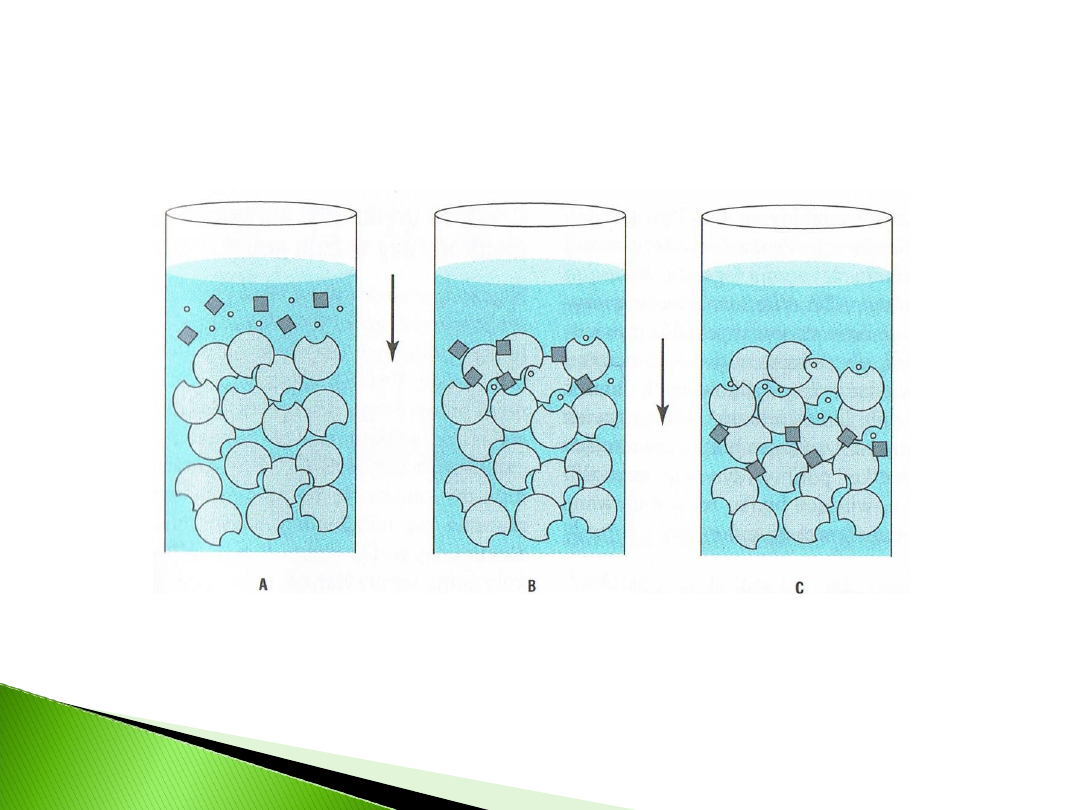
Wykorzystuje różną wielkość cząsteczek
Stosowane żele: dekstran, aragoza lub poliakryloamid
(typowa średnica ziaren 100µm=0,1mm).
Mieszaninę białek w
małej objętości nakłada
się na kolumnę
wypełnioną porowatymi
ziarnami żelu. Duże
białka wypływają
wcześniej od małych,
ponieważ nie mogą
wniknąć do wnętrza
ziaren żelu.
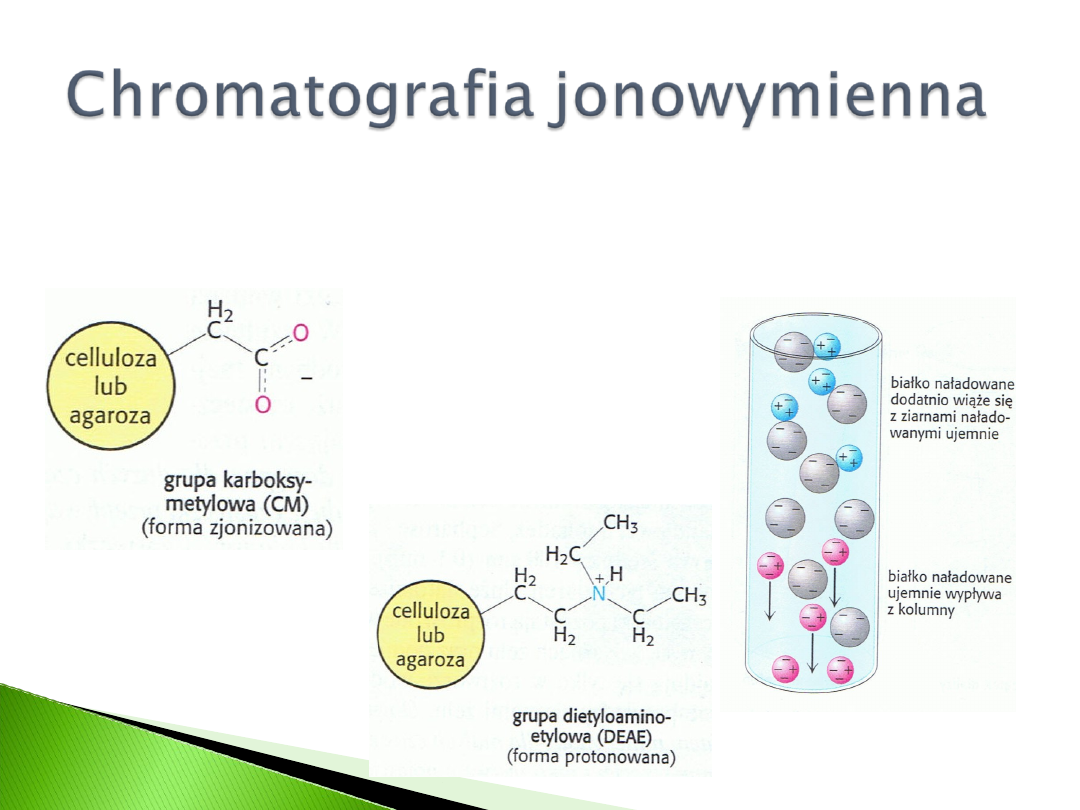
Wykorzystuje różnicę w ładunku wypadkowym odmiennych
cząsteczek

Etapy eksperymentów
jonowymiennych
1.Równoważenie
2.Aplikacja i oczyszczanie
3.Eluacja
4.Regeneracja

Ogólna charakterystyka
• Oddziaływania
elektrostatyczne
• Prawo Coulomba
Wartość siły zależy od:
1.
Wartości wypadkowego
powierzczniowego ładunku
biomolekuły oddziałującej
z gr. funkcyjnymi złoża
2.
Gęstości ładunku
jonowymieniacza
3.
Siły jonowej środowiska
4.
Rodzaju jonów obecnych w
środowisku

Siła jonowa
Rodzaj jonu lub jonów wypierających
Wartość pH
Rola w procesie retencji białek na
jonowymiennych kolumnach
chromatograficznych.
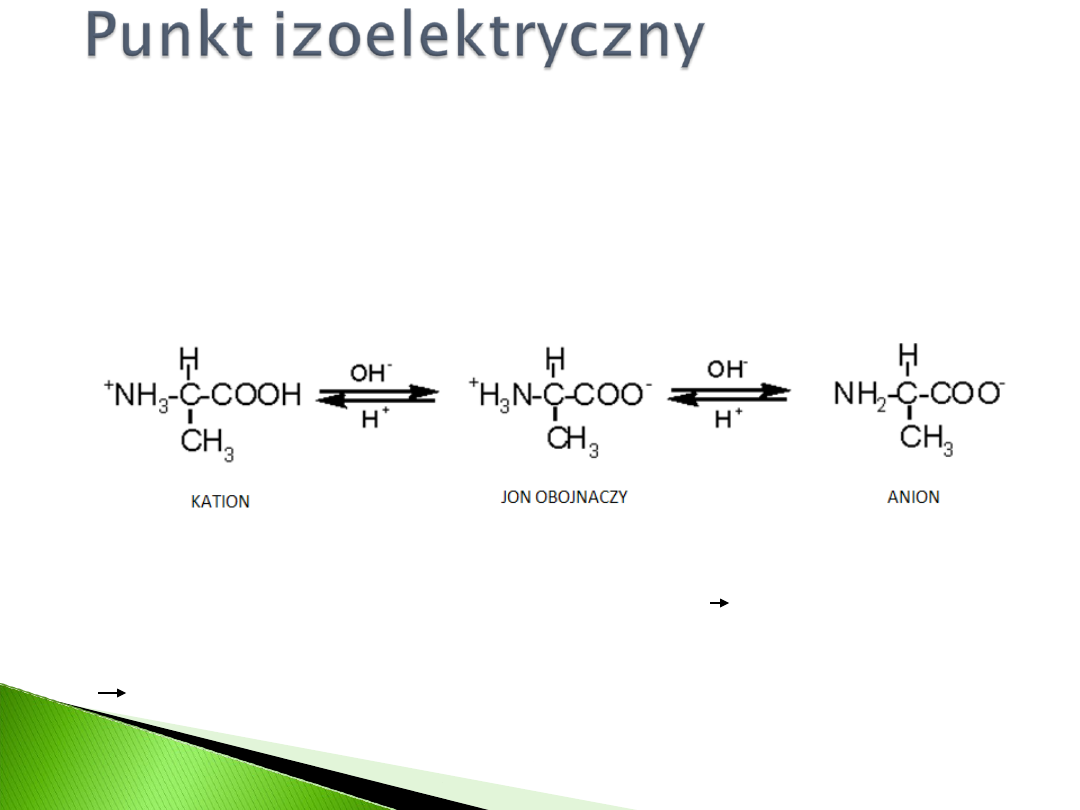
Wartość pH przy której wypadkowy ładunek
cząsteczki białka wynosi zero.
pH<pI uprotonowanie grup aminowych
polikation
pH>pI odczepienie protonów grupy
karboksylowej polianion

Oddziaływania różnych białek ze złożem
jonowymiennym są zróżnicowane, wynika
to z niewielkich zmian ładunków na
powierzchni cząsteczki białek.
W roztworze o pH=pI, wypadkowy ładunek
białka wynosi 0, lecz różna lokalizacja
zjonizowanych reszt aminokwasowych
wewnątrz polipeptydu może wywołać
różnice w potencjale elektostatycznym na
jego powierzchni

Wąski zakres siły jonowej, powyżej której
ma miejsce desorpcja wszystkich białek ze
złoża chromatograficznego powoduje
powszechne polecanie stosowania
gradientu elucyjnego (0,5 mol/l lub 1mol/l
stężenie soli) w celu efektywnego
rozdzielenia mieszaniny białek.

Dość duży problem
Należy eksperymentalnie określić
specyficzność kationów i anionów względem
izolowanego białka
Porównanie czasów retencji tego białka
uzyskanych podczas jego elucji roztworami
zawierającymi różne przeciwjony.
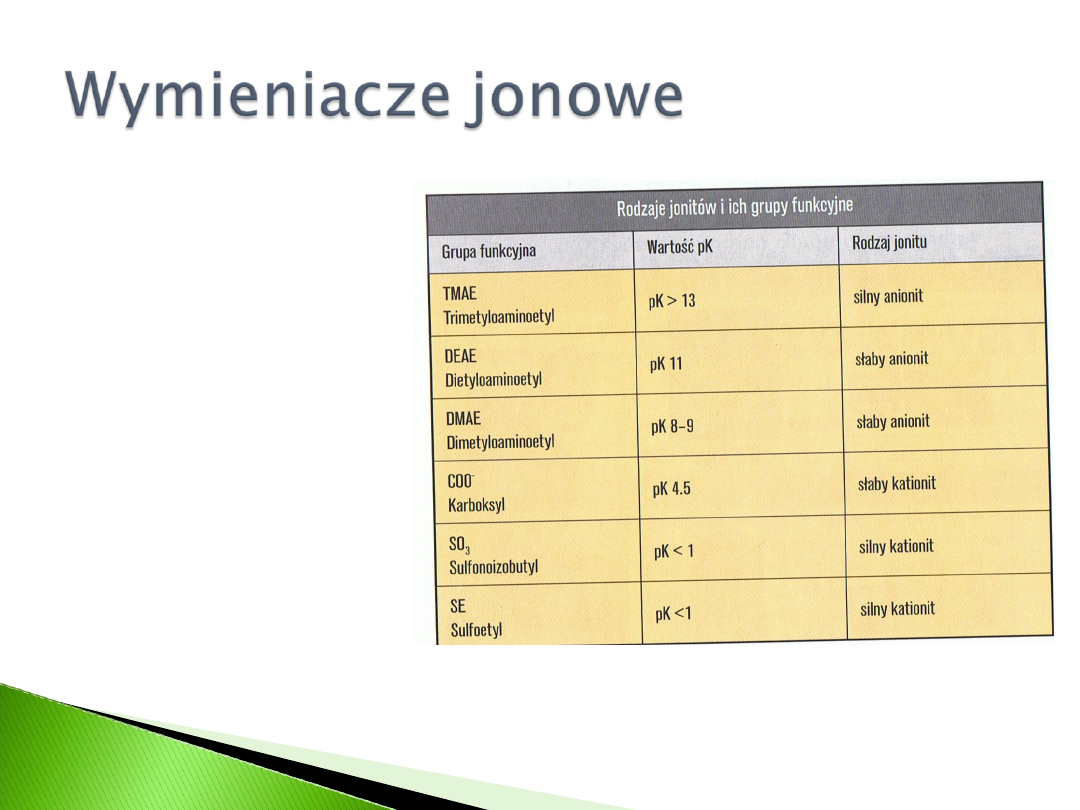
Słaby anionit
Silny anionit
Słaby kationit
Silny kationit
Pojęcie silny/słaby oznacza jedynie
wpływ pH na stan jonizacji grup
funkcyjnych.

Uniwersalne złoże chromatograficzne
stosowane w chromatografii
jonowymiennej
Charakteryzuje się wysoką selektywnością
Katonit zawierający sulfopropylowe grupy
funkcyjne
Wydajny rozdział białek o charakterze
zarówno zasadowym i
obojetnym(trypsynogen, cytochrom c,
lizozym), jak i o charakterze kwasowym
(oksydaza łuszczowa, beta-amylaza)

Ważny czynnik określający retencję białek
na jonowymiennych kolumnach
chromatograficznych
Obok siły jonowej buforu
Zaleca się stosować rozpuszczalniki
organiczne (20%) aby zredukować
oddziaływania hydrofobowe.

Słabe (LiCl, NaF)
Pośrednie NH4Cl)
Silne (NaBr, MgCl2)
Preferowane pośrednie w celu uzyskania
wydajnego procesu oczyszczenia białek.

Hydrfobic Interaction Chromatography, HIC
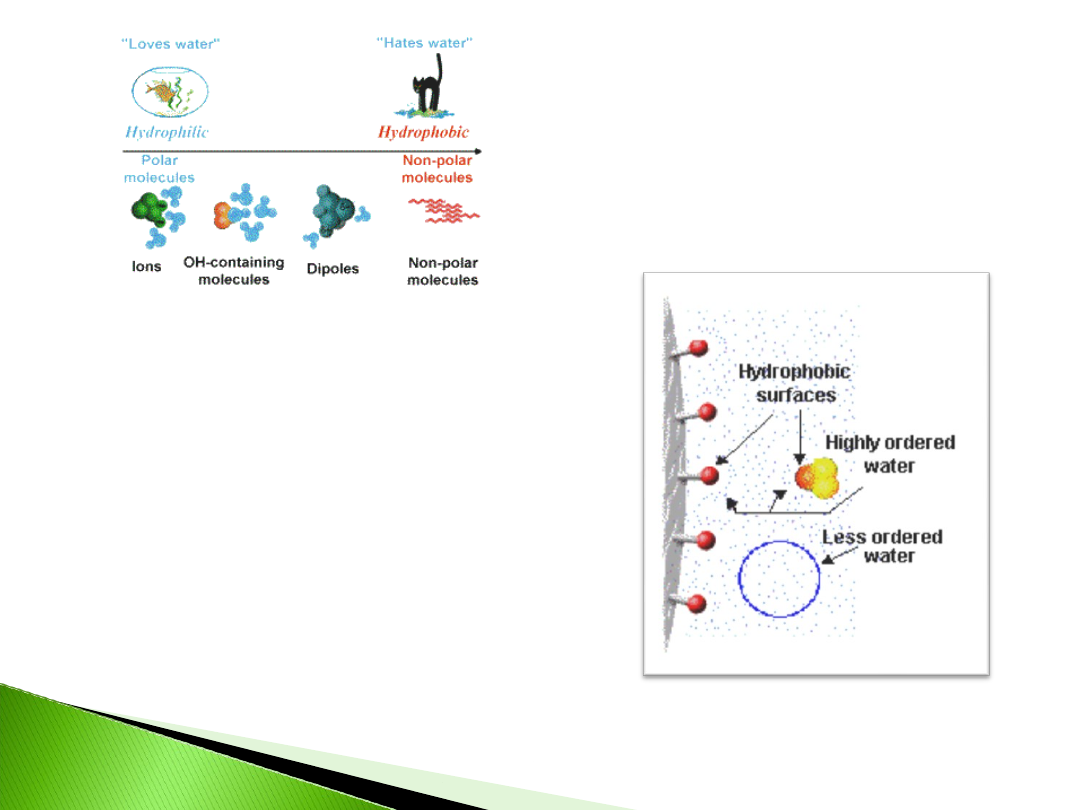
HIC polega na indukowaniu
interakcji (wysoką siłą
jonową fazy ruchomej)
pomiędzy powierzchnią
białka a słabo hydrofobowym
ligandem złoża
Niedenaturujące warunki w
trakcie elucji pozwalają
zachować strukturę
trzeciorzędową białka
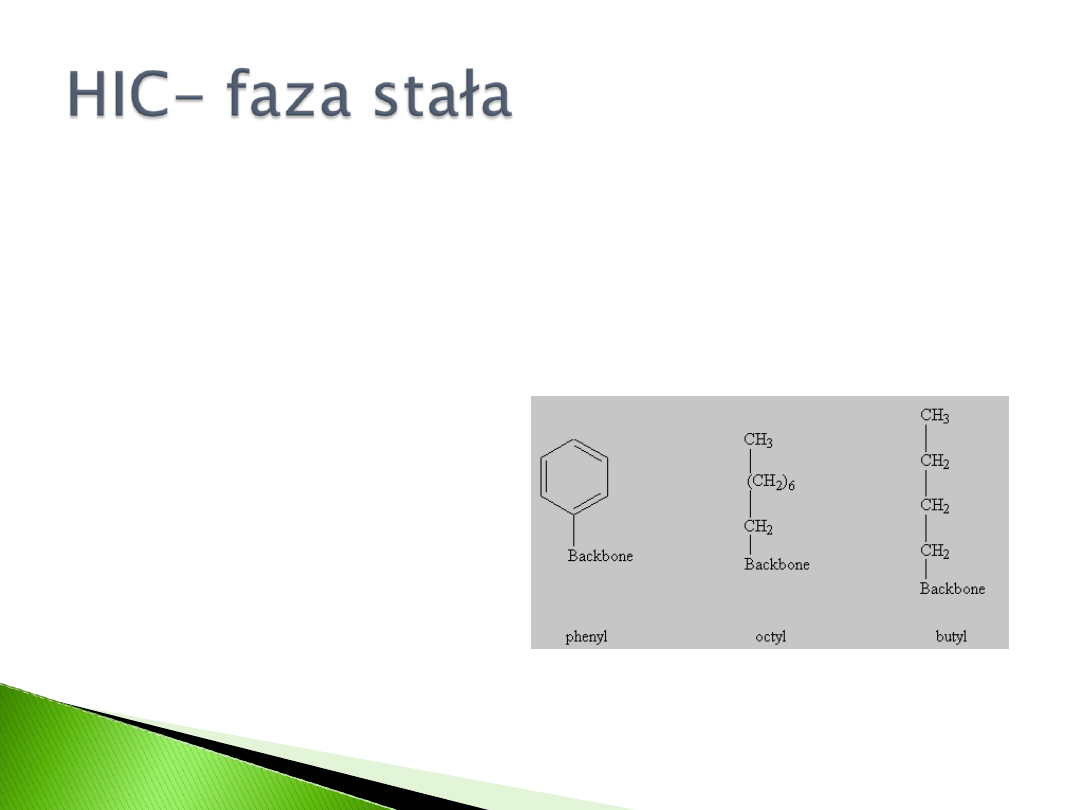
Ligand fazy stałej (złoże krzemionkowe)
powinien być dobierany pod kątem
rozdzielanych białek
Siła adsorpcji białek wzrasta zgodnie z
kolejnością ligandów złoża:
Hydroksypropyl <propyl <benzyl <izopropyl
<fenyl <pentyl
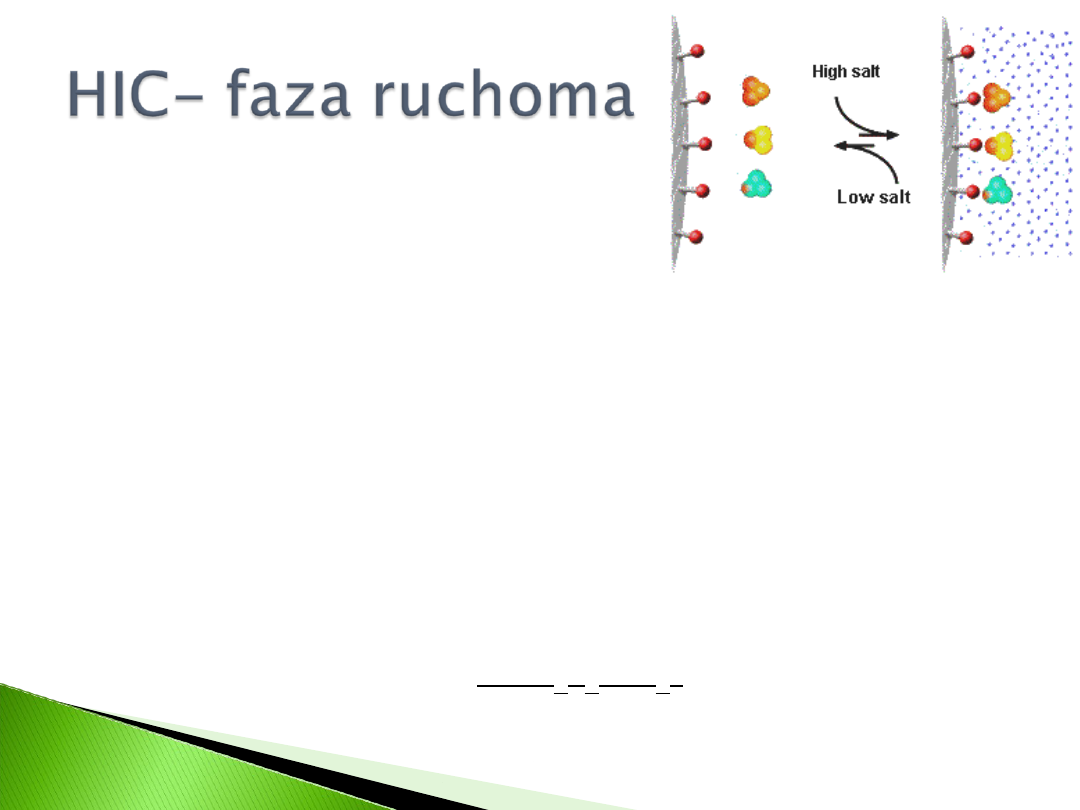
Sorpcja białek zależy od charakteru
liotropowego jonów fazy ruchomej
(warunkujących precypitację), i ich
stężenia
Przy doborze soli należy się kierować
także jej właściwościami fizycznymi i
chemicznymi
Charakter liotropowy soli zmniejsza się
zgodnie z kolejnością ligandów:
Na
2
SO
4
> K
2
SO
4
> (NH
4
)
2
SO
4
> NaCl > NH
4
Cl >
NaBr > NaSCN

Wartość pH wpływa na jonizację grup
aminokwasowych, która to z kolei wpływa
na siłę oddziaływań hydrofobowych. Grupy
te posiadając ładunek wiążą cząstki wody,
co jest równoznaczne ze zwiększeniem
hydrofilności białka. Gdy ładunek
wypadkowy spada, wzrasta siła adsorpcji
białek do złoża.
Dodanie do fazy mobilnej rozpuszczalnika
organicznego sprzyja desorpcji białek.

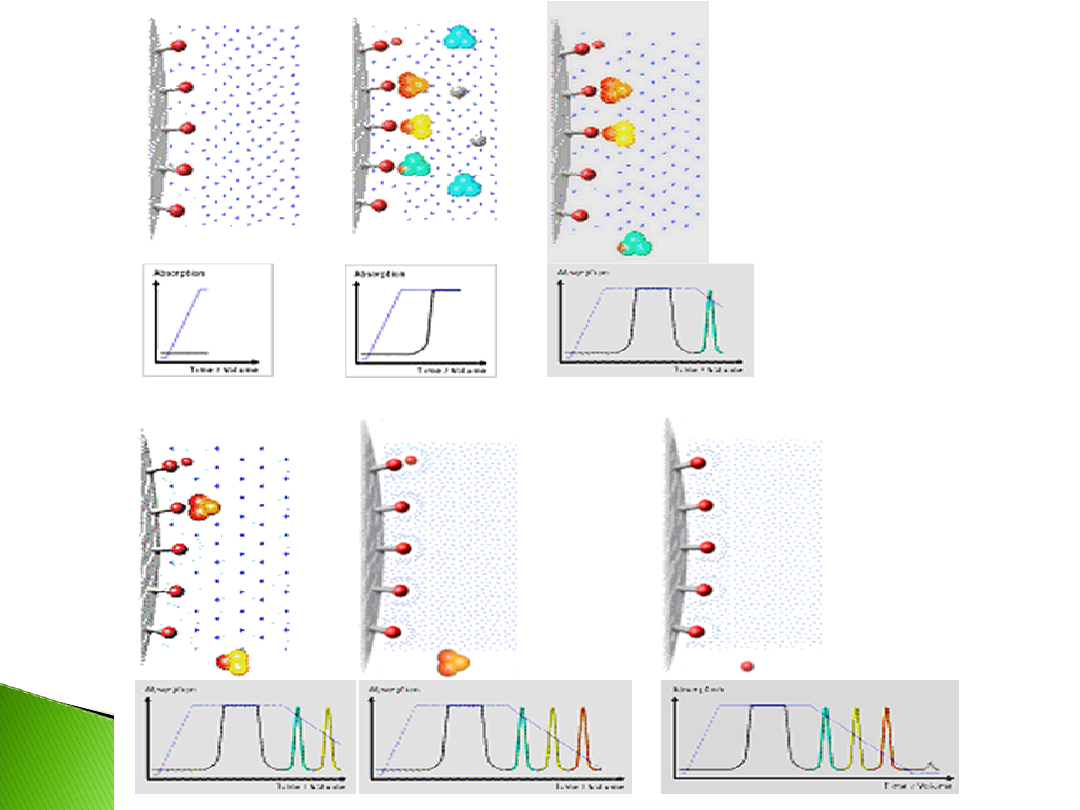
1. Równoważenie fazy stacjonarnej do
pożądanych startowych warunków (poprzez
dodawanie odpowiedniej soli do fazy
mobilnej)
2. Dodawanie próbki i wymywanie
Celem w tym etapie jest
wiązanie cząsteczek docelowych i
wypłukanie całego niezwiązanego
materiału. Wiązanie jest promowane przez
umiarkowanie wysokie stężenie soli.

3. Elucja cząstki uwalniane są z
hydrofobowej powierzchni przez zmianę
składu buforu. Najczęstszą drogą jest
obniżanie gradientu stężenia soli w buforze
4. Regeneracja usuwanie wszystkich
molekuł wciąż związanych. Zapewnia to
pełną zdolność fazy stacjonarnej i
dostępność do następnego użycia.

GE_Hydrophobic+Interaction.swf

Reversed- Phase Chromatography, RPC
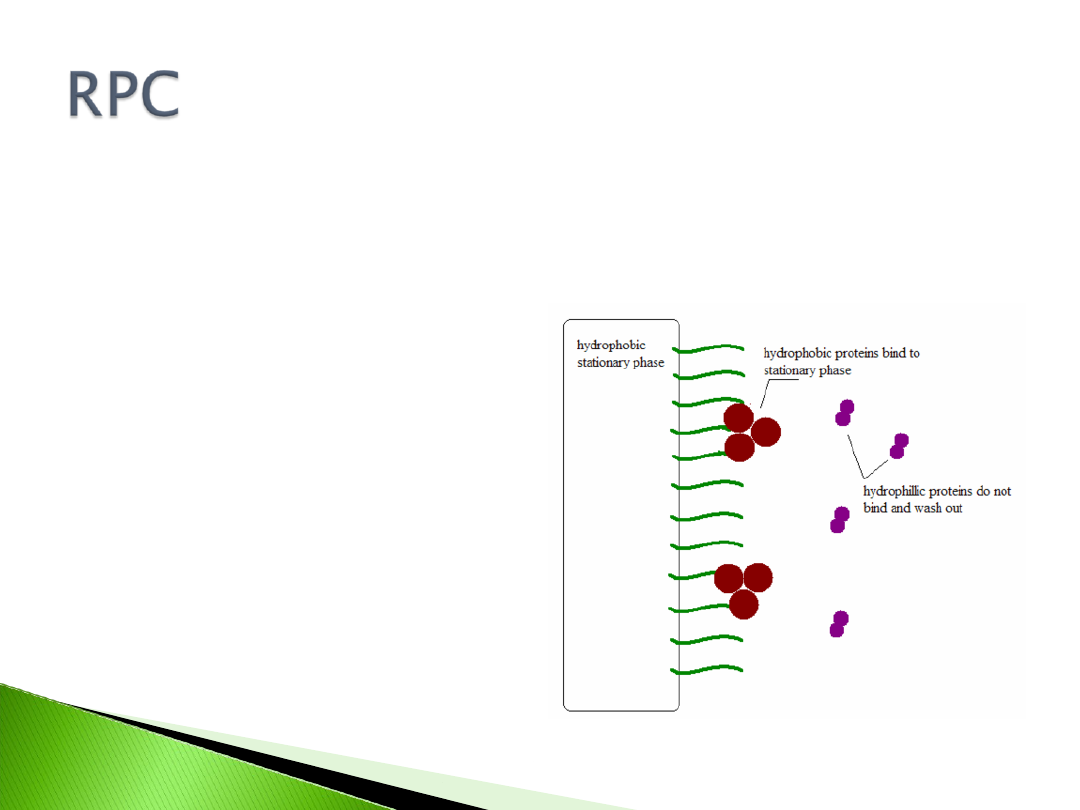
Podobnie jak HIC wykorzystuje
oddziaływania hydrofobowe między cząstką
białka a ligandem hydrofobowej fazy stałej,
siła oddziaływań jest jednak większa (ligand
jest bardziej hydrofobowy).
Faza mobilna używana w wymywaniu w
wielu przypadkach niszczy strukturę
trzeciorzędową białka (tracą aktywność)
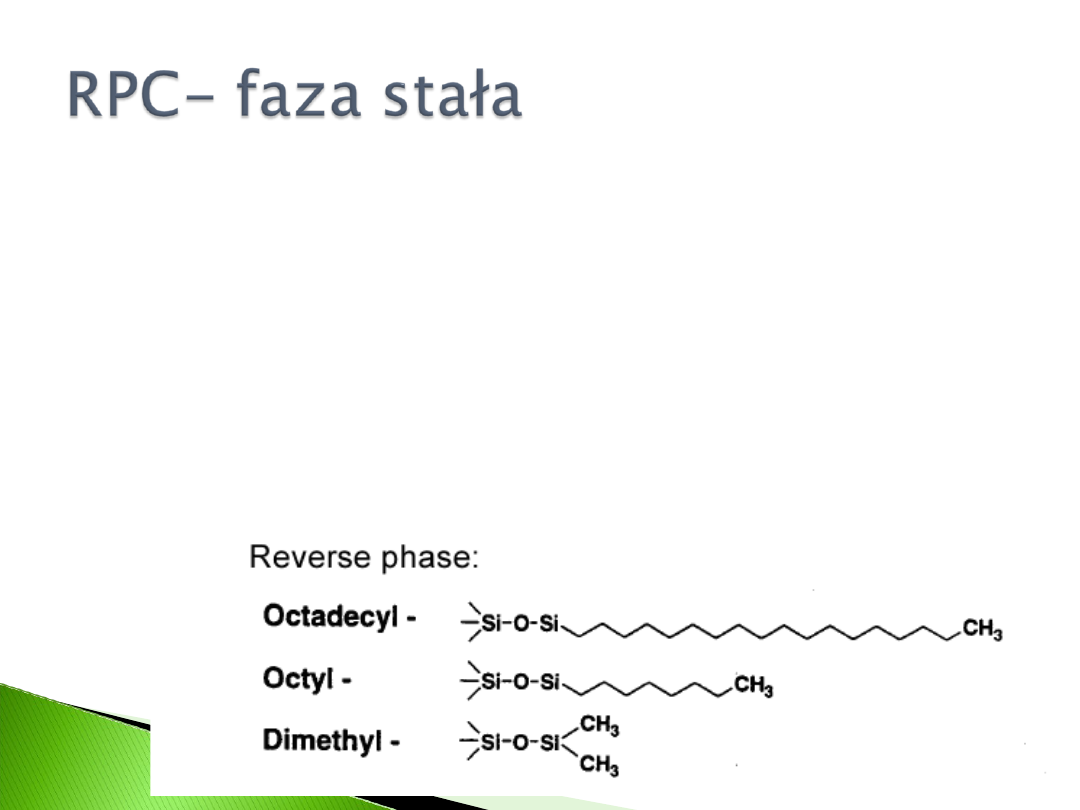
Najczęściej stosowane- wypełnienie
siloksanowe (faza związana typu Si-O-Si-C)
z podstawnikiem C
8
-C
18
.
Długość łańcucha dobierana jest do
substancji rozdzielanej, przy dłuższych
ligandach i w obecności denaturującej fazy
ruchomej może dojść do nieodwracalnej
adsorpcji białka do złoża.
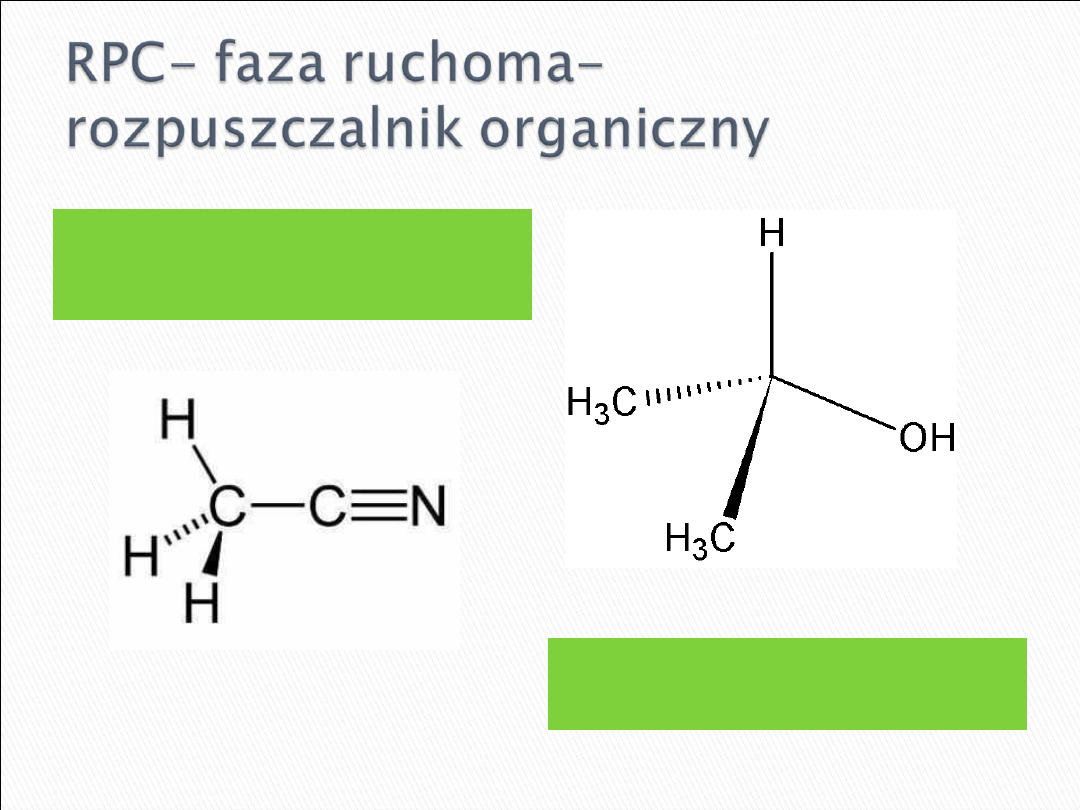
acetonitryl (preferowany, oprócz
rozdzielania protein o charakterze
silnie hydrofobowym)
izopropanol

1.
T – wzrost wydajności
rozdziału w temp 20-60°C
2.
pH- niskie przyczynia się
do denaturacji białek, co
zwiększa efektywność
rozdziału
wysokocząsteczkowych i
hydrofobowych białek
3.
Związki chaotropowe- (np.
mocznik, chlorowodorek
guanidyny) denaturują i
rozpuszczają białka,
zwiększają wydajność i
efektywność rozdzielania
1.
Rybonukleza,
Papaina,
Syntetyczne
peptydy, Kolagen
2.
Papaina,
Cytochrom C
3.
Glikopeptyd

Ion-pairing środki, są często stosowane w RPC
do blokowania ładunku przez co ładunek
cząsteczek próbki jest mniej hydrofobowy.
Kwas fosforowy- powszechnie stosowany w RP-
HPLC, względnie słaby odczynnik typu ion-pairing
Kwas trifluorooctowy (TFA)- pośrednie właściwości
ion-pairing
Kwas mrówkowy- zalecany do stosowania dla
białek trudno rozpuszczalnych, kiedy to TFA jest
nieskuteczne

1. Równoważenie-kolumna
hydrofobowa jest
przygotowywana poprzez
zastosowanie specyficznego
buforu próbki;
2. Dodawanie próbki i
wymywanie- białka próbki
są nanoszone na kolumnę.
Białka w mieszaninie które
mają wysoki procent
eksponowanych
hydrofobowych reszt
aminokwasów będą
absorbowane do
hydrofobowej fazy
stacjonarnej. Inne białka w
mieszaninie będą wymyte;

3. Elucja- Najczęstszym sposobem na to
jest użycie gradientu, który powoli zwiększa
hydrofobowość za pomocą organicznego
rozpuszczalnika. Kolejność, w której białka
są desorbowane jest zazwyczaj relatywna
do liczby zewnętrznych reszt
hydrofobowych każdego białka;
4. regeneracja- Ten etap polega na
zmyciu pozostałych białek z fazy
stacjonarnej i powrót do warunków, jakie
były na początku procesu.
4

http://www.gelifesciences.com/aptrix/upp0
1077.nsf/AttachmentsByTitle/RPC/$FILE/GE_
Reversed+Phase.swf
GE_Reversed+Phase (1).swf

•
Jedna z wielu technik chromatograficznych
•
Unikatowa – wykorzystuje specyficzne
powinowactwo dwóch substancji
biologicznie czynnych
•
Zmniejszona liczba procedur
•
Wyodrębnienie białek – zwłaszcza
enzymatycznych
•
Użyteczna przy białkach których
oczyszczenie jest trudne lub niemożliwe.
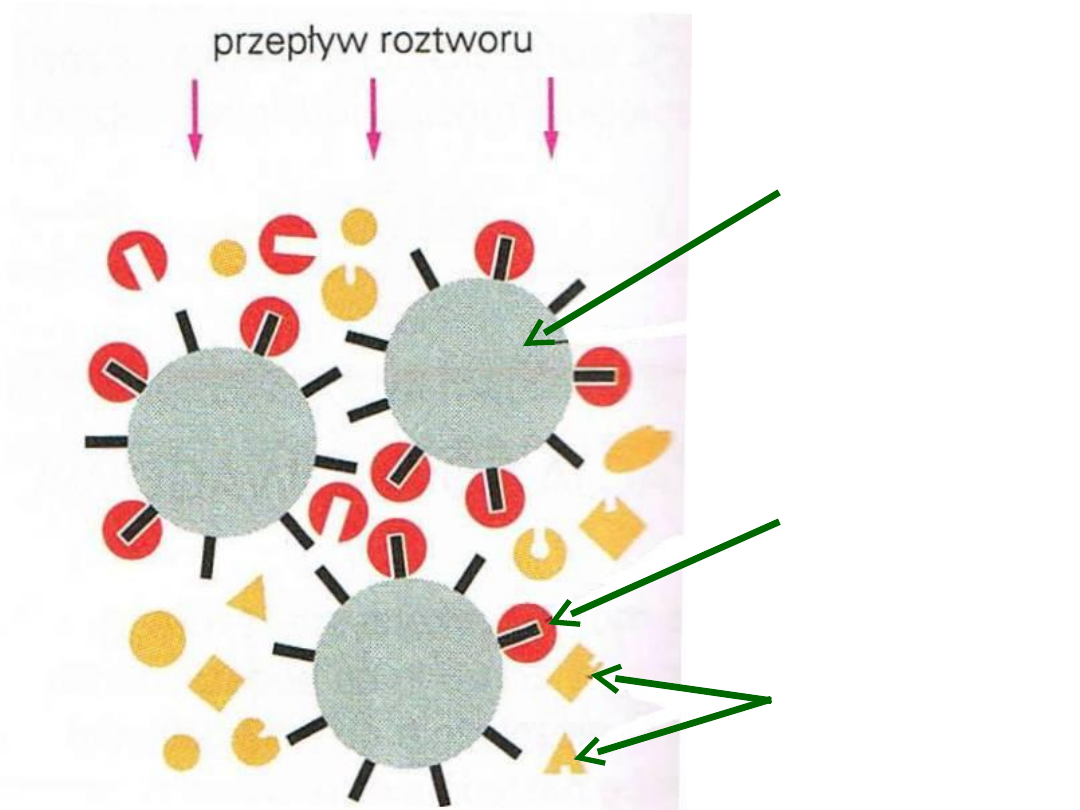
ziarno z
kowalencyjnie
związanym
substratem
związana
cząsteczka
białka
inne nie wiązane
białka
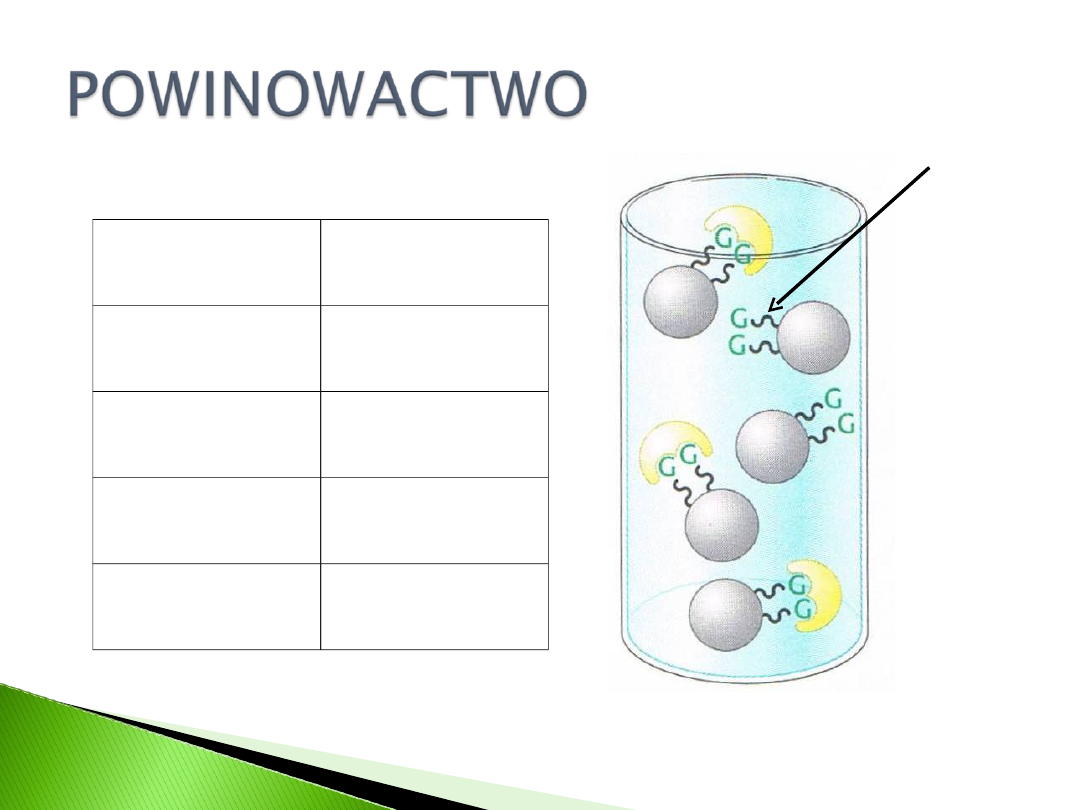
bisorbent
Ligand
Specyficznoś
ć
NAD, NADP
Dehydrogenaz
y
Białko G
Przeciwciała
Arginina
Fibronektyna,
protrombina
Heparyna
Lipoproteiny

W tej chromatografii duże znaczenie ma
nośnik, który jest stosowany. Wypełniacz
kolumn powinien mieć następujące
właściwości:
Hydrofilowość
Strukturę makroporowatą
Sztywność struktury
Obojętność chemiczną
Stabilność chemiczną
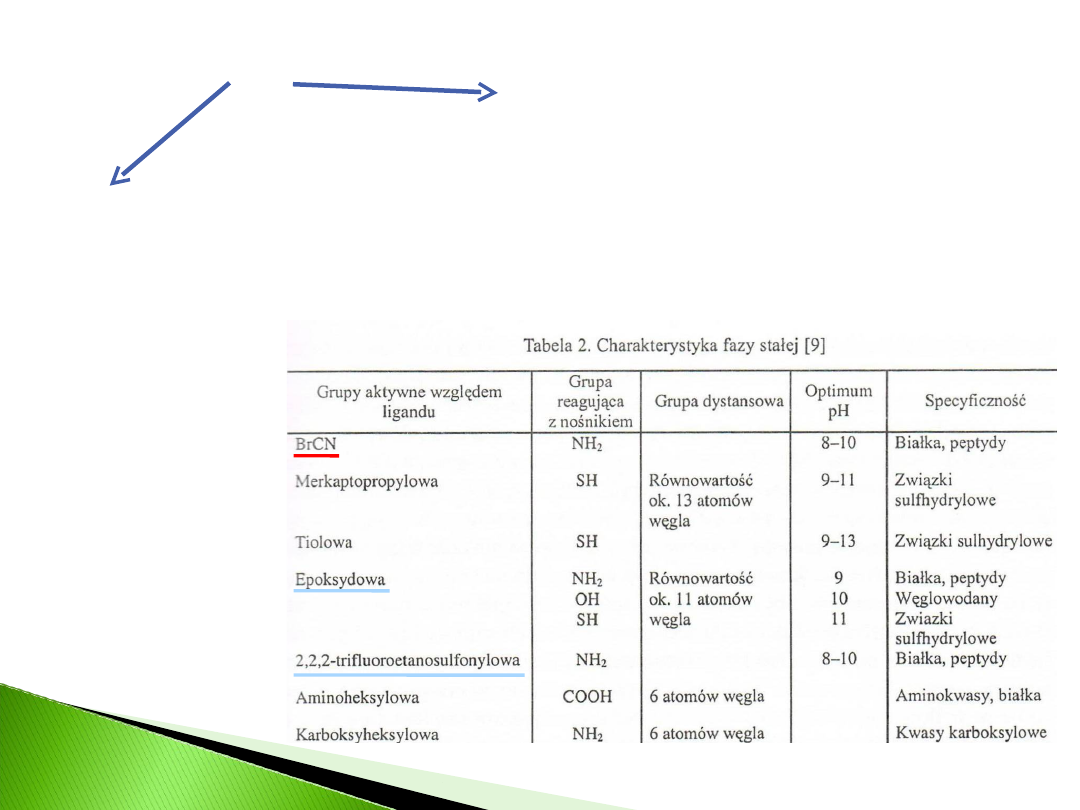
NOŚNIK
NIEAKTYWOWANY
AKTYWOWANY
może być
przystosowan
y do celów
chromatografi
i we własnym
zakresie
spotykana w
handlu, obejmuje
nośniki specjalnie
przygotowane do
wiązania z
ligandem

Aktywność bisorbentu można znacznie
podwyższyć przez zmianę odległości miedzy
ligandem i nośnikiem
Długość tego wiązania ma
znaczenie dla małych ligandów
Duży ligand wiązany z małym białkiem nie
wymaga takiej grupy dystansowej
Przy dużym białku obecność takiej grupy jest
wskazana
Grupy takie eliminują efekty steryczne nośnika
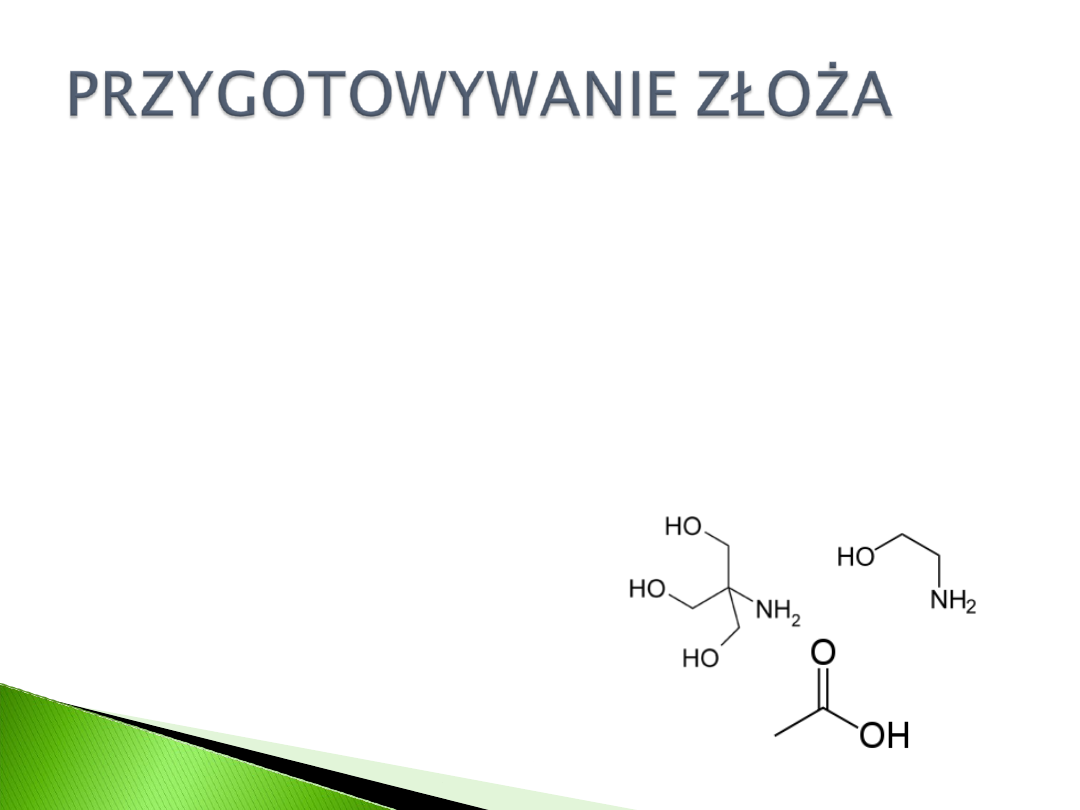
PRZYŁĄCZANIE LIGANDU
Należy zwrócić uwagę na efekty steryczne i
grupę dystansową
Stężenie ligandu
Wielkość ligandu
stabilność
USUNIĘCIE NADMIARU LIGANDU
Tris lub etanoloamina
Kwas octowy
PRZEMYCIE BUFOREM

Na tak przygotowaną kolumnę możemy
nałożyć próbkę
Białka są rozpuszczone w buforze
fosforanowym lub w 0,1-0,2M Tris
Jest to zazwyczaj też bufor elucyjny
Obecność 0,1-0,5M NaCl jest wskazana w
buforze elucyjnym

Jeden z rodzajów chromatografii
powinowactwa
Szybkie i wydajne oczyszczanie białek
Mechanizm opiera się na oddziaływaniach
pomiędzy grupami funkcyjnymi
aminokwasów (-OH, -NH
2
, -SH) i
immobilizowanym jonem metalu.
Znaczenie niektórych aminokwasów
Zastosowanie tej techniki do frakcjonowania
białek
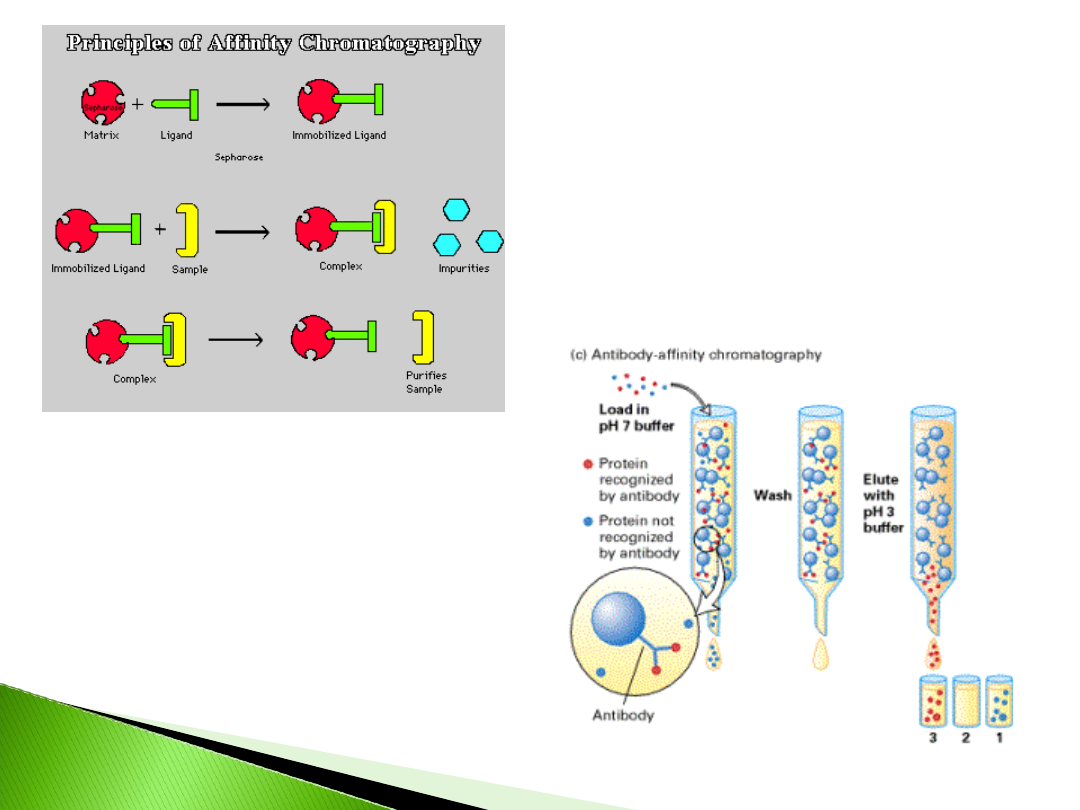

Najczęstsze wypełniacze to:
•
Agaroza
•
Krzemionka
•
Związki polimerowe o charakterze
hydrofilowym
Do nich przyłączone są
związki chelatujące
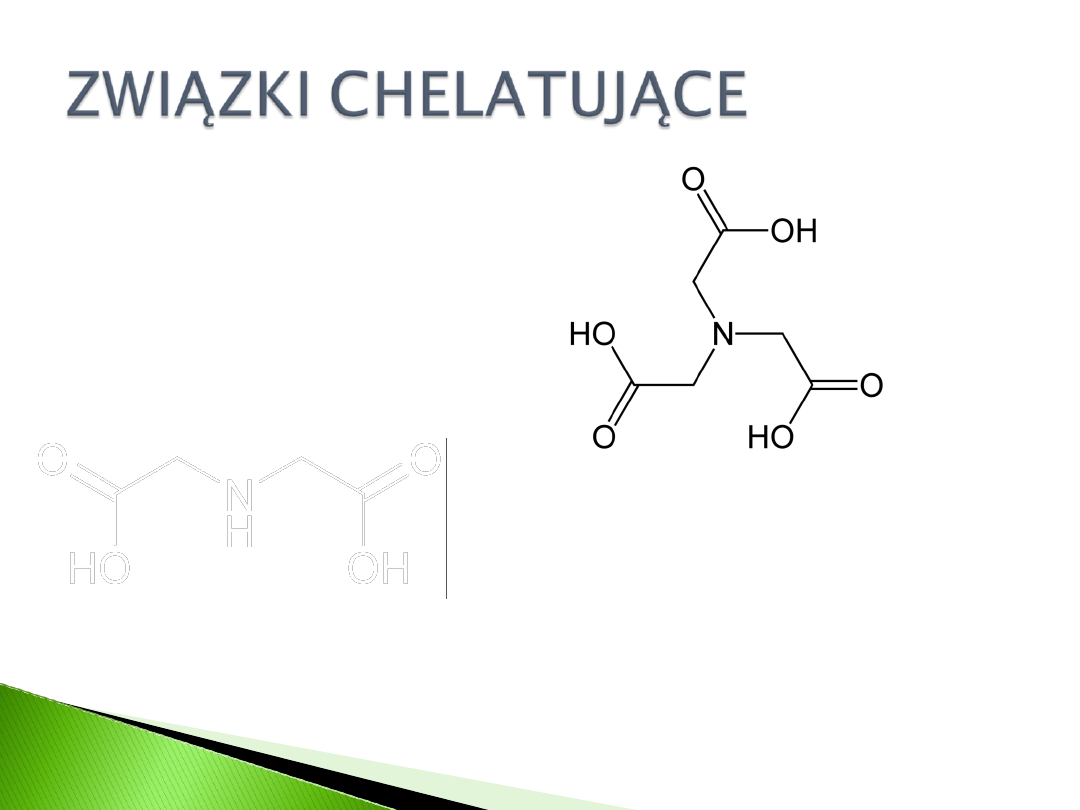
IDA
–kwas iminodioctowy
TED
–tris(karboksymetylo)etyleno-diamina
NTA
–kwas nitrylotrioctowy
W tej chromatografii ważny jest też
dobór metalu. Najczęściej stosowane
to: Cu(II),Ni(II), Ca(II), Zn(II), Fe(II),
Fe(III), a także Al(III), Ga(III), In(III),
Tl(III)
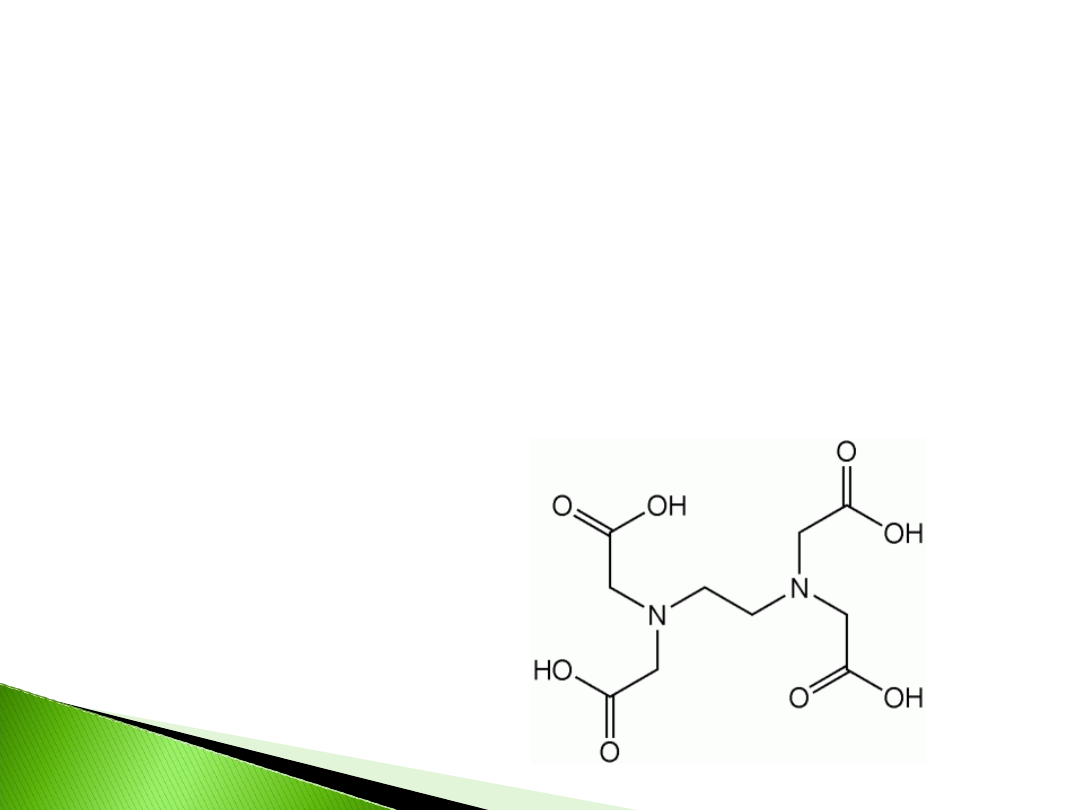
Możliwość usunięcia chelatowanego metalu z
kolumny i zastąpienie go innym wyróżnia tą
chromatografię spośród innych chromatografii
powinowactwa. Usunięcie tego metalu
zachodzi przy użyciu EDTA
–kwas
etylenodiaminotetraoctowy
•
Selektywność wiązania białek z jonami
metali zależy od pH fazy ruchomej
•
Mapy retencji w celu określenia
optymalnego pH
•
Dodanie związku adsorbującego do
koordynacyjnego miejsca na powierzchni
białka lub substancji konkurujących z
białkami
pH=7
pH>7
pH<7
Ni(II) może
preferować
siarkę
cysteiny i
azot
histydyny
Fe(III) ma
tendencję
do wiązania
się z siarką i
z tlenem
grup -COOH

Stosuje się roztwory wodne zawierające
sole, związki powierzchniowo czynne,
mocznik, rozpuszczalniki organiczne
Obecność NaCl w fazie ruchomej powoduje
wzrost adsorpcji i selektywności
Rozpuszczalniki organiczne wykazują
właściwości wzmacniające silne
oddziaływania i osłabiające słabe

Białko
Metal
Kolagenaza
Zn(II)
Fibrynogen ludzki
Zn(II)
Somatotropina
Cu(II)
Perforyna
Co(II)
Białka wyizolowane techniką IMAC

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
cw 1 Chemia fluorowców Wykorzystanie metody chromatograficznej i analitycznej do rozdzielania anion
Instrukcja Wykorzystanie przewodnictwa do rozdziau makromoleku skrcony
Instrukcja Wykorzystanie przewodnictwa do rozdziau makromoleku skrcony
list intencyjny1, Prywatne, Technik administracji, II semestr 2013-zima, Technika Pracy Biurowej, do
Informacje techniczne, Audio, Końcówki do przewodów typy
Elementy statystyki matematycznej wykorzystywane do opracowywania wielkości wyznaczanych, Geodezja i
diatermia, Diatermia kondensatorowa wykorzystuje do nagrzania tkanek pole elektryczne
ćw 17 Układ zasilania aparatu Epsteina do rozdziału strat metodą częstotliwościową
Podstawa programowa z techniki, szkoła, Materiały do techniki(technika)
techniki plastyczne wykorzystywane w przedszkolu, prace plastyczne
Broken Heart Od Prologu do Rozdziału 24
CV przyklady, Prywatne, Technik administracji, II semestr 2013-zima, Technika Pracy Biurowej, do opa
WSTP DO PRAWOZNAWSTWA materialy, Technik administacji, WSTĘP DO PRAWOZNAWSTWA
gajda#1, Gajda - skrypt do rozdziału 5
Mechanika Techniczna I Skrypt przyklady do rozwiazania id 291
technika pobierania materiału do badań
więcej podobnych podstron