
KULOMETRIA
KULOMETRIA
Budzyńska Paulina
Budzyńska Paulina
Malicka Kamila
Malicka Kamila

Czym jest kulometria?
Czym jest kulometria?
Kulometria
Kulometria
– to metoda analizy
– to metoda analizy
elektrochemicznej , w której masę
elektrochemicznej , w której masę
oznaczanej substancji określa się na
oznaczanej substancji określa się na
podstawie zmierzonego ładunku
podstawie zmierzonego ładunku
elektrycznego potrzebnego do
elektrycznego potrzebnego do
zmiany stopnia utlenienia
zmiany stopnia utlenienia
oznaczanej substancji.
oznaczanej substancji.
Wielkością mierzoną w tej metodzie
Wielkością mierzoną w tej metodzie
jest ładunek.
jest ładunek.

Ładunek elektryczny przepływający
Ładunek elektryczny przepływający
przez obwód elektryczny mierzy się
przez obwód elektryczny mierzy się
za pomocą:
za pomocą:
kulometrów
kulometrów
Integratorów,
Integratorów,
które są połączone szeregowo z
które są połączone szeregowo z
naczynkiem elektrolitycznym.
naczynkiem elektrolitycznym.

Kulometr
Kulometr
(woltametr) - urządzenie do
(woltametr) - urządzenie do
pomiaru średniego natężenia prądu stałego.
pomiaru średniego natężenia prądu stałego.
Kulometr jest naczyniem, w którym przebiega
Kulometr jest naczyniem, w którym przebiega
elektroliza, tak skonstruowanym, że można
elektroliza, tak skonstruowanym, że można
dokładnie zmierzyć ilość produktów elektrolizy.
dokładnie zmierzyć ilość produktów elektrolizy.
Na przykład w kulometrze srebrowym można
Na przykład w kulometrze srebrowym można
dokładnie zważyć osadzone na elektrodzie
dokładnie zważyć osadzone na elektrodzie
srebro, a w kulometrze gazowym zmierzyć
srebro, a w kulometrze gazowym zmierzyć
objętość wytworzonych w czasie elektrolizy
objętość wytworzonych w czasie elektrolizy
gazów (wodór i tlen). Znając ilość produktów
gazów (wodór i tlen). Znając ilość produktów
elektrolizy, oblicza się na podstawie prawa
elektrolizy, oblicza się na podstawie prawa
Faradaya wielkość ładunku elektrycznego, który
Faradaya wielkość ładunku elektrycznego, który
przepłynął przez kulometr, a dzieląc tę wielkość
przepłynął przez kulometr, a dzieląc tę wielkość
przez czas przepływu prądu określa się jego
przez czas przepływu prądu określa się jego
natężenie.
natężenie.

Zasada metody
Zasada metody
Jest to metoda elektroanalityczna
Jest to metoda elektroanalityczna
oparta na zjawisku elektrolizy.
oparta na zjawisku elektrolizy.
Polega na pomiarze ładunku
Polega na pomiarze ładunku
elektrycznego przepływającego przez
elektrycznego przepływającego przez
roztwór, konieczny do
roztwór, konieczny do
przeprowadzenia reakcji
przeprowadzenia reakcji
elektroutleniania lub elektroredukcji.
elektroutleniania lub elektroredukcji.
Ilościową zależność pomiędzy masą
Ilościową zależność pomiędzy masą
wydzielonej (przereagowanej)
wydzielonej (przereagowanej)
substancji, a przepływającym
substancji, a przepływającym
ładunkiem podał Faraday w postaci
ładunkiem podał Faraday w postaci
dwóch praw.
dwóch praw.

I Prawo Faradaya
I Prawo Faradaya
Masa substancji wydzielonej na danej
Masa substancji wydzielonej na danej
elektrodzie jest proporcjonalna do
elektrodzie jest proporcjonalna do
ładunku elektrycznego (Q), który
ładunku elektrycznego (Q), który
przepłynął przez elektrolit:
przepłynął przez elektrolit:
m = k∙Q = k ∙
m = k∙Q = k ∙
∫
∫
dt
dt
gdzie:
gdzie:
k – równoważnik elektrochemiczny,
k – równoważnik elektrochemiczny,
t - czas
t - czas

m = k∙Q
m = k∙Q
a ponieważ
a ponieważ
Q= It, więc:
Q= It, więc:
m = k∙I∙t
m = k∙I∙t
gdzie:
gdzie:
m - masa substancji wydzielonej
m - masa substancji wydzielonej
(przereagowanej) na elektrodzie [g]
(przereagowanej) na elektrodzie [g]
I – natężenie prądu płynącego na obwodzie
I – natężenie prądu płynącego na obwodzie
[A]
[A]
t – czas elektrolizy [s]
t – czas elektrolizy [s]
Q – ładunek jaki przepłynął przez obwód [C]
Q – ładunek jaki przepłynął przez obwód [C]
k - równoważnik elektrochemiczny [g/C]
k - równoważnik elektrochemiczny [g/C]

Określa ilość elektryczności potrzebną
Określa ilość elektryczności potrzebną
do wydzielenia na elektrodzie
do wydzielenia na elektrodzie
substancji odpowiadającej przejściu
substancji odpowiadającej przejściu
jednego mola elektronów. Wynosi ona
jednego mola elektronów. Wynosi ona
96494 kulombów
96494 kulombów
. Ta ilość
. Ta ilość
elektryczności nosi nazwę
elektryczności nosi nazwę
stałej
stałej
Faradaya
Faradaya
[C/mol].
[C/mol].
(F=96469 C)
(F=96469 C)
II Prawo Faradaya
II Prawo Faradaya

Stała Faradaya wyraża się wzorem,
Stała Faradaya wyraża się wzorem,
w którym współczynnik
w którym współczynnik
k
k
jest masą
jest masą
substancji wydzieloną pod wpływem
substancji wydzieloną pod wpływem
ładunku 1 C(kulomba):
ładunku 1 C(kulomba):
k = M / n∙F
k = M / n∙F
gdzie:
gdzie:
k - masa substancji wydzielona pod wpływem
k - masa substancji wydzielona pod wpływem
ładunku 1 C (kolumba),
ładunku 1 C (kolumba),
M - masa molowa wydzielanej substancji,
M - masa molowa wydzielanej substancji,
n - liczba elektronów biorących udział w
n - liczba elektronów biorących udział w
elektrochemicznym utlenianiu lub redukcji jednego
elektrochemicznym utlenianiu lub redukcji jednego
jonu,
jonu,
F – stała Faradaya (w zaokrągleniu równa 96500 C).
F – stała Faradaya (w zaokrągleniu równa 96500 C).

Inne, częściej spotykane
Inne, częściej spotykane
sformułowanie drugiego prawa
sformułowanie drugiego prawa
elektrolizy Faradaya brzmi:
elektrolizy Faradaya brzmi:
S
S
tosunek mas
tosunek mas
m1
m1
oraz
oraz
m2
m2
substancji wydzielonych na
substancji wydzielonych na
elektrodach podczas przepływu
elektrodach podczas przepływu
jednakowych ładunków
jednakowych ładunków
elektrycznych jest równy
elektrycznych jest równy
stosunkowi ich równoważników
stosunkowi ich równoważników
elektrochemicznych
elektrochemicznych
R1
R1
oraz
oraz
R2
R2
,
,
czyli:
czyli:
m1/m2 = R1/R2
m1/m2 = R1/R2
.
.

Przy omawianiu praw elektrolizy i
Przy omawianiu praw elektrolizy i
metody analizy elektrochemicznej
metody analizy elektrochemicznej
(kulometria) wyjaśnimy pojęcia
(kulometria) wyjaśnimy pojęcia
związane z tym procesem takie jak:
związane z tym procesem takie jak:
Polaryzacja (stężeniowa i
Polaryzacja (stężeniowa i
aktywacyjna)
aktywacyjna)
Nadnapięcie
Nadnapięcie
Napięcie rozkładowe
Napięcie rozkładowe

Polaryzacja
Polaryzacja
elektrody czyli zmiana jej
elektrody czyli zmiana jej
potencjału występuje w wyniku
potencjału występuje w wyniku
połączenia jej z zewnętrznym źródłem
połączenia jej z zewnętrznym źródłem
napięcia prądu elektrycznego. Przy czym
napięcia prądu elektrycznego. Przy czym
nie jest istotne czy dana elektroda jest
nie jest istotne czy dana elektroda jest
częścią składową ogniwa czy
częścią składową ogniwa czy
elektrolizera. Zmiany jakim ona ulegnie
elektrolizera. Zmiany jakim ona ulegnie
są zależne jedynie od budowy elektrody
są zależne jedynie od budowy elektrody
oraz od gęstości prądu przepływającego
oraz od gęstości prądu przepływającego
przez jej powierzchnię.
przez jej powierzchnię.
Jako miarę spolaryzowania elektrody
Jako miarę spolaryzowania elektrody
stosuje się wielkość zwaną
stosuje się wielkość zwaną
nadnapięciem
nadnapięciem
.
.

Nadnapięcie
Nadnapięcie
jest to różnica
jest to różnica
potencjałów elektrody polaryzowanej
potencjałów elektrody polaryzowanej
określoną gęstością prądu a
określoną gęstością prądu a
statycznym, tzn. równowagowym
statycznym, tzn. równowagowym
potencjałem tej elektrody:
potencjałem tej elektrody:
η
η
= Ei – Er
= Ei – Er
Gęstość prądu to stosunek natężenia
Gęstość prądu to stosunek natężenia
prądu do powierzchni elektrody.
prądu do powierzchni elektrody.
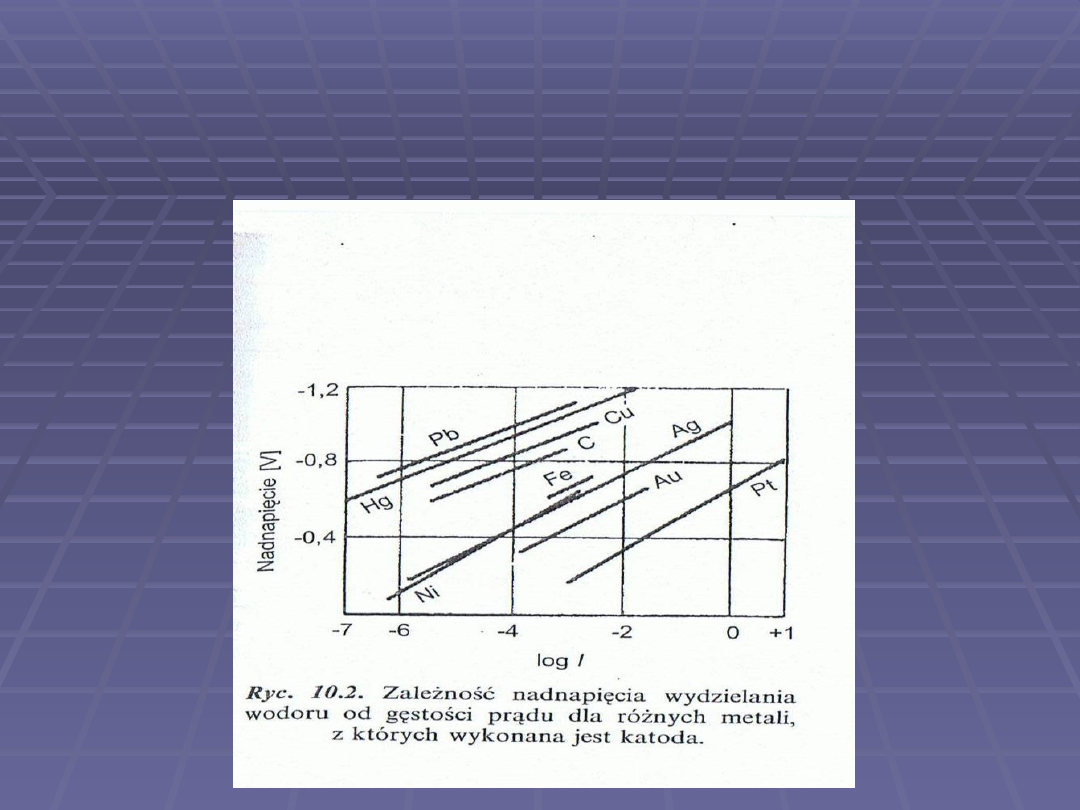
Krzywe zależności nadnapięcia wydzielania
Krzywe zależności nadnapięcia wydzielania
wodoru od logarytmu z gęstości prądu dla
wodoru od logarytmu z gęstości prądu dla
kilku różnych metali stanowiących materiał
kilku różnych metali stanowiących materiał
elektrody
elektrody

Polaryzacja stężeniowa
Polaryzacja stężeniowa
to
to
polaryzacja powstająca gdy w pobliżu
polaryzacja powstająca gdy w pobliżu
elektrody wytwarzają się gradienty
elektrody wytwarzają się gradienty
stężenia substancji analizowanej.
stężenia substancji analizowanej.
Gradienty te powstają gdy
Gradienty te powstają gdy
najwolniejszym etapem procesu
najwolniejszym etapem procesu
elektrodowego jest transport tej
elektrodowego jest transport tej
substancji do powierzchni elektrody
substancji do powierzchni elektrody
lub w kierunku przeciwnym.
lub w kierunku przeciwnym.

Polaryzacja aktywacyjna
Polaryzacja aktywacyjna
to
to
polaryzacja występująca wtedy, gdy
polaryzacja występująca wtedy, gdy
najwolniejszy etap procesu
najwolniejszy etap procesu
elektrodowego wymaga znacznej
elektrodowego wymaga znacznej
energii aktywacji. Jej miarą jest
energii aktywacji. Jej miarą jest
nadnapięcie aktywacyjne. Ten rodzaj
nadnapięcie aktywacyjne. Ten rodzaj
nadnapięcia ma szczególnie duże
nadnapięcia ma szczególnie duże
znaczenie w przypadku katodowego
znaczenie w przypadku katodowego
wydzielania wodoru oraz anodowego
wydzielania wodoru oraz anodowego
wydzielania tlenu.
wydzielania tlenu.

Empiryczne obserwacje dotyczące
Empiryczne obserwacje dotyczące
katodowego wydzielania wodoru
katodowego wydzielania wodoru
doprowadziły do stwierdzenia, że
doprowadziły do stwierdzenia, że
proces ten jest w znacznym stopniu
proces ten jest w znacznym stopniu
zależny od temperatury i ze
zależny od temperatury i ze
wzrostem temperatury maleje. Zależy
wzrostem temperatury maleje. Zależy
również od pH roztworu, od rodzaju
również od pH roztworu, od rodzaju
metalu z którego wykonana jest
metalu z którego wykonana jest
elektroda i od trucizn, które już w
elektroda i od trucizn, które już w
śladowych ilościach powodują duży
śladowych ilościach powodują duży
wzrost napięcia. Wszystkie te cechy
wzrost napięcia. Wszystkie te cechy
odróżniają nadnapięcie aktywacyjne
odróżniają nadnapięcie aktywacyjne
od stężeniowego.
od stężeniowego.

Napięcie rozkładowe
Napięcie rozkładowe
to pojęcie
to pojęcie
odnoszące się do elektrod będących
odnoszące się do elektrod będących
w równowadze z roztworem zanim
w równowadze z roztworem zanim
zostanie przyłożone napięcie.
zostanie przyłożone napięcie.
Ponieważ prąd rośnie stale w miarę
Ponieważ prąd rośnie stale w miarę
wzrostu napięcia nie można dokładnie
wzrostu napięcia nie można dokładnie
sprecyzować kiedy rozpoczyna się
sprecyzować kiedy rozpoczyna się
elektroliza. Jako
elektroliza. Jako
napięcie rozkładowe
napięcie rozkładowe
przyjmuje się wartość otrzymaną
przyjmuje się wartość otrzymaną
przez ekstrapolację krzywej
przez ekstrapolację krzywej
„natężenie prądu-napięcie” do
„natężenie prądu-napięcie” do
zerowego natężenia prądu.
zerowego natężenia prądu.
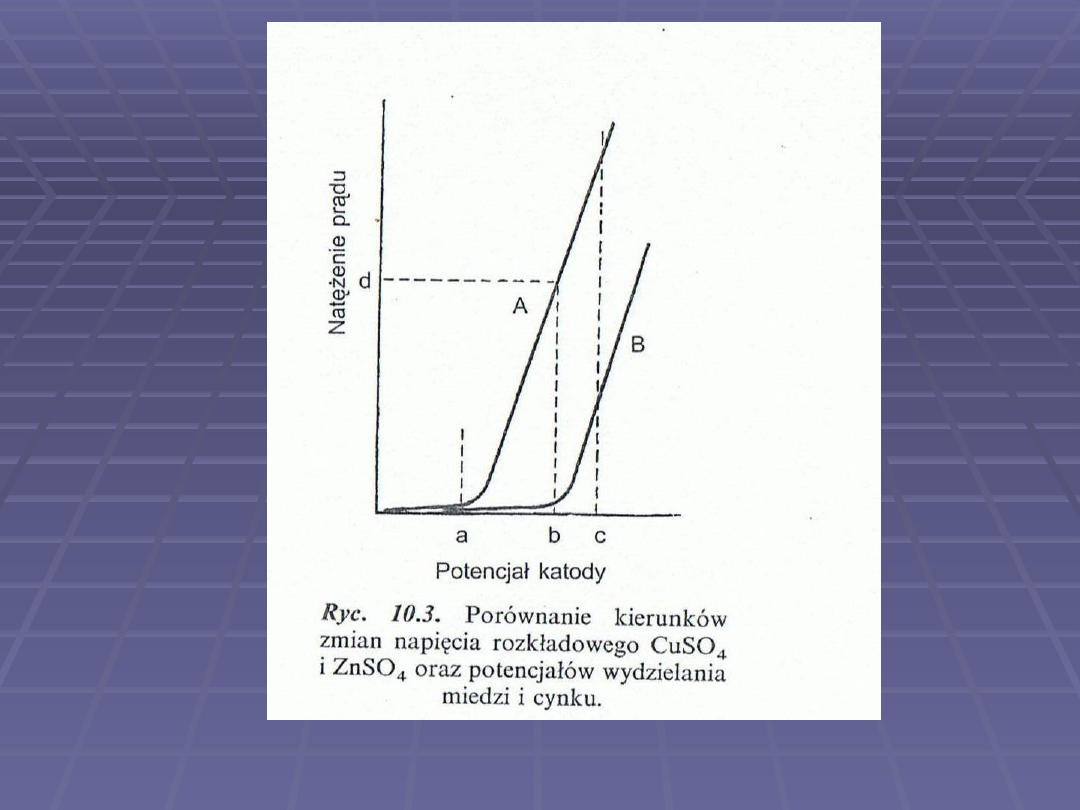

Krzywe prąd-napięcie
Krzywe prąd-napięcie
wyznaczyć można dwoma
wyznaczyć można dwoma
podstawowymi metodami:
podstawowymi metodami:
galwanostatycznie
galwanostatycznie
potencjostatycznie
potencjostatycznie

Metoda galwanostatyczna
Metoda galwanostatyczna
polega na mierzeniu potencjału
polega na mierzeniu potencjału
badanej elektrody
badanej elektrody
względem elektrody odniesienia (np.
względem elektrody odniesienia (np.
elektroda kalomelowa) przy
elektroda kalomelowa) przy
wymuszonym zewnętrznie znanym
wymuszonym zewnętrznie znanym
prądzie płynącym między elektrodą
prądzie płynącym między elektrodą
badaną a przeciwelektrodą.
badaną a przeciwelektrodą.

W
W
metodzie
metodzie
potencjostatycznej
potencjostatycznej
mierzy się
mierzy się
prąd płynący między elektrodą
prąd płynący między elektrodą
badaną a przeciwelektrodą przy
badaną a przeciwelektrodą przy
wymuszonym, stałym i znanym
wymuszonym, stałym i znanym
potencjale elektrody badanej
potencjale elektrody badanej
względem elektrody odniesienia.
względem elektrody odniesienia.

Rozdzielanie elektrolityczne
Rozdzielanie elektrolityczne
Jednym z zastosowań elektrolizy z
Jednym z zastosowań elektrolizy z
kontrolowanym potencjałem, oprócz oznaczania
kontrolowanym potencjałem, oprócz oznaczania
ilościowego, jest rozdzielanie metali. Metodę tę
ilościowego, jest rozdzielanie metali. Metodę tę
stosuje się głównie do rozdzielania dużych ilości
stosuje się głównie do rozdzielania dużych ilości
metali od innych małych ilości, które następnie
metali od innych małych ilości, które następnie
oznacza się innymi metodami chemicznymi lub
oznacza się innymi metodami chemicznymi lub
instrumentalnymi. Dobre wyniki rozdzielania
instrumentalnymi. Dobre wyniki rozdzielania
zależą głównie od różnic potencjałów redukcji
zależą głównie od różnic potencjałów redukcji
poszczególnych metali. W przypadku, gdy
poszczególnych metali. W przypadku, gdy
potencjały różnią się o 0,4 V, łatwiej redukujący
potencjały różnią się o 0,4 V, łatwiej redukujący
się metal można rozdzielić z dokładnością 99 %.
się metal można rozdzielić z dokładnością 99 %.

Elektrograwimetria
Elektrograwimetria
Elektrograwimetria – to kolejna
Elektrograwimetria – to kolejna
metoda służąca do ilościowego
metoda służąca do ilościowego
oznaczania substancji.
oznaczania substancji.
Wyróżniamy 3 rodzaje
Wyróżniamy 3 rodzaje
elektrograwimetrii:
elektrograwimetrii:
klasyczną
klasyczną
wewnętrzną
wewnętrzną
z kontrolowanym potencjałem.
z kontrolowanym potencjałem.

Elektrograwimetria
Elektrograwimetria
klasyczna
klasyczna
Ta metoda analizy ilościowej zachodzi przy
Ta metoda analizy ilościowej zachodzi przy
stałej gęstości prądu (gęstością prądu nazywa
stałej gęstości prądu (gęstością prądu nazywa
się stosunek natężenia prądu do powierzchni
się stosunek natężenia prądu do powierzchni
elektrody) i nadaje się przede wszystkim do
elektrody) i nadaje się przede wszystkim do
analizy pojedynczych substancji, a zwłaszcza
analizy pojedynczych substancji, a zwłaszcza
metali wydzielających się na elektrodzie
metali wydzielających się na elektrodzie
podczas elektrolizy. Najczęściej stosowane
podczas elektrolizy. Najczęściej stosowane
elektrody są platynowe. Stosuje się przy tym
elektrody są platynowe. Stosuje się przy tym
możliwie największe gęstości prądu w celu
możliwie największe gęstości prądu w celu
skrócenia czasu elektrolizy oraz ogrzewanie i
skrócenia czasu elektrolizy oraz ogrzewanie i
mieszanie roztworu.
mieszanie roztworu.

Zestaw składa się ze zlewki z
Zestaw składa się ze zlewki z
analizowanym roztworem, w której
analizowanym roztworem, w której
zanurzone są dwie elektrody
zanurzone są dwie elektrody
platynowe – katoda w postaci siatki i
platynowe – katoda w postaci siatki i
anoda w postaci spirali. Elektrody
anoda w postaci spirali. Elektrody
połączone są przez opornik z
połączone są przez opornik z
prostownikiem zasilanym z sieci.
prostownikiem zasilanym z sieci.
Amperomierz i woltomierz włączone w
Amperomierz i woltomierz włączone w
obwód pozwalają na kontrolę
obwód pozwalają na kontrolę
natężenia i napięcia prądu płynącego
natężenia i napięcia prądu płynącego
przez układ.
przez układ.
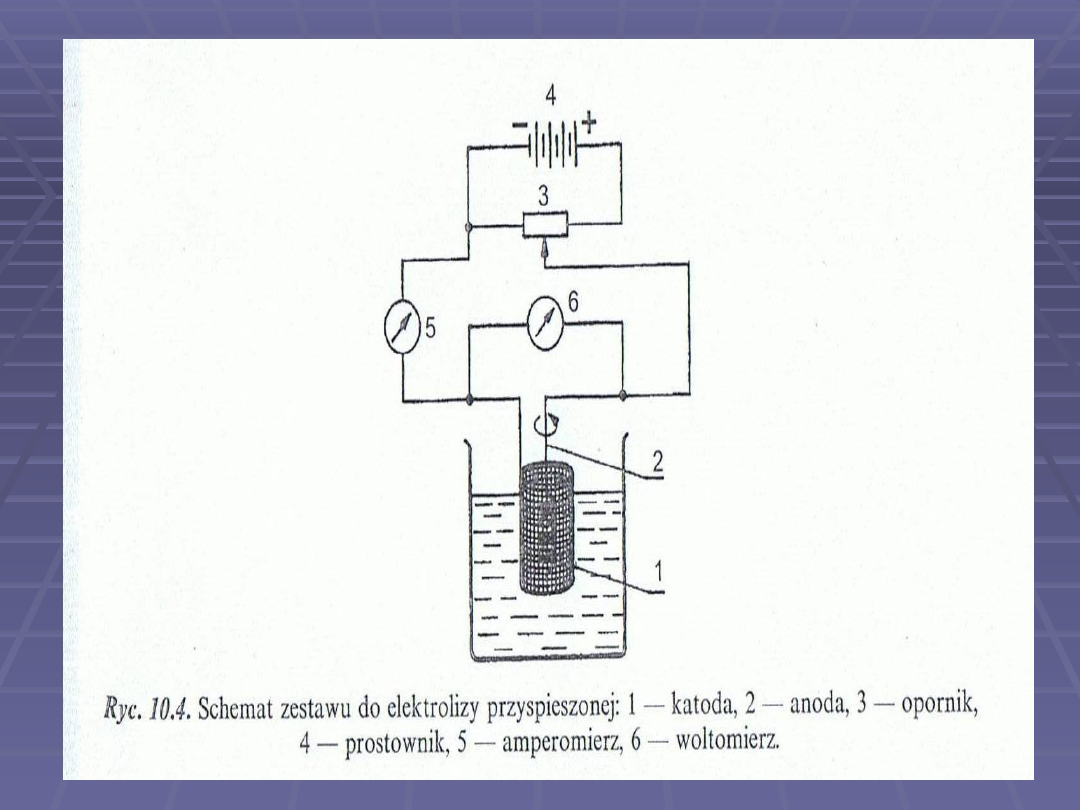

Aby uniknąć błędów w analizie i
Aby uniknąć błędów w analizie i
uzyskać odpowiednią jakość
uzyskać odpowiednią jakość
wydzielonego metalu do badanej
wydzielonego metalu do badanej
próby dodaje się depolaryzatory np.
próby dodaje się depolaryzatory np.
NO
NO
3
3
-
-
, hydrazynę czy hydroksyaminę.
, hydrazynę czy hydroksyaminę.
Zarówno proces redukcji jak i
Zarówno proces redukcji jak i
utlenienia powoduje wydzielenie się
utlenienia powoduje wydzielenie się
gazów, które dodatkowo mieszają
gazów, które dodatkowo mieszają
roztwór. Zakończenie elektrolizy ustala
roztwór. Zakończenie elektrolizy ustala
się drogą odpowiedniej próby
się drogą odpowiedniej próby
(np.reakcja kroplowa na bibule).
(np.reakcja kroplowa na bibule).

Analiza kulometryczna
Analiza kulometryczna
Jest to technika pomiaru elektryczności
Jest to technika pomiaru elektryczności
wymaganej do całkowitego przebiegu reakcji w
wymaganej do całkowitego przebiegu reakcji w
naczyńku elektrolitycznym.
naczyńku elektrolitycznym.
Oznaczana substancja może podlegać:
Oznaczana substancja może podlegać:
-
bezpośredniej reakcji na jednej z elektrod –
bezpośredniej reakcji na jednej z elektrod –
analiza kulometryczna bezpośrednia
analiza kulometryczna bezpośrednia
-
reakcji z inną substancją wytwarzaną na
reakcji z inną substancją wytwarzaną na
elektrodzie –
elektrodzie –
analiza kulometryczna pośrednia
analiza kulometryczna pośrednia
Aby ilościowo analizować substancje metodami
Aby ilościowo analizować substancje metodami
kulometrycznymi , wydajność prądowa reakcji
kulometrycznymi , wydajność prądowa reakcji
musi być 100-procentowa, a przebieg reakcji w
musi być 100-procentowa, a przebieg reakcji w
roztworze stechiometryczny.
roztworze stechiometryczny.

Aparatura kulometryczna
Aparatura kulometryczna
Ilość elektryczności [C] mierzy się za pomocą
Ilość elektryczności [C] mierzy się za pomocą
kulometrów.
kulometrów.
Wyróżnia się kulometry: chemiczne (wagowe,
Wyróżnia się kulometry: chemiczne (wagowe,
miareczkowe, gazowe, kolorymetryczne) oraz
miareczkowe, gazowe, kolorymetryczne) oraz
integratory elektrochemiczne i elektroniczne
integratory elektrochemiczne i elektroniczne
KULOMETRY WAGOWE
KULOMETRY WAGOWE
-
Pomiar ilości elektryczności odbywa się na
Pomiar ilości elektryczności odbywa się na
podstawie zmian masy elektrody po elektrolizie
podstawie zmian masy elektrody po elektrolizie
-
Najważniejsze to : kulometr srebrowy i miedziowy
Najważniejsze to : kulometr srebrowy i miedziowy
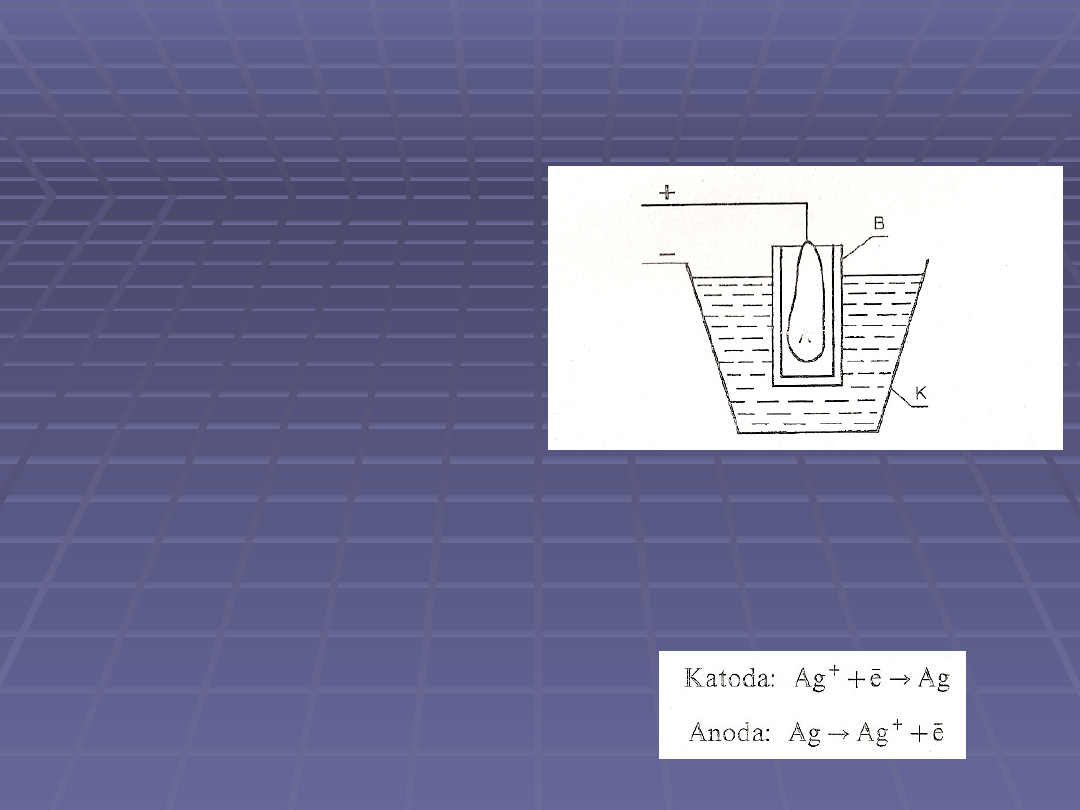
Kulometr srebrowy
Kulometr srebrowy
Składa się z anody wykonanej ze
Składa się z anody wykonanej ze
srebra i platynowej katody,
srebra i platynowej katody,
stanowiącej jednocześnie obudowę
stanowiącej jednocześnie obudowę
kulometru
kulometru
Anoda jest dodatkowo umieszczona
Anoda jest dodatkowo umieszczona
w naczyniu z porowatej porcelany,
w naczyniu z porowatej porcelany,
co zapobiega opadaniu cząstek
co zapobiega opadaniu cząstek
srebra z anody na katodę
srebra z anody na katodę
Kulometr napełniony jest 15–
Kulometr napełniony jest 15–
procentowym roztworem AgNO3.
procentowym roztworem AgNO3.
Po skończonym pomiarze roztwór
Po skończonym pomiarze roztwór
wewnętrzny usuwa się, a
wewnętrzny usuwa się, a
wydzielone na elektrodzie srebro
wydzielone na elektrodzie srebro
przemywa się, suszy i waży
przemywa się, suszy i waży
Kulometr srebrowy jest bardzo
Kulometr srebrowy jest bardzo
precyzyjny (zakres pomiarowy
precyzyjny (zakres pomiarowy
wynosi 10-100 C) Ewentualne
wynosi 10-100 C) Ewentualne
błędy wynikają jedynie z błędów
błędy wynikają jedynie z błędów
ważenia
ważenia
K – katoda
K – katoda
A – anoda
A – anoda
B – naczynie wewnętrzne
B – naczynie wewnętrzne
Reakcje jakie przebiegają na elektrodach:
Reakcje jakie przebiegają na elektrodach:

KULOMERY MIARECZKOWE
KULOMERY MIARECZKOWE
Największe zastosowanie mają:
Największe zastosowanie mają:
kulometr jodowy
kulometr jodowy
i
i
alkacymetryczny
alkacymetryczny

Kulometr jodowy
Kulometr jodowy
Zasada działania oparta jest na
Zasada działania oparta jest na
wydzielaniu na anodzie wolnego
wydzielaniu na anodzie wolnego
jodu:
jodu:
,
,
który następnie miareczkuje się
który następnie miareczkuje się
mianowanym roztworem tiosiarczanu
mianowanym roztworem tiosiarczanu
VI sodu
VI sodu
1 kulomb elektryczności odpowiada
1 kulomb elektryczności odpowiada
1,315 mg jodu
1,315 mg jodu
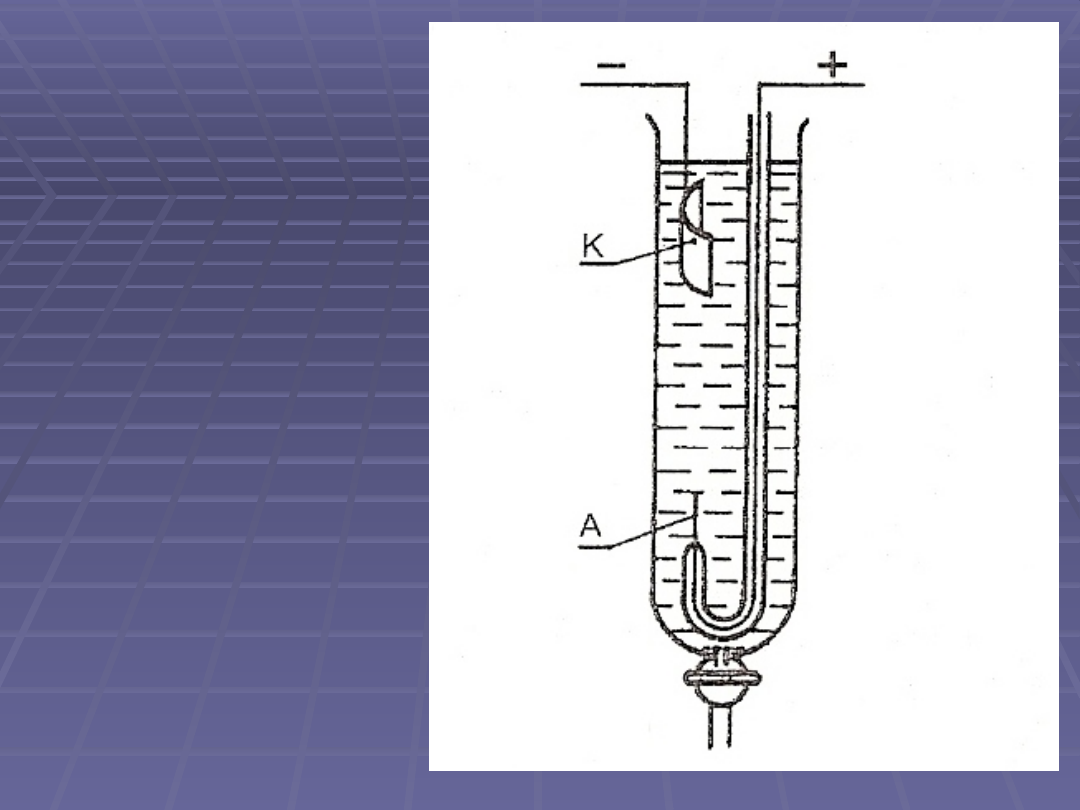
schemat
schemat
kulometru
kulometru
jodowego
jodowego

Kulometr alkacymetryczny
Kulometr alkacymetryczny
Zbudowany jest z 2 elektrod, z których anodą jest drut srebrny
Zbudowany jest z 2 elektrod, z których anodą jest drut srebrny
zwinięty w spiralę, a katodą - blaszka platynowa
zwinięty w spiralę, a katodą - blaszka platynowa
Elektrody są zanurzone w roztworach KBr i K2SO4
Elektrody są zanurzone w roztworach KBr i K2SO4
Reakcje zachodzące na elektrodach:
Reakcje zachodzące na elektrodach:
Tak więc sumaryczna reakcja wygląda następująco:
Tak więc sumaryczna reakcja wygląda następująco:
Jony OH- postałe w wyniku reakcji miareczkuje się
Jony OH- postałe w wyniku reakcji miareczkuje się
pehametrycznie roztworem HCl.
pehametrycznie roztworem HCl.
Kulometr alkacymetryczny jest bardzo czuły – pozwala na
Kulometr alkacymetryczny jest bardzo czuły – pozwala na
pomiary ładunku rzędu 1 C.
pomiary ładunku rzędu 1 C.
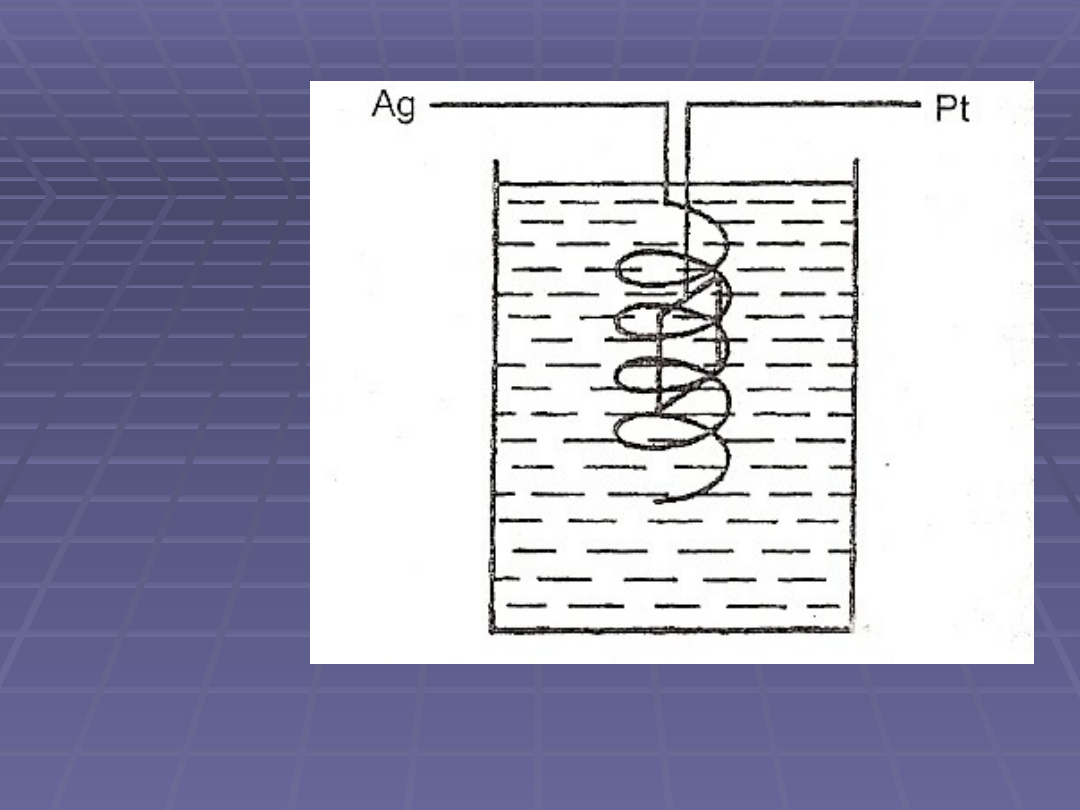
schemat
schemat
kulometru
kulometru
alkacymetrycznego
alkacymetrycznego

KULOMETRY KOLORYMETRYCZNE
KULOMETRY KOLORYMETRYCZNE
Zasada działania opiera się na zmianie barwy roztworu wskutek
Zasada działania opiera się na zmianie barwy roztworu wskutek
przebiegającej reakcji elektrodowej
przebiegającej reakcji elektrodowej
Jako naczynie kulorymetryczne stosuje się kuwetę szklaną lub kwarcową
Jako naczynie kulorymetryczne stosuje się kuwetę szklaną lub kwarcową
Elektroda pracująca jest spirlnym drutem obracanym przez silnik
Elektroda pracująca jest spirlnym drutem obracanym przez silnik
elektryczny
elektryczny
Stosuje się zewnętrzną elektrodę pomocniczą, połączoną z roztworem za
Stosuje się zewnętrzną elektrodę pomocniczą, połączoną z roztworem za
pomocą mostka elektrolitycznego
pomocą mostka elektrolitycznego
Najlepsze wyniki uzyskuje się z zastosowaniem :
Najlepsze wyniki uzyskuje się z zastosowaniem :
-
Redukcji jonu manganianowego (VII) na katodzie platynowej
Redukcji jonu manganianowego (VII) na katodzie platynowej
(zakres 0,1 - 3 C)
(zakres 0,1 - 3 C)
-
Utlenienia anody miedzianej do niebieskiego kompleksu
Utlenienia anody miedzianej do niebieskiego kompleksu
trietanoloaminowego ( zakres 1 – 10 C)
trietanoloaminowego ( zakres 1 – 10 C)
-
Zmiany barwy wskażników alkacymetrycznych w wyniku wytwarzania
Zmiany barwy wskażników alkacymetrycznych w wyniku wytwarzania
jonów OH- na platynowej katodzie lub jonu wodorowego na platynowej
jonów OH- na platynowej katodzie lub jonu wodorowego na platynowej
anodzie zakres 0,01 – 1 C
anodzie zakres 0,01 – 1 C
KULOMETRY
KULOMETRY
GAZOWE
GAZOWE
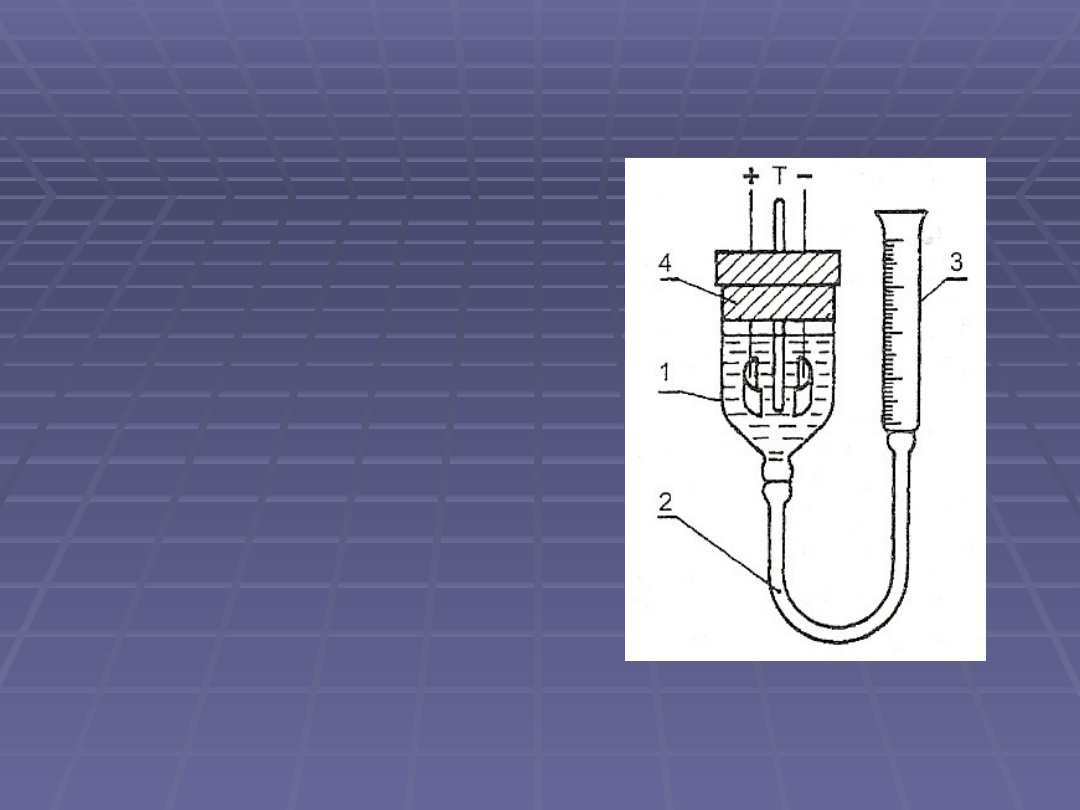
Kulometr tlenowo-wodorowy
Kulometr tlenowo-wodorowy
Ilość elektryczności mierzy się
Ilość elektryczności mierzy się
na podstawie objętości gazu
na podstawie objętości gazu
wydzielonego podczas
wydzielonego podczas
elektrolizy
elektrolizy
Elektrody są wykonane z
Elektrody są wykonane z
platyny i zanurzone w roztworze
platyny i zanurzone w roztworze
K
K
2
2
SO
SO
4
4
, Na
, Na
2
2
SO
SO
4
4
, KOH lub NaOH
, KOH lub NaOH
Podczas przepływu prądu na
Podczas przepływu prądu na
elektrodach wydzielają się
elektrodach wydzielają się
odpowiednie gazy: na anodzie
odpowiednie gazy: na anodzie
tlen, na katodzie wodór
tlen, na katodzie wodór
Na podstawie objętości tlenu i
Na podstawie objętości tlenu i
wodoru (lub tylko wodoru)
wodoru (lub tylko wodoru)
przeliczonych na warunki
przeliczonych na warunki
normalne oblicza się ilość
normalne oblicza się ilość
ładunku jaka przepłynęła przez
ładunku jaka przepłynęła przez
kulometr
kulometr
1 – naczyńko elektrolityczne
1 – naczyńko elektrolityczne
2 – rurka gumowa
2 – rurka gumowa
3 – biureta
3 – biureta
4 - korek
4 - korek

METODY KULOMETRYCZNE
METODY KULOMETRYCZNE
Kulometria amperostatyczna –
Kulometria amperostatyczna –
stałe
stałe
natężenie prądu
natężenie prądu
Kulometria potencjostatyczna
Kulometria potencjostatyczna
– stały
– stały
potencjał elektrody
potencjał elektrody

Kulometria
Kulometria
potencjostatyczna
potencjostatyczna
Natężenie prądu maleje wykładniczo w zależności od czasu wg
Natężenie prądu maleje wykładniczo w zależności od czasu wg
równania:
równania:
,
,
gdzie: I
gdzie: I
0
0
– początkowe natężenie prądu
– początkowe natężenie prądu
I
I
t
t
– natężenie prądu po czasie t
– natężenie prądu po czasie t
k – stała
k – stała
Natężenie prądu dąży asymptotycznie do zera, tak, że nie można
Natężenie prądu dąży asymptotycznie do zera, tak, że nie można
określić czasu, po którym możnaby stwierdzić, że reakcja przebiegła
określić czasu, po którym możnaby stwierdzić, że reakcja przebiegła
do końca
do końca
Stosunek I
Stosunek I
t
t
/I
/I
0
0
równa się stosunkowi stężenia c
równa się stosunkowi stężenia c
t
t
, które powstało po
, które powstało po
czasie t, do początkowego stężenia c
czasie t, do początkowego stężenia c
0
0
, dlatego można przerwać
, dlatego można przerwać
elektrolizę w chwili, gdy stosunek I
elektrolizę w chwili, gdy stosunek I
t
t
/I
/I
0
0
zmaleje do wartości
zmaleje do wartości
odpowiadającej żądanemu stopniowi całkowitego przebiegu reakcji
odpowiadającej żądanemu stopniowi całkowitego przebiegu reakcji
Na całkowity przebieg reakcji wskazuje spadek natężenia prądu
Na całkowity przebieg reakcji wskazuje spadek natężenia prądu
praktycznie do zera
praktycznie do zera
W metodzie potencjostatycznej mierzy się
W metodzie potencjostatycznej mierzy się
prąd
prąd
płynący między
płynący między
elektrodą badaną a przeciwelektrodą przy wymuszonym, stałym i
elektrodą badaną a przeciwelektrodą przy wymuszonym, stałym i
znanym potencjale elektrody badanej względem elektrody odniesienia
znanym potencjale elektrody badanej względem elektrody odniesienia

Metoda ta, przy starannym postępowaniu, prowadzi do bardzo
Metoda ta, przy starannym postępowaniu, prowadzi do bardzo
dokładnych wyników również w w roztworach rozcieńczonych.
dokładnych wyników również w w roztworach rozcieńczonych.
Można nią również oznaczać kilka substancji w tym samym
Można nią również oznaczać kilka substancji w tym samym
roztworze, w przypadku gdy przez odpowiedni dobór stałego
roztworze, w przypadku gdy przez odpowiedni dobór stałego
napięcia można uniknąć współwytrącania składników. W pewnych
napięcia można uniknąć współwytrącania składników. W pewnych
przypadkach można wydzielić razem dwie substancje, zważyć i
przypadkach można wydzielić razem dwie substancje, zważyć i
równocześnie oznaczyć ilość zużytej elektryczności.
równocześnie oznaczyć ilość zużytej elektryczności.
Reakcję redoks jaka przebiega na elektrodzie w sposób odwracalny
Reakcję redoks jaka przebiega na elektrodzie w sposób odwracalny
można przedstawić sumarycznym równaniem:
można przedstawić sumarycznym równaniem:
Składają się na nią dwa procesy :
Składają się na nią dwa procesy :
-
redukcja
redukcja
-
utlenianie
utlenianie
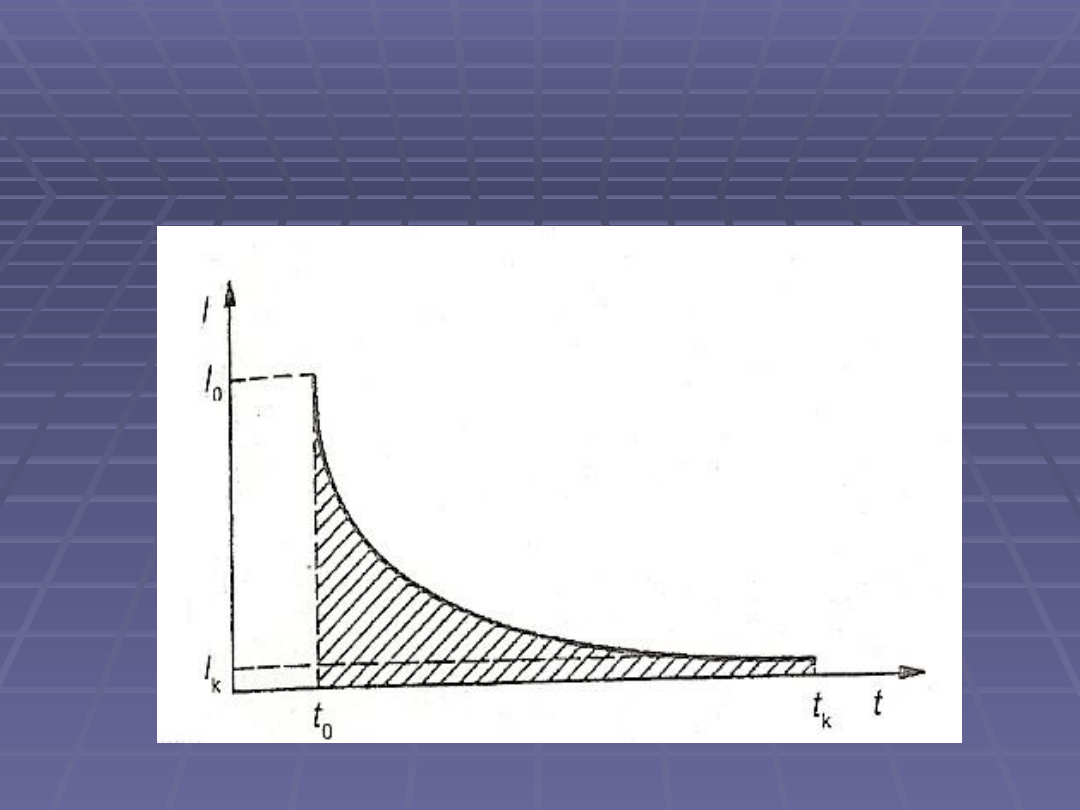
Krzywa zależności prądu od czasu w
Krzywa zależności prądu od czasu w
kulometrii potencjostatycznej
kulometrii potencjostatycznej
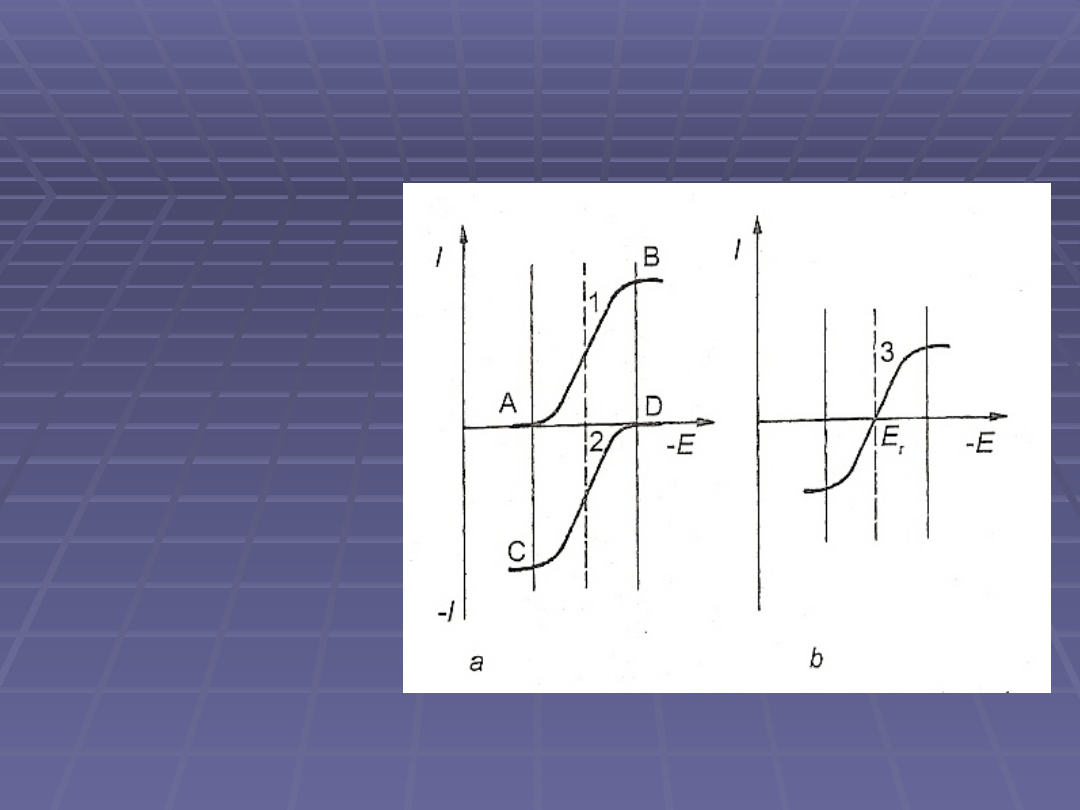
Zależności natężenia prądu od napięcia
Zależności natężenia prądu od napięcia
dla potencjostatycznych metod
dla potencjostatycznych metod
kulometrycznych
kulometrycznych
1 –
1 –
krzywa dla formy
krzywa dla formy
utlenionej
utlenionej
2 – krzywa dla formy
2 – krzywa dla formy
zredukowanej
zredukowanej
3 – krzywa dla układu
3 – krzywa dla układu
zawierającego formę
zawierającego formę
utlenioną i
utlenioną i
zredukowaną
zredukowaną
(Przecina ona oś
(Przecina ona oś
potencjału w punkcie
potencjału w punkcie
Er odpowiadającym
Er odpowiadającym
potencjałowi
potencjałowi
równowagi reakcji
równowagi reakcji
elektrodowej)
elektrodowej)

Kulometria
Kulometria
amperostatyczna
amperostatyczna
Roztwór analizowanej substancji jest poddawany elektrolizie przy stałym
Roztwór analizowanej substancji jest poddawany elektrolizie przy stałym
natężeniu prądu
natężeniu prądu
Zakończenie reakcji w roztworze, a więc konieczność przerwania obwodu
Zakończenie reakcji w roztworze, a więc konieczność przerwania obwodu
elektrycznego określane zostaje za pomocą różnych wskażników
elektrycznego określane zostaje za pomocą różnych wskażników
Obliczenie ilości substancji, która przereagowała wykonuje się na
Obliczenie ilości substancji, która przereagowała wykonuje się na
podstawie wskazań kulometru połączonego szeregowo z naczyńkiem
podstawie wskazań kulometru połączonego szeregowo z naczyńkiem
elektrolitycznym
elektrolitycznym
Pomiar ładunku jest łatwiejszy i bardziej dokładny, gdy utrzymuje się
Pomiar ładunku jest łatwiejszy i bardziej dokładny, gdy utrzymuje się
stałe natężenie prądu i wyznacza iloczyn
stałe natężenie prądu i wyznacza iloczyn
I
I
x
x
t
t
Dokładność metody zależy wówczas tylko od dokładności pomiaru czasu.
Dokładność metody zależy wówczas tylko od dokładności pomiaru czasu.
Kulometrię amperostatyczną rzadko stosuje się jako bezpośrednią
Kulometrię amperostatyczną rzadko stosuje się jako bezpośrednią
metodę analityczną. Najczęściej jest wykorzystywana w
metodę analityczną. Najczęściej jest wykorzystywana w
miareczkowaniu
miareczkowaniu
kulometrycznym.
kulometrycznym.
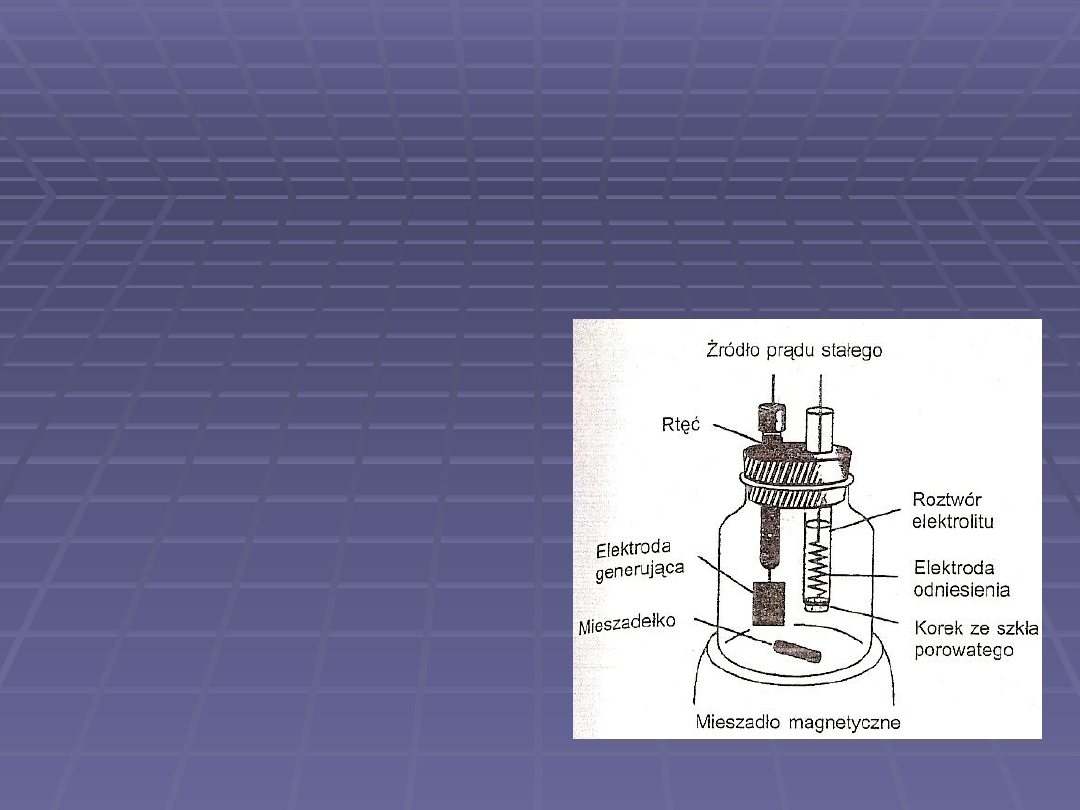
Miareczkowanie
Miareczkowanie
kulometryczne
kulometryczne
Do wytwarzania odczynnika,
Do wytwarzania odczynnika,
który reaguje z oznaczaną
który reaguje z oznaczaną
substancją stosuje się elektrolizę
substancją stosuje się elektrolizę
Podstawowym wymaganiem
Podstawowym wymaganiem
jest, aby reakcja zaszła ze 100-
jest, aby reakcja zaszła ze 100-
procentową wydajnością
procentową wydajnością
prądową oraz aby odczynnik
prądową oraz aby odczynnik
miareczkujący reagował
miareczkujący reagował
stechiometrycznie i w miarę
stechiometrycznie i w miarę
możliwości szybko z oznaczaną
możliwości szybko z oznaczaną
substancją
substancją
Odczynnik miareczkujący można
Odczynnik miareczkujący można
wytwarzać bezpośrednio w
wytwarzać bezpośrednio w
badanym roztworze lub w
badanym roztworze lub w
oddzielnym naczyniu, z którego
oddzielnym naczyniu, z którego
nieprzerwanie dopływa do
nieprzerwanie dopływa do
badanego roztworu
badanego roztworu
Najczęściej stosowane
Najczęściej stosowane
naczyńka do miareczkowania
naczyńka do miareczkowania
kulometrycznego
kulometrycznego
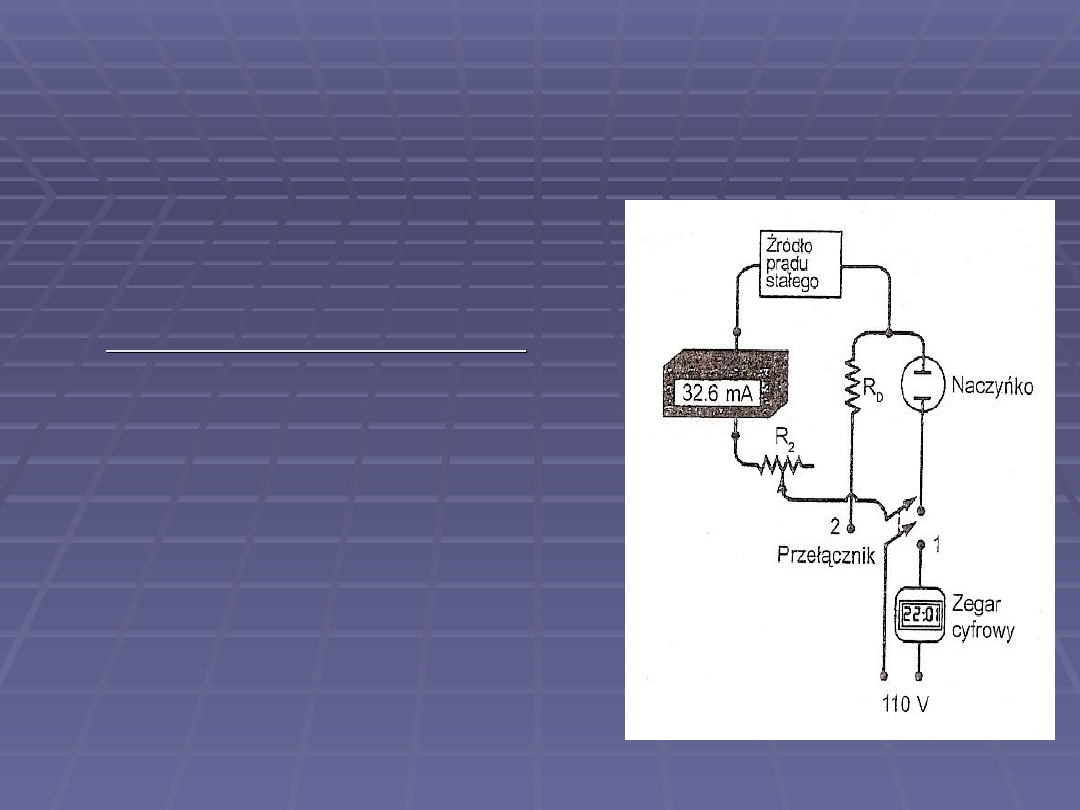
Oprócz naczyń do miareczkowania
Oprócz naczyń do miareczkowania
ważne są żródło prądu stałego( zwykle
ważne są żródło prądu stałego( zwykle
układy baterii połączonych szeregowo z
układy baterii połączonych szeregowo z
regulowanym oporem) oraz urządzenie
regulowanym oporem) oraz urządzenie
do mierzenia natężenia prądu,
do mierzenia natężenia prądu,
określenia punktu równoważnikowego i
określenia punktu równoważnikowego i
pomiaru czasu miareczkowania
pomiaru czasu miareczkowania
Najprostszym sposobem wyznaczania
Najprostszym sposobem wyznaczania
punktu końcowego miareczkowania
punktu końcowego miareczkowania
jest
jest
wizualna obserwacja z zastosowaniem
wizualna obserwacja z zastosowaniem
wskazników lub pomiar fotometryczny,
wskazników lub pomiar fotometryczny,
potencjometryczny lub
potencjometryczny lub
amperometryczny
amperometryczny
Czas miareczkowania mierzy się za
Czas miareczkowania mierzy się za
pomocą zegara, który uruchamia się za
pomocą zegara, który uruchamia się za
pomocą włącznika, który stosuje się
pomocą włącznika, który stosuje się
również do otwierania i zamykania
również do otwierania i zamykania
obwodu elektrolizy
obwodu elektrolizy
Gdy nie jest wymagana duża
Gdy nie jest wymagana duża
dokładność – pomiar natężenia prądu
dokładność – pomiar natężenia prądu
uzyskuje się za pomocą amperomierza,
uzyskuje się za pomocą amperomierza,
natomiast gdy wymagana jest
natomiast gdy wymagana jest
dokładność większa niż 0,5% konieczny
dokładność większa niż 0,5% konieczny
jest pomiar za pomocą układu
jest pomiar za pomocą układu
potencjometrycznego
potencjometrycznego
Schemat aparatu do
Schemat aparatu do
miareczkowania
miareczkowania
kulometrycznego
kulometrycznego
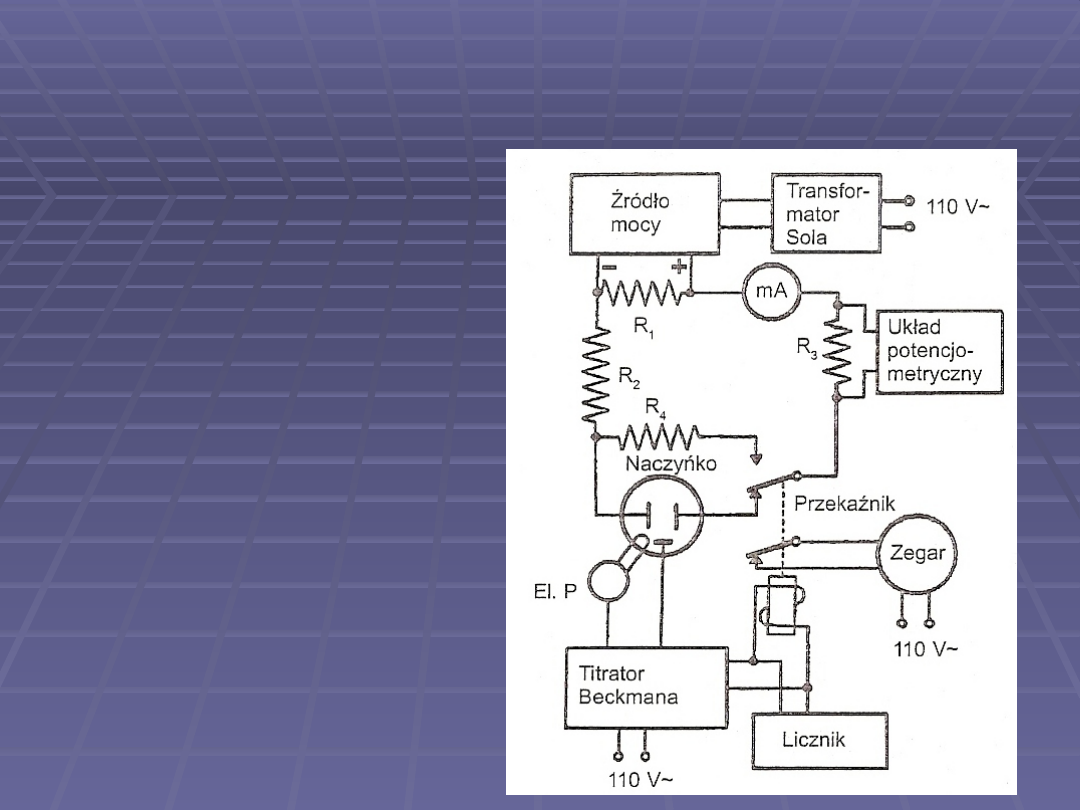
Metodę miareczkowania kulometrycznego można
Metodę miareczkowania kulometrycznego można
zautomatyzować ( podobnie jak w
zautomatyzować ( podobnie jak w
miareczkowaniu potencjometrycznym).
miareczkowaniu potencjometrycznym).
Schemat automatycznego
Schemat automatycznego
tiratora kulometrycznego
tiratora kulometrycznego

Wady i zalety metody
Wady i zalety metody
Zalety:
Zalety:
- miareczkowanie roztworów barwnych,
- miareczkowanie roztworów barwnych,
nieklarownych
nieklarownych
- precyzyjne dozowanie titranta
- precyzyjne dozowanie titranta
(
(
Titrant
Titrant
- w
- w
miareczkowaniu jest to roztwór dodawany z biurety w postaci
miareczkowaniu jest to roztwór dodawany z biurety w postaci
kropel do roztworu analizowanej substancji (analit).
kropel do roztworu analizowanej substancji (analit).
- możliwość miareczkowania titrantami nietrwałymi
- możliwość miareczkowania titrantami nietrwałymi
- wysoka dokładność i precyzja
- wysoka dokładność i precyzja
- łatwość automatyzacji
- łatwość automatyzacji
Wady:
Wady:
- konieczność wyznaczania punktu końcowego
- konieczność wyznaczania punktu końcowego
miareczkowania
miareczkowania

Wady i zalety metody
Wady i zalety metody
Zalety:
Zalety:
- miareczkowanie roztworów barwnych,
- miareczkowanie roztworów barwnych,
nieklarownych
nieklarownych
- precyzyjne dozowanie titranta
- precyzyjne dozowanie titranta
(
(
Titrant
Titrant
- w
- w
miareczkowaniu jest to roztwór dodawany z biurety w postaci
miareczkowaniu jest to roztwór dodawany z biurety w postaci
kropel do roztworu analizowanej substancji (analit).
kropel do roztworu analizowanej substancji (analit).
- możliwość miareczkowania titrantami nietrwałymi
- możliwość miareczkowania titrantami nietrwałymi
- wysoka dokładność i precyzja
- wysoka dokładność i precyzja
- łatwość automatyzacji
- łatwość automatyzacji
Wady:
Wady:
- konieczność wyznaczania punktu końcowego
- konieczność wyznaczania punktu końcowego
miareczkowania
miareczkowania

Dziękujemy za uwagę
Dziękujemy za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
Wyszukiwarka
Podobne podstrony:
Kulometria
miareczkowanie kulometryczne
Analiza Instrumentalna - kulometria, poprawiona strona
Analiza Instrumentalna, kulometria 6-Kulometria
Miareczkowanie kulometryczne, ANALITYKA CHEMICZNA- UŁ, Rok II, Nieseparacyjne, Laboratorium, Sprawoz
Analiza Instrumentalna kulometria Sprawozdanie 6 I
kulometria 5 8
Zeszyt kulometria
Kulometria,sprw 1
kulometria 9 12
kulometria 13 14
kulometria 1 4
więcej podobnych podstron