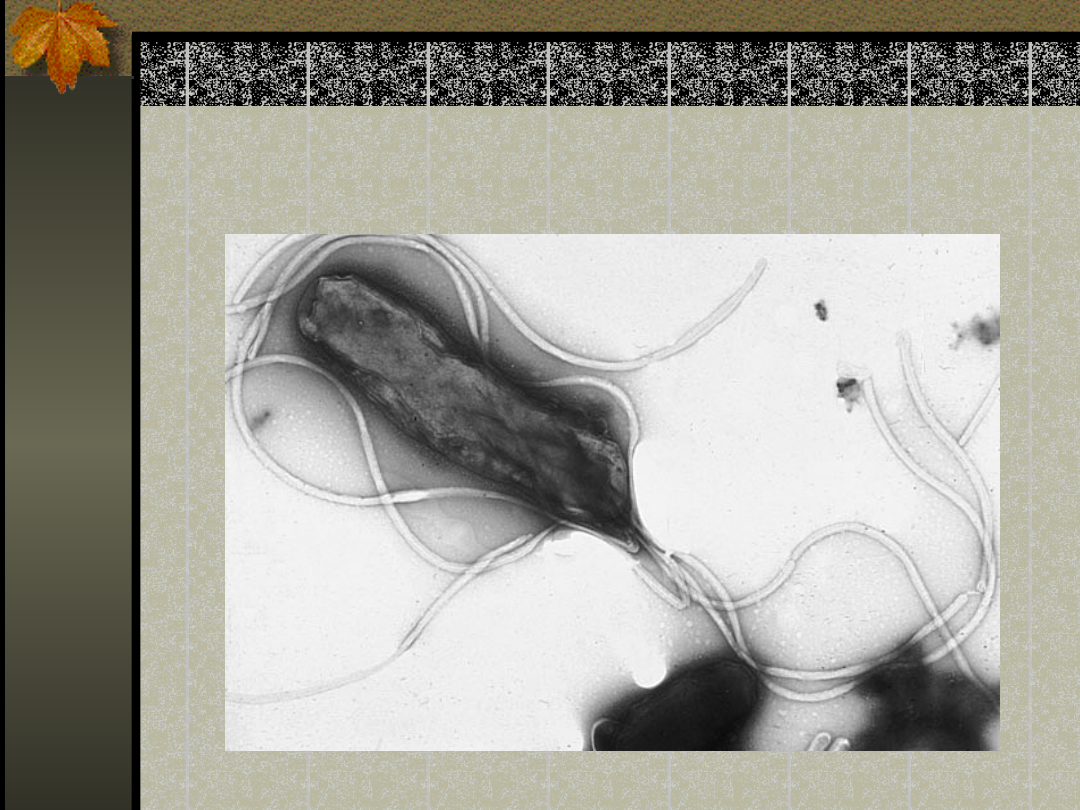
Helicobacter pylori

Budowa
Gram-ujemna bakteria o helikalnym kształcie,
zaliczana do pałeczek.
Wielkości od 0,5 do 3 μm, zakończona kilkoma
(2 do 6) pojedynczymi rzęskami (witkami).
Bakteria ta osiedla się tylko na powierzchni
błony śluzowej wyściełającej żołądek lub na
błonie śluzowej dwunastnicy lub przełyku.
Jej obecność zwiększa ryzyko wystąpienia
zapalenia żołądka typu B i wrzodów trawiennych
Odpowiada w przybliżeniu za 80% przypadków
choroby wrzodowej żołądka i 90% przypadków
choroby wrzodowej dwunastnicy.

Bakteria bytuje w warunkach niewielkiej
dostępności tlenu
Wykazuje dużą ruchliwość w śluzie
pokrywającym błony. Ruchliwość ta wynika z
faktu posiadania kilku pojedynczych witek.
Helicobacter pylori wytwarza hydrogenazę,
dzięki której może pozyskiwać energię z
utlenienia cząsteczkowego wodoru (H
2
)
wytwarzanego przez inne bakterie jelitowe.
Może wytwarzać biofilmy, a także przechodzić
z formy spiralnej do postaci ziarenkowca, co
prawdopodobnie ułatwia jej przeżycie i
rozprzestrzenianie się.
Helicobacter pylori jest raczej wrażliwy na
warunki zewnętrzne, potrafi jednak przeżywać
w kwaśnym środowisku.
Budowa – c.d.

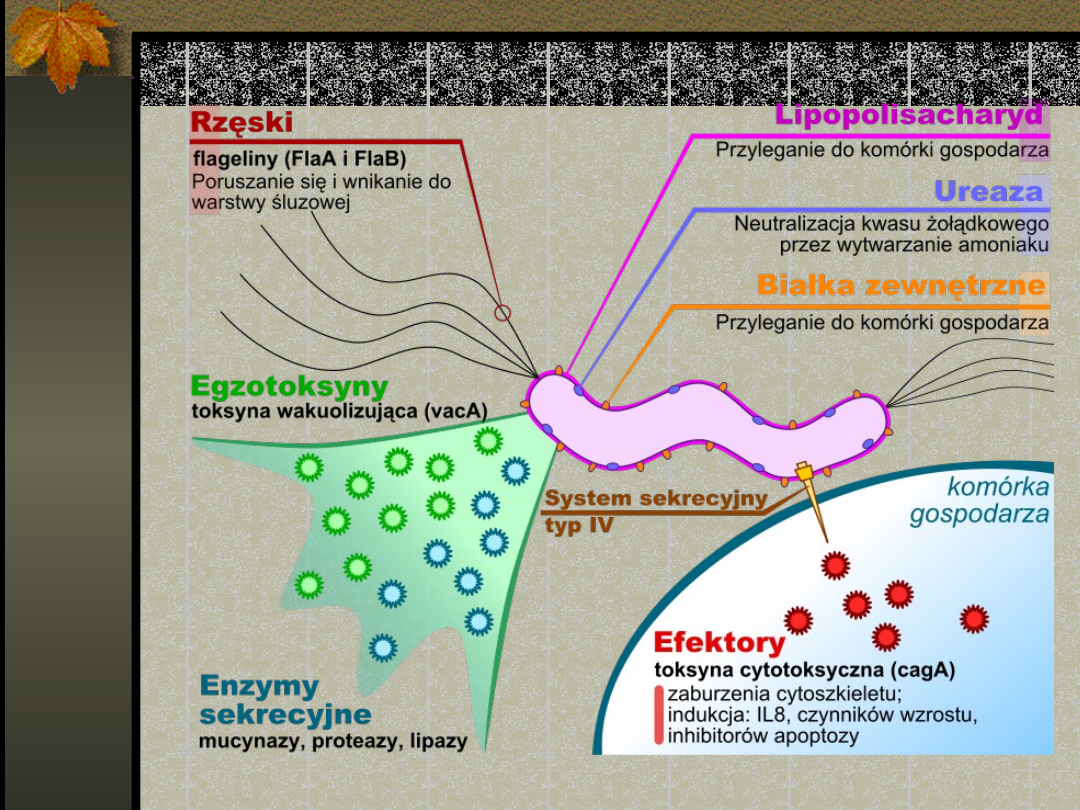
Wytwarzanie w dużych ilościach ureazy –
enzymu katalizującego rozkład mocznika do
amoniaku i dwutlenku węgla. Amoniak powoduje
neutralizację kwasu solnego obecnego w soku
żołądkowym i podwyższenie pH w bezpośrednim
otoczeniu bakterii.
Rzęski – sześć rozmieszczonych biegunowo rzęsek
umożliwia poruszanie się i wnikanie pod warstwę
śluzową. Warstwa śluzowa chroni komórki żołądka
przed działaniem kwasu solnego; w ten sposób
bakteria korzysta z ochronnego systemu
gospodarza. Dzięki nim bakteria jest bardzo
ruchliwa.
Czynniki wirulencji
to cechy bakterii pozwalające przełamywać
naturalne systemy obronne organizmu. Treść
żołądkowa ma odczyn kwaśny i posiada niskie pH (2–
4) które jest zabójcze dla większości bakterii.
Cechy umożliwiające przeżycie w tym wybitnie
trudnym środowisku to:

Czynniki wirulencji –
c.d.
Pompa wypompowująca jony H
+
z komórek.
Blokowanie tych pomp przez niektóre leki (np.
omeprazol) podnosi pH w żołądku, który jest
środowiskiem życia drobnoustroju.
Układ antyoksydacyjny mający na celu neutralizację
wolnych rodników wytwarzanych przez neutrofile.
Adhezyny odpowiadające za przyleganie do nabłonka
żołądka.
Cytotoksyny – Toksyna wakuolizująca (vacA) powoduje
w komórkach nabłonkowych zlanie endosomów z
lizosomami i sprzyja tworzeniu ogromnych wakuoli.
Ułatwia ponadto swobodny przepływ mocznika do
światła żołądka. Toksyna cytotoksyczna zaburza
cytoszkielet komórek nabłonkowych i zwiększa adhezję
bakterii do tak uszkodzonego nabłonka.

Drogi zakażenia
Zakażenie bakterią następuje na drodze pokarmowej, najczęściej we
wczesnym dzieciństwie przed 10 r.ż. i utrzymuje się przez całe życie,
chociaż u części dzieci może dochodzić do samoistnego ustąpienia
zakażenia.
Uważa się, że do transmisji infekcji dochodzi z człowieka na człowieka -
najczęściej matka zakaża dziecko.
Istnieje wiele wątpliwości co do drogi, przez którą najczęściej dochodzi do
zakażenia. Rozważane są:
gastro-oralna,
oralno-oralna
fekalno-oralna.
Często do infekcji może dochodzić w wyniku kontaktu ze śliną
zainfekowanej osoby (picie ze wspólnych butelek, jedzenie ze wspólnego
talerza) lub poprzez jedzenie zanieczyszczonymi rękami.
Kontakt z małą ilością śliny (pocałunek), nie powoduje infekcji.
Istnieje również możliwość przeniesienia zakażenia drogą oralno-analną.
Diagnostyka
Zakażenie można stwierdzić za pomocą metod:
Inwazyjnych -które wymagają pobrania materiału do badania przy
pomocy endoskopu
- gastroskopia z biopsją - pobrany materiał może zostać poddany testowi
na wytwarzanie ureazy, ocenie histopatologicznej lub założeniu hodowli
- string test - polega na połknięciu kapsułki zawieszonej na sznurku i
trzymaniu jej w przewodzie pokarmowym przez kilka godzin. Po
wyjęciu dokonuje się posiewu na podłoże selektywne
Nieinwazyjnych - w których pobieranym materiałem jest krew, ślina,
kał lub wydychane powietrze.
- Testy na obecność przeciwciał - Badanie to polega na wykrywaniu w
surowicy krwi przeciwciał klasy IgG przeciwko Helicobater pylori.
- Testy na wytwarzanie ureazy - Technika ta polega na podaniu do wypicia
pacjentowi roztworu mocznika znakowanego radioaktywnym izotopem,
który jest rozkładany przez obecne w błonie śluzowej żołądka bakterie
H. pylori (test oddechowy, test moczu)
- Badanie metodą PCR - Technika ta polega na próbie namnożenia
specyficznego dla bakterii fragmentu DNA, kodującego toksyny – cagA
i vacA (zazwyczaj badana jest próbka kału)
Poszczególne badania różnią się od siebie czułością, czasem
potrzebnym na otrzymaniem wyniku oraz stopniem uciążliwości dla
badanego.
Żaden test nie daje 100% pewności rozpoznania zakażenia.

Leczenie
Celem leczenia jest całkowite usunięcie
bakterii zagnieżdżonej w błonie śluzowej
żołądka, co określa się mianem
ERADYKACJI
.
W większości przypadków osób z
bezobjawowym zakażeniem Helicobacter
pylori nie jest ona rutynowo stosowana.
W wypadku choroby wrzodowej eradykacja
zapobiega nawrotom choroby i w istocie
prowadzi do trwałego wyleczenia chorego.

Eradykacja
Eradykacja H. pylori jest obecnie najskuteczniejszym
sposobem leczenia i zapobiegania nawrotom
choroby wrzodowej żołądka i dwunastnicy.
Jako jedyna terapia może prowadzić do trwałego
wyleczenia.
Leczenie można jednak wdrożyć tylko w przypadku
zakażenia potwierdzonego jedną z
rekomendowanych metod diagnostycznych.
Skutecznie przeprowadzone leczenie w praktyce
prowadzi do eradykacji bakterii aż w 90%
przypadków.

Farmakoterapia
Od początku zauważono, że standardowa
terapia jednym antybiotykiem nie zapewniała
sukcesu terapeutycznego
Po raz pierwszy terapię potrójną zastosował w
1987 gastroenterolog z Sydney Thomas
Borody. Pierwszy konsensus (1997) stosowano
kombinację trzech leków przez 7 dni:
inhibitor pompy protonowej,
metronidazol/tynidazol
amoksycylinę.

Farmakoterapia – c.d.
Drugi konsensus –(1999) wprowadził dodatkowo
klarytromycynę (obok amoksycyliny i
metronidazolu, stosowanych zamiennie), która
wykazywała najwyższą skuteczność wśród
makrolidów.
Według trzeciego konsensusu z Maastricht
(2000) powinno stosować się:
Leki pierwszego rzutu
(terapia potrójna): sole
bizmutu/inhibitor oraz klarytromycyna i
metronidazol/amoksycylina.
Leki drugiego rzutu
(terapia poczwórna): sole
bizmutu, inhibitor, metronidazol, tetracyklina.
Jeśli bizmut jest niedostępny, używa się
wyłącznie trzech ostatnich leków.

Farmakologia – c.d.
Terapia potrójna jest skuteczna w
około 80–90% przypadków, o ile
jest prowadzona wśród szczepów o
wysokiej wrażliwości na
antybiotyki (brak wcześniejszych
prób eradykacji). Eradykacja przy
zastosowaniu placebo wynosi 0%.

1. antybiotyki i
chemioterapeutyki
amoksycylina
klarytromycyna
tetracykliny
fluorochinolony
metronidazol
tynidazol
furazolidon
2. inhibitory pompy
protonowej
omeprazol
pantoprazol
lanzoprazol
rabeprazol
Esomeprazol
W terapii najczęściej
stosowane są:

Antybiotyki i
chemioterapeutyki
Amoksycylina – półsyntetyczny antybiotyk -
laktamowy o działaniu bakteriobójczym. Blokuje
aktywność transpeptydaz
Klarytromycyna – antybiotyk, którego mechanizm
działania polega na hamowaniu syntezy białka w
komórce bakterii.
Tetracykliny − grupa antybiotyków o szerokim
spektrum działania. Ich działanie polega na hamowaniu
biosyntezy białka (poprzez blokowanie podjednostki
30S rybosomów bakteryjnych) i zaburzaniu procesów
energetycznych w komórkach bakteryjnych.
Chinolony - grupa chemioterapeutyków o działaniu
bakteriobójczym. Ich działanie przeciwbakteryjne
zależy od inhibicji gyrazy DNA(bakteryjna
topoizomeraza II i IV). Podawane są doustnie, dobrze
wchłaniają się z przewodu pokarmowego.

Antybiotyki i
chemioterapeutyki –c.d.
Metronidazol – należy do chemioterapeutyków.
Wykazuje działanie pierwotniakobójcze oraz
bakteriobójcze wobec drobnoustrojów
beztlenowych.
Tinidazol– pochodna 5-nitroimidazolu, jest lekiem
przeciwpasożytniczym i przeciwbakteryjnym. Lek
uszkadza strukturę DNA lub hamuje jego syntezę w
komórkach drobnoustrojów.
Furazolidon, furazolidone – lek przeciwbakteryjny,
pochodna nitrofuranu. Działa bakteriobójczo wobec
wielu szczepów bakterii, w tym na bakterie
najczęściej wywołujące zakażenia jelitowe.

Inhibitory pompy
protonowej
IPP (inhibitory pompy protonowej) to grupa leków
stosowanych w terapii schorzeń górnego odcinka
przewodu pokarmowego.
Opracowanie IPP stanowiło przełom w leczeniu chorób
przebiegających z nadmiernym wydzielaniem kwasu
solnego w żołądku.
Leki te najczęściej znajdują zastosowanie w leczeniu:
zapalenia błony śluzowej żołądka i dwunastnicy,
choroby wrzodowej żołądka i dwunastnicy powstałej
poprzez eradykację Helicobacter pylori,
choroby refluksowej przełyku,
dyspepsji czynnościowej,
krwawienia z górnego odcinka przewodu pokarmowego,
zespołu Zollingera-Ellisona.

Inhibitory pompy
protonowej – działanie
Działanie inhibitorów pompy protonowej polega na
zahamowaniu enzymu - ATPazy zależnej od jonu
potasowego i wodorowego (H+/K+ ATPaza), znajdującego się
w komórkach okładzinowych błony śluzowej żołądka, który jest
niezbędny do wytworzenia kwasu solnego.
Efektem działania IPP jest zmniejszenie wydzielania kwasu
żołądkowego i podwyższenie pH w żołądku. Charakteryzują się
one dużą skutecznością i stosunkowo niewielką ilością działań
niepożądanych. Są silniejsze od innych leków stosowanych w
celu hamowania wydzielania kwasu żołądkowego.
Inhibitory pompy protonowej stosowane są monoterapii oraz w
połączeniu z substancjami należącymi do innych grup.
Mogą być stosowane długotrwale. Zażywa się je zwykle rano, pół
godziny przed śniadaniem. Jest to związane z tym, że po
długotrwałym głodzeniu ilość enzymu ATPazy jest największa, co
umożliwia najlepsze jej zablokowanie. IPP mogą być także stosowane
dwa razy dziennie - wtedy druga dawka leku powinna być zażyta
przed wieczornym posiłkiem.

Problemem leczenia jest reinfekcja, a także wzrastająca
oporność bakterii na standardowo stosowane leki.
Szczepy w Polsce są najczęściej oporne na metronidazol
lub klarytromycynę.
Leczenie powinno trwać 1–2 tygodnie. Skuteczność jest
większa, jeżeli czas trwania terapii trwa 10 dni (zamiast
popularnego tygodnia).
Szanse udanej eradykacji maleją po dwóch nieudanych
próbach, świadczy to o obecności lekoopornych
szczepów na stosowane antybiotyki i chemioterapeutyki.
Aktualnie rozważa się możliwość wprowadzenia jako
standardu terapii poczwórnej lub terapii sekwencyjnej –
powoduje zmniejszającą się wrażliwość bakterii na
stosowane obecnie terapeutyki.
Terapia sekwencyjna polega na stosowaniu inhibitora
pompy protonowej i amoksycyliny w dawce 1,0 przez 5
dni i następnie przez kolejne 5 dni inhibitora pompy
protonowej, klarytromycyny i tynidazolu (oba w dawce 2
x 500 mg).
Problemy w leczeniu

Niepożądane działanie
inhibitorów:
Inhibitory pompy protonowej zwykle nie
powodują działań niepożądanych.
Najczęstszymi objawami są: nudności,
bole brzucha, zaparcie, nadmierne
wytwarzanie gazów jelitowych i biegunka.
Odnotowano także podostre miopatie,
bóle stawów, bóle głowy i wysypkę skórną.
Inhibitory pompy protonowej mogą
wchodzić w interakcje z warfaryną
(ezomeprazol,lanzoprazol, omeprazol i
rabeprazol), diazepamem (ezomeprazol i
omeprazol) oraz cyklosporyną (omeprazol
i rabeprazol).

Leczenie choroby
wrzodowej
Podstawowym celem leczenia jest zagojenie się
niszy wrzodowej oraz zapobieganie nawrotom
choroby.
Na obecny stan wiedzy cele te w pełni realizuje
prawidłowo przeprowadzana farmakoterapia,
wspierana ewentualnie profilaktyką i leczeniem
dietetycznym eliminującym czynniki agresji choroby.
Zaletą tego leczenia jest możliwość przeprowadzenia go
ambulatoryjnie, jedynie z okresową kontrolą lekarską.
Leczenie obejmuje:
Farmakoterapię - oparta jest przede wszystkim na
zwalczaniu zakażenia bakterią Helicobacter pylori -
eradykacja. Przyjęcie do szpitala ma sens jedynie w
celu zdiagnozowania choroby i ewentualnie leczenia jej
powikłań.
Dietę - przestrzeganie zaleceń dietetycznych może
zmniejszać dolegliwości pacjentów i minimalizować
konieczność sięgania po leki doraźne.

Pacjenci z chorobą wrzodową
powinni unikać
następujących produktów:
-
- pikantnych przypraw,
-
- ciężkostrawnych i tłustych potraw,
- smażonych potraw,
- owoców cytrusowych i ich soków,
- kawy,
- mocnej herbaty,
- napojów gazowanych.
Pacjenci powinni dodatkowo unikać produktów, które choć nie
znajdują się w popularnym spisie szkodliwych produktów, wcześniej
powodowały u nich indywidualne dolegliwości.
Pacjenci powinni stosować lekkostrawną dietę, w której dominować
będą chude produkty mięsne. Można spotkać się z zaleceniem
częstego picia mleka. Okazuje się, że ma ono jedynie krótkotrwałe
działanie zmniejszające ból, lecz z czasem pobudza wydzielanie
kwasu solnego.

Leczenie choroby
refluksowej przełyku
W leczeniu choroby refluksowej
przełyku możemy wyróżnić 3
główne kierunki :
niefarmakologiczne
farmakologiczne
zabiegowe

Leczenia
niefarmakologiczne :
osiąganie prawidłowej masy ciała (redukcja nadwagi )
pozycja pionowa tułowia po posiłkach
unikanie pracy w pozycji zgiętej oraz noszenie obcisłej
odzieży
unikanie obfitych posiłków (posiłki skromne, ale często )
spożywanie posiłków 5-6 razy dziennie oraz ostatni posiłek
powyżej 2-3 godzin przed snem
ograniczone spożycie : tłuszczu , kawy , alkoholu (zaleca się
wykluczenie wina i piwa)
wykluczenie z diety: owoców cytrusowych, soków z owoców
cytrusowych, potraw kwaśnych, soków pomidorowych,
ostrych przypraw, warzyw cebulowych, czekolady, kakao,
napojów gazowanych, mięty, słodyczy z alkoholem
zaprzestanie palenia

Dziękujemy za uwagę
Opracowały:
Kamila Perucka
Patrycja Lewandowska
Monika Krupnik
Grupa F2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Helicobacter pylori leczenie?rmakologiczne?RMAKOLOGIA grC2
Dentosept a Helicobacter pylori
Eradykacja Helicobacter pylori
Helicobacter pylori 3
Helicobacter pylori prelekcja
Helicobacter pylori, Ratownictwo medyczne, Ratownictwo
Helicobacter pylori - chorobotwórczość, Mikrobiologia
Zakażenie Helicobacter pylori u dzieci, położnictwo, pielęgniarstwo pediatryczne
Helicobacter pylori
helicobacter pylori
Eradykacja Helicobacter pylori
Helicobacter pylori
Eradykacja Helicobacter pylori
Helicobacter pylori 3
więcej podobnych podstron