
Biotechniki rozrodu
Hodowla zarodków in vitro, ocena
morfologiczna zarodków
Oznaczanie płci zarodków metodą PCR
Zaliczenie przedmiotu

Hodowla zarodków in vitro,
ocena morfologiczna zarodków

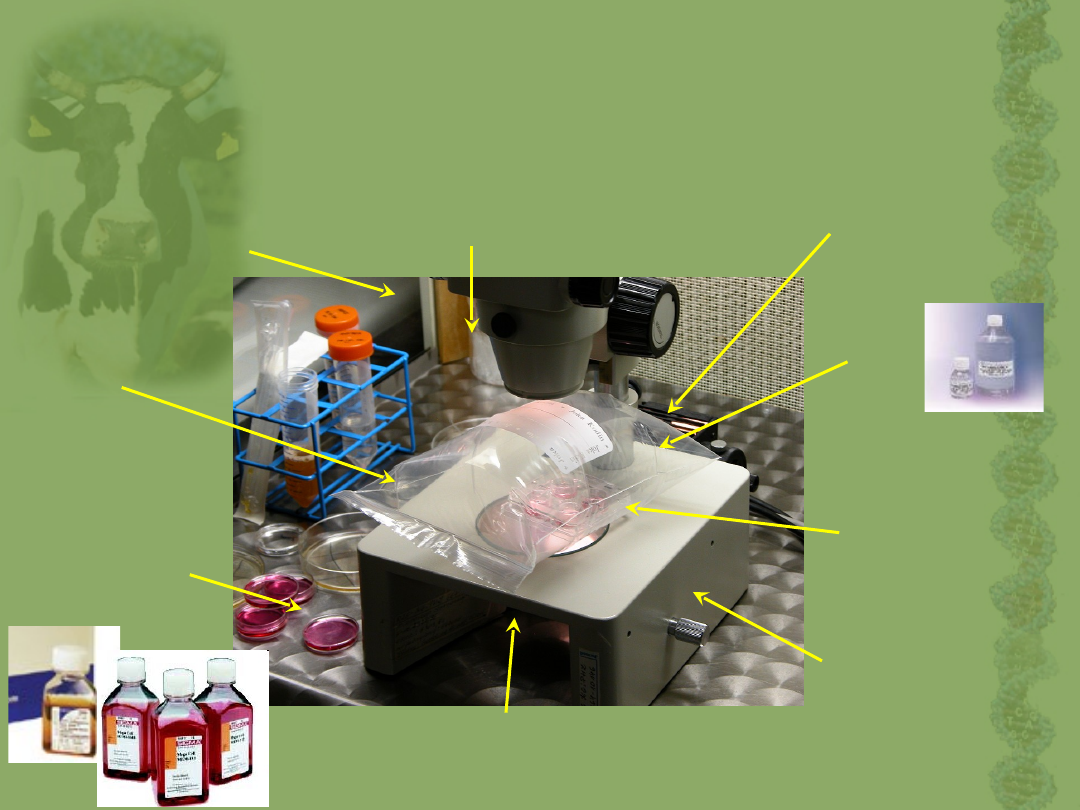
Hodowla zarodków in vitro
Podłoża do hodowli:
SOF,
Komercyjne: G1, G2 (Medicult), Cook
Warunki hodowli:
wilgotność powietrza: 62-70%
Temperatura -38,5 C
1 zarodek /1 ul pożywki
www.gibco.co
www.gibco.co
m
m
Czynniki determinujące
Czynniki determinujące
efektywność IVM/IVF/IVC
efektywność IVM/IVF/IVC
www.sigmaaldrich.c
om
pożywki:
pożywki:
-
skład
skład
(aminokwasy)
(aminokwasy)
-
ekwilibracja,
ekwilibracja,
stałe pH i
stałe pH i
temperatura
temperatura
w kropli
w kropli
mieszanina gazów do
mieszanina gazów do
IVM/IVF/IVC – stały
IVM/IVF/IVC – stały
skład
skład
w inkubatorze
w inkubatorze
płytki
płytki
hodowlane,
hodowlane,
filtry, igły,
filtry, igły,
falkony, tipsy
falkony, tipsy
www.cryobioststem-
imv.com
olej mineralny
olej mineralny
objętości kropli
objętości kropli
hodowlanych,
hodowlanych,
sposób ich
sposób ich
wykonania
wykonania
jakość plemników - efektywność
jakość plemników - efektywność
zapłodnienia, koncentracja,
zapłodnienia, koncentracja,
przygotowanie
przygotowanie
czystość
czystość
powietrza
powietrza
w
w
laboratorium
laboratorium
jakość oocytów
jakość oocytów
częstotliwość wymiany
częstotliwość wymiany
½ kropli hodowlanej
½ kropli hodowlanej

Jakość zarodków - definicja
• Zdolność (potencjał) zarodka do rozwoju
w prawidłowy, żywy organizm – znaczenie
absolutne
• Potencjał zarodka do rozwoju do bardziej
zaawansowanych stadiów rozwoju
(blastocysta – in vitro) oraz zdolność do
implantacji w macicy i dalszego rozwoju
(samodzielny organizm - in vivo)

Podstawowe parametry oceny
zarodków
Stadium rozwoju odpowiadające wiekowi zarodka
(liczba dni od inseminacji)
Liczba przedjądrzy w zygocie (człowiek)
Liczba blastomerów, kolor i proporcje ich wielkości
Stopień degeneracji blastomerów
Stopień kompakcji w stadium moruli
Liczba blastomerów w blastocyscie, prawidłowość
procesu kawitacji
zygota
3PN
morula
(luźne
blastomer
y)

niedojrzały dojrzały
2-bl
3-4-bl
8-16-bl
morula blastocysta
oocyt (-24h) oocyt (0h) 32-36hpi 40-48hpi
56-110hpi
116-
128hpi 140-168hpi
Chronologia rozwoju
przedimplantacyjnego zarodków
bydła (0-7 dzień pi) pi= po
inseminacji
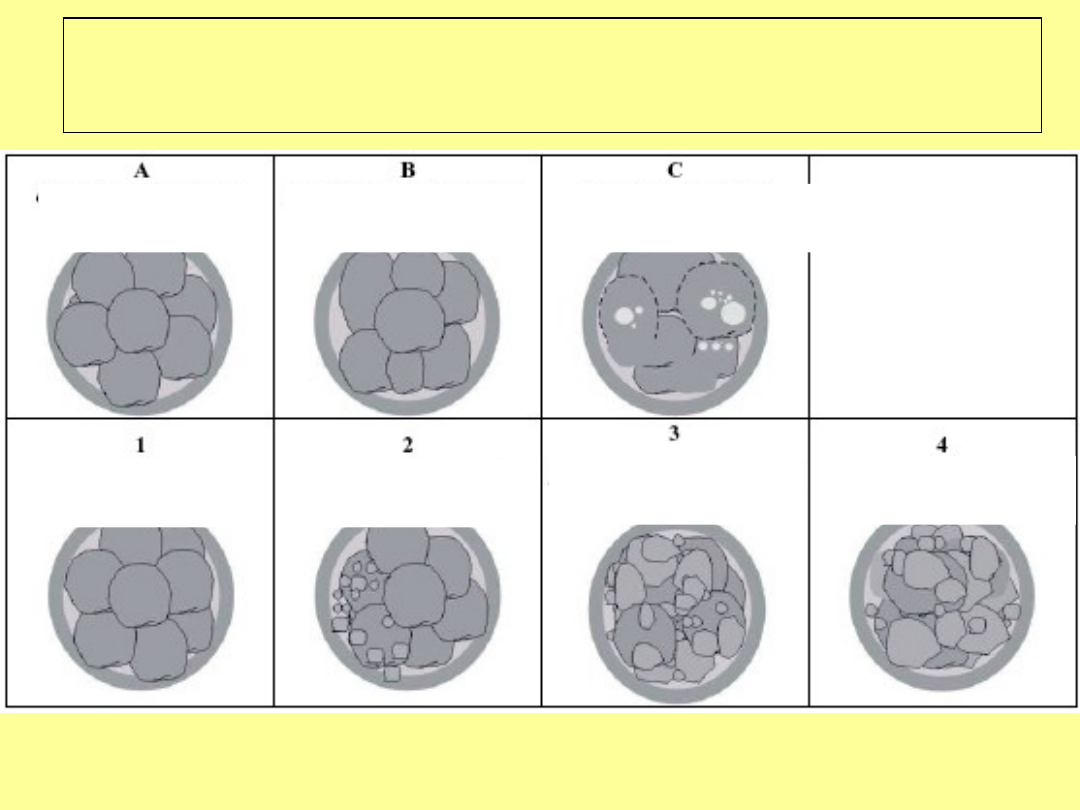
System oceny wczesnych zarodków
człowieka
A - C liczba i wzajemne proporcje wielkości blastomerów
1- 4 stopień fragmentacji blastomerów Bączkowski i wsp. 2004 Reprod
Biol
równe
blastomery
nierówne
blastomery
degeneracja
cytoplazmy
brak
fragmentacji
fragmentacja
<30%
fragmentacja 30-
50%
fragmentacja
>30%

Klasa A1
Klasa C3
Ocena morfologiczna -
przykłady
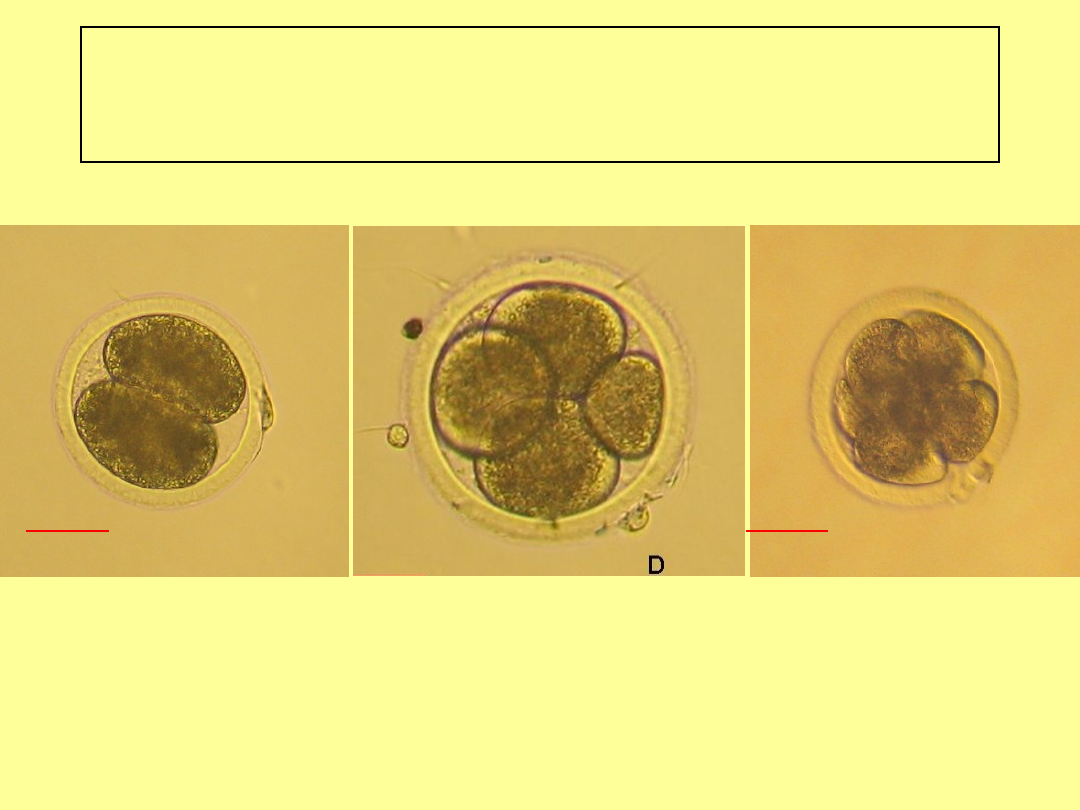
Zarodki wczesne do stadium 8bl
C
50m
E
50m
Stadium 2 kom.
Stadium 4 kom.
Stadium 8 kom.
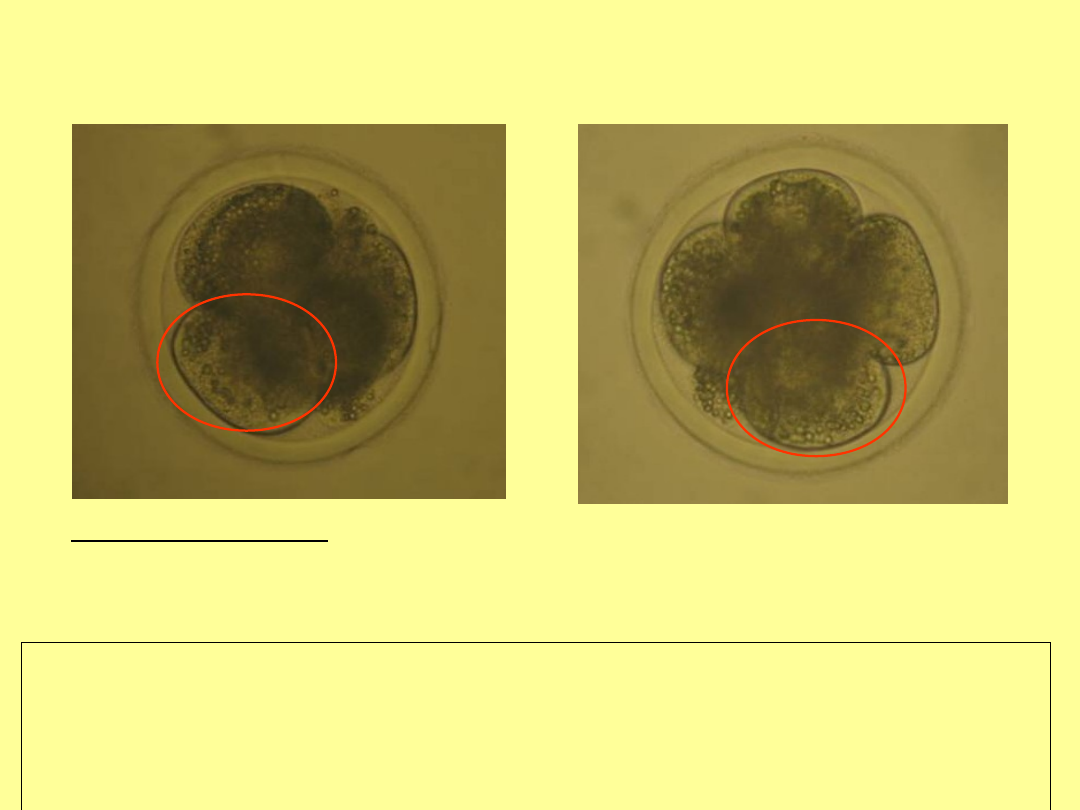
Zarodki hybrydowe bydło domowe x żubr, 3 dzień po inseminacji
(pi)
A) stadium 3-4-blastomerowe
B) stadium 5-6-blastomerowe (
widoczna wakuolizacja
cytoplazmy
)
100µm
A
B
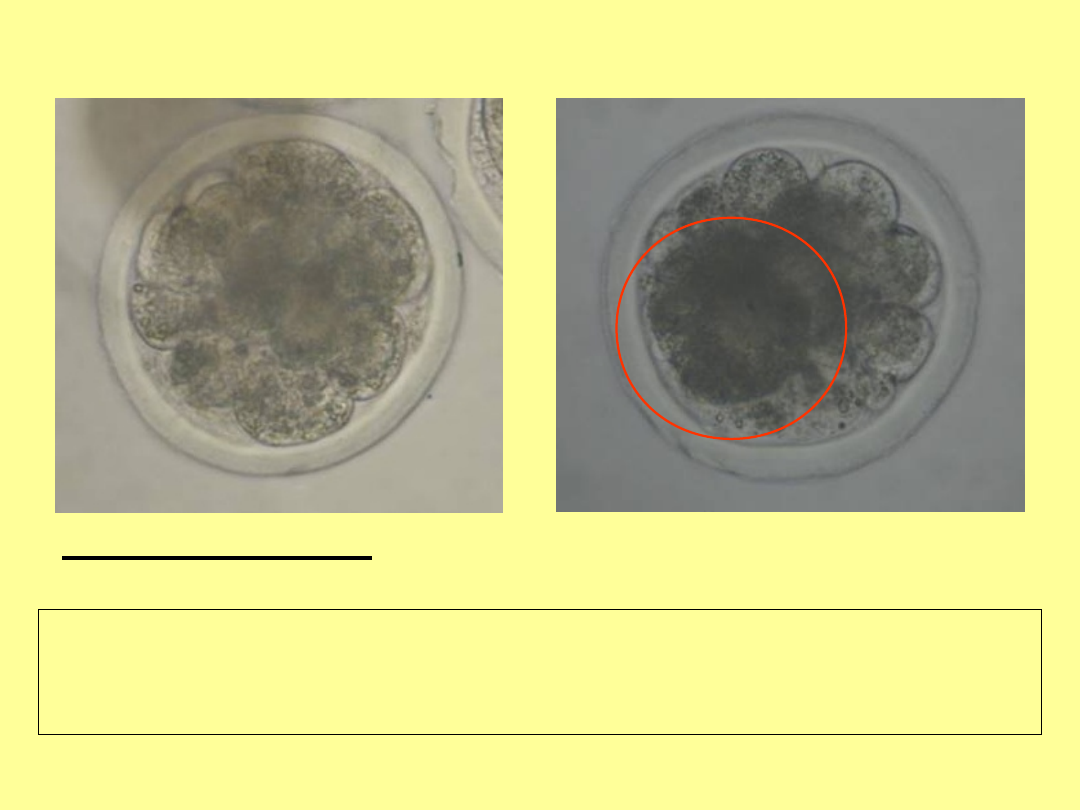
Zarodki hybrydowe bydło x żubr, 5 dzień pi
ok. 15-20 blastomerów, komórki luźno ułożone, brak kompakcji,
blastomer wcześniej zahamowany w rozwoju
100µm
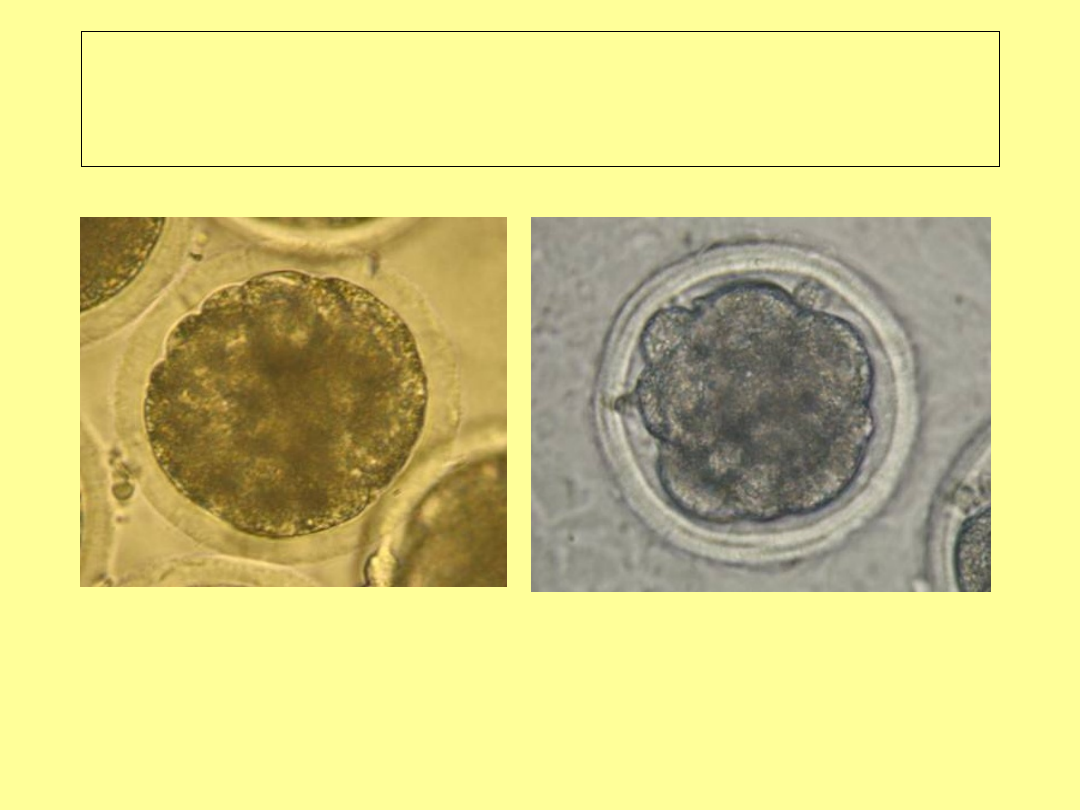
Stadium moruli (5 dzień
pi)
przed kompakcją
w czasie kompakcji
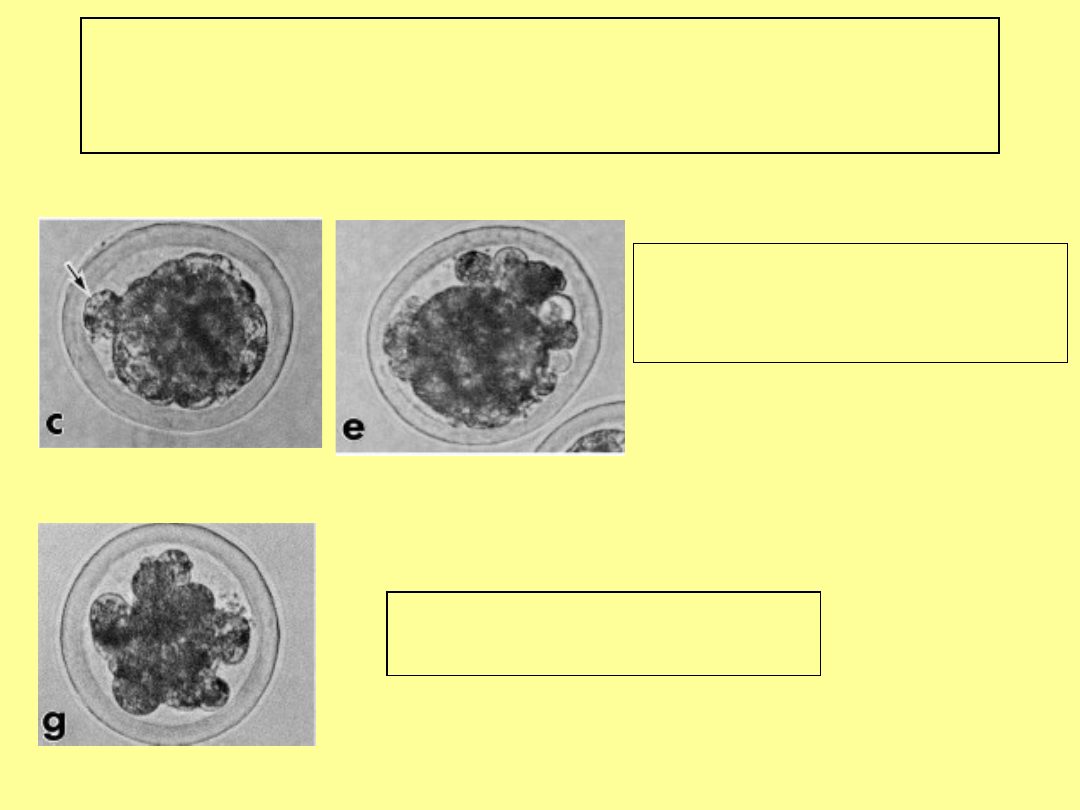
Stadium moruli – zarodki o
obniżonej jakości
niewiele blastomerów
(<16) brak kompakcji
Prawidłowa kompakcja,
luźne blastomery w
przestrzeni okołożółtkowej
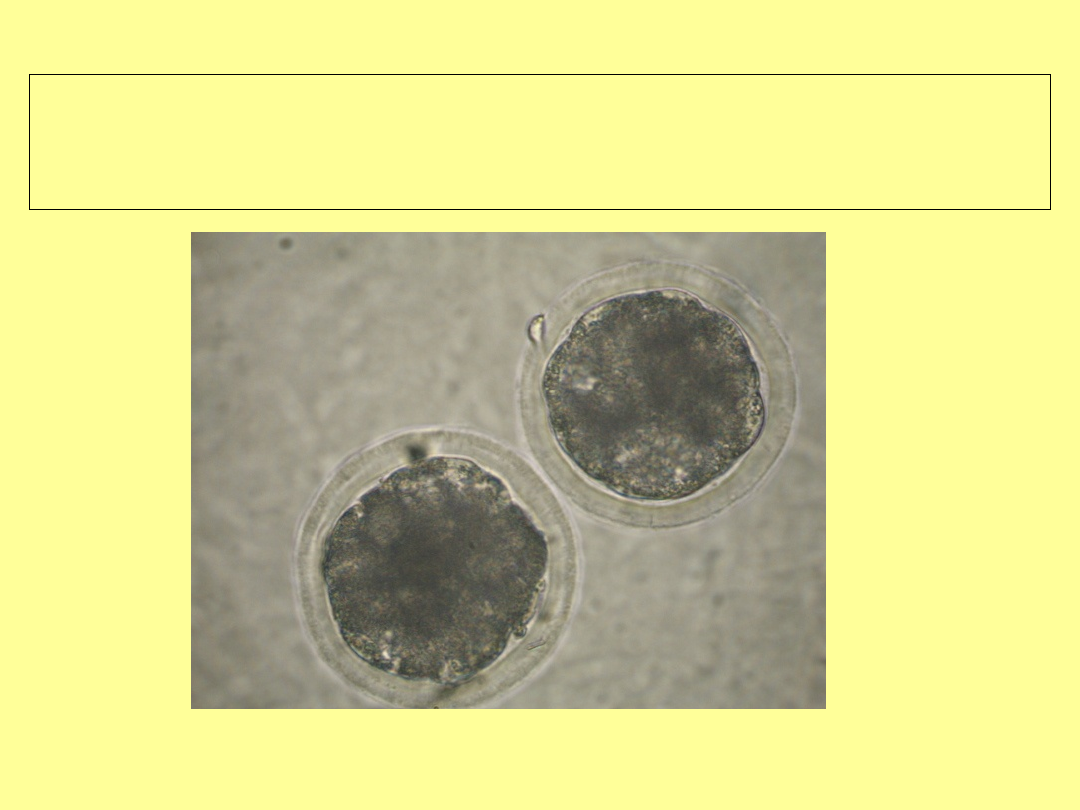
Stadium późnej moruli / wczesnej
blastocysty (
początek formowania jamy –
blastocel)
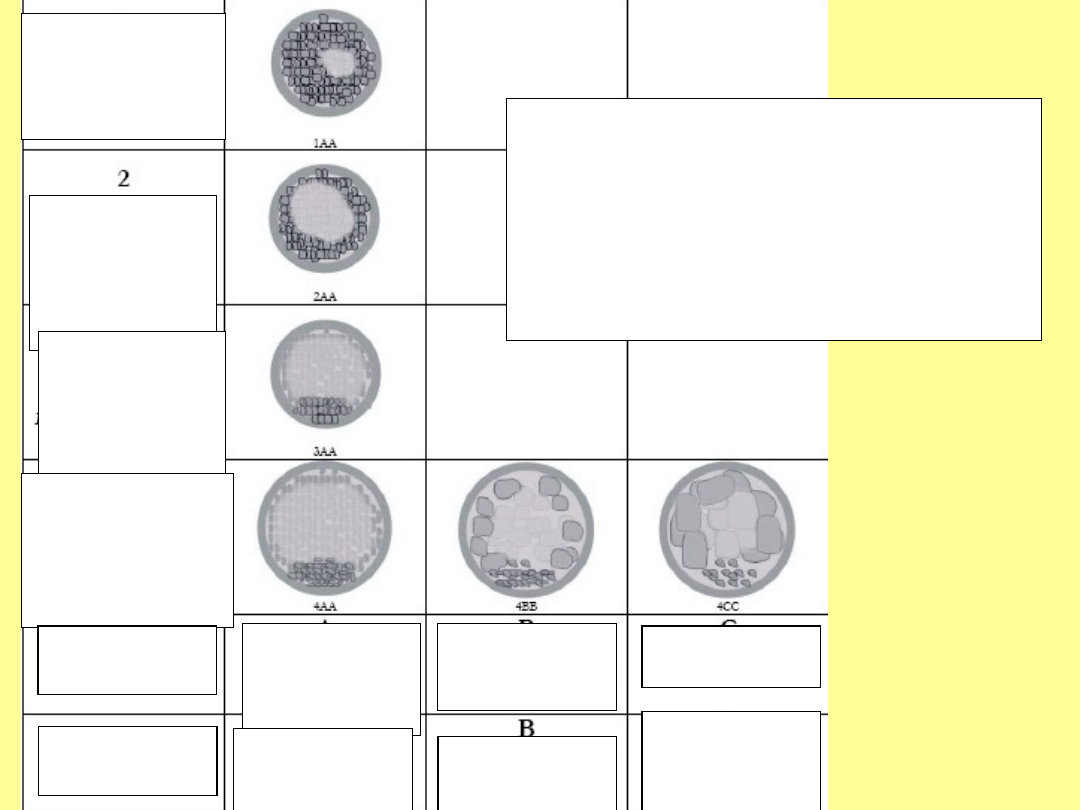
System oceny
morfologii
blastocyst
człowieka
1 wczesna
blastocysta
(jama mniejsza
niż ½ zarodka
2
blastocysta
(jama
większa niż
½ zarodka
3
blastocysta
(jama
wypełnia
zarodek)
4
ekspandujaca
blastocysta
(duży zarodek,
cienka zona)
ICM (węzeł
zarodkowy)
TE
(trofoblast)
A
liczne i
ściśle
upakowane
komórki
B
mniej
komórek luźno
upakowanych
C
niewiele
komórek
A
liczne
komórki w
formie
nabłonka
B
mniej
komórek w
formie luźnego
nabłonka
C
nieliczne luźne
komórki
Stadium wczesnej blastocysty
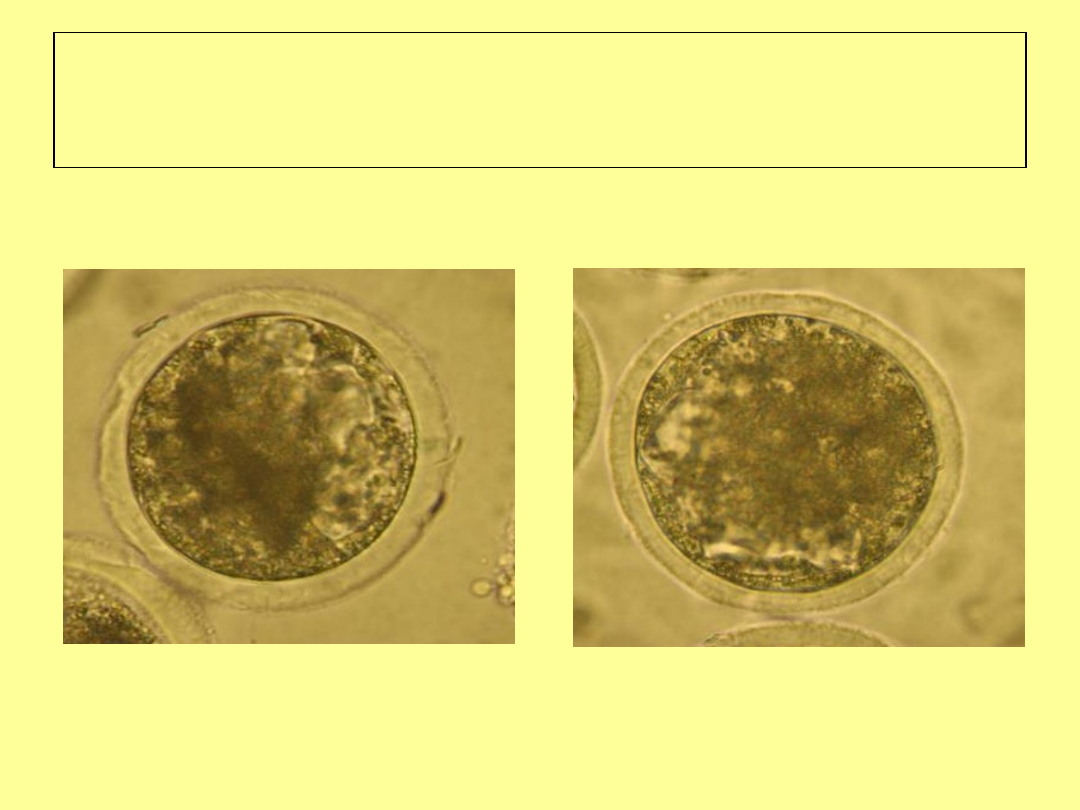
Stadium ekspandującej
blastocysty (dzień 8 pi)
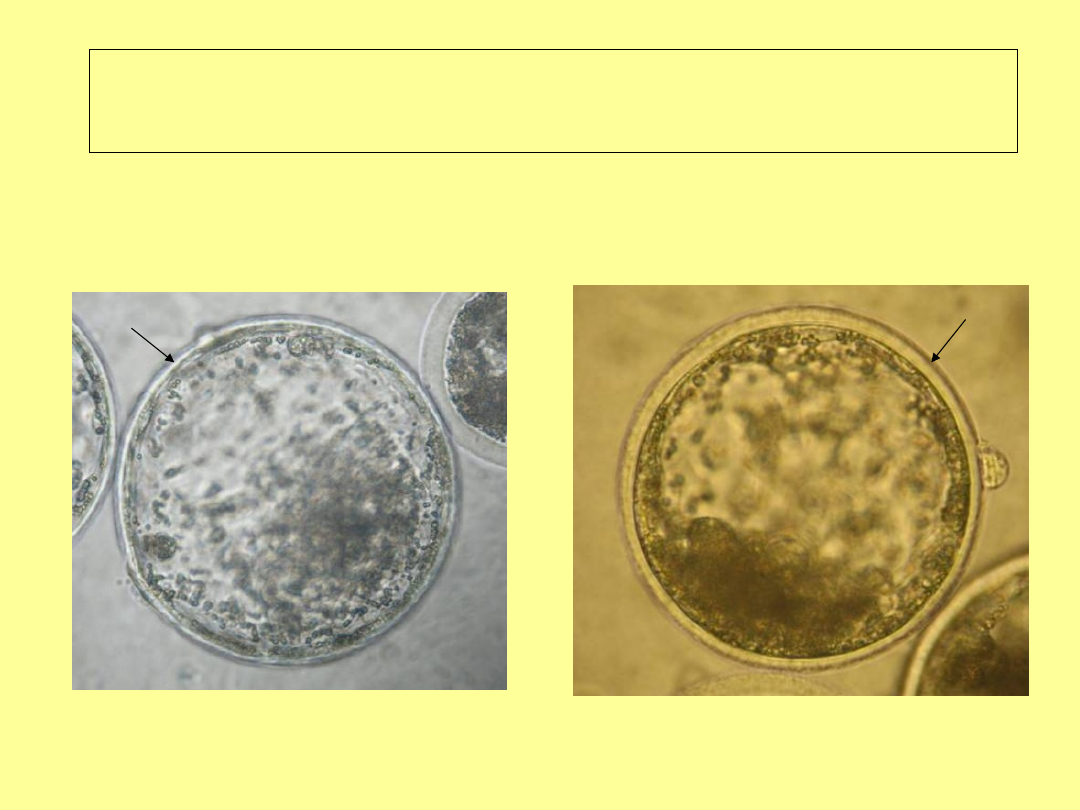
Stadium wylęgającej się
blastocysty
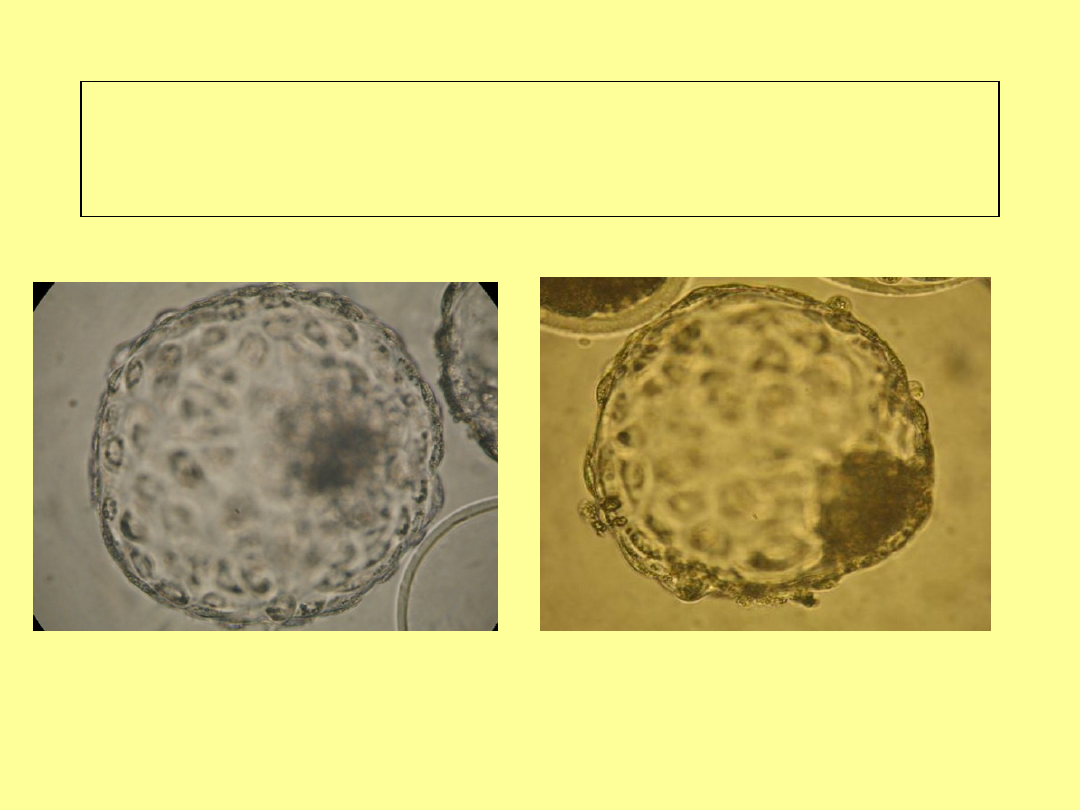
Stadium wylęgłej blastocysty

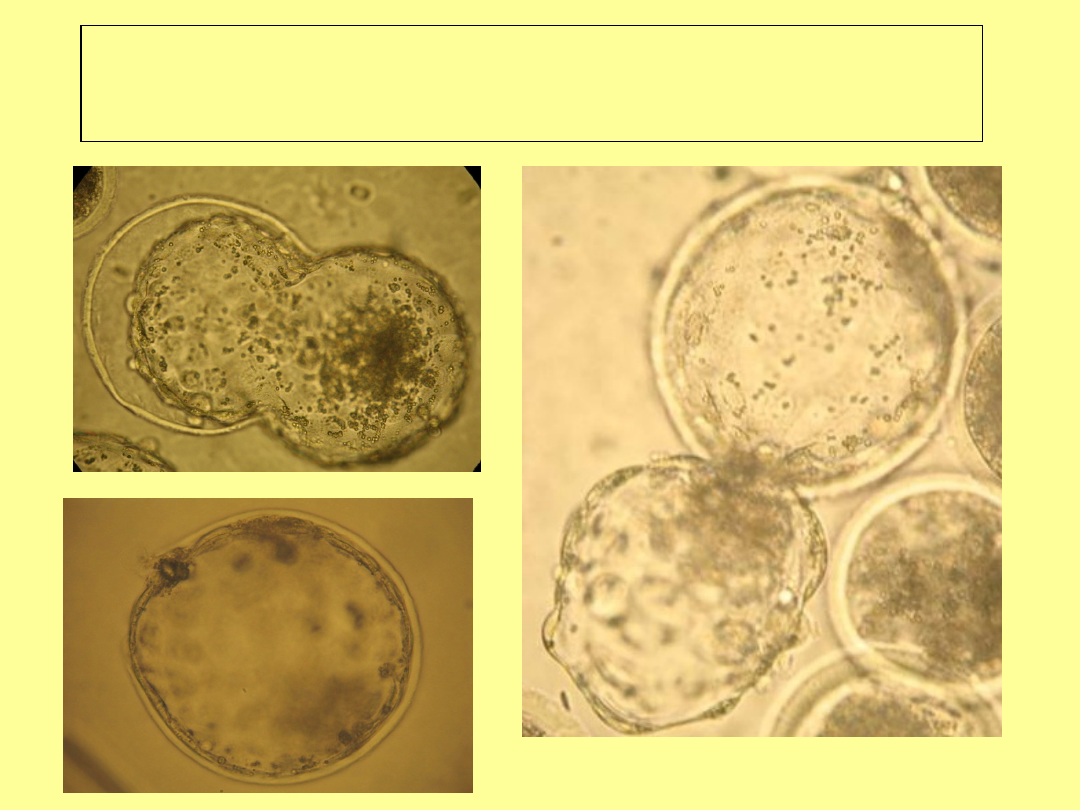
Ocena morfologiczna –
przykłady
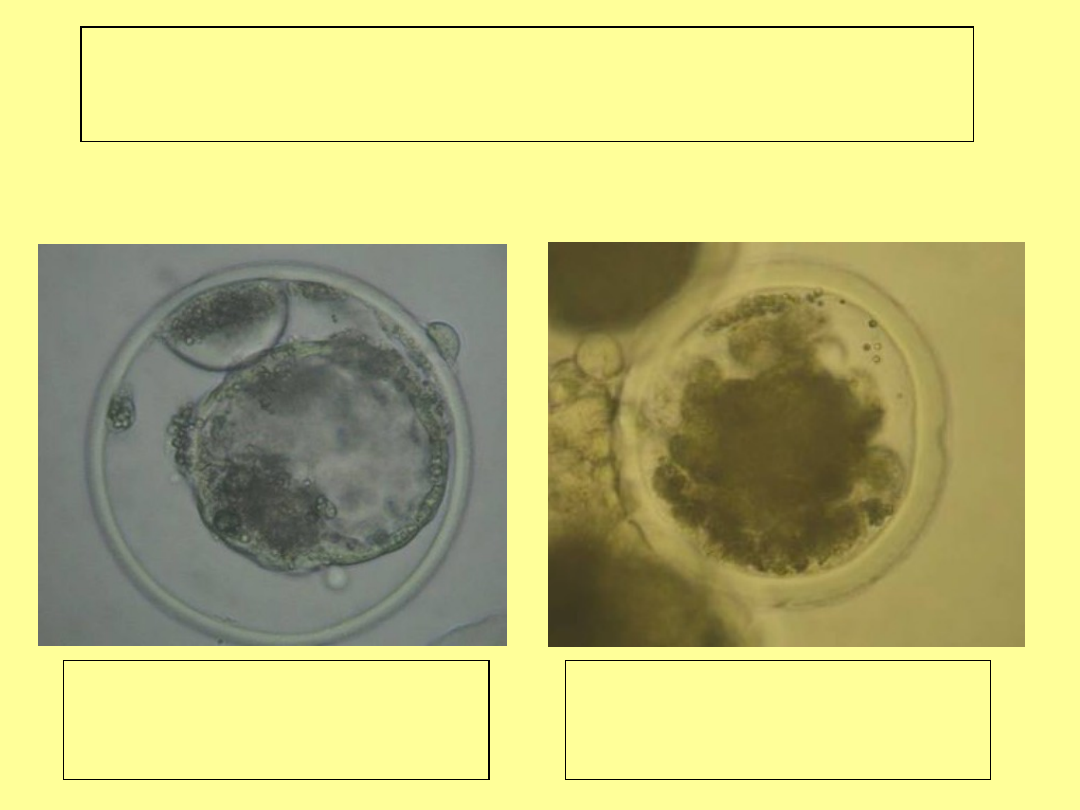
Zarodki nieprawidłowe
obkurczona blastocysta
wewnątrz zp - zaburzenie
wylęgania się
morula – pełna
degeneracja luźnych
blastomerów
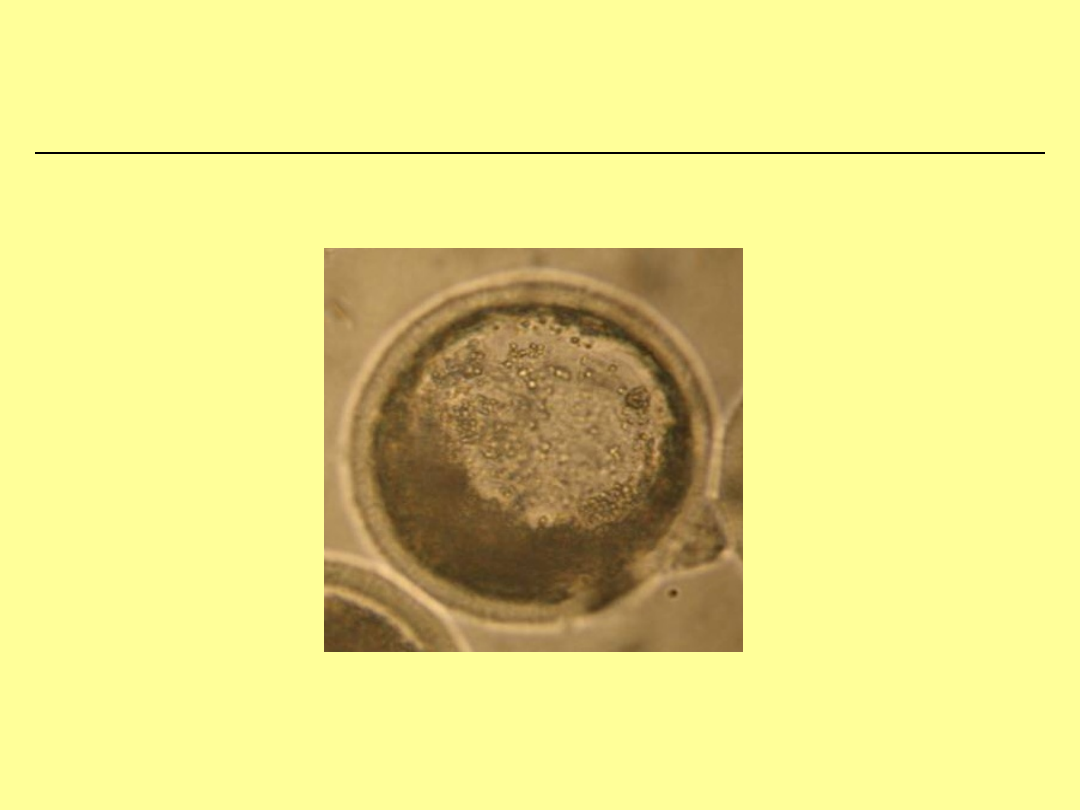
Zdegenerowane oocyty

Jakość zarodków – liczba
blastomerów w
ICM
i
TE
(barwienie
różnicujące – DS)
Komórki
węzła
zarodkoweg
o – ang. ICM
Komórki
trofoblastu
– ang. TE
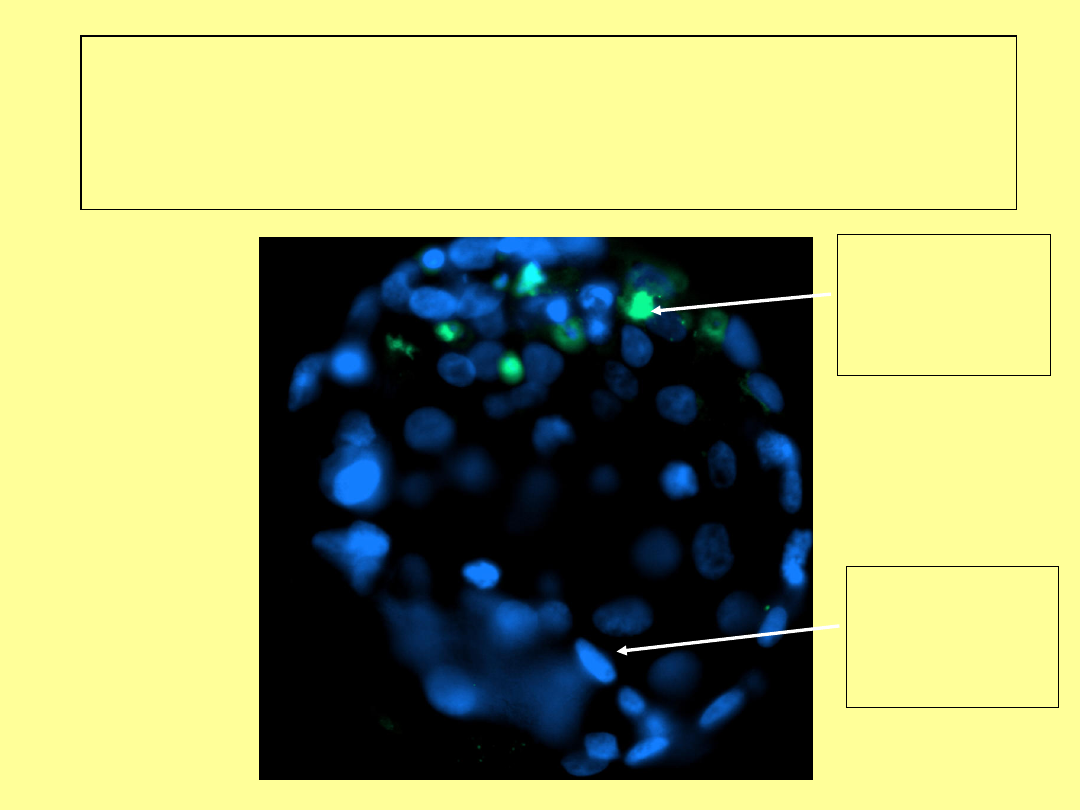
Jakość zarodków – występowanie
apoptotycznych blastomerów
(technika Tunel)
Sygnał
apoptotyczn
y –śmierć
komórki
Wybarwione
jądro
komórkowe
blastomeru

Oznaczanie płci zarodków
metodą PCR
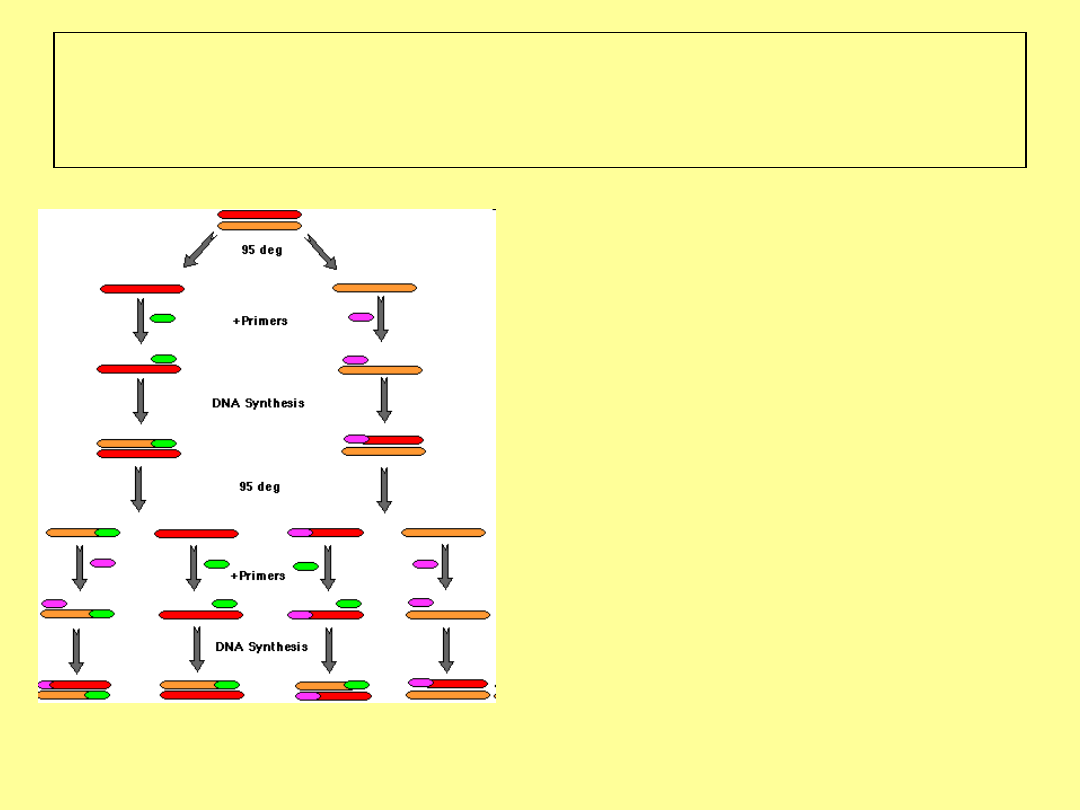
PCR – jedna z technik
molekularnego oznaczania płci
zarodków
Do przeprowadzenia
PCR wymagane
są:
DNA badanego
zarodka
Wolne nukleotydy
Enzym polimeraza
termostabilna Taq
Odpowiedni bufor z
jonami magnezu
Startery dla
badanego
fragmentu DNA

Izolacja DNA z zarodków
Inkubacja komórek zarodka z proteinazą
K
w 37C przez 30 min
zarodek (1 komórka)
Bufor do PCR
Proteinaza K
dNTP
H
2
O
Inaktywacja proteinazy K – 5 min w 95C

Mieszanina reakcyjna PCR
Przygotowanie mieszaniny reakcyjnej
do PCR
Lizat – 5ul
dNTP – 0,5 ul (2mM/ul)
Primer F – 1,5 ul (5uM/ul)
Primer R – 1,5 ul (5uM/ul)
Bufor dla polimerazy – 2,5 ul (10x/ul)
Polimeraza – 0,4ul (5U/ul)
H2O – do 25 ul

Polimorfizm genu
amelogeniny
U człowieka i bydła wykryto gen amelogeniny (AMGL),
który ma swoje locus na obu chromosomach płci X i Y
Na chromosomie Y stwierdzono delecję w sekwencji
tego genu – efektem tego jest polimorfizm
U samca gen AMGL występuje na chromosomach X i Y
w dwóch różnych formach, u samicy obecna jest tylko
sekwencja charakterystyczna dla chromosomu X

Warunki amplifikacji DNA dla
starterów AMGL – temperatura
przyłączenia
Sekwencja AMGL:
5’ CAG CCA AAC CTC CCT CTG C
3’ CCC GCT TGG TCT TGT CTG TTG C
Wzór na ustalenie teoretycznej temperatury
przyłączania starterów
:
Tp = 4(G + C) + 2(A + T)
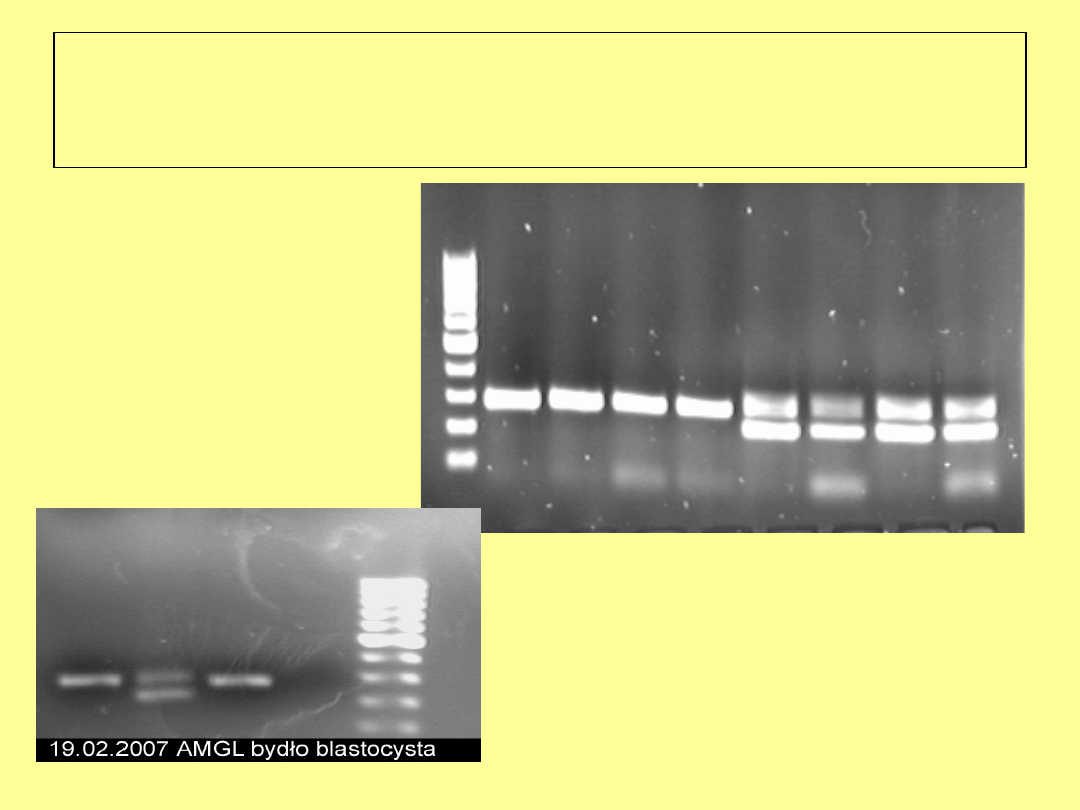
Polimorfizm genu
amelogeniny
Osobniki referencyjne
Osobniki referencyjne
samica
samica
samiec
samiec
Produkt PCR z ½ blastocysty
Produkt PCR z ½ blastocysty

Program reakcji PCR dla
AMGL
Denaturacja wstępna DNA – 97ºC 1 min
Denaturacja DNA – 97ºC 3 min
Przyłączanie starterów – 1 min
Elongacja nici DNA - 72 ºC 1 min
Elongacja końcowa - 72 ºC 10 min
Liczba
cykli 40
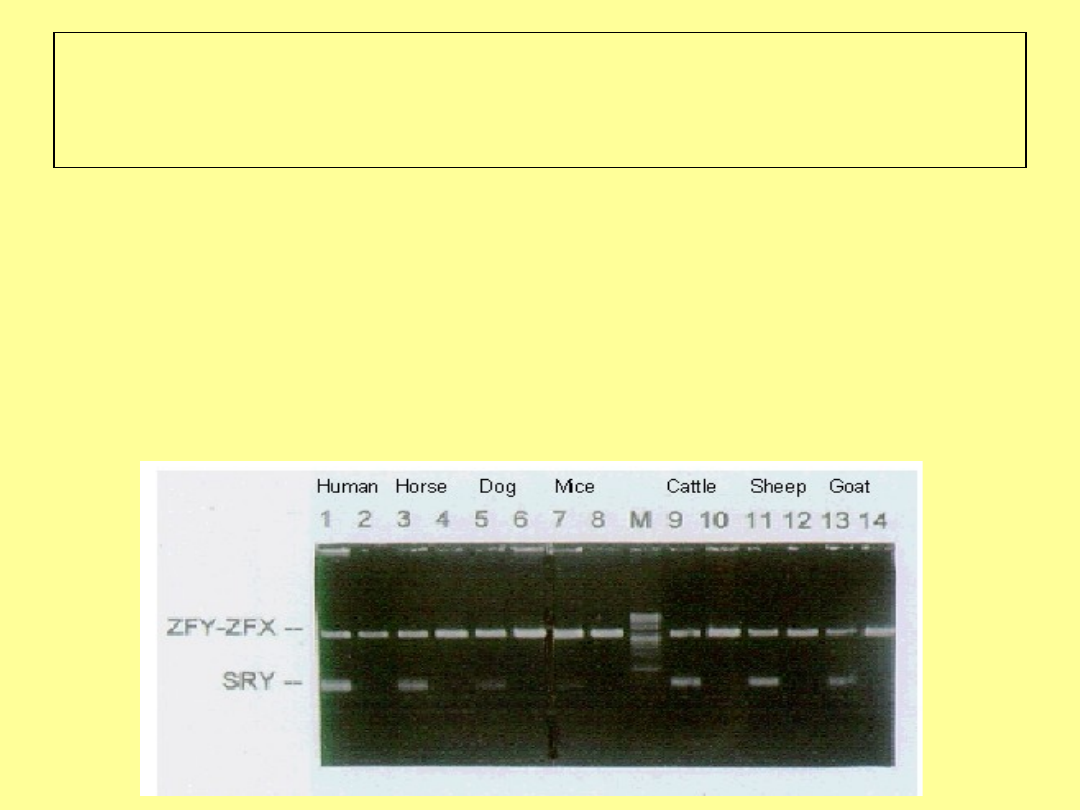
PCR multipleks
PCR z wykorzystaniem dwóch par starterów:
dla sekwencji na chromosomie Y
dla dowolnej sekwencji autosomalnej
(marker obecności DNA w probówce)

Dziękuję za uwagę…
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
Biotechnologia Rozrodu Zwierzat Indeks id 89115 (2)
2006 01 biotechnologia w rozrodzie
BIOLOGIA I BIOTECHNOLOGIA ROZRODU, SGGW-egzam inż-zootech
WYKŁAD I, biotechniki rozrodu
biotechnologia rozrodu
biotechniki w rozrodzie kotowat Nieznany (2)
Biotechnologia rozrodu bydła
Biotechnologia Rozrodu Zwierzat Indeks id 89115 (2)
biotechnika rozrodu
biotechnika rozrodu kolo
rozrodpytania, PRZYKŁADOWE PYTANIA Z ROZRODU I BIOTECHNOLOGII ZWIERZĄT
BIOTECHNICZNE METODY KIEROWANIA ROZRODEM ŚWIŃ
Biotechnologia w 6
etapy i perspektywy biotechnologii
Wyklad 5 biotech2
więcej podobnych podstron