
Konstrukcja
rekombinantowych szczepów
mikroorganizmów
o znaczeniu
biotechnologicznym

Cel – produkcja białek, których
wytwarzanie na innej drodze jest
trudne
niebezpieczne
ekonomicznie nieopłacalne
Konstrukcja rekombinantowych szczepów
mikroorganizmów o znaczeniu
biotechnologicznym
Charakterystyka gospodarzy ekspresyjnych
Bakterie
• dobrze scharakteryzowane
• łatwość przeprowadzenia manipulacji genetycznych
• wydajne systemy ekspresyjne
• brak modyfikacji posttranslacyjnych
• możliwość produkcji białek w postaci nierozpuszczalnych
ciał inkluzyjnych
• możliwość produkcji białek fuzyjnych posiadających domeny
ułatwiające oczyszczanie i detekcję białek, zwiększające
rozpuszczalność, zwiększające immunogenność

Bakteryjny system ekspresyjny
Gospodarz ekspresyjny
Escherichia coli
Wektor ekspresyjny

Konstrukcja rekombinantowych szczepów
mikroorganizmów o znaczeniu
biotechnologicznym
Charakterystyka gospodarzy ekspresyjnych
Drożdże
• dobrze scharakteryzowane
• łatwość przeprowadzenia manipulacji genetycznych
• wydajne systemy ekspresyjne
• trwałe rekombinanty – integracja plazmidów ekspresyjnych z
genomem gospodarza
• modyfikacje
posttranslacyjne
–
tworzenie
mostków
disiarczkowych,
glikozylacja,
przyłączanie
kwasów
tłuszczowych
• możliwość produkcji białek fuzyjnych posiadających domeny
ułatwiające oczyszczanie i detekcję białek, zwiększające
immunogenność

Konstrukcja rekombinantowych szczepów
mikroorganizmów o znaczeniu
biotechnologicznym
Gatunki drożdży stosowane do produkcji
heterologicznych białek
Saccharomyces cerevisiae
Pichia pastoris
Pichia methanolica
Hansenula polymorpha
Kluyveromyces lactis
Yarrowia lipolytica
Schizosaccharomyces pombe

Konstrukcja rekombinantowych szczepów
drożdży Pichia pastoris
Charakterystyka gospodarzy ekspresyjnych
drożdże metylotroficzne – zdolne do wzrostu w
pożywce zawierającej metanol jako jedyne
źródło węgla
możliwość konstytutywnej i indukowanej ekspresji obcych
genów
możliwość wewnątrz- i zewnątrzkomórkowej produkcji obcych
białek
markery selekcyjne auksotroficzne i antybiotykowe
trwałe rekombinanty – integracja wektorów ekspresyjnych z
genomem drożdży
glikozylacja białek
łatwość zwiększenia skali procesu biotechnologicznego
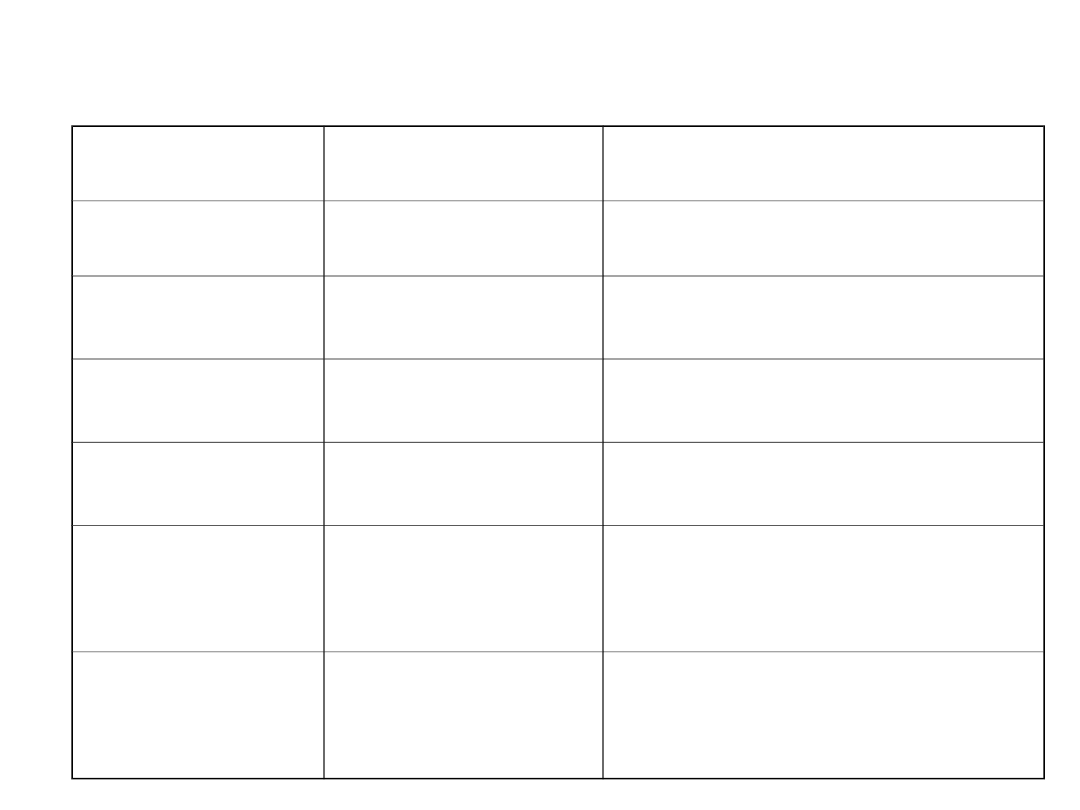
Szczepy Pichia pastoris wykorzystywane do
ekspresji obcych genów
Szczep
Genotyp
Uwagi
X-33, Y-11430
szczep dziki
Selekcja antybiotykowa
GS115
his4
Selekcja rekombinantów na
podłożu bez histydyny
GS190
arg4
Selekcja rekombinantówna
podłożu bez argininy
JC254
ura3
Selekcja rekombinantówna
podłożu bez uracylu
KM71
his4,
aox1::ARG4,
arg4
Selekcja rekombinantów na
podłożu bez histydyny;
fenotyp Mut
S
SMD1168
his4, pep4
Selekcja rekombinantów na
podłożu bez histydyny;
brak aktywności proteazy A
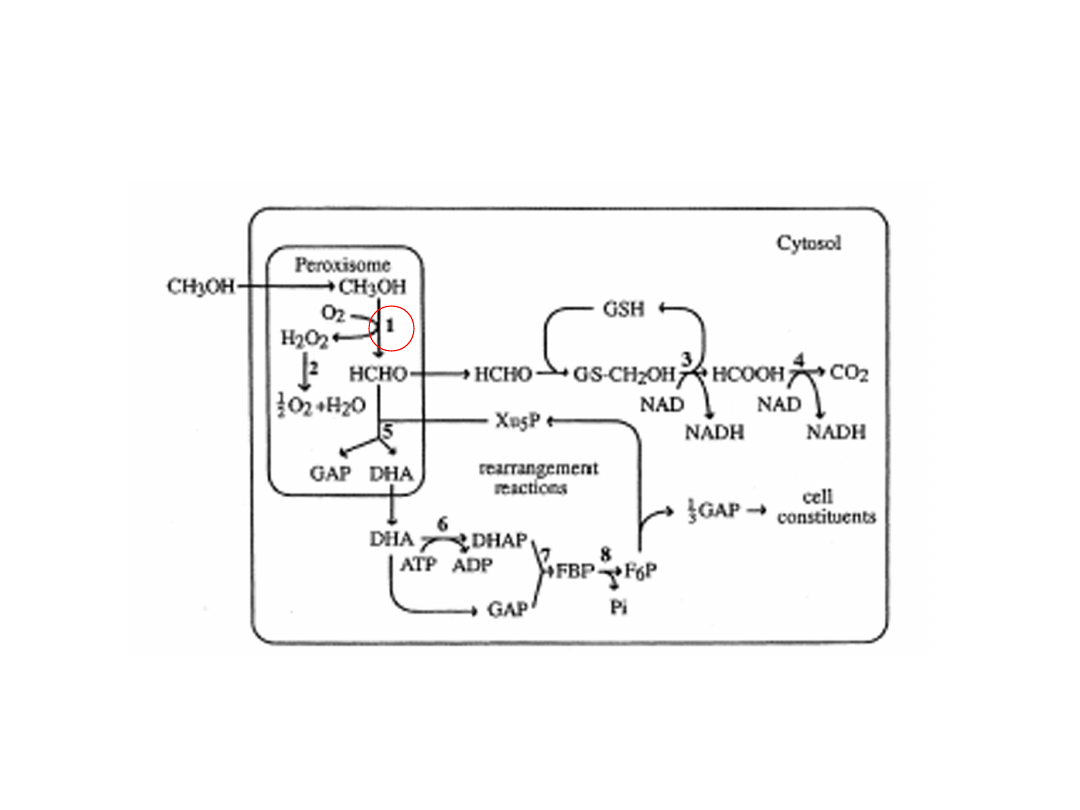
Konstrukcja rekombinantowych szczepów drożdży
Pichia pastoris
Metabolizm metanolu
1 – oksydaza alkoholowa, 2 – katalaza, 3 – dehydrogenaza
formaldehydowa, 4 - dehydrogenaza kwasu mrówkowego, 5 - syntaza
dihydroksyacetonu, 6 - kinaza dihydroksyacetonu, aldolaza 1,6-
fruktozobisfosforanu, 8 – fruktozo 1,6-bisfosforan
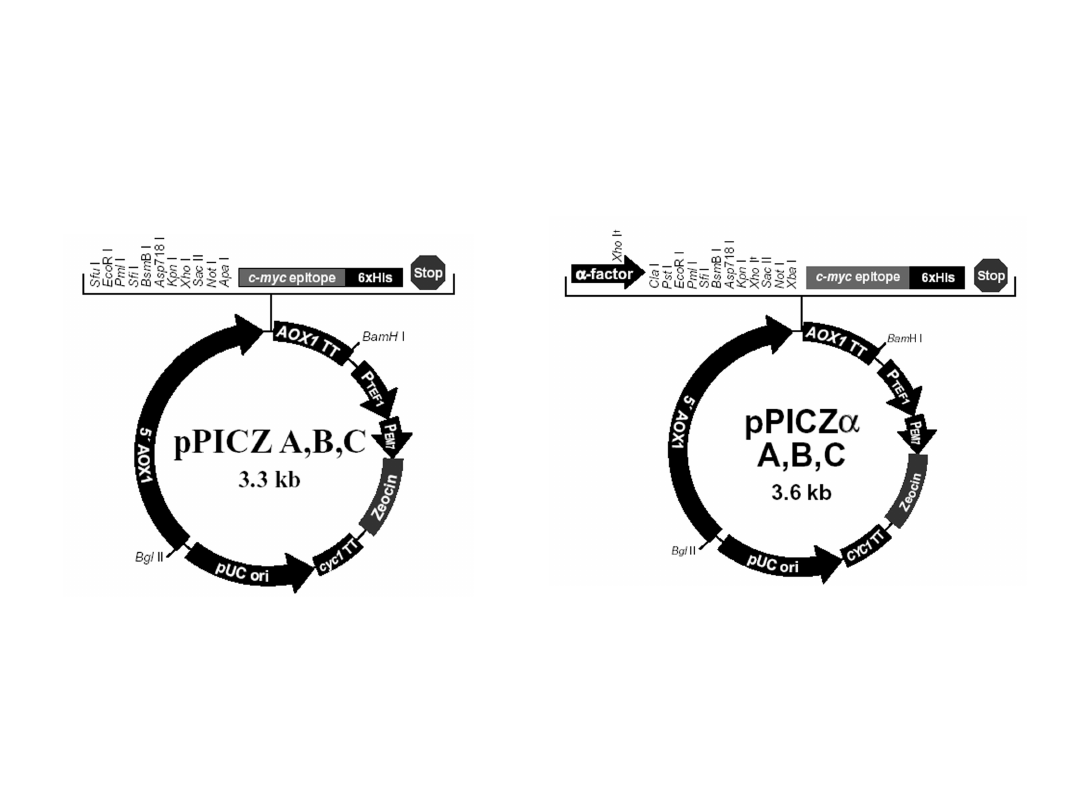
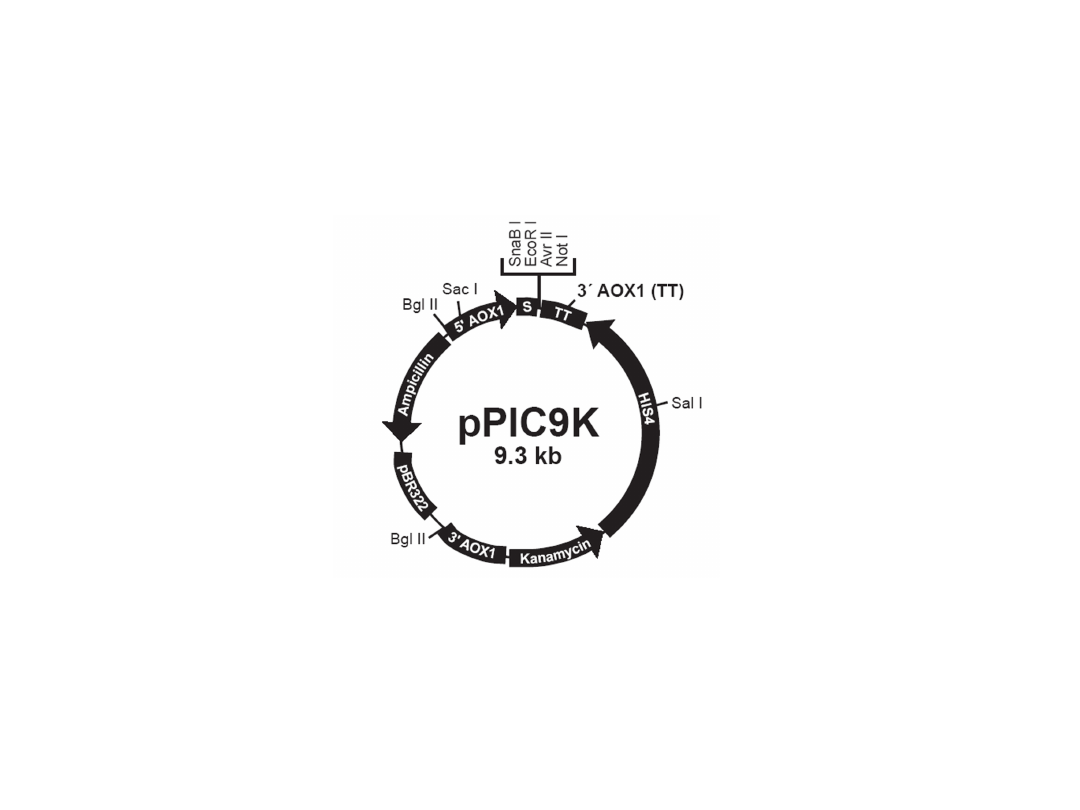
Wektory stosowane do indukowanej
ekspresji obcych genów
Geny klonowane pod kontrolę promotora oksydazy
alkoholowej, indukcja ekspresji genów metanolem
Selekcja rekombinantów na podłożu z Zeocyną
Wektory stosowane do indukowanej
ekspresji obcych genów
Geny klonowane pod kontrolę promotora oksydazy alkoholowej
Selekcja rekombinantów na podłożu nie zawierającym histydyny
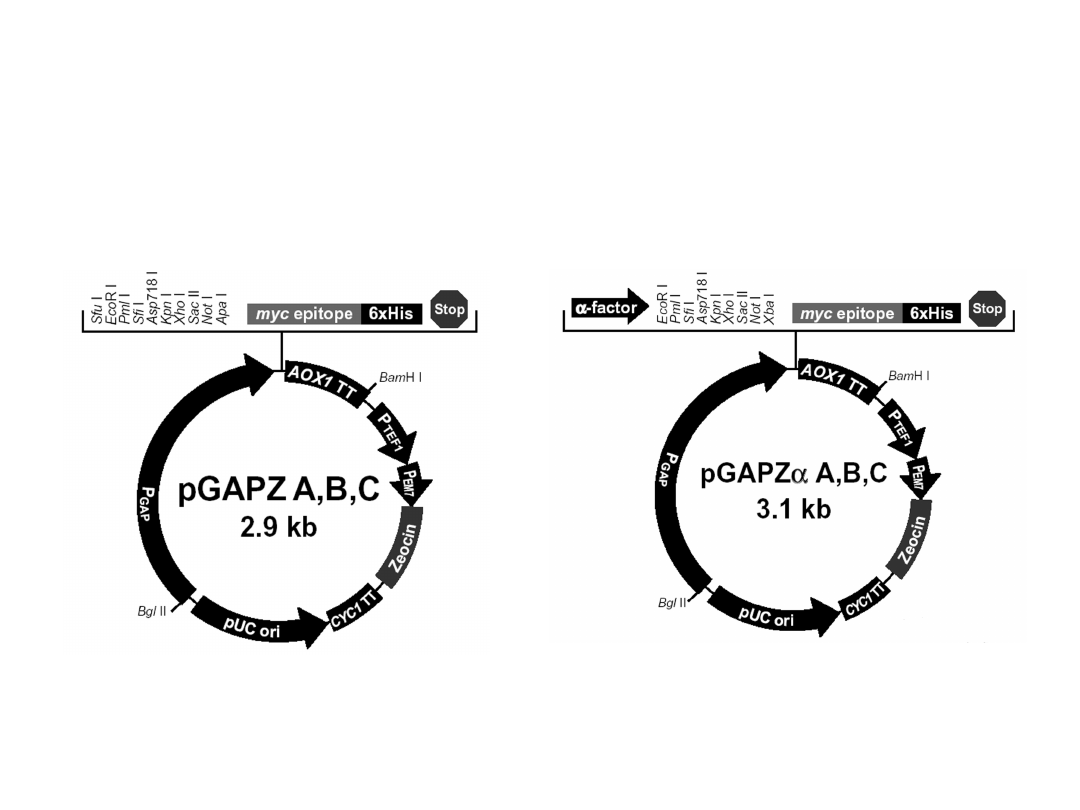
Wektory stosowane do konstytutywnej
ekspresji obcych genów
Geny klonowane pod kontrolę promotora dehydrogenazy aldehydu
3-fosfoglicerynowego

Sekwencje sygnalne stosowane w celu
zewnątrzkomórkowej produkcji obcych
białek
Sekwencja sygnalna α-
faktora
Saccharomyces
cerevisiae
Sekwencja sygnalna kwaśnej
fosfatazy Pichia pastoris
Własne sekwencje sygnalne
białek kodowanych przez
klonowane geny

Produkcja termostabilnej
β-D-galaktozydazy Pyrococcus woesei
w systemie ekspresji Pichia pastoris
β-D-galaktozydaza
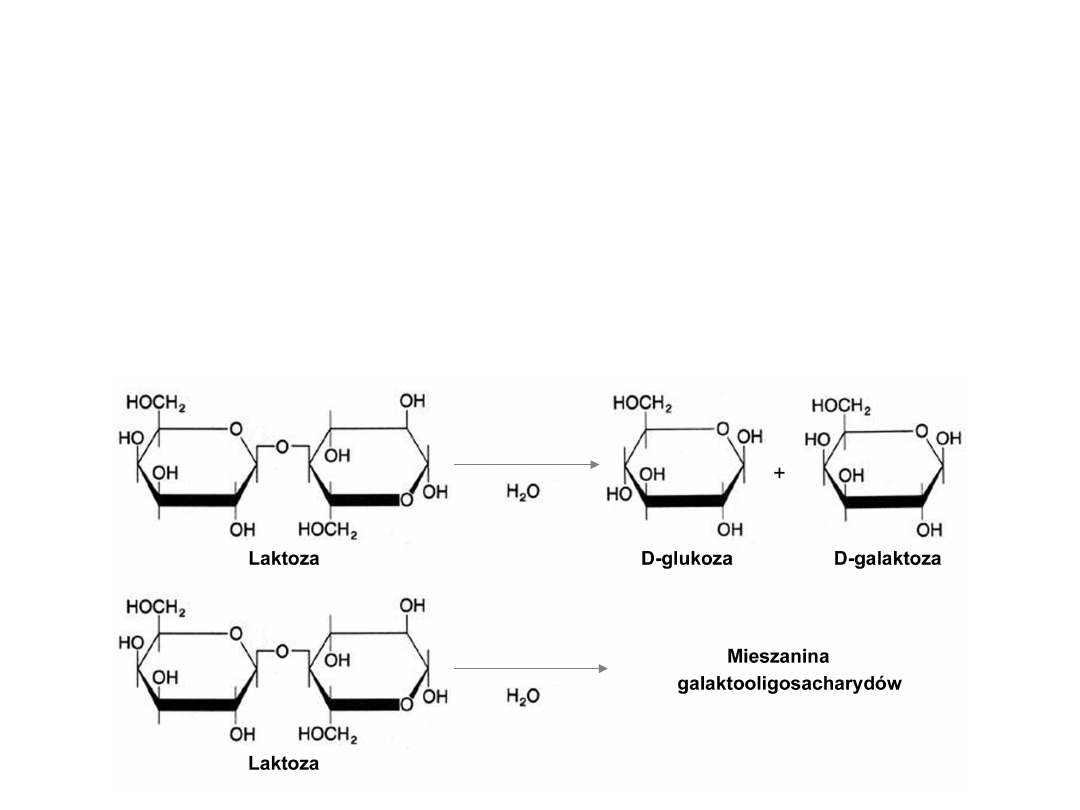
(EC 3.2.1.23)
Katalizuje reakcję hydrolizy wiązań β-1,4-O-
glikozydowych w β-D-galaktozydach
Katalizuje reakcję transglikozylacji
β-D-
galaktozydaza
β-D-
galaktozydaza

Przemysłowe zastosowanie β-D-
galaktozydazy
Produkcja mleka o obniżonej zawartości laktozy
Produkcja dietetycznych przetworów mlecznych
Produkcja syropu glukozowo-galaktozowego
Produkcja bezlaktozowej serwatki
Synteza galaktooligosacharydów

Pyrococcus woesei
izolowany z morskiej solfatary (Porto di Levante, wyspa
Volcano, Włochy)
Domena: Archaea
Grupa: Euryarchaeota
Klasa: Thermococci
Rząd: Thermococcales
Rodzina:
Thermococcaceae
Rodzaj: Pyrococcus
Gatunek: Pyrococcus
woesei
Beztlenowiec
Optimum temperatury - 97 - 100°C
Optimum pH - 6,0
Optimum NaCl - 30%
Produkty metabolizmu - H
2
, H
2
S (w obecności S
0
)
Ziarniak
0,8 - 2,0 μm
Urzęsienie
lofotrichalne
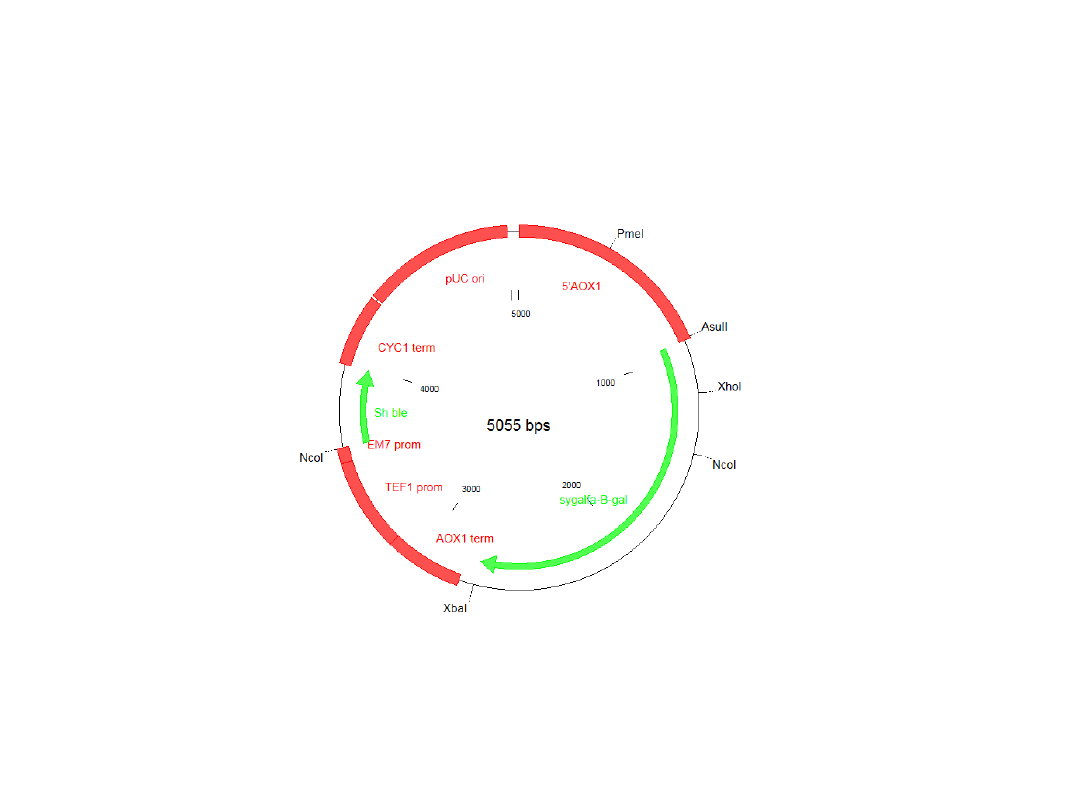
Konstrukcja systemu ekspresyjnego
Pichia pastoris
pPICZαβ-gal
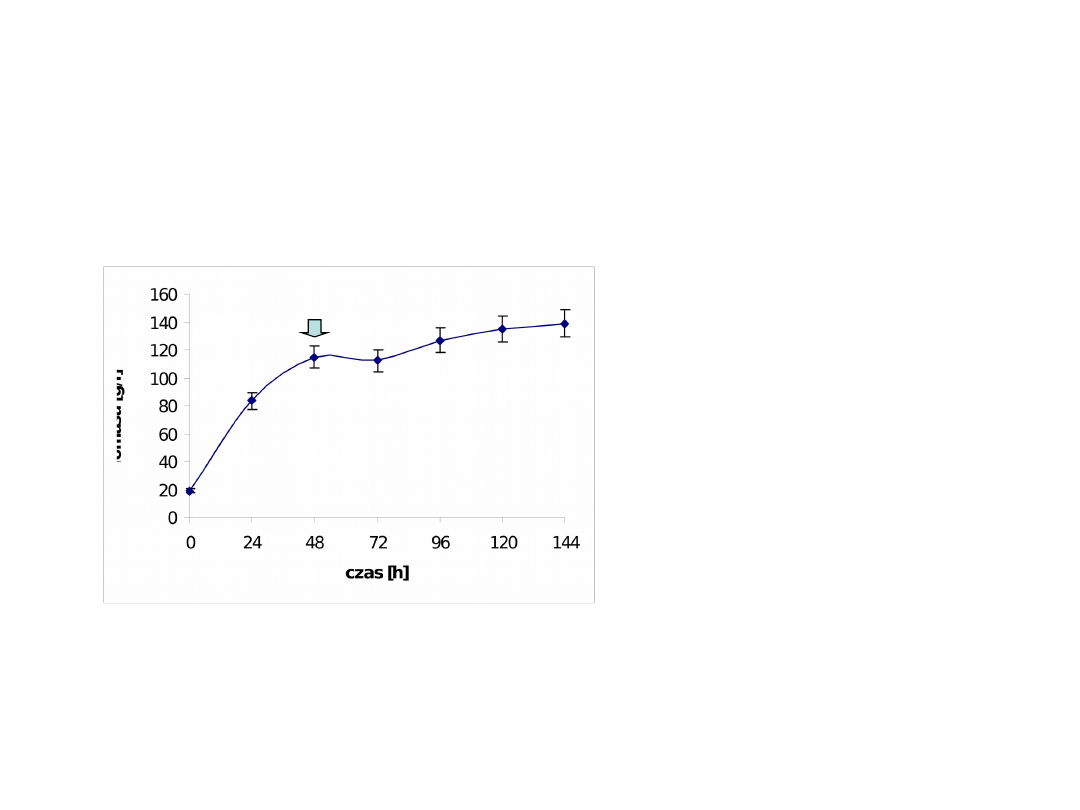
Produkcja β-D-galaktozydazy P. woesei
w systemie ekspresji P. pastoris (AOX1)
Indukcja ekspresji
genu
Krzywa wzrostu P. pastoris GS115 + pPICZαβ-
gal
24 – 47 h – 25% (m/v)
glicerol + 5*10
-4
% biotyna
+ 0,05% histydyna (0,24
ml/min)
48 – 72 h – 25% (v/v) MeOH
+ 5*10
-4
% biotyna +
0,05%
histydyna
(0,24
ml/min)
72 – 144 h – 30% (v/v)
MeOH + 5*10
-4
% biotyna +
0,05%
histydyna
(0,24
ml/min)
Pożywka BMGY (2% pepton K, 1% ekstrakt drożdżowy, 0,1 M K
2
HPO
4
/KH
2
PO
4
pH 6,0,
1,34% YNB, 4*10
-5
% biotyna, 2% glicerol), 30 °C, napowietrzanie 3,0 vvm,
mieszanie 1200 obr./min, Biostat R, 5l (B. Braun Biotech International, Niemcy), 2,5 l
objętości roboczej
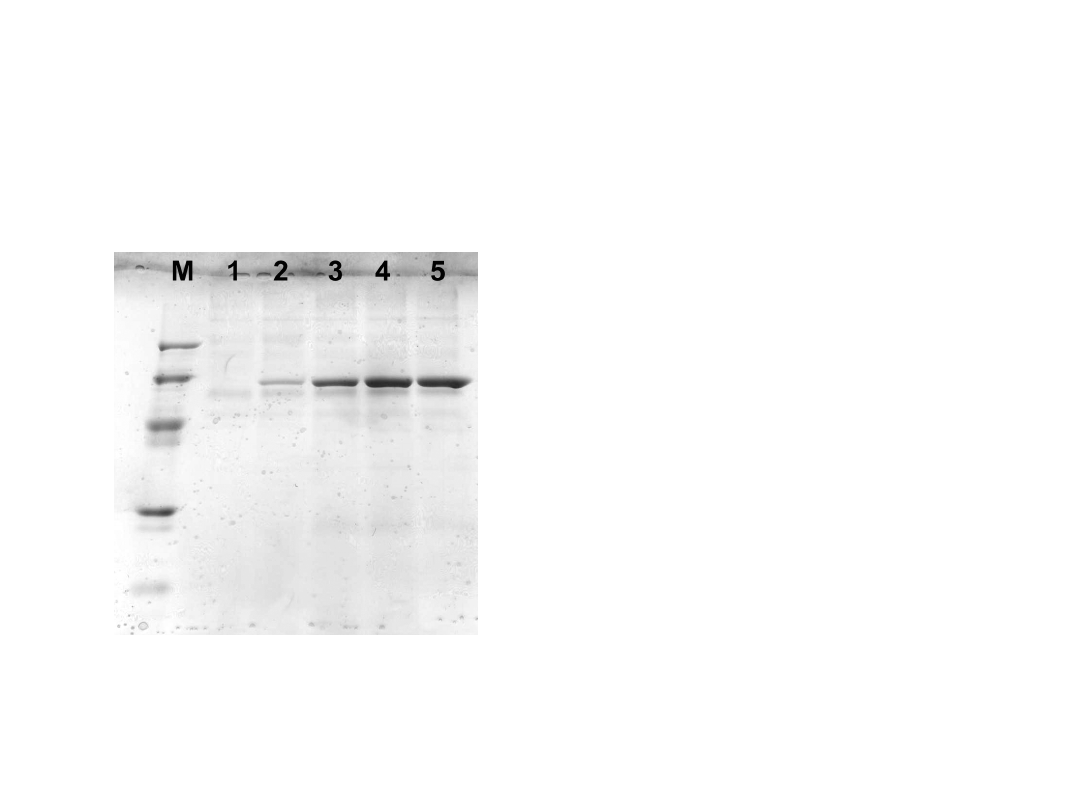
Produkcja β-D-galaktozydazy P. woesei
w systemie ekspresji P. pastoris (AOX1)
M – LMW SDS Marker: 97, 66, 45, 30,
20,1 i 14,4 kDa
1 – pożywka hodowlana po 48 h hodowli
2 – pożywka hodowlana po 72 h hodowli
3 – pożywka hodowlana po 96 h hodowli
4 – pożywka hodowlana po 120 h
hodowli
5 – pożywka hodowlana po 144 h
hodowli
P. pastoris GS115 + pPICZαβ-
gal
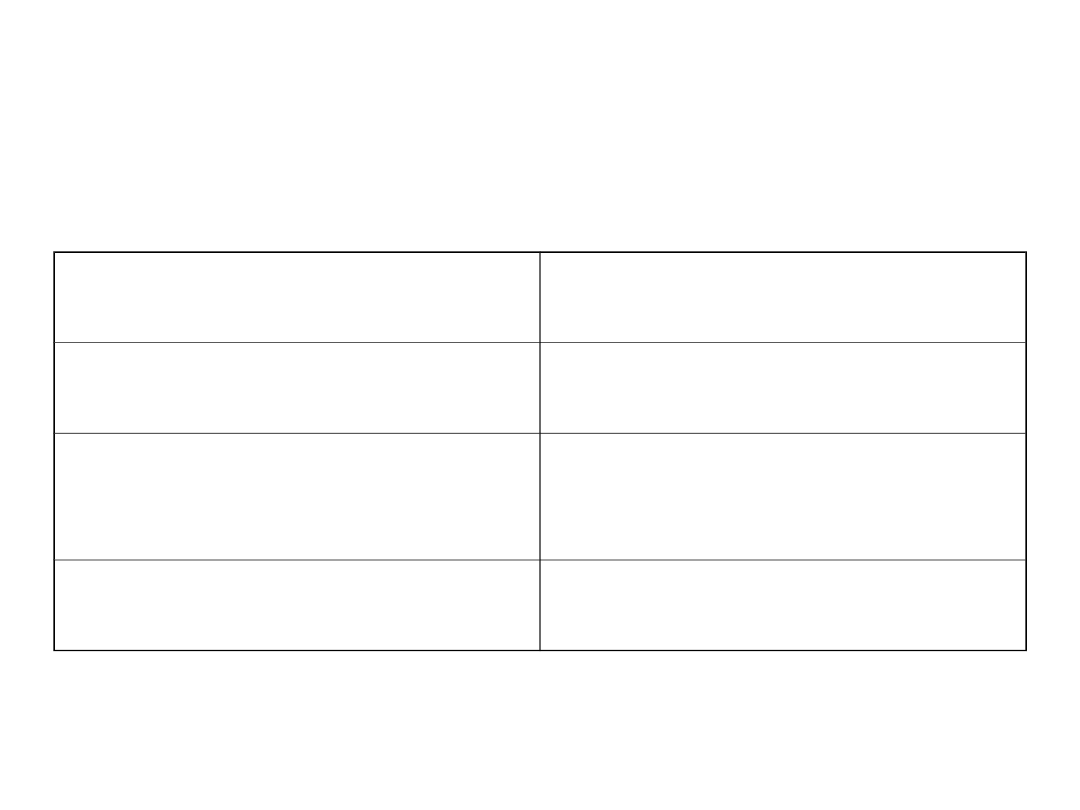
Izolacja β-D-galaktozydazy P. woesei
z pożywki pohodowlanej
Etap oczyszczania
Ilość białka [mg]
Pożywka pohodowlana
520
Wysalanie białek siarczanem
amonu
338
Strącanie termiczne białek
302

Szczepionki zawierające
rekombinantowe antygeny
białkowe

Cechy idealnej szczepionki
skuteczność
bezpieczeństwo
trwałość
łatwość podawania
niska cena
łatwość i bezpieczeństwo produkcji
Szczepionka
– produkt pochodzenia biologicznego
zawierający
substancje
zdolne
do
wywołania
określonych
procesów
immunologicznych
warunkujących powstanie trwałej odporności bez
wywoływania działań toksycznych
Inne
składniki
Inne
składniki
Substancja
stabilizująca
Substancja
stabilizująca
Substancja
konserwująca
Substancja
konserwująca
Adiuwant
Adiuwant
Antygen
Antygen
Elementy
składowe
szczepionki
Elementy
składowe
szczepionki

Szczepionki zawierające
rekombinantowe antygeny białkowe
Charakterystyka szczepionek
Ściśle zdefiniowany skład
Bezpieczeństwo produkcji
• wyeliminowanie
konieczności
hodowli
mikroorganizmów
chorobotwórczych w celu izolacji antygenów szczepionkowych
• mikroorganizmy
stosowane
do
produkcji
antygenów
rekombinantowych o statusie GRAS (Generally Recognized as Safe)
Bezpieczeństwo stosowania
• brak możliwości wywołania choroby
• niska odczynowość
Wymagają stosowania adiuwantów
Koszt produkcji uzależniony od stosowanego systemu
produkcji

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Czynnik etiologiczny – wirus
HBV
Rodzina: Hepadnaviridae
Rodzaj: Orthohepadnavirus
Struktura:
ikosaedralny
nukleokapsyd otoczony podwójną
osłonką; kulisty; śr. 42 nm
Kwas nukleinowy: DNA
Replikacja: hepatocyty
Rezerwuar: człowiek
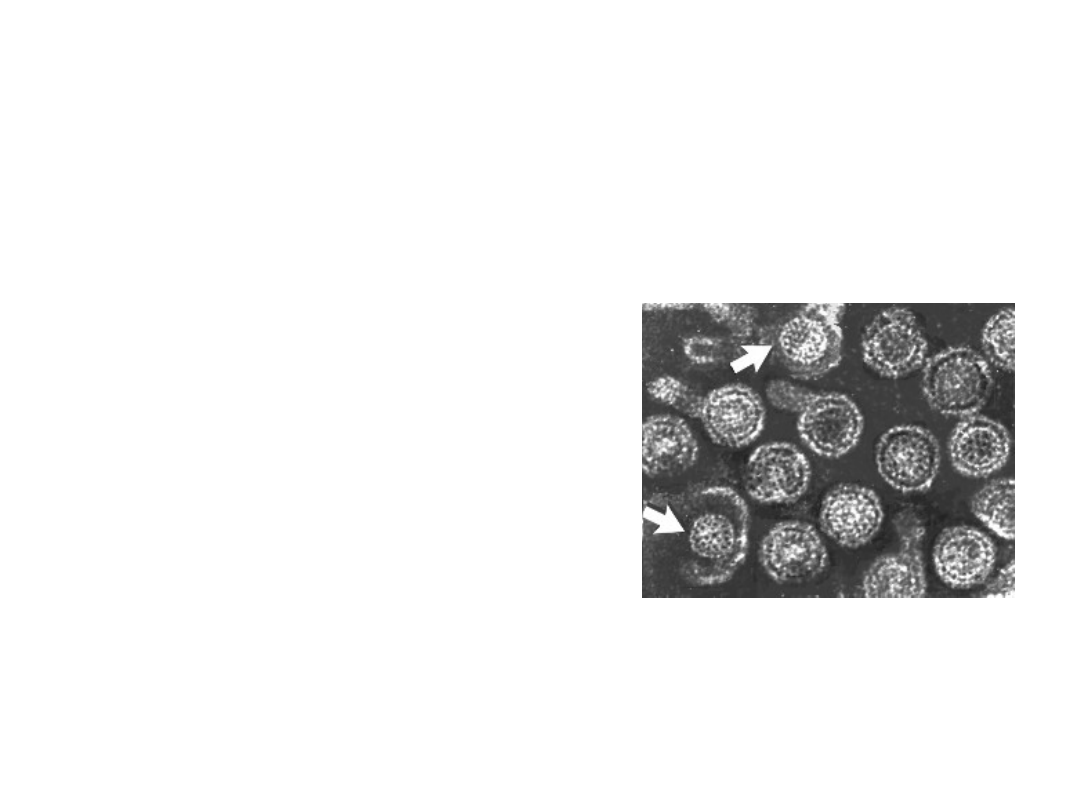
Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Droga przenoszenia: krew i płyny
ustrojowe, w tym wydzielina
szyjki macicy, nasienie
Wysoka zakaźność – nawet 0,1 μl
krwi może spowodować zakażenie
Hodowla
w
warunkach
laboratoryjnych – nie zakaża
zarodków kurzych i powszechnie
stosowanych linii komórkowych
We krwi do 10
10
wirusów/ml
Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Ostre wirusowe zapalenie wątroby typu B
Okres wylęgania 2 – 3 miesiące
Początkowe objawy: złe samopoczucie, utrata apetytu, gorączka
Żółtaczka
Wyzdrowienie
(90%)
Nadostre
zapalenie
wątroby
(0,1%)
Zgon
Przewlekłe zakażenie
(10%)
Antygenemi
a
brak
uszkodzenia
wątroby
Przetrwałe
zapalenie
wątroby
niewielkie
uszkodzenie wątroby
Aktywne
zapalenie
wątroby
Marskość
wątroby
Pierwotny rak
wątroby

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Wirusowe zapalenie wątroby typu B
zakażenie okołoporodowe
Dzieci urodzone przez matki w ostrej fazie wzw B
zakażenie z ostrymi objawami choroby
Dzieci urodzone przez matki z przewlekłym aktywnym wzw B
zakażenie bez ostrych objawów choroby
nosicielstwo HBV
śmierć z powodu marskości wątroby lub raka wątroby (50% chłopców,
15% dziewczynek)
Na świecie 200 mln nosicieli HBV
z tego 75% ulega zakażeniu podczas porodu
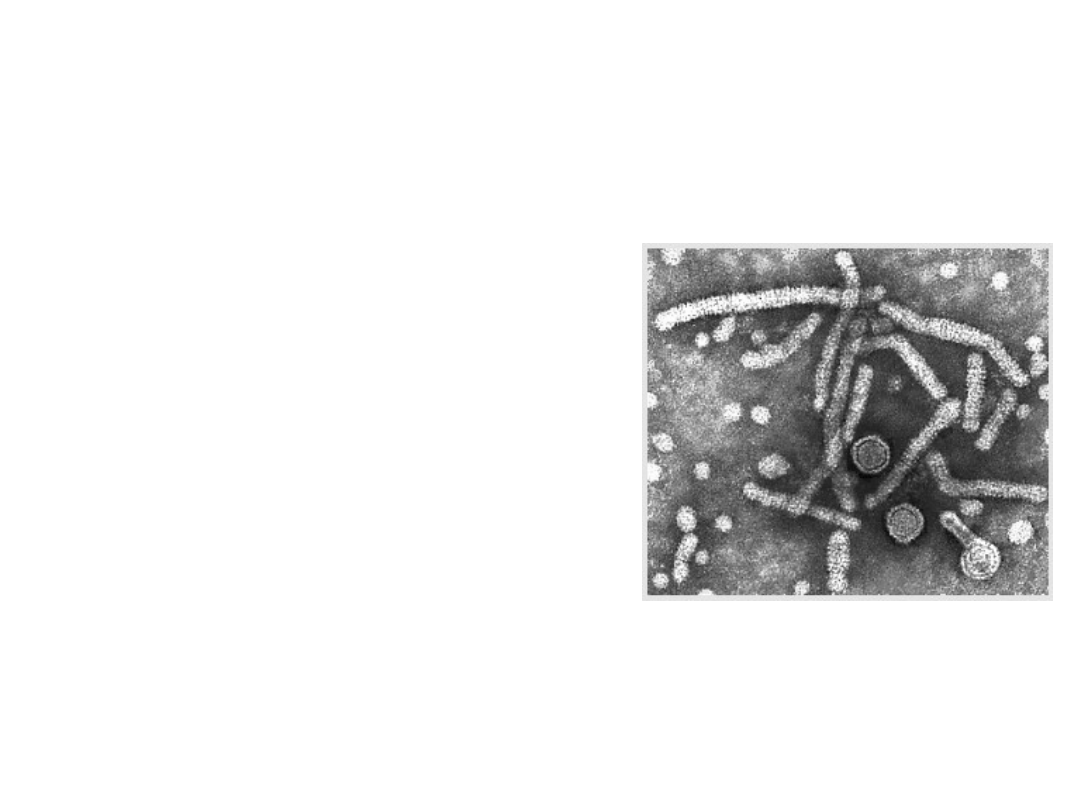
Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Antygeny wirusa HBV
HBcAg – białko rdzenia
HBeAg – białko rdzenia
HBsAg – białko powierzchniowe
• tworzy zewnętrzną osłonkę wirusa
• nadmiar białka obecny we krwi w
postaci kulistych lub pałeczkowatych
agregatów
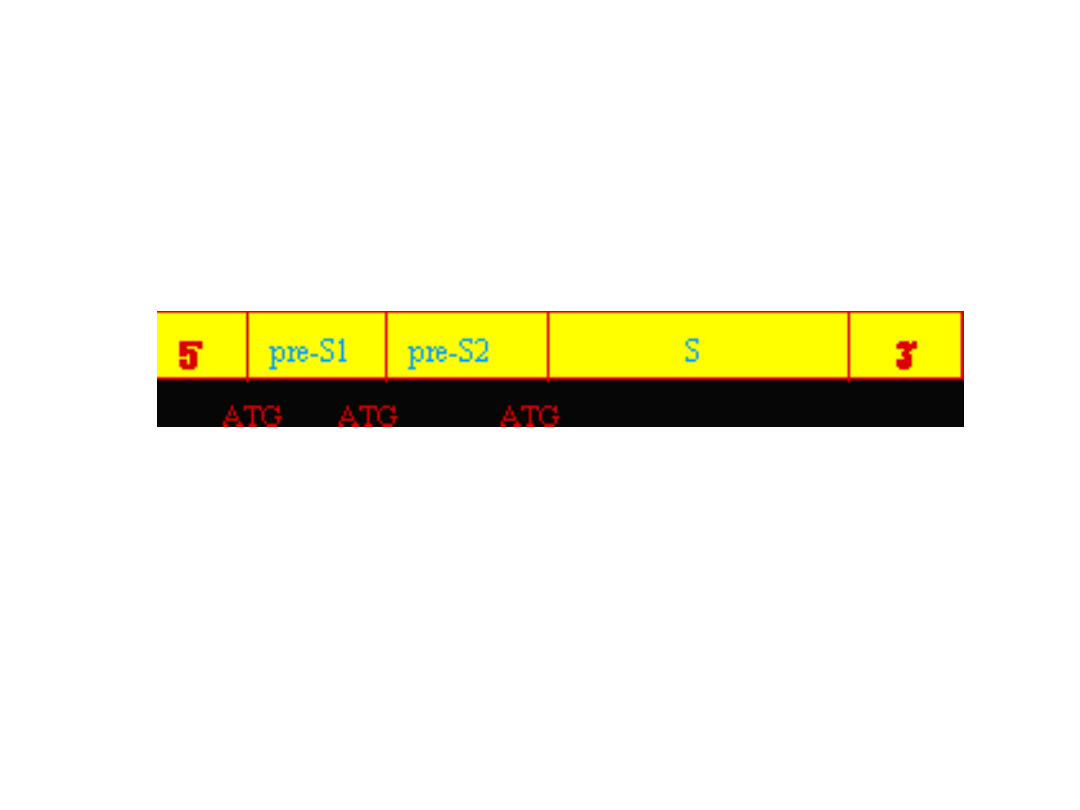
Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Gen kodujący antygen HBsAg – koduje 3 polipeptydy
preS1
preS2
S

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki I generacji
(plazmatyczne)
Substancja czynna – białkowy
antygen powierzchniowy HBsAg
• białko S
• śladowe ilości białka preS1
• śladowe ilości białka preS2
Sposób otrzymywania – izolacja
ciał kulistych i pałeczkowatych z
krwi bezobjawowych nosicieli
HBV,
inaktywacja
formaldehydem
Bezpieczeństwo
–
ryzyko
transmisji
patogenów
przenoszonych przez krew

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki II generacji
(rekombinowane)
Pierwsza szczepionka
zarejestrowana w 1986 r.
Substancja czynna – białkowy antygen
powierzchniowy HBsAg
• białko S
Sposób otrzymywania – produkcja
białka S w komórkach drożdży S.
cerevisiae
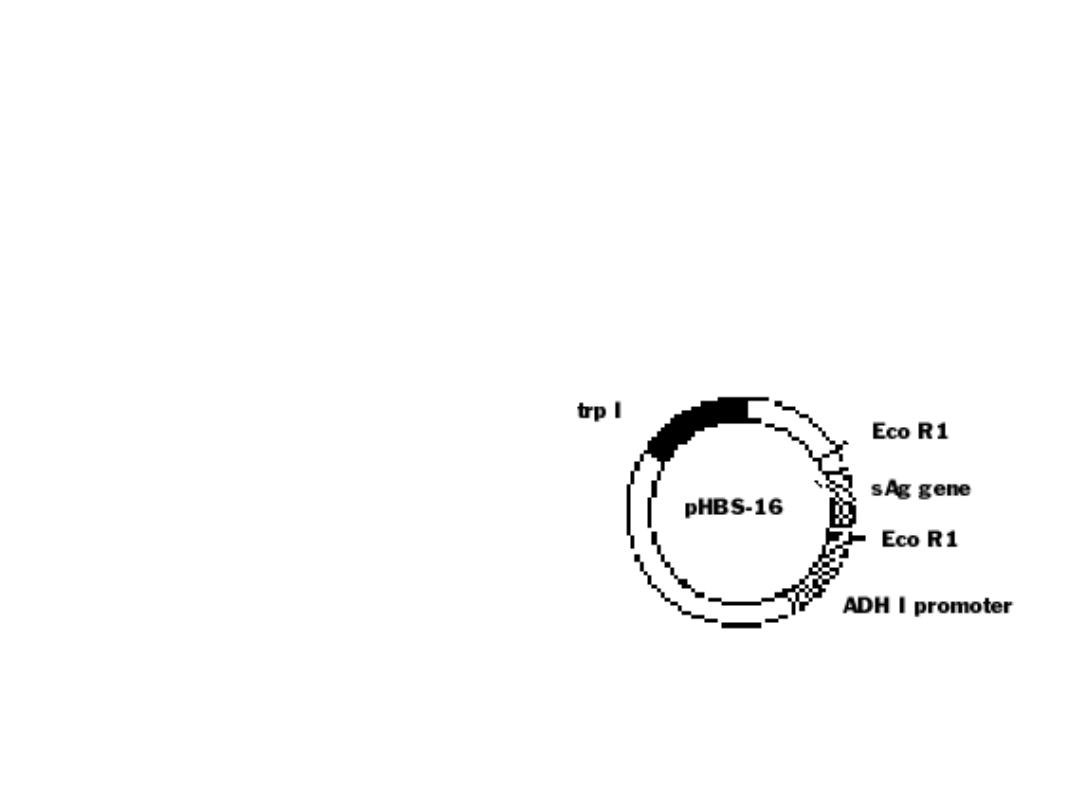
Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki II
generacji
(rekombinowane)
Pierwszy układ ekspresyjny
opublikowany w 1982 r.
(P. Valenzuela, A. Medina, W.J.
Rutter, Nature, 289, 347 – 350)
wektor ekspresyjny – pHBS-16
• autonomiczna replikacja
• ori replikacji pBR322
• gen oporności na ampicylinę
• ori replikacji plamidu 2μ
• gen trp1
• sekwencja kodująca białko S pod
kontrolą
promotora
ADH
I
dehydrogenazy alkoholowej I

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki II generacji
(rekombinowane)
gospodarz – S. cerevisiae XV610-
8C
• szczep
auksotroficzny
–
brak
zdolności do wzrostu na podłożu nie
zawierającym tryptofanu
białko S produkowane w postaci
kulistych agregatów
(agregaty 1000x bardziej
immunogenne
niż
pojedyncze
cząsteczki białka S)
2 – 5 μg białka z 200 ml hodowli
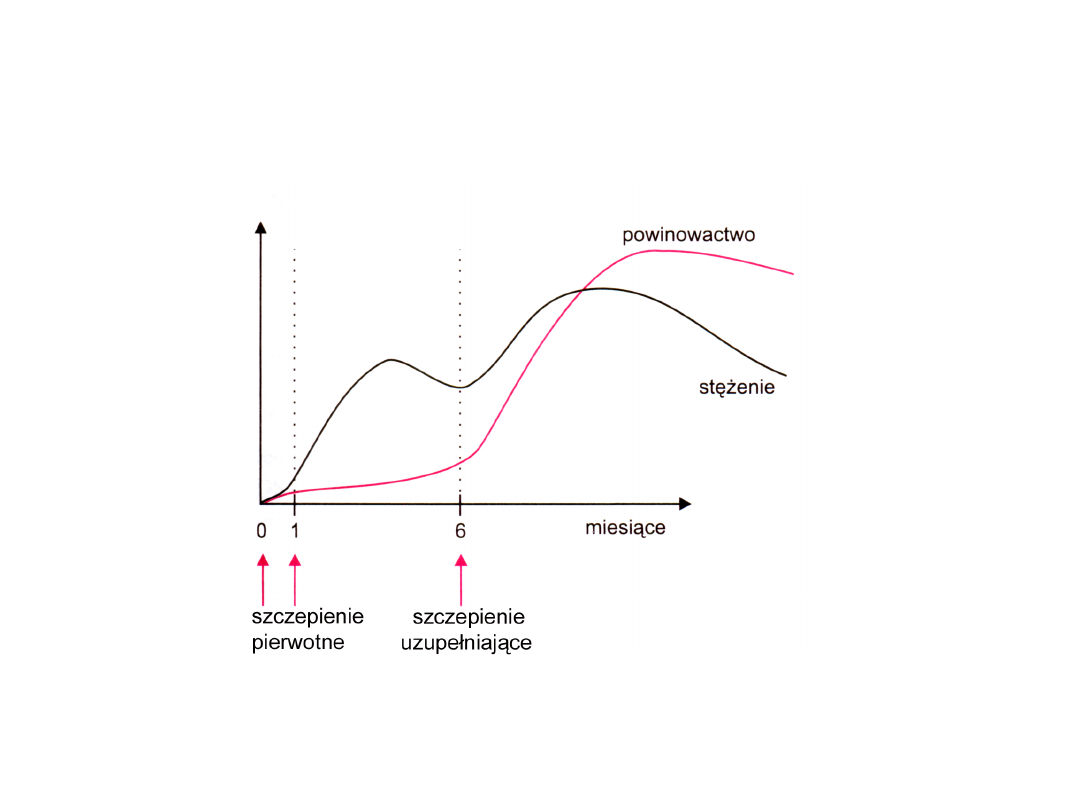
Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Schemat szczepienia
Narastanie stężenia i powinowactwa przeciwciał
w cyklu szczepień przeciwko WZW typu B

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki II generacji (rekombinowane)
Skuteczność szczepionki
• u 95 – 100% szczepionych skuteczna ochrona przed zachorowaniem
• 98% noworodków od matek nosicielek HBV – zabezpieczenie przed
zakażeniem po podaniu szczepionki i HBIg w dniu urodzenia
Bezpieczeństwo szczepionki – wysokie
• może być stosowana u kobiet ciężarnych
• matek karmiących piersią
• osób z niedoborami odporności
Niepożądane odczyny poszczepienne
• łagodne miejscowe odczyny poszczepienne
• rzadko występujące odczyny ogólne – powiększenie węzłów chłonnych,
wymioty, biegunka, nudności, obniżenie ciśnienia krwi, zaburzenia ze strony
układu nerwowego

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki II generacji (rekombinowane)
Dostępne w postaci szczepionek monowalentnych
• Engerix B, GlaxoSmithKline
• H-B-VAX, Merck Sharp Dohme
Dostępne w postaci szczepionek skojarzonych
• Hexavac, Aventis Pasteur (błonica, tężec, krztusiec, polio, Hib,
WZW B)
• Ambirix, GlaxoSmithKline (WZW A, WZW B)
• Procomvax, Merck Sharp Dohme (WZW B, Hib)

Szczepionki przeciwko wirusowemu
zapaleniu wątroby typu B
Szczepionki II generacji (rekombinowane)
Białko S produkowane w komórkach drożdży metylotroficznych
Hansenula polymorpha (Hepavax Gene, Green Cross Vaccine,
Korea)
Białko S produkowane w komórkach drożdży metylotroficznych
Pichia pastoris
wektory ekspresyjne zintegrowane z chromosomem gospodarza
(stabilne konstrukty)
indukowana metanolem ekspresja genów [geny klonowane pod
kontrolę promotorów AOX lub MOX – oksydazy alkoholowej u P.
pastoris (metanolowej u H. polymorpha)]

Szczepionki przeciwko wirusowi HPV
(wirusowi ludzkiego brodawczaka)
Silgard (MSD)
Substancja czynna – białko L1
czterech typów HPV (16, 18, 6 i
11)
Cervarix
(GlaxoSmithCline)
Substancja czynna – białko L1
dwóch typów HPV (16 i 18)
Białko L1 produkowane w drożdżach S.
cerevisiae
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
Biotechno konstruowanie nowych szczepów drobnoustrojów i lin, Studia, Biotechnologia
SZCZEPIENIA
Szczepienia zalecane
marszalek szczepienia2
Szczepienia ochronne u dzieci
Szkol Szczepionka p HiV
W5 screening szczepu
Bill Gates można zredukować liczbę ludności na świecie dzięki… szczepionkom
Ważna wiadomość dotycząca szczepionki HPV, Prof. Dorota Majewska
A propos tekstu dra Jaśkowskiego list prof. Majewskiej, Zdrowie i ekologia, Szczepionki
UE szczepienia i racjonalne stosowanie antybiotyków, Zdrowie publiczne, W. Leśnikowska - Ścigalska -
Jarek kefirek szczepienia, Zdrowie i ekologia, Szczepionki
krycie szczepienia
10 ZASADY I TECHNIKA WYKONYWANIA SZCZEPIEŃ
bezpieczne szczepienia id 83941 Nieznany (2)
O problemie patogennych zanieczyszczeń szczepionek
49 onak szczepanik
więcej podobnych podstron