Metody uzyskiwania
chromosomów
człowieka
i analiza
MATERIAŁ BIOLOGICZNY
DO HODOWLI
CHROMOSOMÓW
pełna krew obwodowa
komórki płynu owodniowego – amniocyty
komórki kosmówki (trofoblastu)
krew pępowinowa
tkanki poronionego zarodka
fibroblasty skóry
komórki nowotworowe z wysiękowych
płynów nowotworowych (np. z jamy
otrzewnej, opłucnej)
fragmenty tkanek guzów nowotworowych
pobrane po operacji
komórki nowotworowe pobrane metodą
biopsji cienkoigłowej
szpik kostny (komórki nowotworowe
pochodzące z biopsji szpiku)
POBIERANIE MATERIAŁU
DO BADAŃ
CYTOGENETYCZNYCH
Materiał do badań musi być pobrany jałowo.
Musi być umieszczony w sterylnym,
zamykanym pojemniku.
Krew pobiera się na heparynę z żyły
łokciowej, nie może zawierać skrzepów.
Komórki płynu owodniowego są
uzyskiwane przez amniopunkcję:
wczesną – 12-14 tydzień ciąży
późną – 15-17 tydzień ciąży
Komórki trofoblastu uzyskuje się z kosmówki za
pomocą biopsji przez powłoki brzuszne, rzadziej
przez szyjkę macicy, między 8 a 11 tygodniem ciąży.
Komórki szpiku kostnego pobiera się przez nakłucie
mostka lub talerza kości biodrowej (u dzieci).
Bioptat szpiku wprowadza się natychmiast do
jałowej próbówki zawierającej ogrzany do 37
o
C płyn
hodowlany.
Pojemniki zawierające próbki tkanek do badań muszą być
oznaczone co najmniej dwoma danymi
identyfikacyjnymi pacjenta (np. imię i nazwisko oraz
data urodzenia).
OPTYMALNE ILOŚCI MATERIAŁU DO
BADAŃ:
KREW ŻYLNA
2-10 ML
KREW PĘPOWINOWA 2-10 ML
PŁYN OWODNIOWY
15-20 ML
KOSMÓWKA
10-20 MG
SZPIK KOSTNY
1-2 ML
PRZECHOWYWANIE I TRANSPORT
Czas przechowywania należy ograniczyć do minimum.
Krew
– 24 godziny w temperaturze pokojowej, lub 3
doby w temp. poniżej 4
o
C.
Płyn owodniowy
– nie dłużej niż 24 godziny w temp.
+4
o
C.
Świeże tkanki umieszczone w pożywce
– do 3 dni w
temp. +4
o
C.
Tkanki najlepiej jest zaraz po pobraniu umieszczać
w pojemnikach z podłożem hodowlanym.
Transport tkanek powinien odbywać się w pojemnikach
z podłożem lub bez podłoża w temp. 0
o
C
HODOWLA CHROMOSOMÓW
(IN VITRO)
Z LIMFOCYTÓW
KRWI OBWODOWEJ
SKŁADNIKI:
a)
podłoże Eagle’a
b)
fitohemaglutynina M (PHA)
c)
sól sodowa heparyny
d)
płodowa surowica cielęca
e)
penicylina krystaliczna
f)
streptomycyna
g)
Colcemid (kolchicyna)
h)
KCl – 0,075 M
i)
płyn Carnoy’a
j)
barwnik Giemsy
PRZYGOTOWANIE PŁYNU
HODOWLANEGO
Do sterylnej butelki odmierzamy 100 ml
płynu Eagle’a, dodajemy:
fitohemaglutyninę M
– stężenie 1%
penicylinę krystaliczną – stężenie 100 IU /
ml
streptomycynę
– stężenie 100
g/ml
ZAKŁADANIE I PROWADZENIE
MAKROHODOWLI
Hodowlę komórkową zakładamy w
sterylnych jednorazowych naczyniach
hodowlanych NUNC o pojemności 25
ml w warunkach jałowych (komora
laminarna).
a)
do sterylnej próbówki z 1 ml heparyny
(stężenie – 50IU / 1 ml krwi) pobieramy
od pacjenta 10 ml krwi żylnej
odstawiamy na ok. 2 godz. do
sedymentacji w temperaturze
pokojowej.
b)
pobieramy osad krwinek białych wraz
z 1 ml osocza, przenosimy do naczynia
hodowlanego z 8 ml wyżej opisanego
płynu hodowlanego, dodajemy 1 ml
surowicy płodowej cielęcej.
Naczynie szczelnie zamykamy.
Końcowa objętość hodowli wynosi 10
ml.
c)
przenosimy naczynko hodowlane do
cieplarki i prowadzimy hodowlę w temp.
37
o
C przez 48-72 godz.
Każdego dnia hodowlę dokładnie
mieszamy.
d)
na 2 godziny przed zakończeniem
hodowlę wyjmujemy z cieplarki, dodajemy
Colcemid (kolchicyna) w stężeniu 0,15
g / ml i ponownie wstawiamy do cieplarki
na ostatnie 2 godz.
WYKAŃCZANIE HODOWLI
a)
wyjętą z cieplarki zawartość naczynka
hodowlanego przelewamy do sterylnych
próbówek wirowniczych, wstawiamy do
wirówki, wirujemy 7 min, 800 obr. / min.
b)
zlewamy płyn znad osadu, próbówkę
wstrząsamy i dodajemy do osadu kroplami
10 ml 0,075 M KCl (0,55% KCl).
Pozostawiamy na 17 min. w temp.
pokojowej, wirujemy 7 min, 800 obr. / min.
c)
zlewamy płyn znad osadu, a do osadu
dodajemy ok. 10 ml płynu Carnoy’a
(mieszanina metanolu i kwasu octowego
lodowatego w proporcji 3:1).
Próbówki umieszczamy w lodówce na 10 min.
Wirujemy 7 min, 800 obr. / min – czynność
powtarzamy 3-krotnie.
d)
po ostatnim wirowaniu zlewamy płyn znad
osadu, a osad nakraplamy na oziębione
szkiełka podstawowe.
e)
po wysuszeniu preparaty barwimy barwnikiem
Giemsy.
ZAKŁADANIE I PROWADZENIE
MIKROHODOWLI
Mikrohodowla stosowana jest powszechnie
w rutynowej diagnostyce noworodków i
małych dzieci.
odczynniki - jak w makrohodowli.
przygotowanie płynu hodowlanego –
jak w makrohodowli.
Mikrohodowlę zakładamy w wysterylizowanych
buteleczkach po penicylinie o pojemności 5 ml
lub w naczynkach plastikowych.
Do 2 ml płynu hodowlanego dodajemy 4 krople
(0,3 – 0,5 ml) pełnej krwi (pobranej z pięty lub
żyły ciemieniowej).
Hodowlę prowadzi się przez 72 godziny wg
tych samych procedur jak w przypadku
makrohodowli.
HODOWLA CHROMOSOMÓW
(IN VITRO)
Z KOMÓREK
SZPIKU KOSTNEGO
Bioptat szpiku (1-2 ml) należy wprowadzić
natychmiast do uprzednio przygotowanej
jałowej próbówki, zawierającej ogrzany do
37
o
C płyn hodowlany, np. RPMI 1640 z
dodatkiem 15% płodowej surowicy cielęcej
oraz antybiotyki (penicylinę,
streptomycynę) w standardowych
stężeniach. Dodatkowo próbówka powinna
zawierać heparynę w stężeniu 250 IU/ml
ZAKŁADANIE I PROWADZENIE
HODOWLI
Są dwie drogi postępowania
A.
Metoda uzyskiwania chromosomów
bezpośrednio po pobraniu komórek
ze szpiku kostnego.
B.
Metoda krótkotrwałej hodowli.
METODA BEZPOŚREDNIA
Polega na inkubacji komórek szpiku przez
1-2 godziny w pożywce zawierającej
kolcemid (25 g/ml)
Postępowanie jest zalecane w ostrych
białaczkach szpikowych i limfatycznych
METODA KRÓTKOTRWAŁEJ
HODOWLI
Hodowlę komórkową zakładamy w wyżej
opisanym płynie hodowlanym stosując
rozcieńczenie zawiesiny komórek szpiku
kostnego – 1 milion na ml hodowli.
Komórki hoduje się najczęściej przez okres 24 lub 48
godzin w cieplarce w temp. 37
o
C i 5% stężeniu CO
2
.
Mitozy blokuje się Colcemidem o stężeniu 5-10 g/ml
na okres 45-60 min. przed zakończeniem hodowli.
Szok hipotoniczny w celu odpowiedniego rozproszenia
chromosomów w jądrze przeprowadza się 0,4%
roztworem KCl lub mieszaniną o składzie:
3,0 g KCl
4,8 g HEPES
0,2 g EGTA
w 1000 ml wody o pH 7,4.
Dalsze etapy utrwalania i wykańczania hodowli
w obu metodach są podobne jak w
standardowych technikach cytogenetycznych.
W przypadku białaczek, gdy komórki
nowotworowe znajdują się we krwi
obwodowej, stosuje się 24-48 godzinne
niestymulowane mitogenami hodowle komórek
pobranych drogą nakłucia żylnego.
Zasady barwienia chromosomów komórek
szpiku są takie same, jak chromosomów
uzyskanych z innych tkanek człowieka.
HODOWLA CHROMOSOMÓW
(IN VITRO)
Z TKANEK POCHODZĄCYCH
Z GUZÓW NOWOTWOROWYCH
Transport guza
jałowe naczynie
płyn Hanksa lub Eagle’a lub
0,9% NaCl + antybiotyki: penicylina
krystaliczna (100 IU / ml), streptomycyna (100
g / ml)
Przygotowanie tkanek guza
1-3 cm
3
tkanki guza przenosimy na szalkę
Petriego
rozdrabniamy tkankę guza nożyczkami
dodajemy 2 ml płynu Hanksa z antybiotykami i
dalej rozdrabniamy.
Skład płynu hodowlanego:
płyn RPMI z penicyliną (100 IU/ml) i
streptomycyną (100 g / ml)
10-15 % v/v surowica płodowa cielęca
1 ml L-glutaminy
Przeniesienie tkanki guza do naczynka
hodowlanego NUNC,
w którym znajduje się:
5 ml płynu hodowlanego
1 ml kolagenazy o stężeniu 150-200 IU/ml
Całość pozostawiamy w cieplarce (37
o
C, 5%
CO
2
, 24 h)
po 24 godzinach rozpipetowujemy
przenosimy materiał do dużej próbówki
wirowniczej
dodajemy 10 ml płynu RPMI z antybiotykami
zamykamy i wirujemy 10 min, 1000 obr./min
po odwirowaniu dodajemy 1,5 ml płynu RPMI
ZAKŁADANIE I PROWADZENIE
HODOWLI
Zakładanie hodowli
Naczynie szklane:
•
8,5 ml płynu hodowlanego
•
1,5 ml zawiesiny komórek guza
Naczynie plastikowe:
•
4,5 ml płynu hodowlanego
•
0,5 ml zawiesiny komórek guza
Hodowlę prowadzimy w cieplarce w temp 37
o
C, z
przepływem 5% CO
2
.
Codziennie oglądamy w mikroskopie odwróconym
wzrost hodowli.
Uwaga: co 2-3 dni zmieniamy płyn hodowlany.
Zakończenie hodowli
Przy widocznych mitozach (po kilku,
kilkunastu dniach i więcej), na okres od 30
min do 2 godz. przed zakończeniem hodowli
dodajemy Colcemid w stężeniu 5-10 g/ml.
Następnie zdrapujemy „drapaczką” komórki
hodowli.
Całość zlewamy do próbówek wirowniczych
Wirujemy 10 min. 1100 obr./min
Przeprowadzenie szoku hipotonicznego
Skład płynu hipotonicznego
KCl
- 1,5 g
HEPES -
2,4 g
EGTA - 0,1 g
500 ml dejonizowanej H
2
O
pH = 7,4 doprowadzić NaOH HCl
Szok hipotoniczny prowadzimy w temp. 37
o
C,
45 min.
Wirujemy 10 min 1100 obr. / min
Utrwalanie materiału komórkowego
metanol (cz.d.a.) : lodowaty kwas octowy
(cz.d.a.) w proporcji 3:1
czynność powtarzamy 3-krotnie przez 20
minut
wirowanie – 10 min, 1100 obr./min
nakrapianie na zimne (wyjęte z wody z
lodem) szkiełka podstawowe.
Szybki wzrost komórek:
możliwość zahamowania kontaktowego
wzrostu
wykonujemy wtedy pasażowanie w
użyciem roztworu trypsyny i zakładamy
2 hodowle z 1
Brak przyczepu komórek do ścianki
naczynia hodowlanego:
zakładamy ponownie hodowlę w
buteleczkach z Vitrogenem
(Kollagen)
Dodatkowe czynności, które mogą
być wykonane w czasie
prowadzenia hodowli:
Nadmiar erytrocytów:
Płuczemy komórki hodowlane w płynie
niszczącym erytrocyty
Bufor do rozpuszczania erytrocytów:
•
NH
4
Cl -
8,29 g
•
KHCO
3
-
1,0 g
•
EDTA - 0,0371 g
Rozpuścić w 1000 ml H2O destylowanej
Bufor wstawić do autoklawu na 15 min.
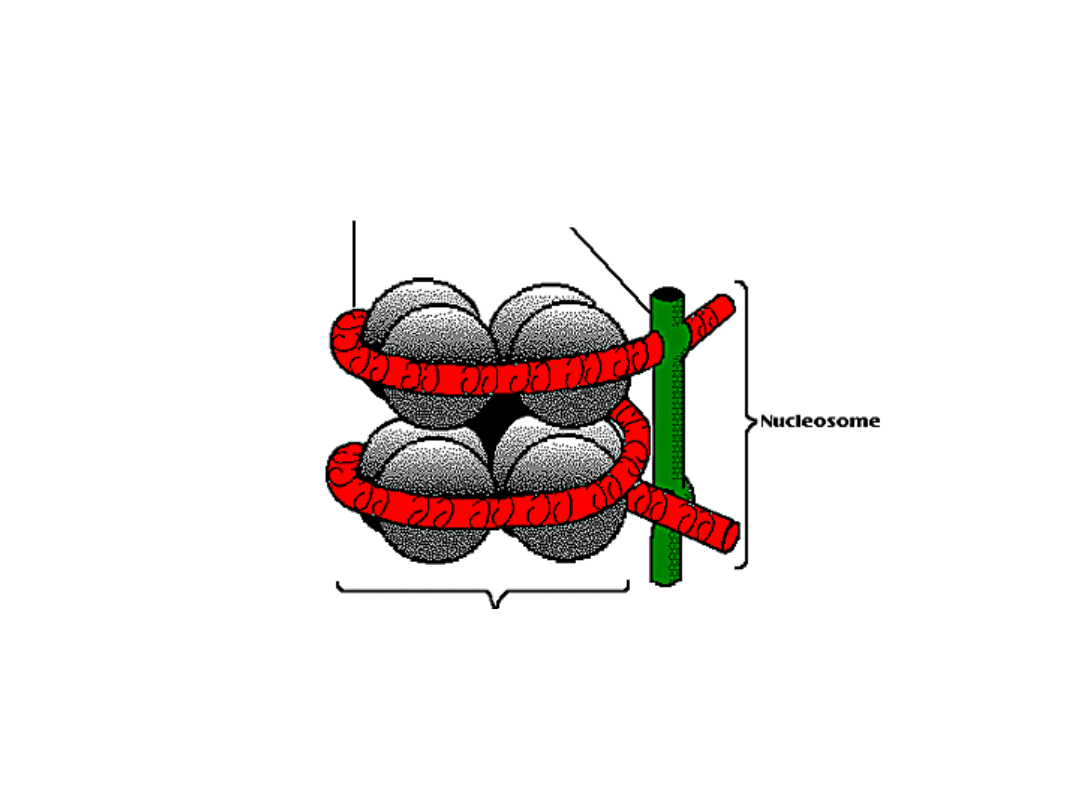
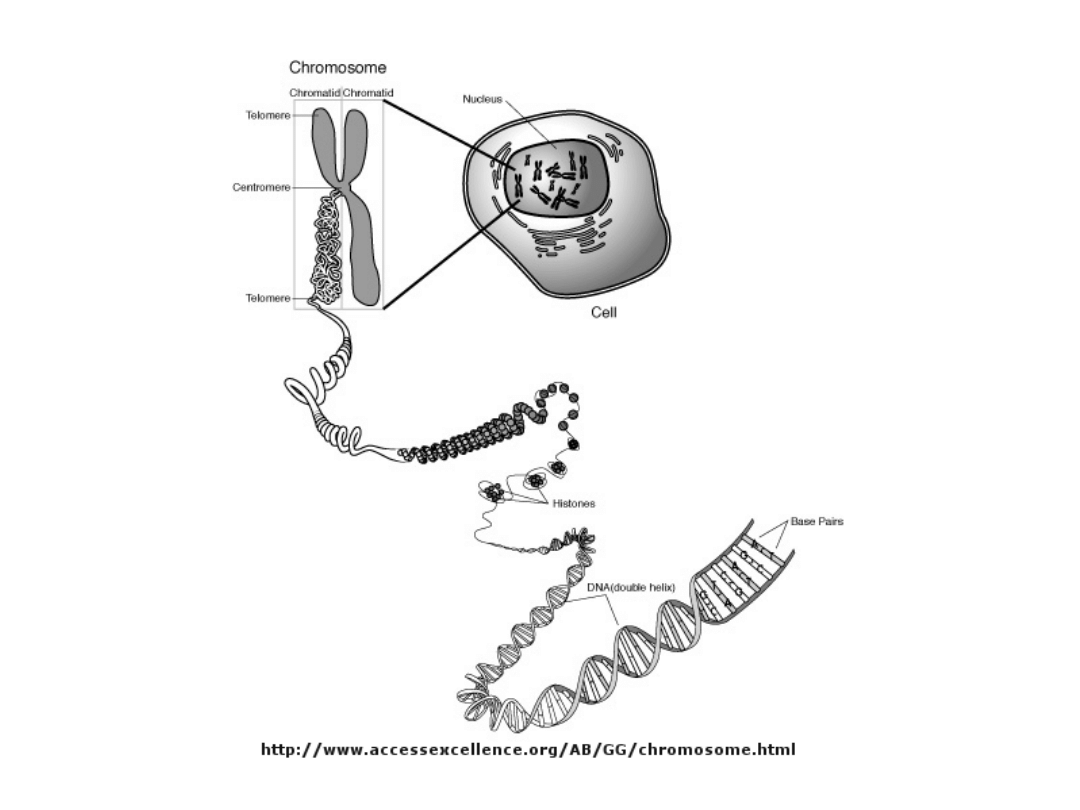
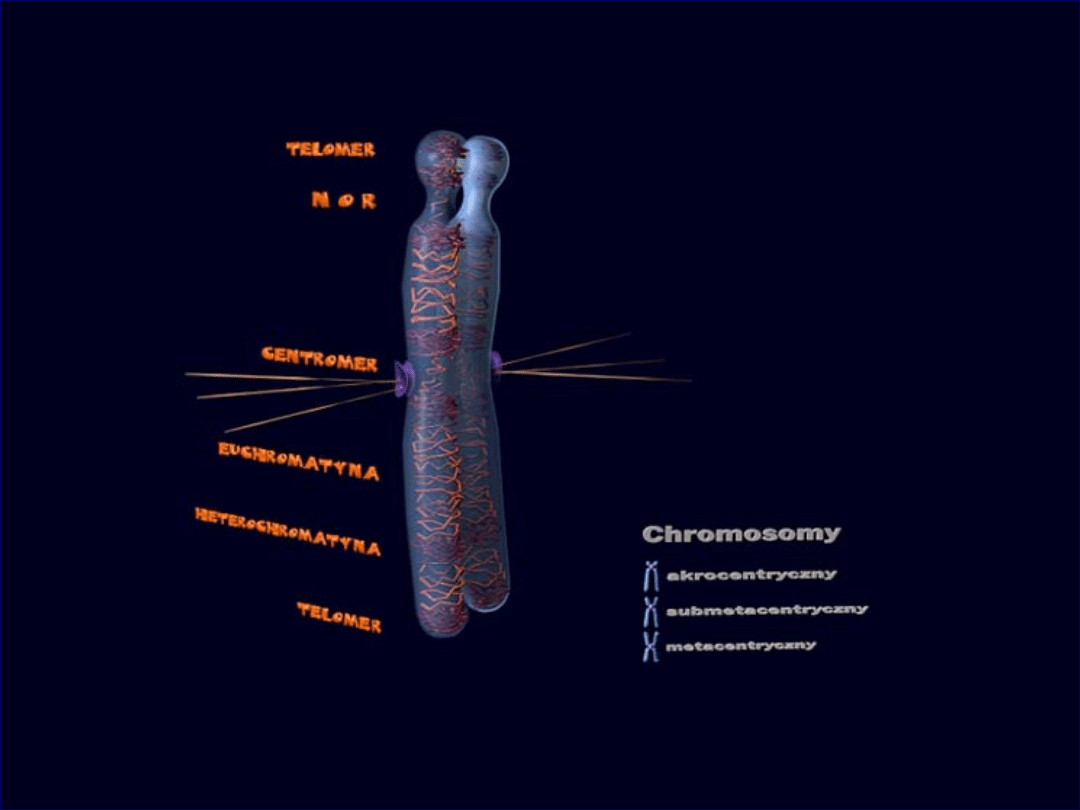
Budowa nukleosomu
DNA
histon H1
8 cząsteczek histonów
rdzeniowych
Nukleosom

11nm
30nm
300nm
700nm
1400nm
2nm
Skondensowany fragment
chromosomu metafazowego -
minipasmo
Fragment podwójnej helisy
DNA
Nukleosomy
Włókno chromatynowe
(solenoid) z upakowanych
nukleosomów
Fragment „rozwiniętego”
chromosomu - pętle
Chromosom
metafazowy
Alberts, et al. Molecular Biology of the Cell, 3rd edn
2
nm
10
nm
30
nm
300
nm
700
nm
1400
nm
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Metody reologiczne w analizie żywności
Prelekcja 10 - cz 2 - Mutacje chromosomowe człowieka, Genetyka
09 metody zintegrowanej analizyid 7959
Metody wykorzystywane w analizie ekonomicznej, Szkoła, Analiza ekonomiczna
Analiza ekonomiczna (33 strony), Rozdział I PROBLEMY METODYCZNE WYKORZYSTANIA ANALIZ
metody badan, ANALIZA WYTWORËW UCZNIOWSKICH
13 WYZNACZENIE ŚRODKA ZGINANIA b, Budownictwo PG, sem4, MDwAK, Metody doświadczalne w analizie konst
2 Metody planowania i analizy strategicznej
MDcw1, Politechnika Gdańska Budownictwo, Semestr 4, Metody doświadczalne w analizie konstrukcji, Spr
dziedziczenie sprzężone z chromosomem x u człowieka
02a Opis Metody wstepnej analizy zagrozen PHA, BHP, Ocena Ryzyka Zawodowego
06 ANALIZA SEKWENCJI CZLOWIEKA A
więcej podobnych podstron