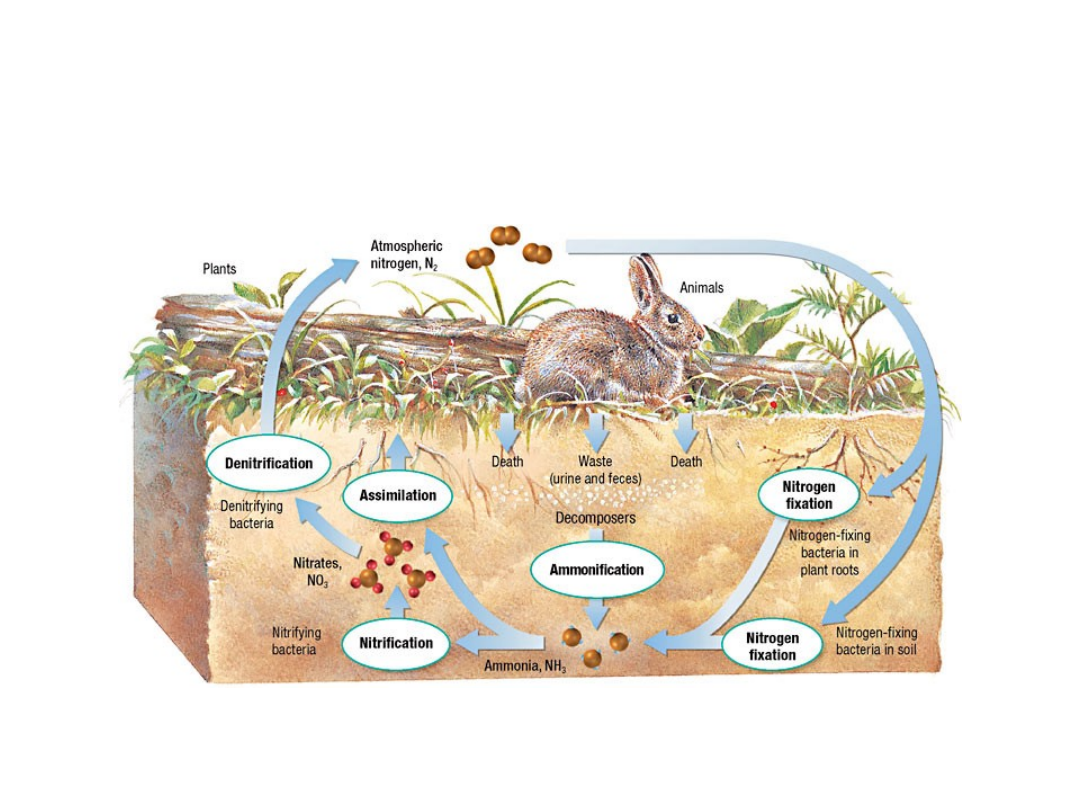
ASYMILACJA AZOTU PRZEZ ROŚLINY

BAKTERIE WOLNOŻYJĄCE
• Clostridum
• Bakterie anaerobowe, szeroko rozpowszechnione w glebach.
Wysoka odporność na niesprzyjające warunki zewnętrzne.
Szybki wzrost
• Azotobacter
• Typowy przedstawiciel bakterii wiążących azot. Szeroko
rozpowszechniony w zbiornikach wodnych i glebach. Wysoka
intensywność oddychania i intensywność wiązania azotu, ok. 1
g/m
2
w ciągu roku.
• Anaeroby fakultatywne
• Znaczenie we wzbogaceniu gleby w azot nie w pełni
wyjaśnione
• Nostocaceae, Scytonemataceae, Rivulariaceae,
Microchaetaceae (sinice)
• Ważna funkcja gospodarcza na polach ryżowych

BAKTERIE SYMBIOTYCZNE
• Większość bakterii
symbiotycznych (Rhizobium)
wykazuje zdolność do
wiązania azotu
atmosferycznego w symbiozie
z roślinami wyższymi
• Proces wiązania azotu
odbywa się w bakteroidach
brodawek
• Występująca w brodawkach
leghemoglobina
odgrywa rolę
czynnika regulującego dostęp
tlenu do bakteroidów
• Nitrogenaza
jest
odpowiedzialna za wiązanie i
redukcję azotu
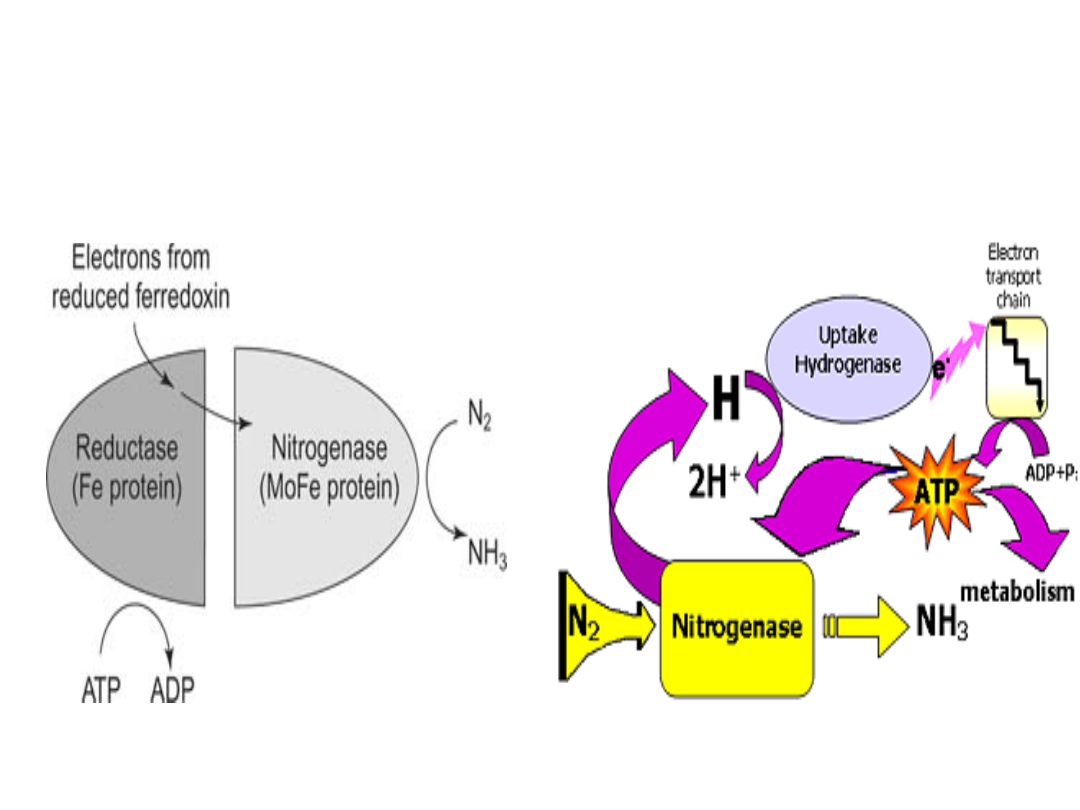
NITROGENAZA
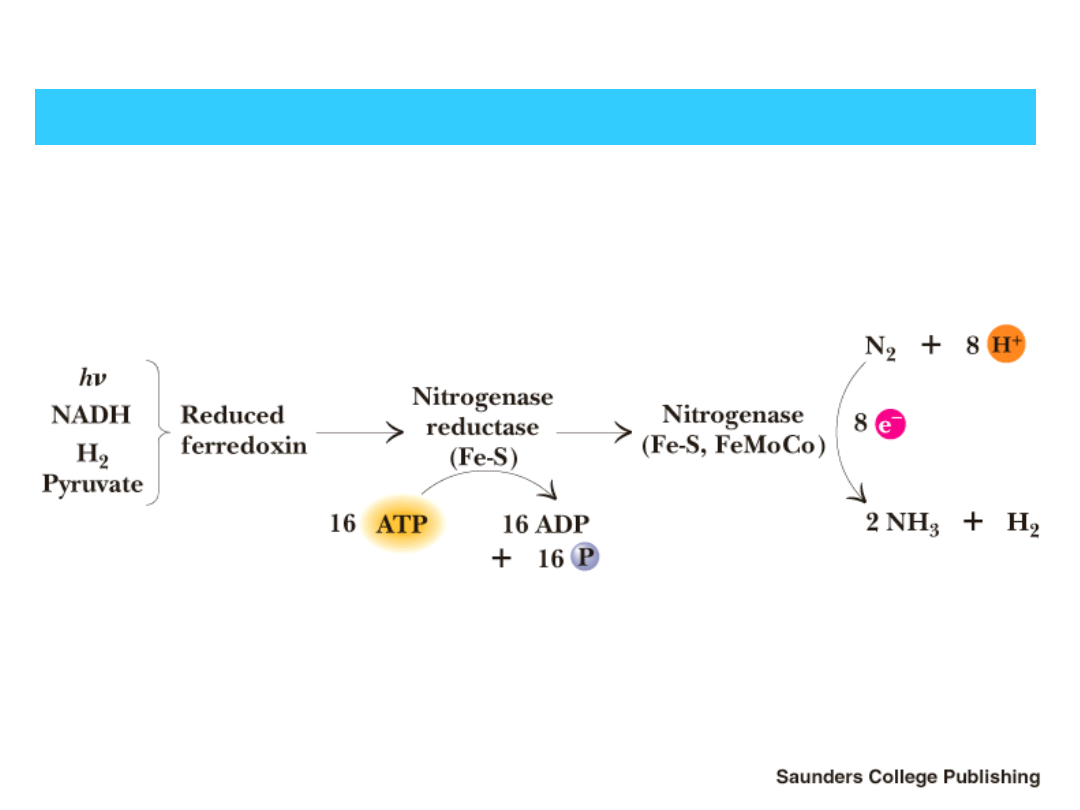
TRANSPORT ELEKTRONÓW DO NITROGENAZY
TRANSPORT ELEKTRONÓW DO NITROGENAZY
Accumulati
on of
electrons
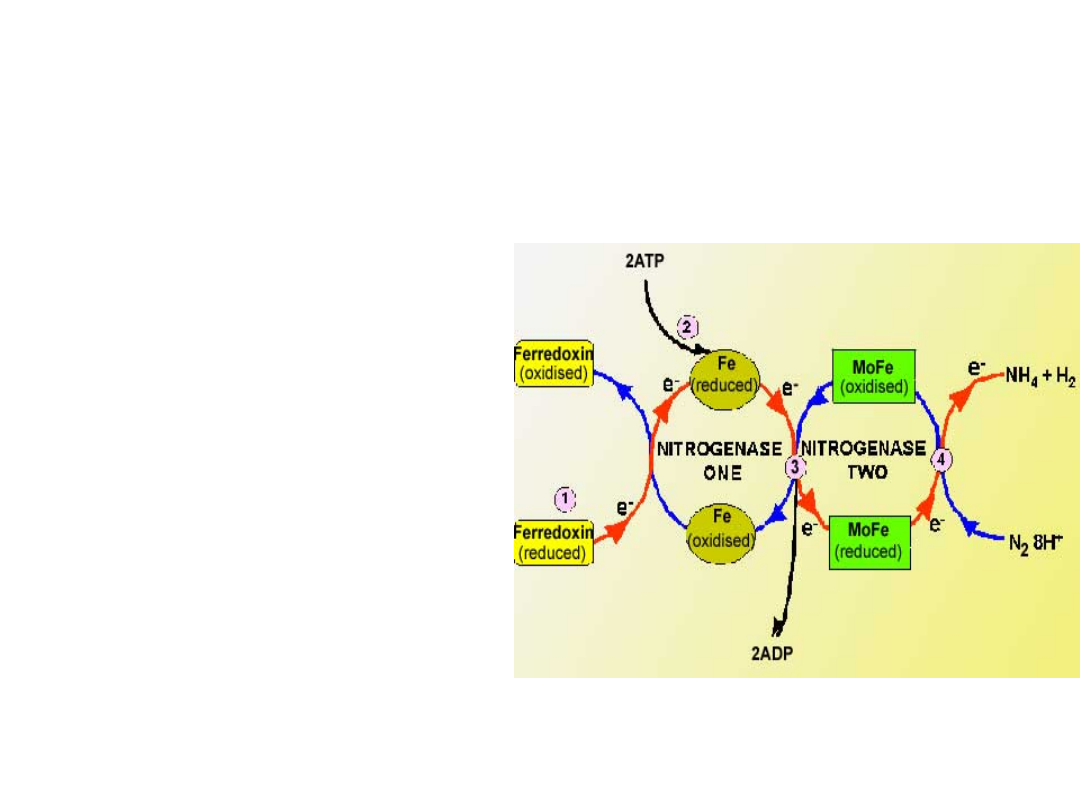
NITROGENAZA
• U wszystkich
organizmów wiążących
azot pierwotnym
stabilnym produktem
jest amoniak
• Amoniak jest
przekazywany tkankom
brodawki i w nich
wykorzystywany na
drodze aminowania
ketokwasów
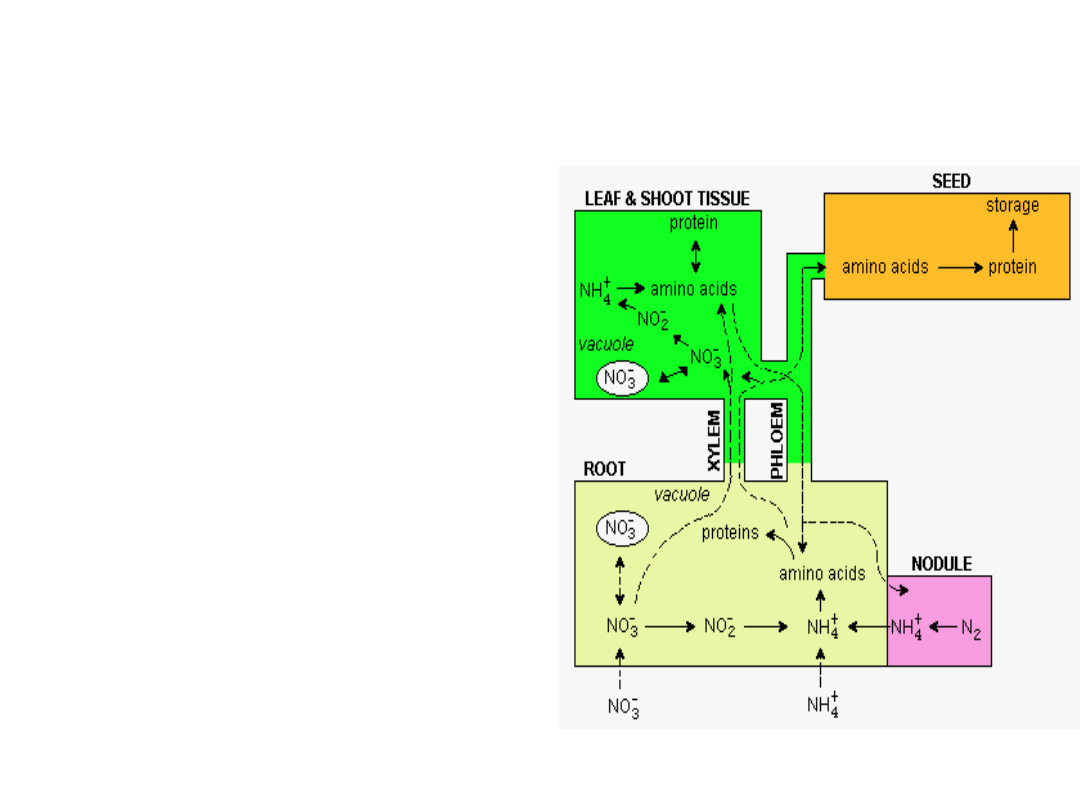
TRANSPORT AMINOKWASÓW
• Amoniak produkowany
przez bakteroidy jest
głównie wykorzystywany w
syntezie kwasu
glutaminowego w
obecności dehydrogenazy
glutaminianowej oraz w
syntezie glutaminy
katalizowanej przez
syntetazę glutaminową
• Aminokwasy i amidy
produkowane w
brodawkach są następnie
rozprowadzane po całym
organizmie rośliny-
gospodarza
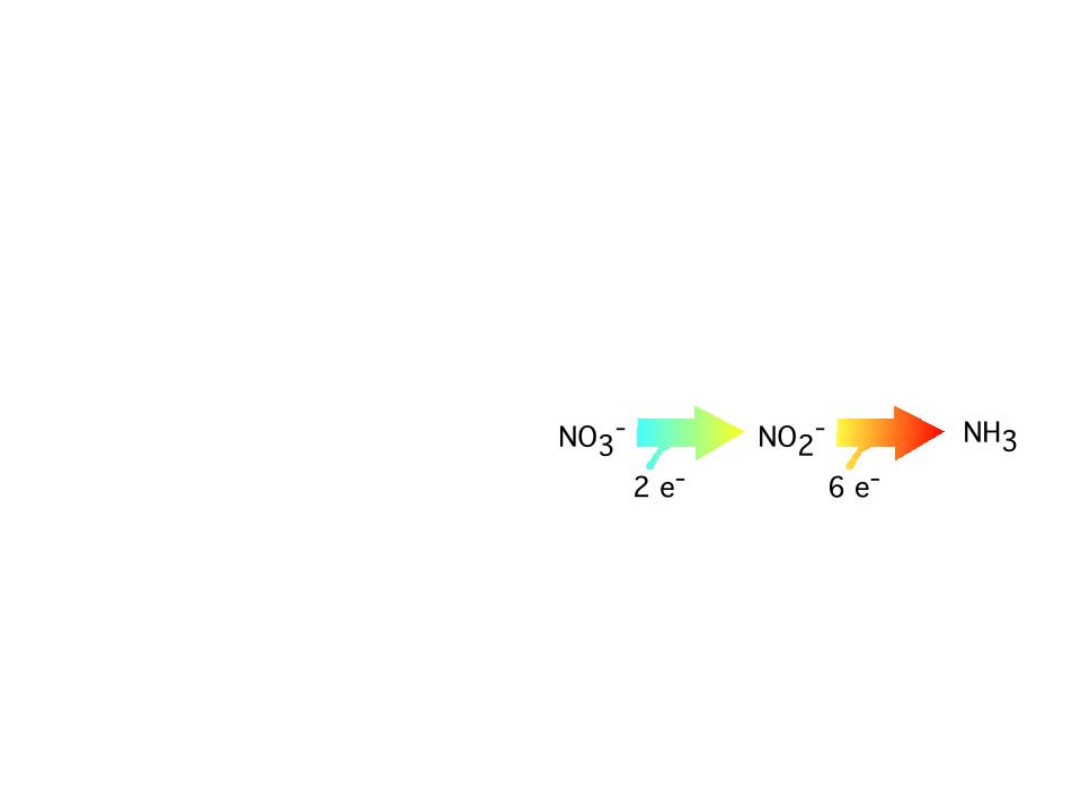
PRZYSWAJANIE AZOTANÓW PRZEZ ROŚLINY WYŻSZE
• W tkankach roślin mogą
nagromadzać się duże ilości
azotanów , gdyż nie
przejawiają one w stosunku do
rośliny właściwości
toksycznych
• Jedyną formą azotu, która
może być wykorzystywana
przez rośliny do biosyntezy
związków organicznych jest
zredukowana forma azotu
(amoniak)
• W tkankach roślin występują
dwie formy reduktaz:
azotanowa i azotynowa, które
katalizują ciągły proces
redukcji azotanów do
amoniaku
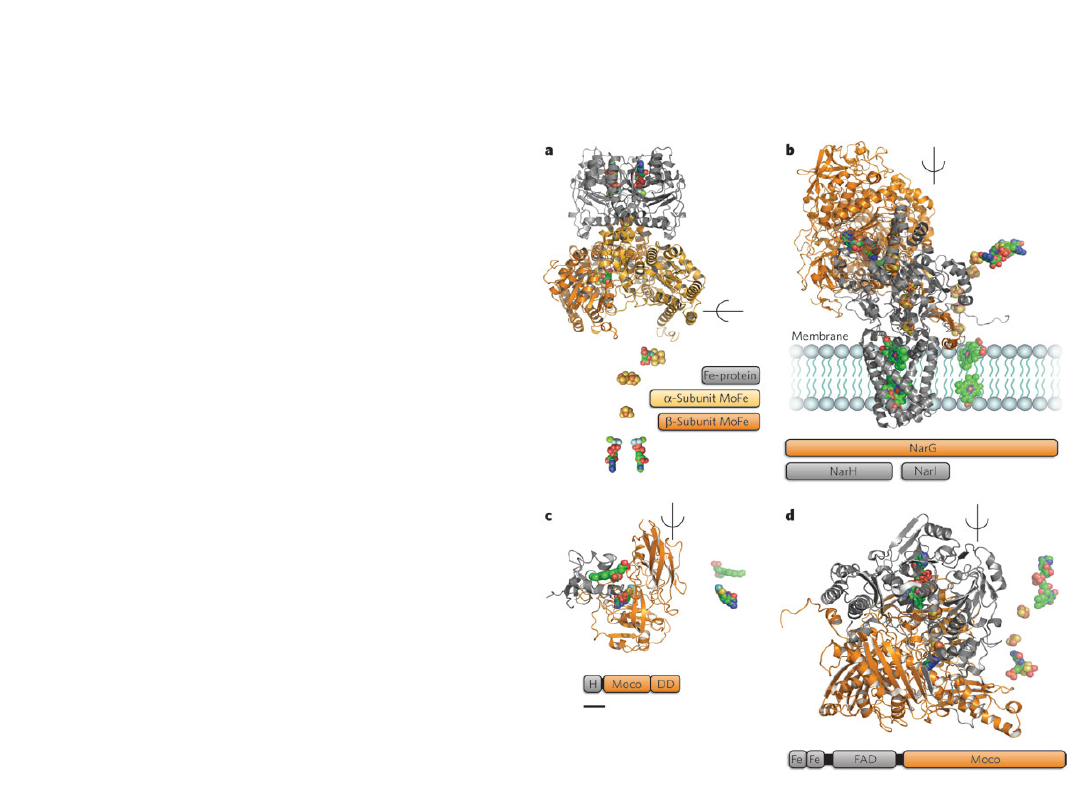
REDUKTAZA AZOTANOWA
• Reduktaza azotanowa jest
kompleksem enzymatycznym
zlokalizowanym w
cytoplazmie
• FAD i Mo występują jako
grupy prostetyczne
• Masa cząsteczkowa waha się
pomiędzy 500 a 600 kDa
• Dawcą elektronów jest NADH
• Jako pierwszy enzym szlaku
redukcji azotanów odgrywa
rolę regulatorową przemian
azotanowych w roślinach
REGULACJA AKTYWNOŚCI REDUKTAZY AZOTANOWEJ
• Enzym indukcyjny tzn.
wytwarzany tylko w
obecności azotanów
• Redukcja azotanów
związana z rozpadem
cukrów i dlatego jej
aktywność zależy od
oświetlenia i stężenia
dwutlenku węgla

REDUKTAZA AZOTYNOWA
• Reduktaza azotynowa
katalizuje redukcję azotynów
do amoniaku
• Masa cząsteczkowa 60-64 kDa
• Występuje w chloroplastach
• Dawcą elektronów w tym
procesie jest ferredoksyna
• Redukcja azotanów do
amoniaku wymaga
przeniesienia 8 elektronów
• Ze względu na zużywanie
dużej ilości energii
promieniowania słonecznego
proces ten przebiega przede
wszystkim w zielonych
częściach roślin
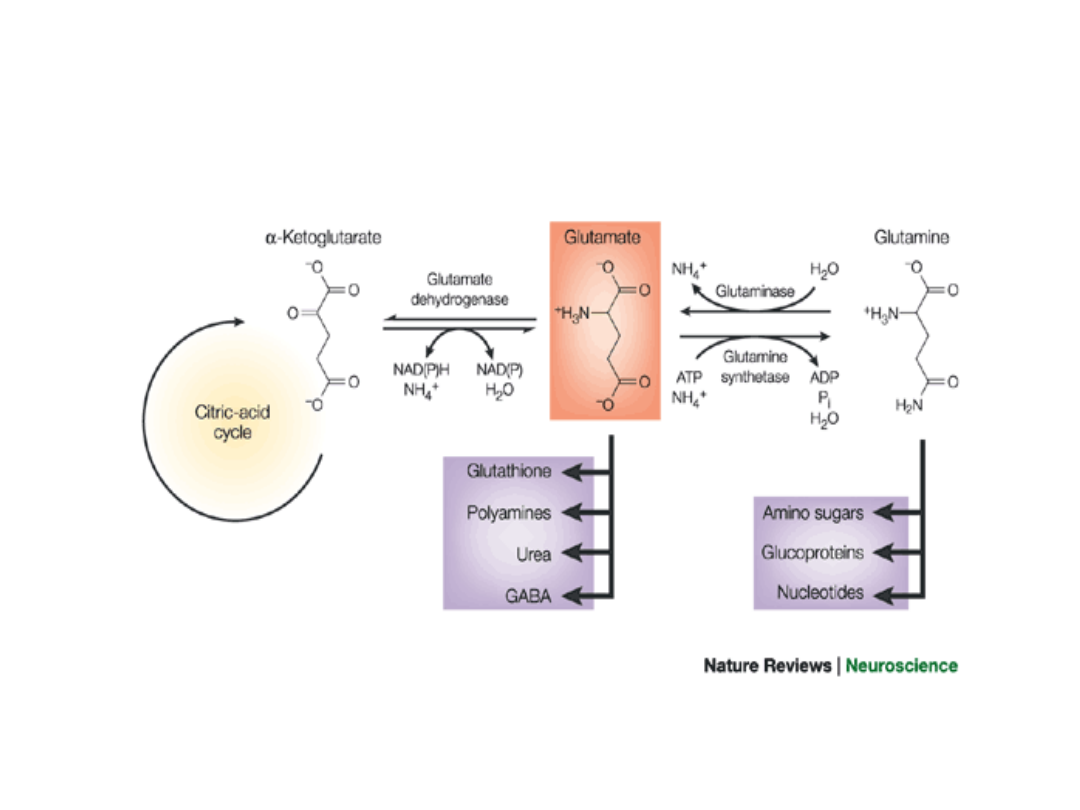
ASYMILACJA AMONIAKU (pierwotna synteza
aminokwasów)
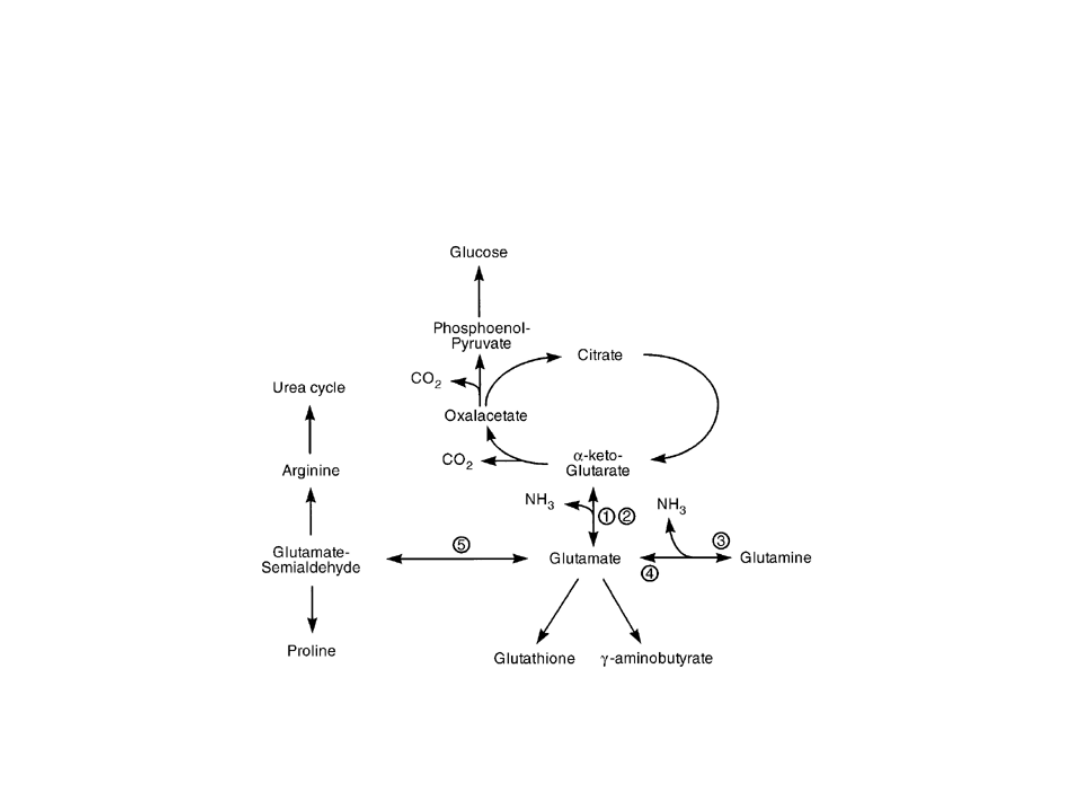
Dehydrogenaza glutaminianowa
.
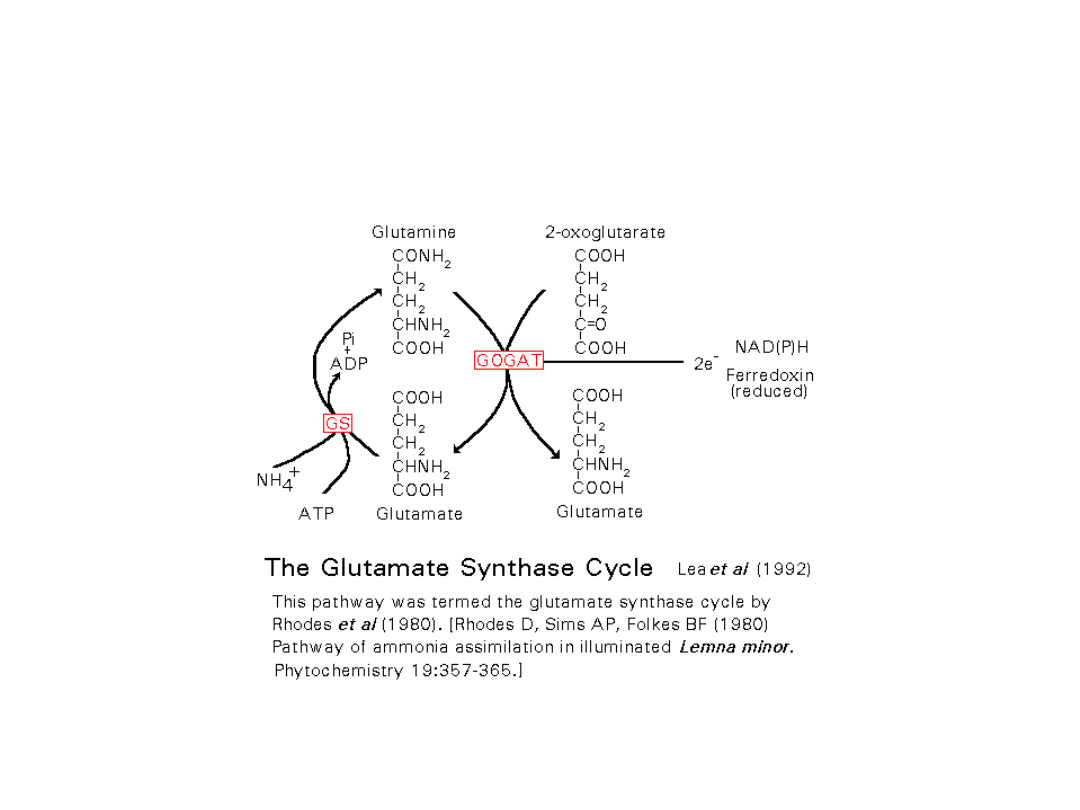
CYKL GS-GOGAT
GS- SYNTAZA GLUTAMINIANOWA
GOGAT –AMINOTRASFERAZA GLUTAMINIAN:2-OKSOGLUTARAN
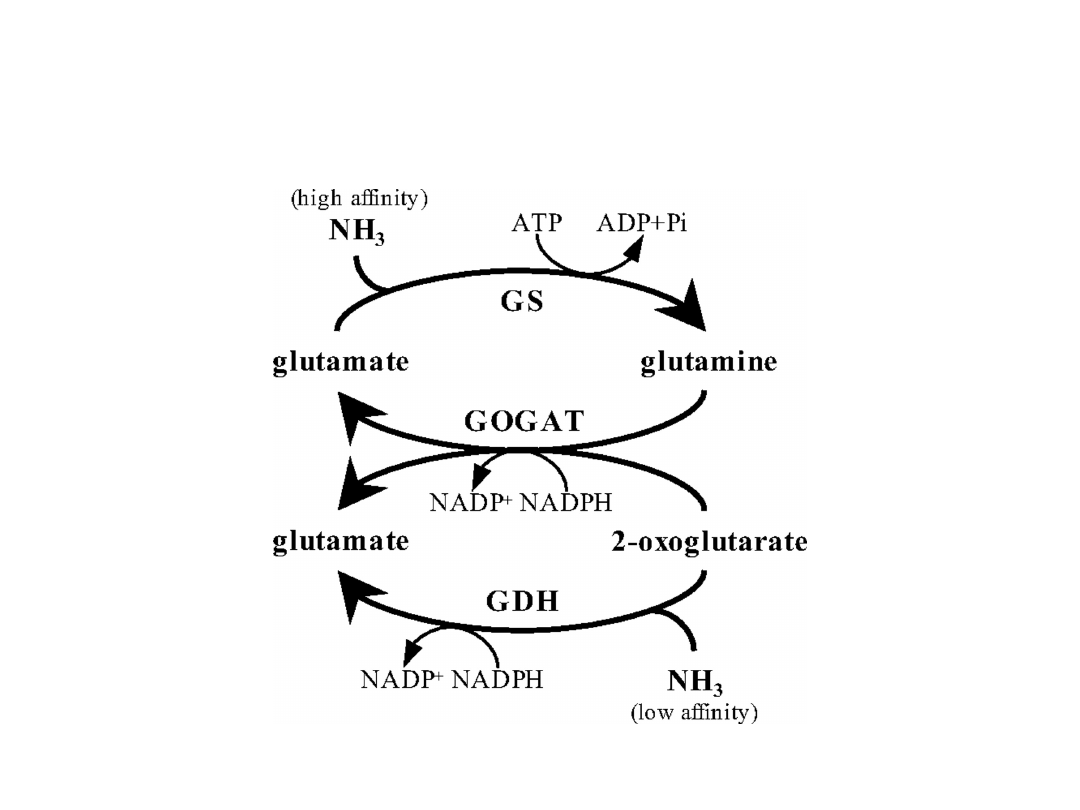
CYKL GS-GOGAT
ROZKŁAD AMINOKWASÓW

Aminokwasy występujące w organizmie w
nadmiarze
nie mogą być magazynowane. Nie są
również wydalane
• Nadmiar aminokwasów jest wykorzystywany jako
materiał energetyczny
• Grupa α-aminowa aminokwasu jest odłączana od
aminokwasu
• Powstały szkielet węglowy jest przekształcany do
głównego intermediatu metabolicznego
• Większość grup aminowych aminokwasów
występujących w nadmiarze ulega przekształceniu w
mocznik
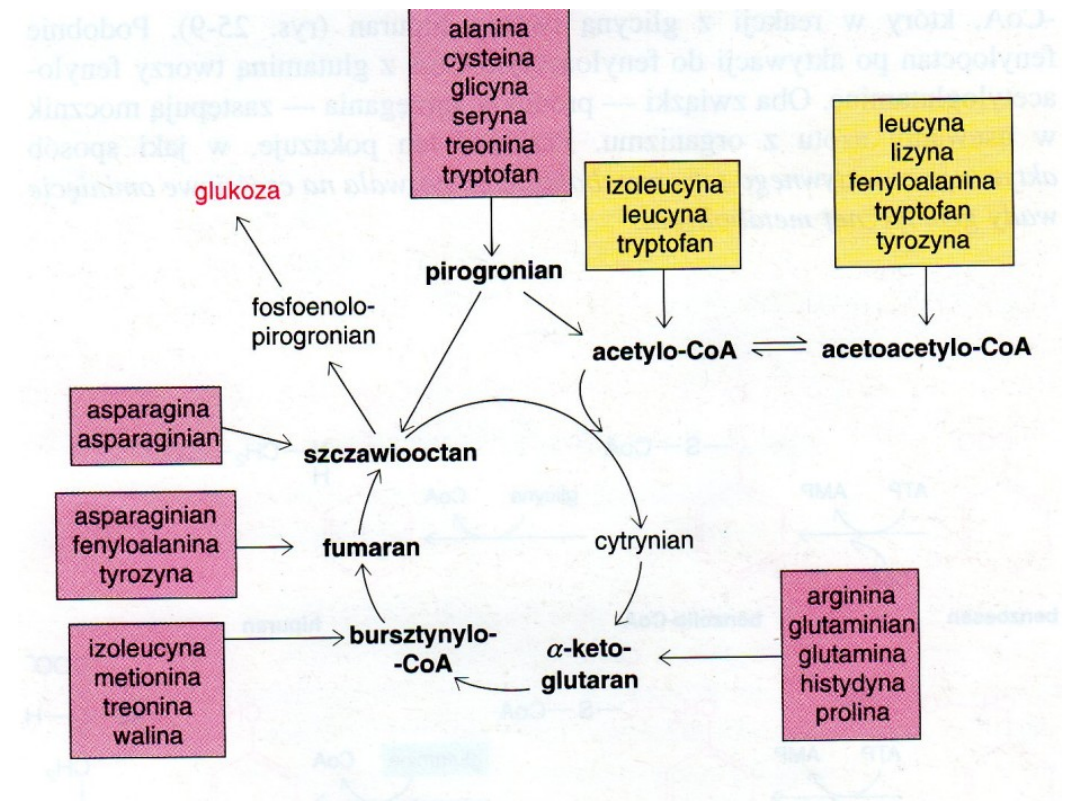
• Szkielety węglowe aminokwasów są przekształcane
w acetylo-CoA, pirogronian lub jeden z
intermediatów TCA
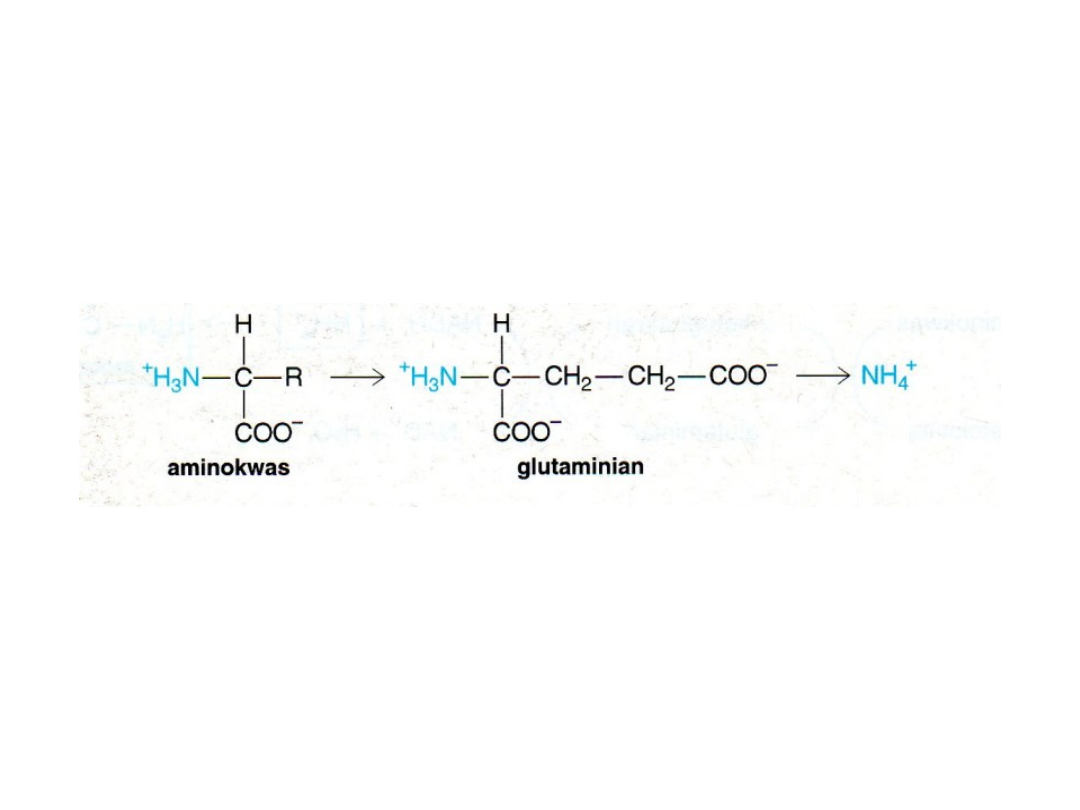
Grupy α-aminowe ulegają przekształceniu w jony
amonowe przez
oksydacyjną deaminację
glutaminianu
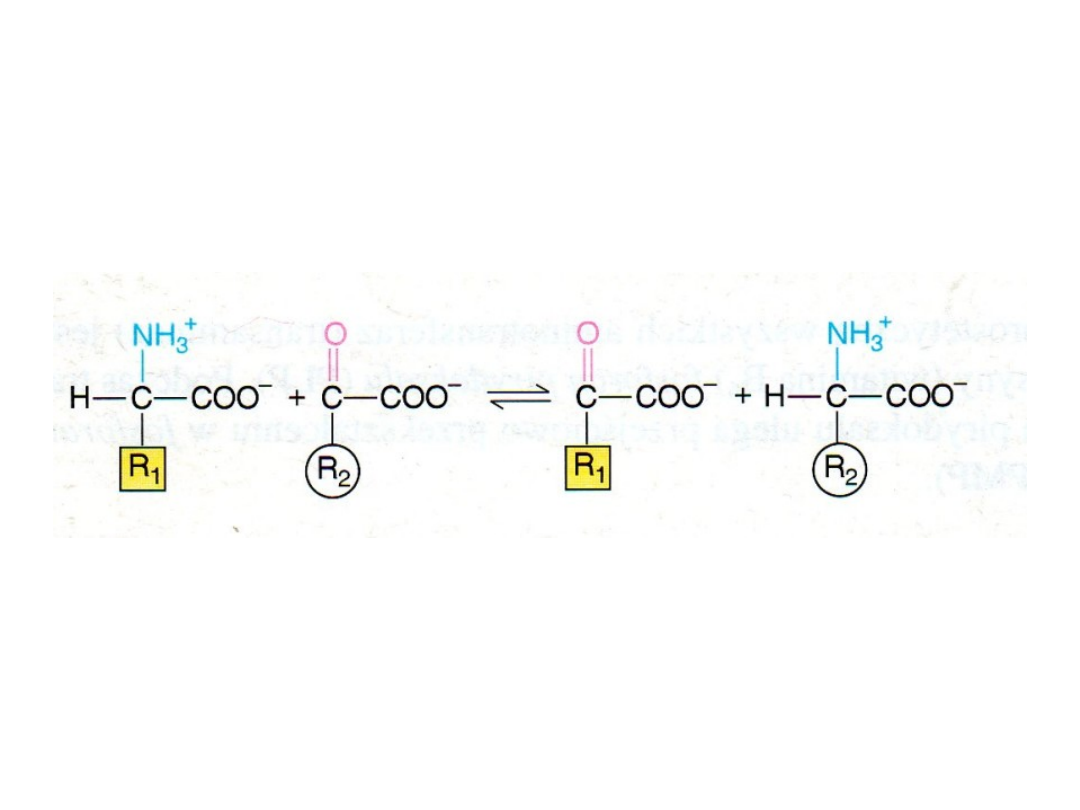
Przeniesienie grup α-aminowych z α-aminokwasu na α-ketokwas
katalizują
aminotransferazy (transaminazy)
Ogólnie aminotransferazy skierowują spływ grup aminowych z różnych
aminokwasów na α-ketoglutaran w celu przemiany w NH
4+

Aminotransferazy
• Aminotransferaza asparaginianowa:
Asparaginian + α-ketoglutaran ↔ szczawiooctan +
glutaminian
• Aminotransferaza alaninowa
Alanina + α-ketoglutaran ↔ pirogronian +
glutaminian
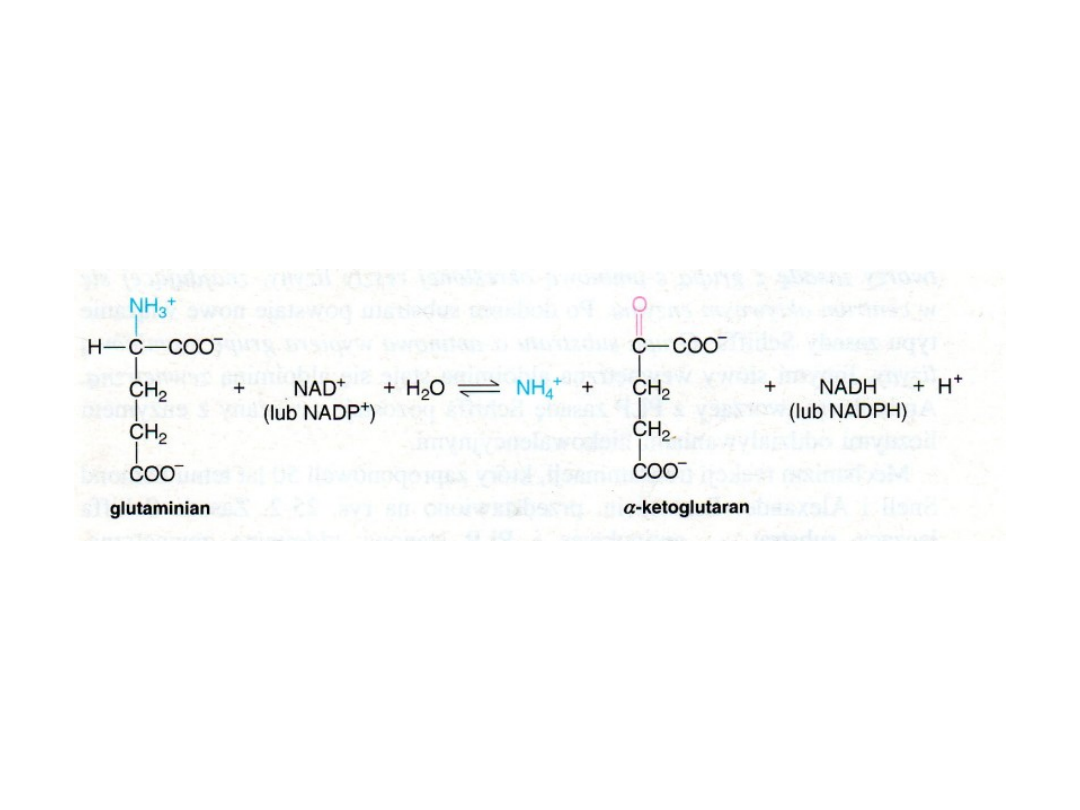
Jony amonowe powstają w procesie oksydacyjnej
deaminacji glutaminianu
Reakcję tę katalizuje
dehydrogenaza glutaminianowa;
może ona
wykorzystywać
jako akceptory wodoru zarówno
NAD jak i NADP
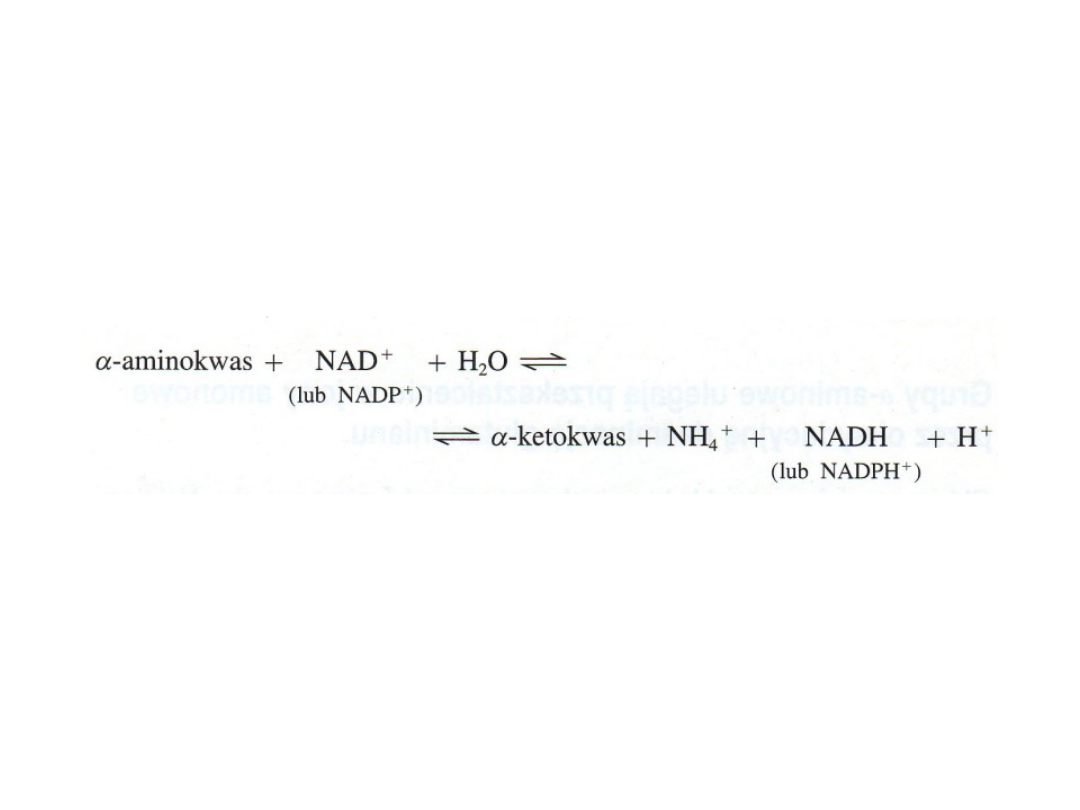
Po zsumowaniu reakcje katalizowane przez
transaminazy i przez dehydrogenazę glutaminianową
można przedstawić równaniem:
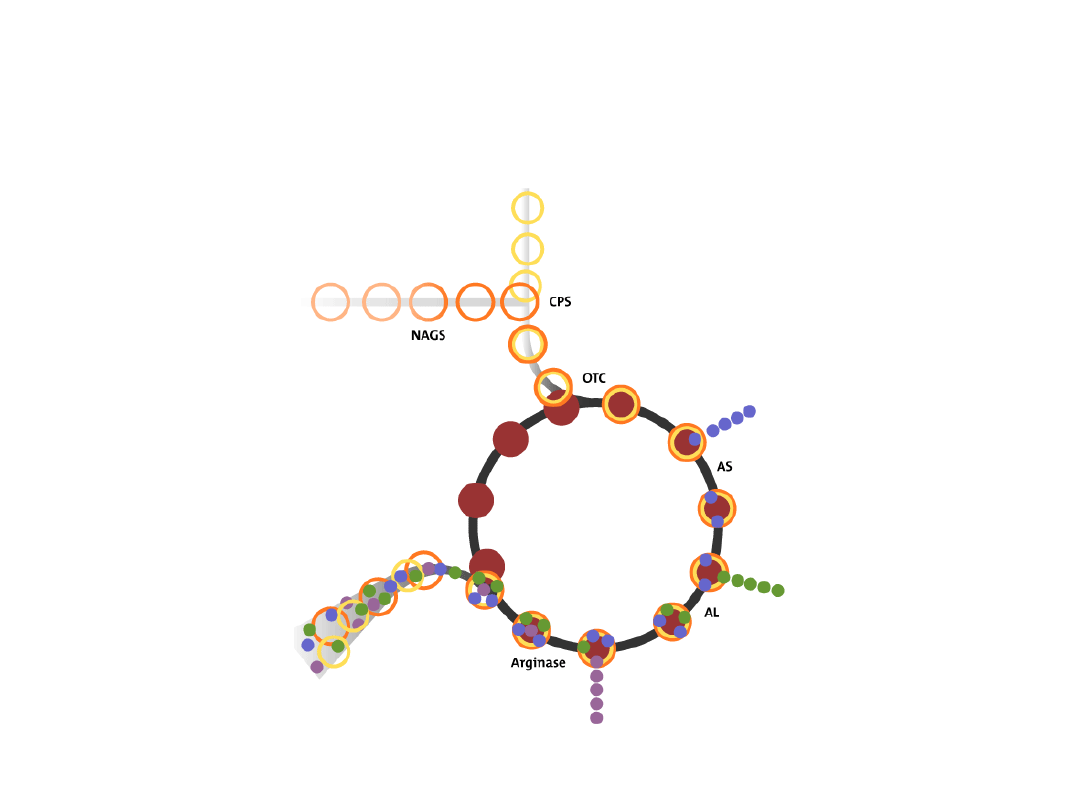
CYKL MOCZNIKOWY
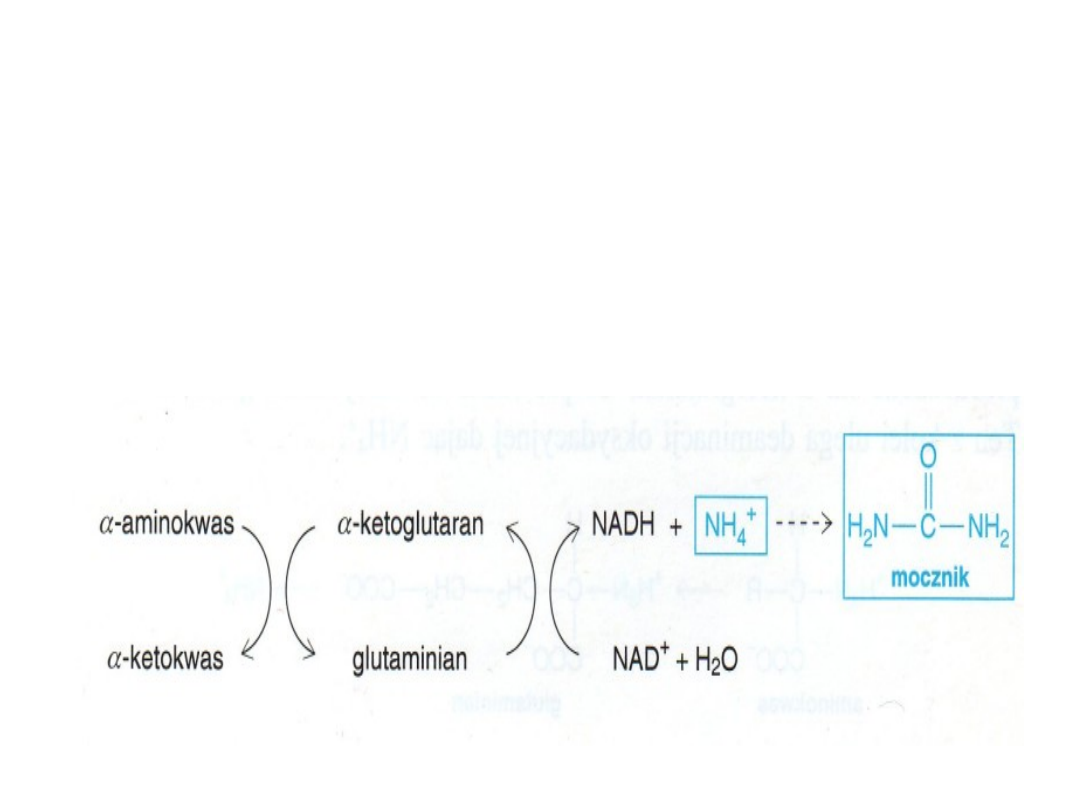
W organizmach kręgowców lądowych jony amonowe
ulegają dalszym przemianom tworząc mocznik i w tej
postaci są wydalane. Mocznik nie nagromadza się w
tkankach roślin wyższych ponieważ jest hydrolizowany
do amoniaku i dwutlenku węgla przez urazę
(amidohydrolazę mocznika).
Główna funkcja u roślin: detoksykacja jonów amonowych
oraz wytwarzanie argininy występującej w białkach
zapasowych
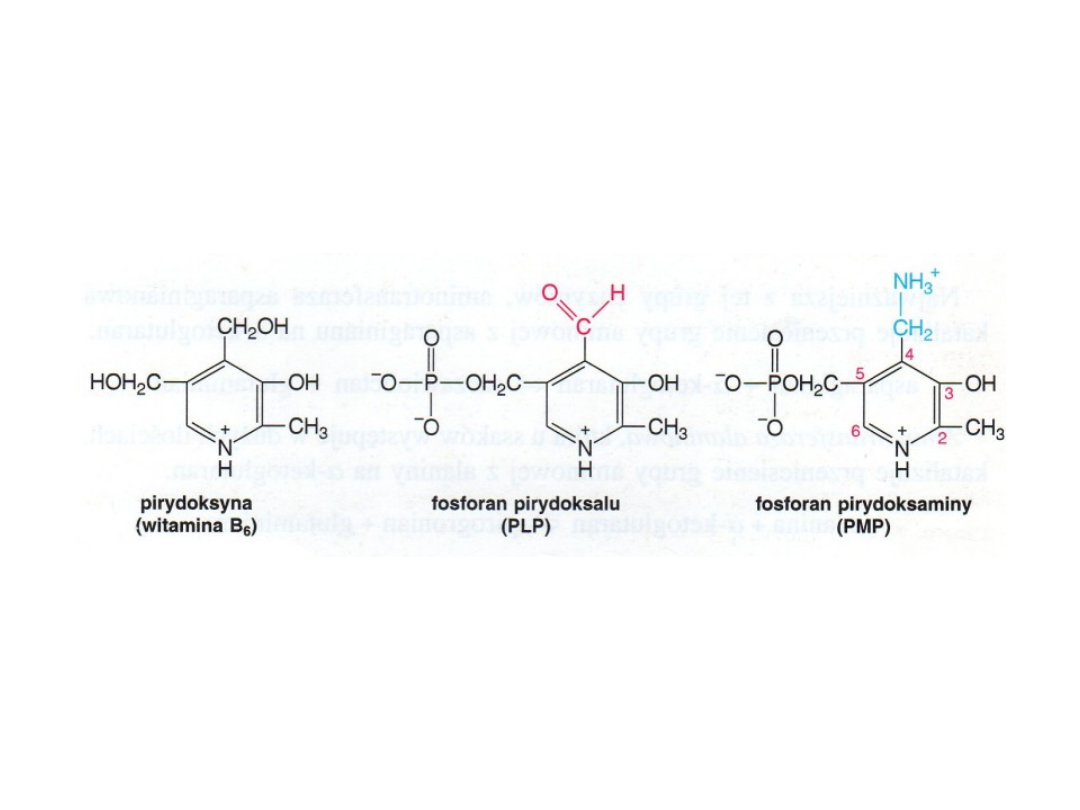
Grupa prostetyczna aminotransferaz, fosforan pirydoksalu tworzy
intermediaty o charakterze zasady Schiffa

CYKL MOCZNIKOWY
• Ptaki i gady lądowe przed wydaleniem
przekształcają grupy amonowe w kwas
moczowy
organizmy urykoteliczne
• Zwierzęta wodne wydalają bezpośrednio jony
amonowe
organizmy amonoteliczne
• Kręgowce lądowe wydalają nadmiar jonów
amonowych w postaci mocznika
organizmy
ureoteliczne
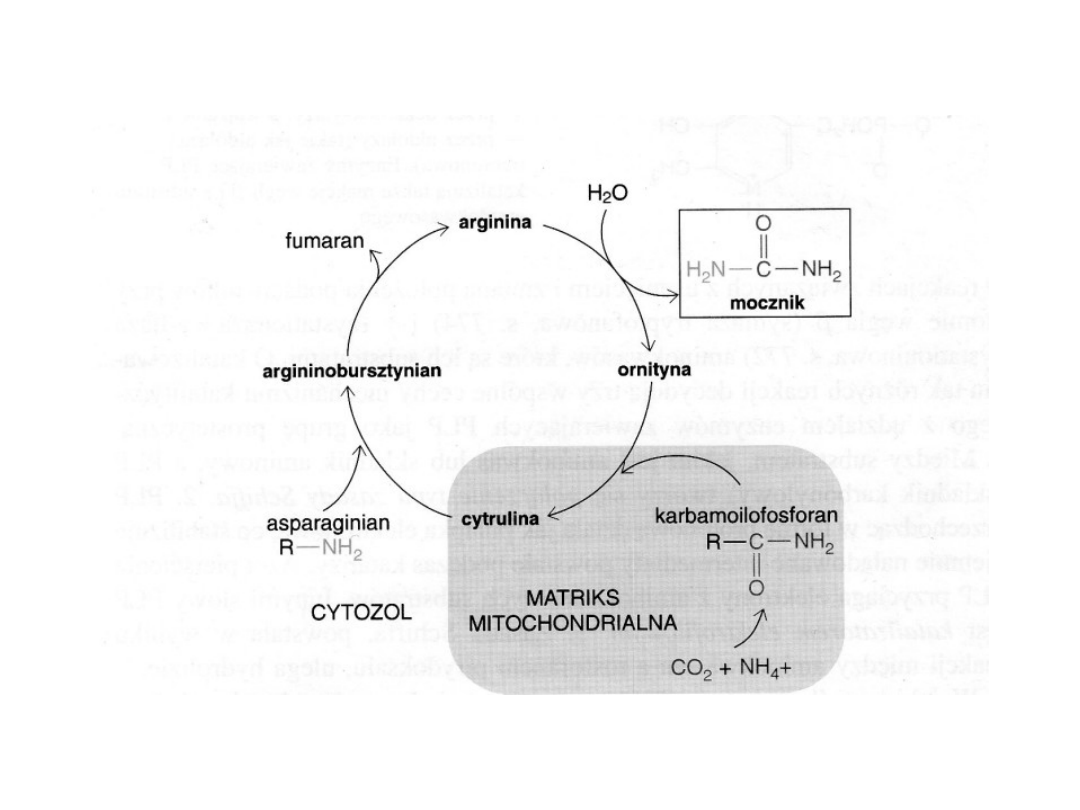
Cykl mocznikowy był pierwszym dobrze poznanym
cyklicznym torem metabolicznym (H. Krebs i K. Henseleit 1932)
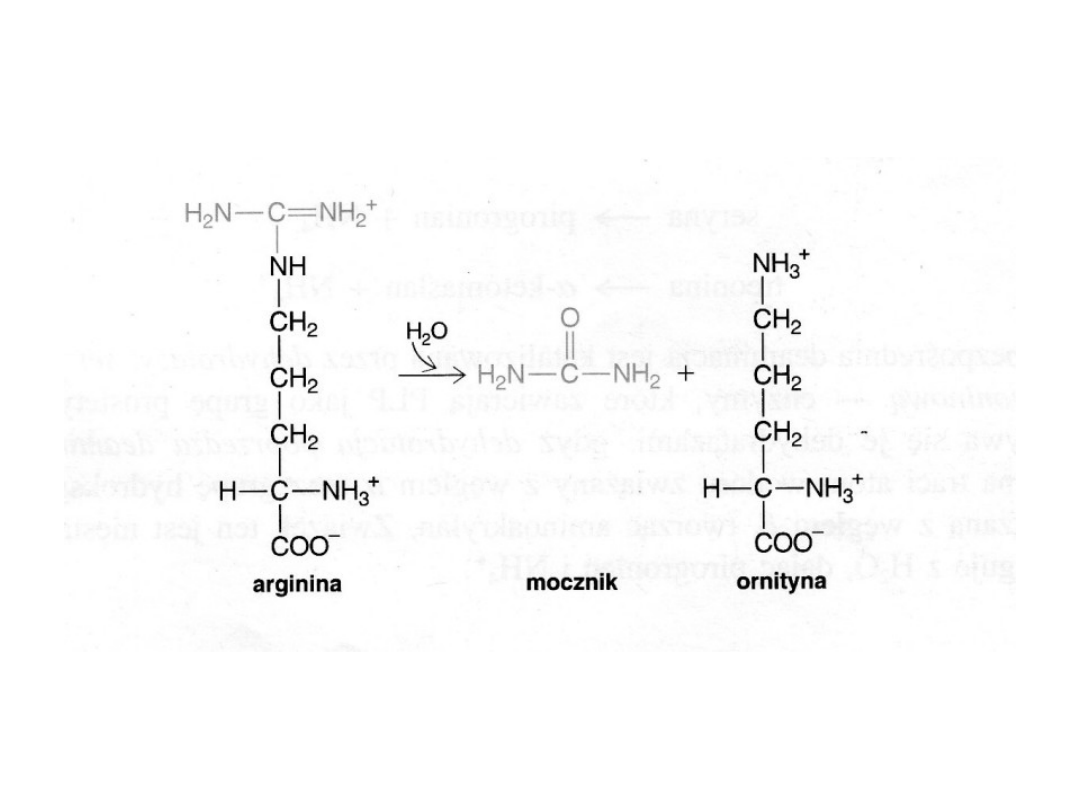
Bezpośrednim prekursorem mocznika jest arginina, która z udziałem
arginazy ulega hydrolizie do mocznika i ornityny
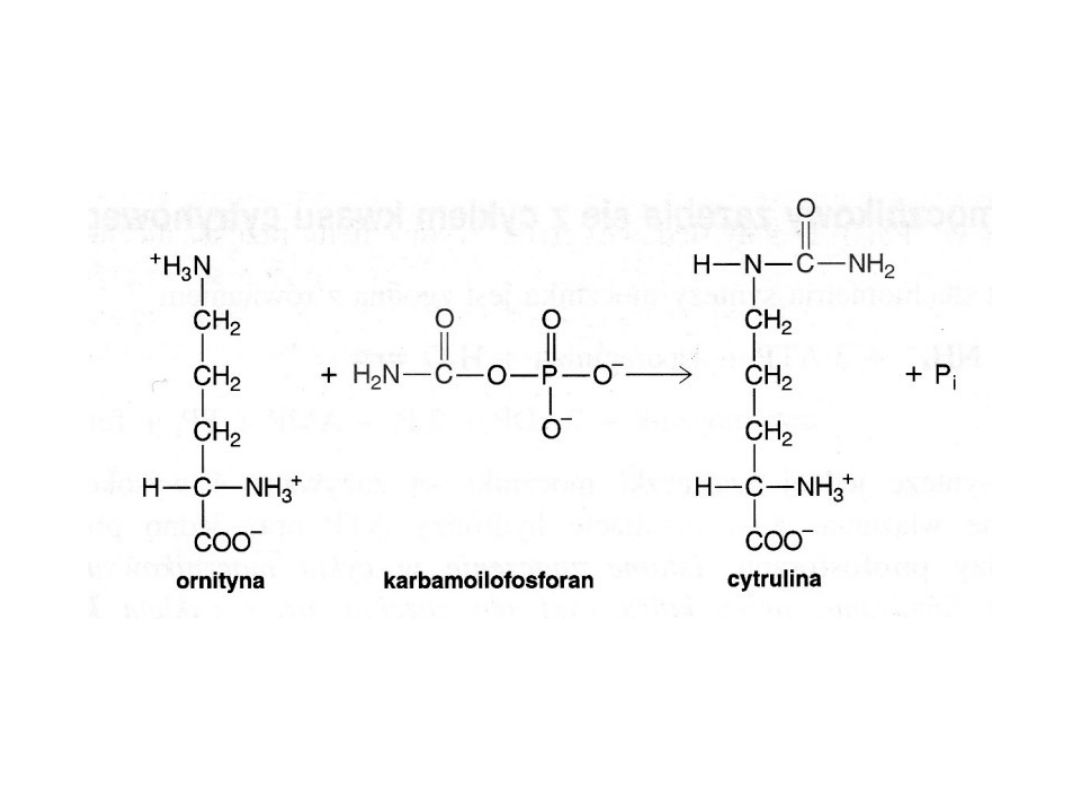
Pozostałe reakcje cyklu mocznikowego prowadzą do syntezy argininy
z ornityny
Najpierw na ornitynę zostaje przeniesiona grupa karbamoilowa, co
prowadzi do
powstania cytruliny. Reakcję tę katalizuje karbamilotransferaza
ornitynowa
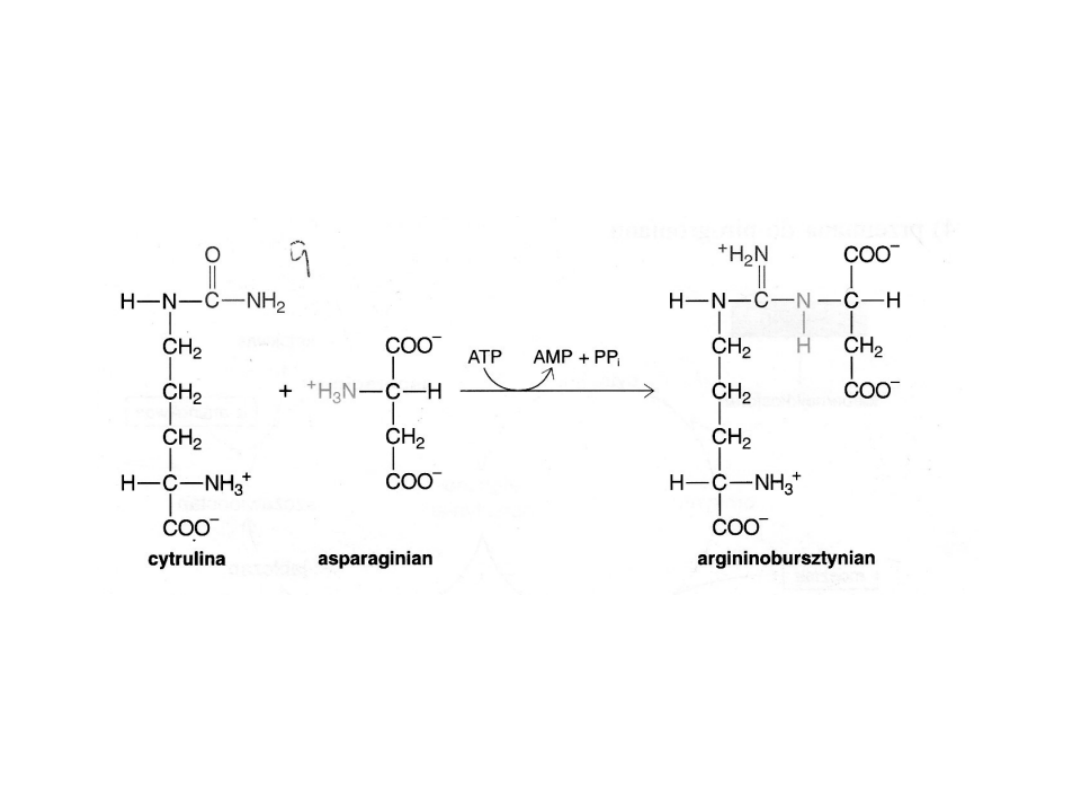
W następnym etapie syntetaza argininobursztynianowa katalizuje kondensację
cytruliny z asparaginianem. Reakcja ta przebiega kosztem energii ATP
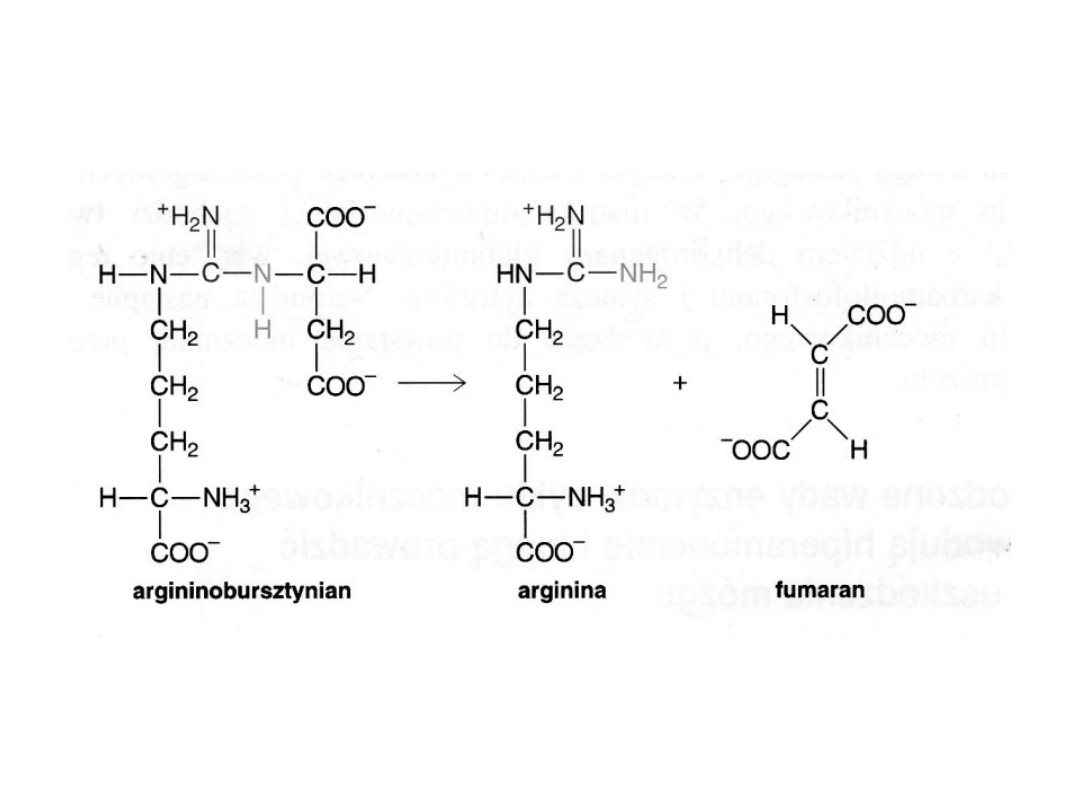
Liaza argininobursztynianowa rozszczepia argininobursztynian na argininę i fumaran
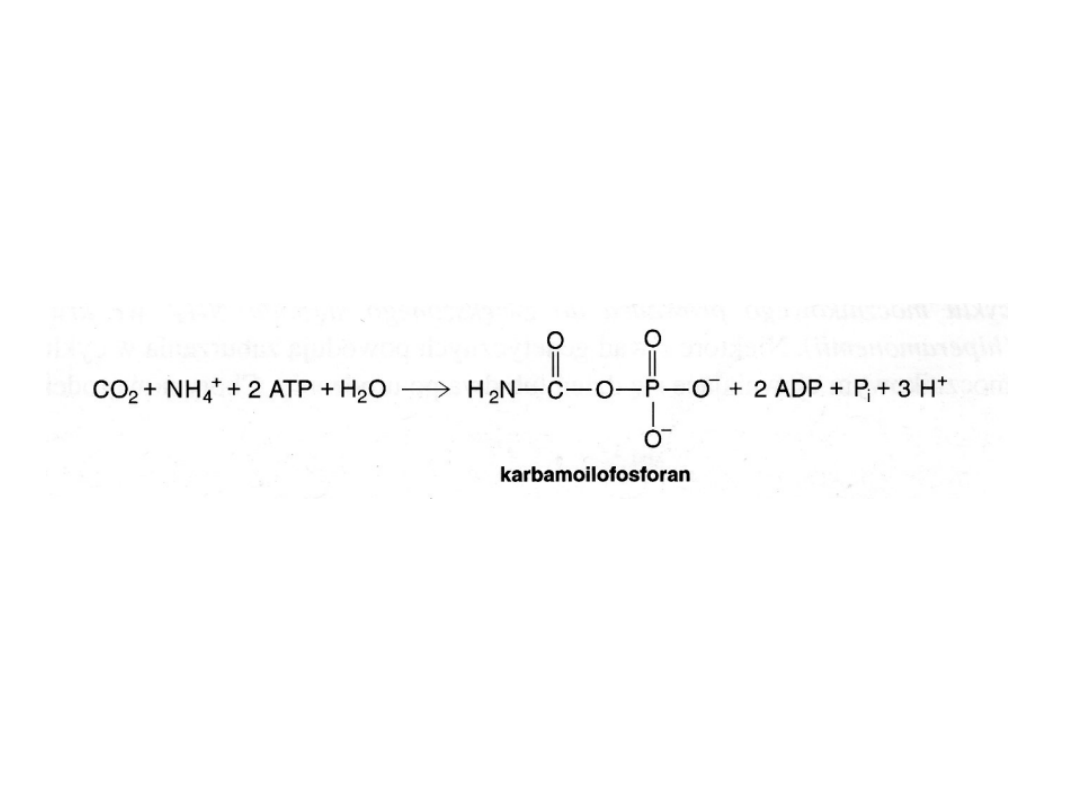
Karbamoilofosforan niezbędny do utworzenia cytruliny jest
syntetyzowany z
CO
2
, NH
4+
, ATP i H
2
O w reakcji katalizowanej przez syntetazę
karbamoilofosforanową. Synteza karbamoilofosforanu jest praktycznie
nieodwracalna, gdyż zużywane są 2 cząsteczki ATP

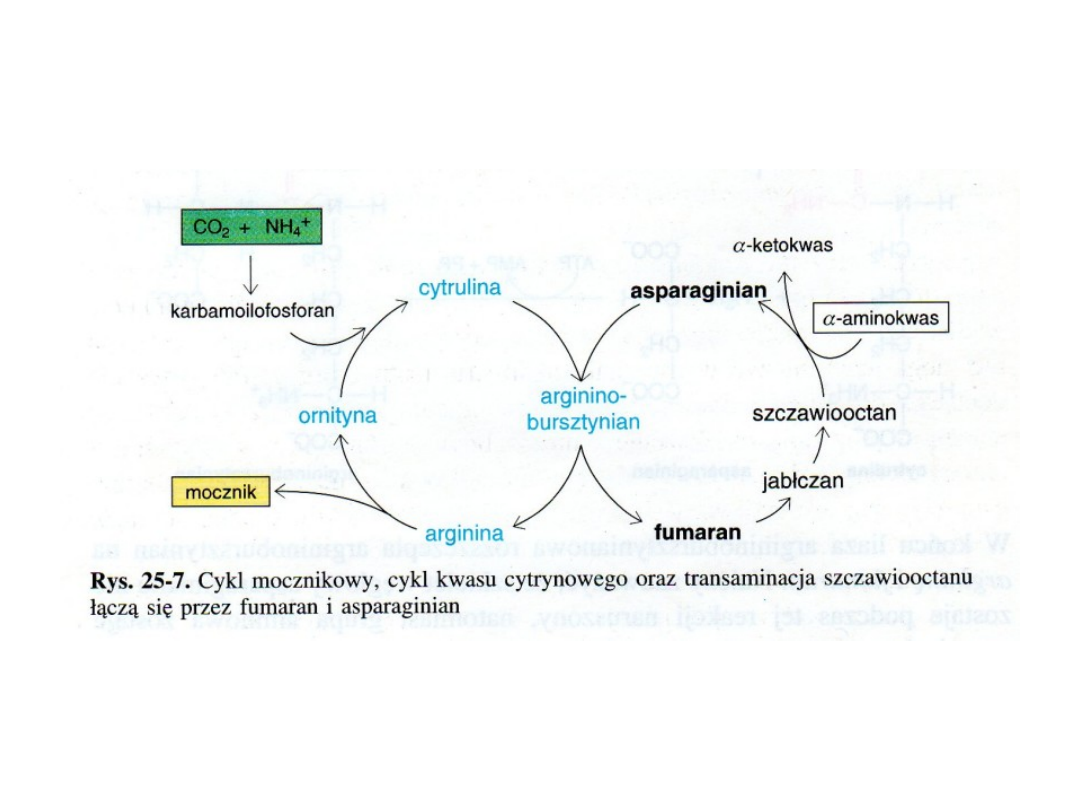

Wrodzone wady enzymów cyklu mocznikowego
powodują hiperamonemię i mogą prowadzić do
uszkodzenia mózgu
• Główną drogą usuwania jonów amonowych z organizmu jest
synteza mocznika przebiegająca w wątrobie
• Wszystkie wady enzymów cyklu mocznikowego prowadzą do
zwiększonego stężenia jonów amonowych we krwi
(hiperamonemia)
• Brak liazy argininobursztynianowej (argininobursztynuria)
Skutki tej wady metabolicznej można częściowo złagodzić
podając choremu w diecie nadmiar argininy oraz ograniczając
ogólną zawartość białka
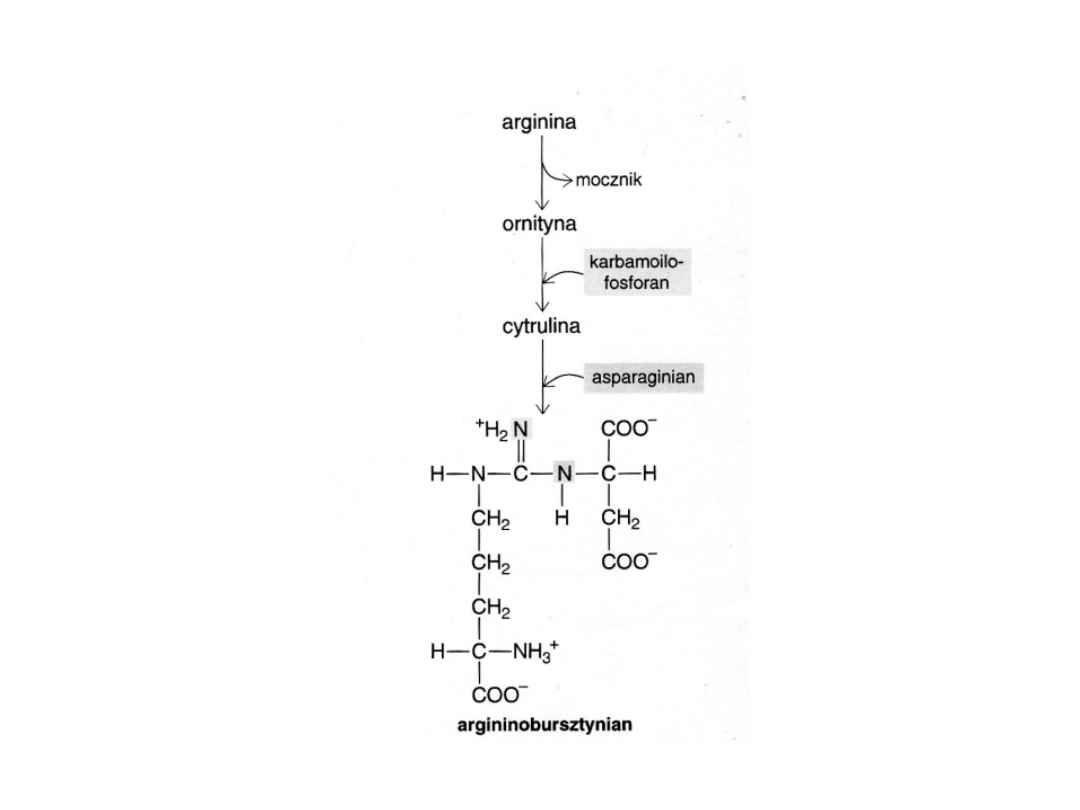
• Arginina w wątrobie ulega przekształceniu do mocznika i
ornityny
• W reakcji ornityny z karbamoilofosforanem tworzy się cytrulina,
która kondensując z asparaginianem daje argininobursztynian
(wydalany z organizmu):
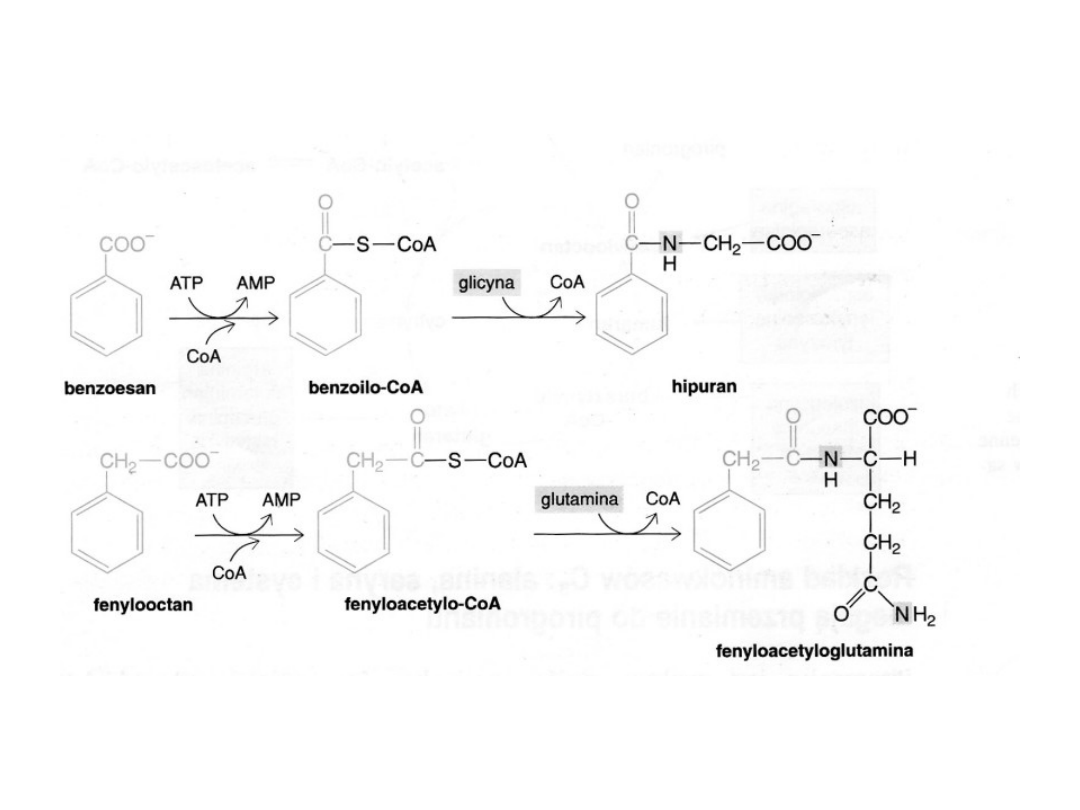
Brak syntetazy karbamoilofosforanowej klub karbamoilotransferazy ornitynowej
Ukazuje inny możliwy sposób ominięcia wadliwego toru metabolicznego.
Dietę ograniczająca białko uzupełnia się dużą ilością benzoesanu i fenylooctanu
Hipuran i fenyloacetyloglutamina zastępują mocznik w usuwaniu azotu z organizmu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Wykład katabolizm azotu aminokwasów
Czujnik tlenków azotu
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE ZWIĄZKÓW AZOTU
Selenowa mieszanina do onaczania azotu
Właściwości azotu
6 Tlenki azotu otrzymywanie, właściwości
Właściwości tlenu wystepowanie azotu chemia, Ściągi, Chemia
Biologiczne usuwanie azotu mineralnego ze ścieków
A, JO 20, Do objawów ubocznych po podaniu donorów tlenku azotu należą:
A, JO 19, Bezwzględnym przeciwwskazaniem do podawania donorów tlenku azotu nie jest:
Związki azotu wykład (2)
usuwanie azotu
źródła węgla,azotu i energii
179 nitroceluloza (zawarto azotu do 12,6) zwilona alkoholem butylowym pl
więcej podobnych podstron