Absorpcja
Absorpcja

Cząsteczka oprócz energii elektronowej Ee
związanej z poziomami energetycznymi
elektronów posiada również:
Energię oscylacyjną Eo – związaną z
oddalaniem się lub zbliżaniem do siebie
cząsteczek
Energię rotacyjną Er – związaną z ruchem
obrotowym cząsteczki
Każda z tych energii jest skwantowana, tzn.
że może przyjmować ściśle określoną
wartość.
Całkowita energia
cząsteczki wynosi:
E = Ee + Eo + Er

Cząsteczka pochłonie fotony, których
energia spełni warunek :
hע = ∆ Ee + ∆ Eo + ∆ Er
gdzie ∆ Ee , ∆ Eo , ∆ Er są różnicami
pomiędzy poziomami energetycznymi.
Stosunek energii Er : Ee : Eo ma się do
siebie tak jak 1 : 10 : 1000

Wzbudzone stany elektronowe powstają gdy
cząsteczka zaabsorbuje fotony z zakresu
promieniowania UV, widzialnego i bardzo
bliskiej podczerwieni,
Wzbudzenia oscylacyjne, po zaabsorbowaniu
fotonów z zakresu promieniowania
podczerwonego,
Wzbudzenia rotacyjne po zaabsorbowaniu
dalekiej podczerwieni.
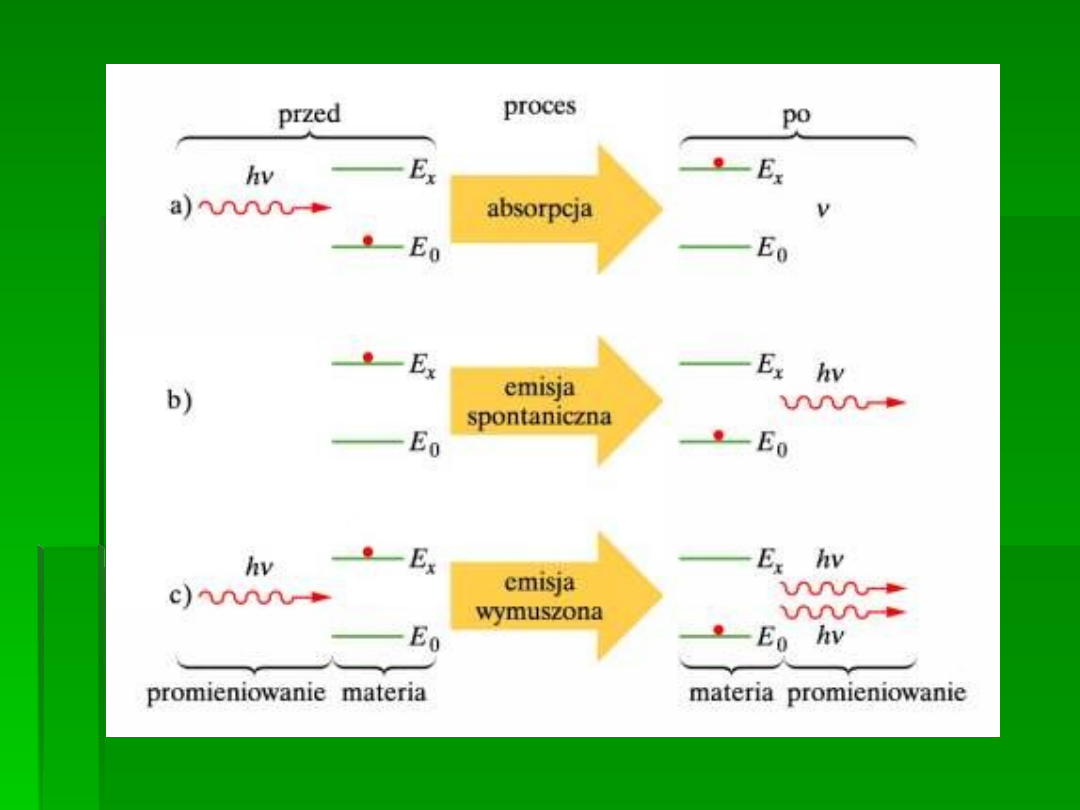
Zjawisko absorpcji cząsteczki M fotonów
światła przedstawia sie symbolicznie :
M → M*
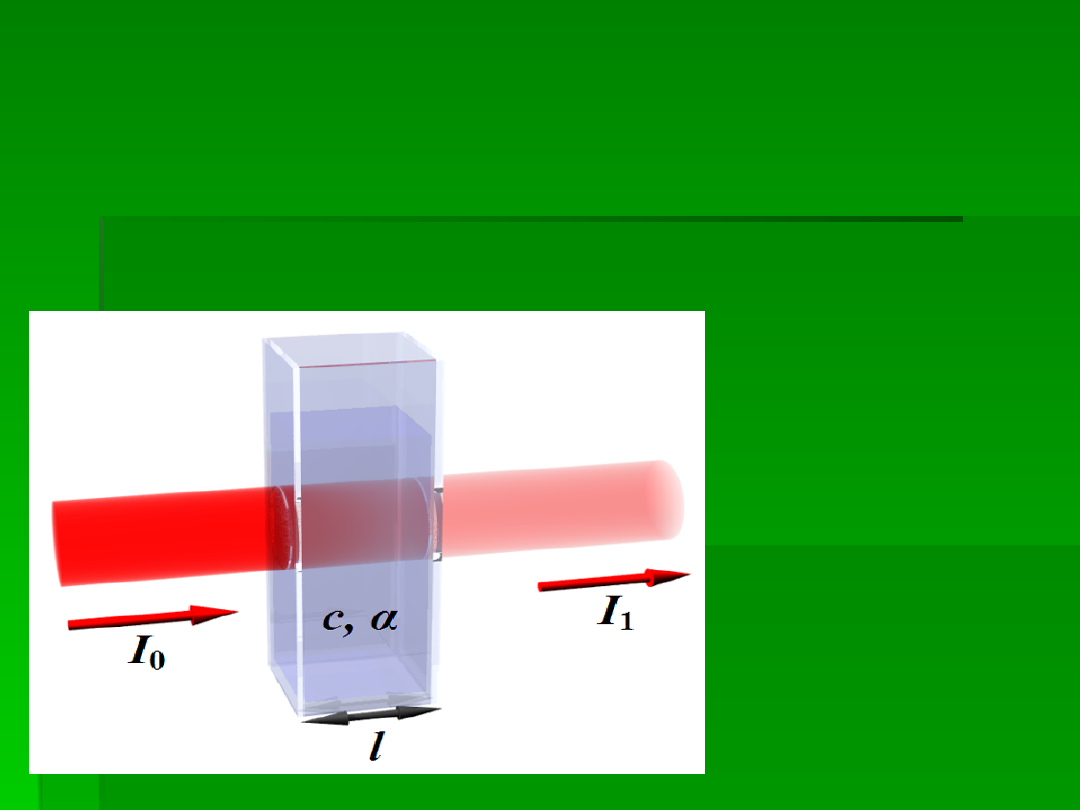
Zjawisko absorpcji w sposób ilościowy opisuje prawo Lamberta –
Beera. Mówi ono ze ilość absorbowanego promieniowania zależy
od liczby absorbujących cząsteczek na drodze wiązki
promieniowania monochromatycznego.
W matematycznym zapisie, zamiast energii promieniowania
stosuję się pojęcie natężenia promieniowania padającego (Io) i
natężenia promieniowania przechodzącego przez roztwór.
I = Io e
-αl
I – natężenie
promieniowania
przechodzącego
przez roztwór
Io – natężenie
promieniowania
padającego
α – współczynnik
absorpcji
charakterystyczny
dla danej substancji
l – grubość warstwy
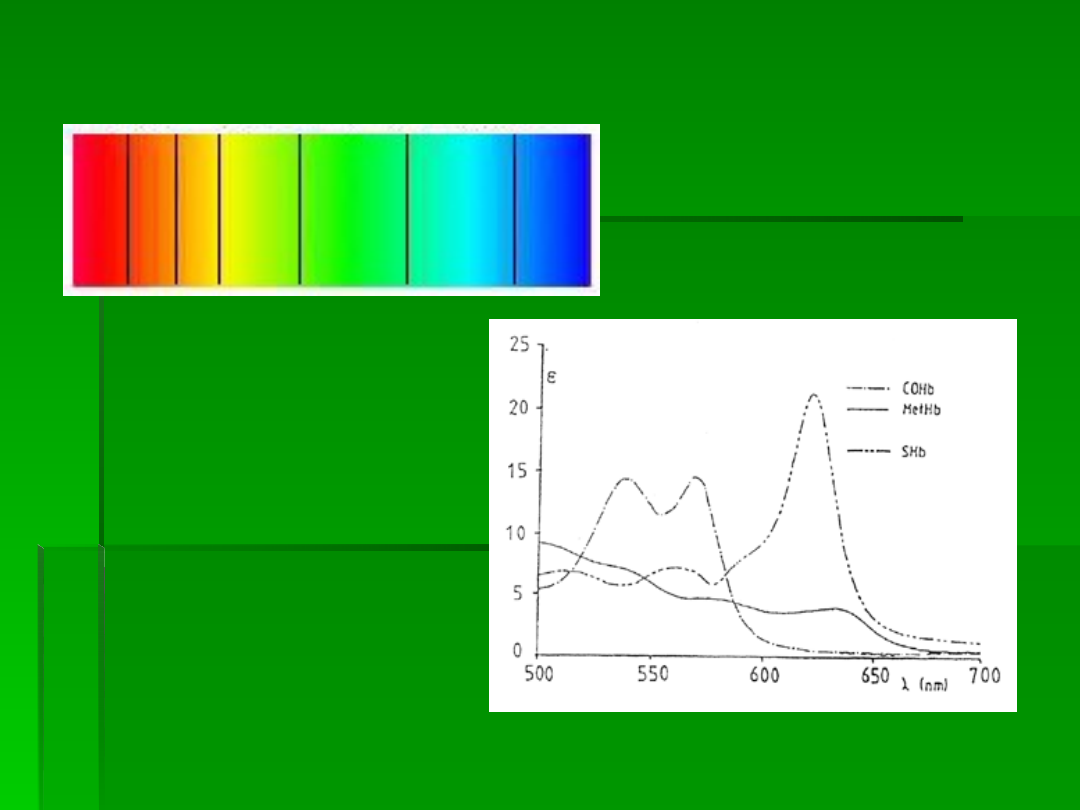
Widma absorpcyjne
Document Outline
Wyszukiwarka
Podobne podstrony:
Kolumna absorpcyjna z wypelnieniem
Kolumna absorpcyjna
Mechanizmy absorpcji trucizn, TOKSYKOLOGIA, Toksykologia
laborka-absorpcja2, fizyka Laboratorium
Cw 33 badanie charakterystyk pracy chłodziarki absorpcyjne
Absorpcyjna Spektrofotometria czasteczkowa
35 Widmo absorpcji liniowe i pasmowe
Absorpcja korpuskularnego promieniowania jonizującego
wyznaczenie optycznych widm emisyjnych i absorpcyjnych2, Szkoła, penek, Przedmioty, Fizyka, Laborki
Budowa i badania spektrofotometrów i fotometrów absorpcyjnych
absorpcja
Promieniowanie beta, absorpcja elektronów
Wyznaczanie współczynnika absorpcji , Uczelnia, sem I, fiza, LABORATORIUM, Nowe laborki, promienie
ABSORPCJOMETRIA WYZNACZANIE STĘŻENIA ROZTWORU
Absorbcja promieniowania gamma, Absorpcja promieniowania gamma 4, Politechnika ˙l˙ska
Badanie statystycznego charakteru rozpadu promieniotwórczego, absorbcujna promienie beta 1, Absorpcj
WYZNACZANIE WSPÓŁCZYNNIKA ABSORPCJI PROMIENI GAMMA2, WYDZIA? BUDOWNICTWA
więcej podobnych podstron