
Kataliza enzymatyczna,
inhibicja enzymów i
allosteria

Kataliza enzymatyczna
•
Zjawisko przyspieszenia szybkości reakcji
chemicznej pod wpływem dodania do układu niewielkiej
ilości katalizatora
•
Praktycznie wszystkie reakcje zachodzące w komórkach
i tkankach organizmów żywych są katalizowane przez
enzymy
•
Enzymy tworzą z substratami połączenia
międzycząsteczkowe, w których cząsteczka substratu
ulega aktywacji, polegającej na osłabieniu określonych
wiązań.
•
Katalizy nie należy mylić z inicjacją chemiczną, w
której inicjator łączy się z innymi substratami na trwałe
lub ulega rozkładowi.
•
Np. trawienie pokarmu i reakcje zachodzące podczas
powielania materiału genetycznego

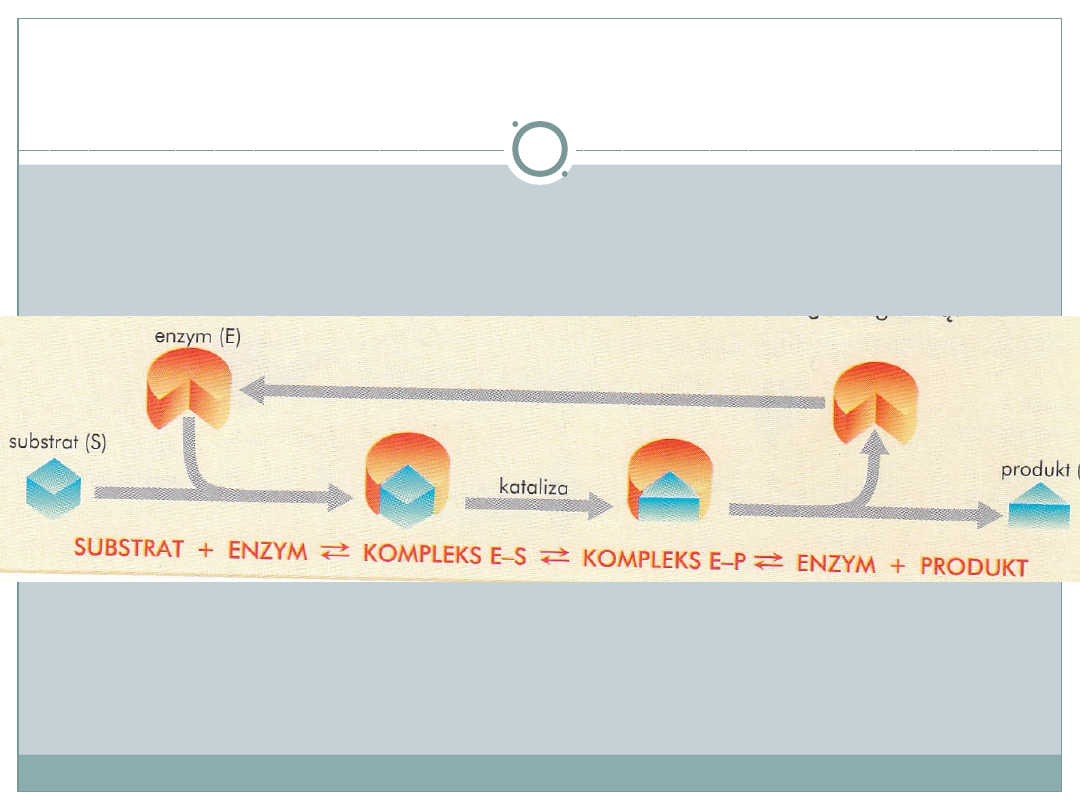
Przebieg katalizy enzymatycznej
•
Substraty wiązane są za pomocą oddziaływań
niekowalencyjnych
•
Budowa centrum aktywnego zapewnia
odpowiednie ułożenie substratów względem
siebie
•
Oddziaływanie między substratami i centrum
aktywnym powoduje zajście reakcji
enzymatycznej
•
Po zakończeniu reakcji produkty oddysocjowują
a enzym przyłącza kolejne cząsteczki substratów

Katalizę dzieli się na:
•
homogeniczną
– kiedy katalizator znajduje się
w tej samej fazie termodynamicznej co
substraty (np. jest razem z substratami
rozpuszczony w układzie)
•
heterogeniczną
– kiedy katalizator znajduje się
w innej fazie termodynamicznej niż jeden lub
wszystkie substraty (np. katalizator jest
osadzony na powierzchni ciała stałego)

Niektóre czynniki wpływające na aktywność
enzymów: (1)
•
Temperatura
- szybkość reakcji rośnie, jednak
powyżej 50-60*C dochodzi do denaturacji i
zahamowania katalizy; niska powoduje spadek
aktywności(odwracalna)
•
Odczyn środowiska-
różne enzymy mają różne
optymalne pH; jego wartość zależy przede
wszystkim od typu reakcji i standardowego
miejsca jej przeprowadzania(pepsyna 1,5-3;
trypsyna ok. 8)

Niektóre czynniki wpływające na aktywność
enzymów: (2)
Stężenie soli-
różne optimum dla różnych
enzymów
Obecność inhibitorów
Obecność aktywatorów-
łącząc się z enzymem
zmieniają konformację centrum aktywnego, co
umożliwia zachodzenie reakcji
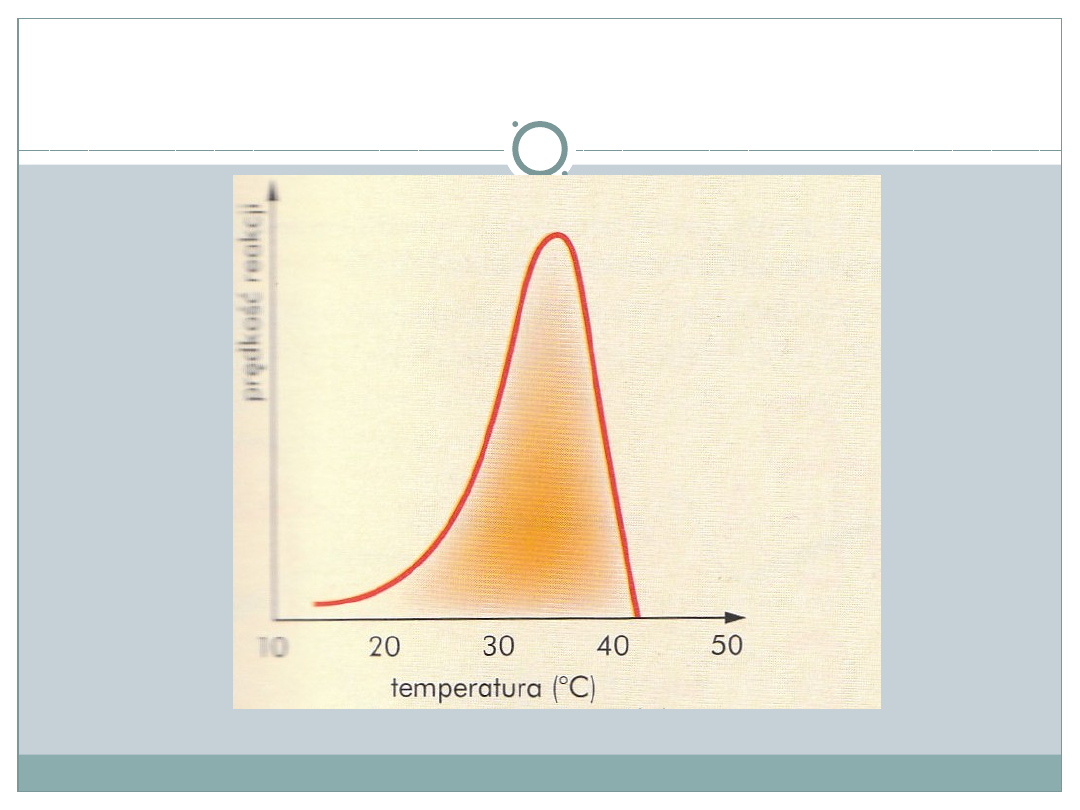
Zależność szybkości reakcji od temperatury
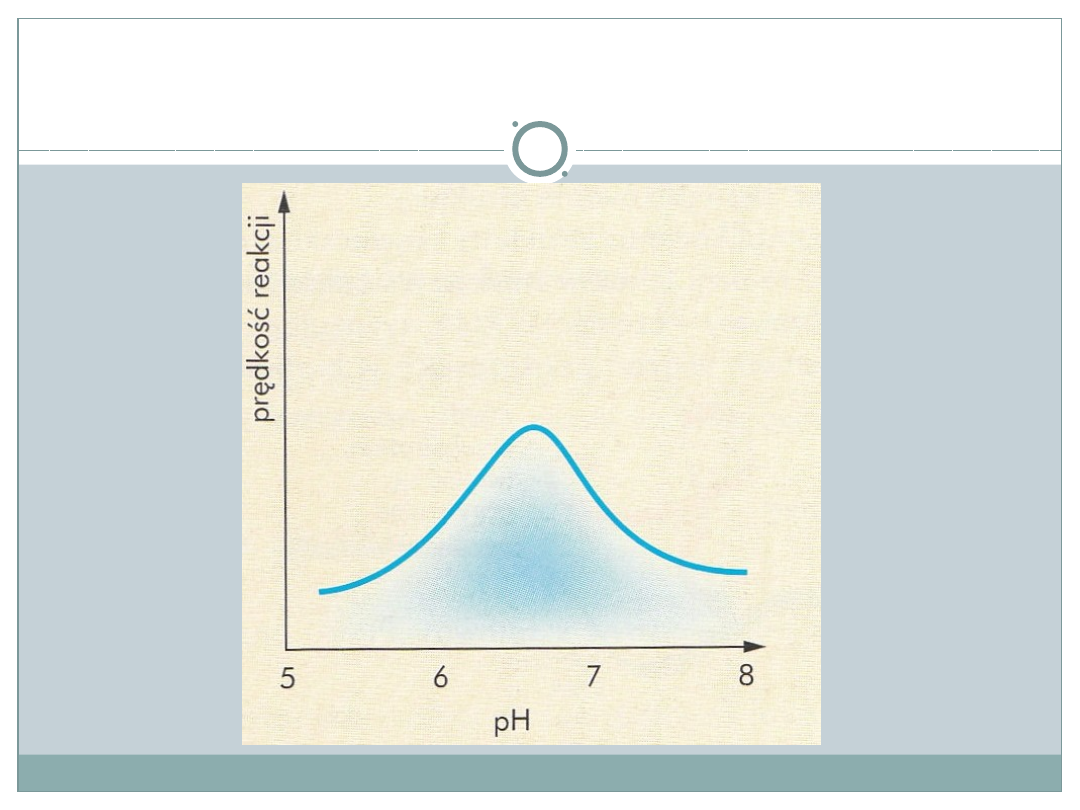
Szybkość reakcji w zależności od pH

Inhibicja
zjawisko opóźnienia reakcji chemicznej pod
wpływem inhibitora.
Często jest ona niepoprawnie
nazywana katalizą ujemną, a inhibitor często
jest niepoprawnie nazywany katalizatorem
ujemnym.

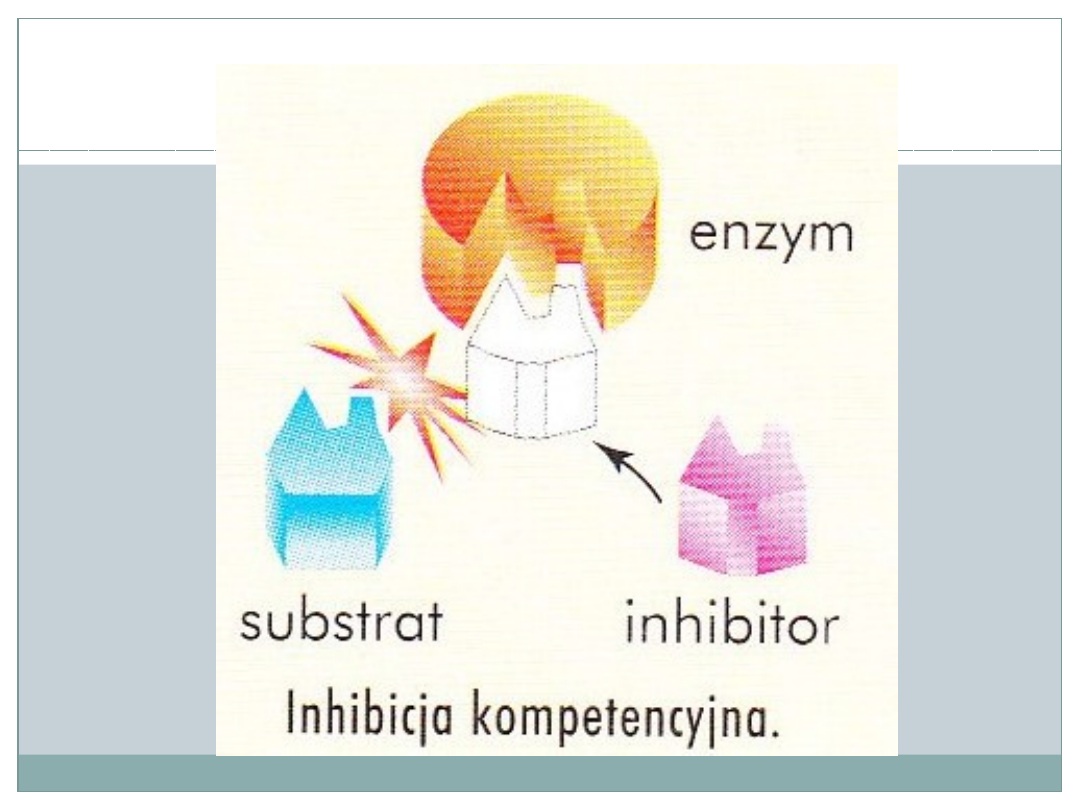
Inhibicja kompetencyjna
•
Inhibitor ma strukturę przynajmniej częściowo
podobną do substratu
•
Inhibitor łączy się z centrum aktywnym,
prowadząc do unieczynnienia enzymu
•
Inhibitor współzawodniczy z właściwym
substratem przy wiązaniu do centrum
aktywnego
•
Siła inhibicji zależna jest od stężenia substratu
i inhibitora: przy dużym stężeniu substratu
efekt inhibitora jest mniejszy

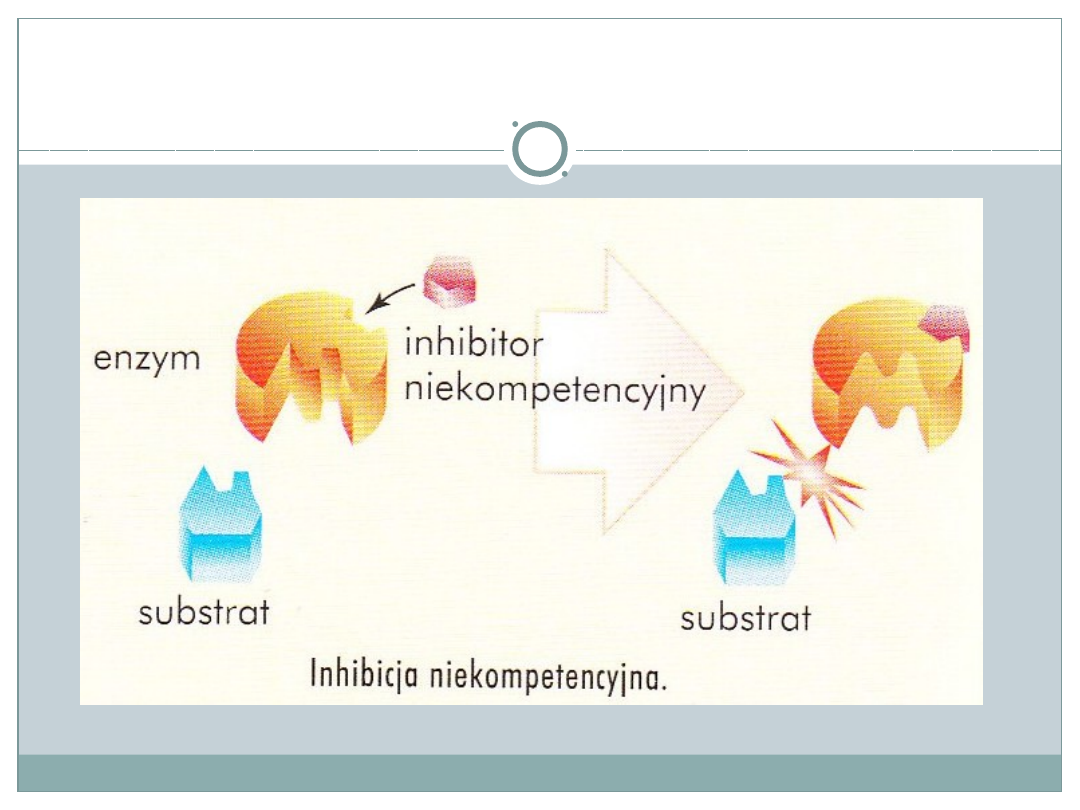
Inhibicja niekompetencyjna
•
Inhibitor zazwyczaj jest niepodobny do
substratu
•
Inhibitor łączy się z enzymem poza centrum
aktywnym zmieniając jego konformację
blokuje go
•
Inhibitor nie współzawodniczy z właściwym
substratem o centrum aktywne enzymu
•
Siła inhibicji nie zależy od stężenia substratu

Allosteria
•
zmiana powinowactwa chemicznego białka do
cząsteczek (np. enzymów do substratów lub
białek przenośnikowych do ich ładunku), przez
zmianę struktury przestrzennej.
•
nie zmienia pierwszorzędowej struktury
enzymu jako białka, zmienia natomiast jego
strukturę przestrzenną co ma wpływ na
aktywność metaboliczną enzymu.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
ENZYMY prezentacja biochemia
Enzymy prezentacja
ENZYMY prezentacja biochemia 2
ENZYMY prezentacja biochemia
Prezentacja z biochemii - izoenzymy, Lekarski WLK SUM, lekarski, biochemia, enzymy
UP Biochemia Biol Prezentacja enzymy
prezentacja finanse ludnosci
prezentacja mikro Kubska 2
Religia Mezopotamii prezentacja
Prezentacja konsument ostateczna
Strategie marketingowe prezentacje wykład
motumbo www prezentacje org
lab5 prezentacja
Prezentacja 18
Materialy pomocnicze prezentacja maturalna
Prezentacja na seminarium
Lato prezentacja 3
więcej podobnych podstron