
1
Pierwiastki i związki chemiczne
występują
w
trzech
stanach
skupienia:
gazowym - ciekłym -
stałym
STANY SKUPIENIA MATERII
STANY SKUPIENIA MATERII

2
G a z d o s k o n a ł y jest to wyidealizowany stan
materii spełniający następujące warunki:
•cząsteczki gazu są jednorodnymi doskonale
sprężystymi kulami,
•objętość własna cząsteczek jest tak mała w
stosunku do objętości zajmowanej przez gaz,
że można ją zaniedbać
•cząsteczki są w stanie ciągłego ruchu,
•zderzenia między cząsteczkami są idealnie
sprężyste,
•cząsteczki nie oddziaływają na siebie, są
chemicznie obojętne,
•ruch cząsteczek jest chaotyczny, bez
uprzywilejowanego kierunku.
Aby wytłumaczyć zachowanie się gazów wprowadzono pojęcie
g a z u d o s k o n a ł e g o
STAN GAZOWY
STAN GAZOWY

3
G a z r z e c z y w i s t y
nie spełnia
wszystkich w/w warunków. Własności gazu
rzeczywistego zbliżają się do własności gazu
doskonałego gdy:
- panuje ciśnienie niskie, oraz
- temperatura jest wysoka.
PRAWA GAZOWE określają zależności
pomiędzy parametrami ( P, T, V ).
S T A N G A Z U
określają wartości
parametrów:
*
temperatury ( T )
* ciśnienia ( P )
* objętości ( V )
Zmiana jednego z parametrów - zmiana
stanu.
4
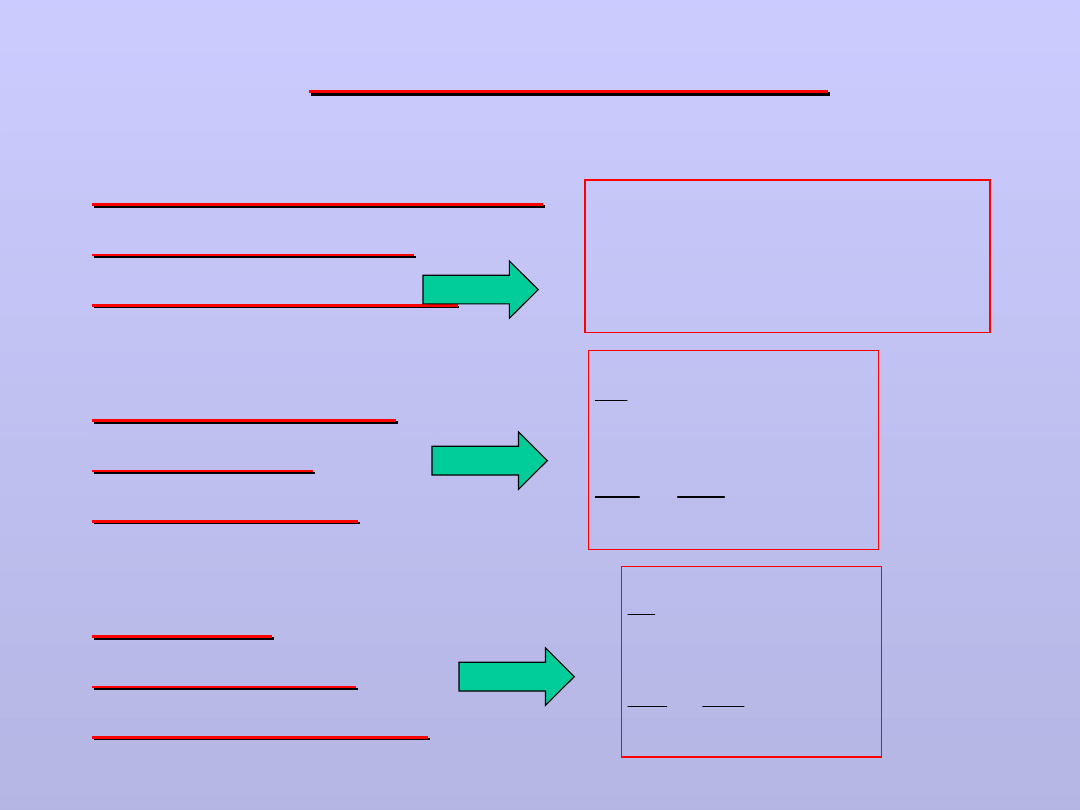
PRAWA GAZOWE
PRAWA GAZOWE
PRAWO GAY-
PRAWO GAY-
LUSSACA
LUSSACA
IZOBARA
IZOBARA
(2)
T
V
T
V
const;
T
V
2
2
1
1
P= const.
PRAWO
PRAWO
CHARLESA
CHARLESA
IZOCHORA
IZOCHORA
(3)
T
P
T
P
const;
T
P
2
2
1
1
V =
const.
PRAWO BOYLE'A -
PRAWO BOYLE'A -
MARIOTTE'A
MARIOTTE'A
IZOTERMA
IZOTERMA
P V = const;
P
1
V
1
= P
2
V
2
(1)
T = const
5
RÓWNANIE STANU GAZU
RÓWNANIE STANU GAZU
DOSKONAŁEGO
DOSKONAŁEGO
P
P
V = R
V = R
T
T
dla 1 mola
gazu
P
P
V = n
V = n
R
R
T
T
dla n moli
gazu
R - stała gazowa; tj. praca wykonana przez 1 mol
gazu doskonałego rozprężającego się pod stałym
ciśnieniem przy wzroście temperatury o 1 K.
K
mol
J
8,314
R
K
mol
dm
atm
082
,
0
R
3
K
mol
cal
1,987
R
R
=
T
V
P
const.;
T
V
P
Z równania ( 1 ) i ( 3 )
M
m
n
ponieważ
to
T
R
M
m
V
P
V
P
T
R
m
M
gdzie: m - masa [ g ]; M - masa molowa [ g/mol ]
6
Gęstość gazów zależy od:
- ciśnienia
- temperatury.
GĘSTOŚĆ GAZÓW
GĘSTOŚĆ GAZÓW
Gęstość bezwzględna
V
m
d
V
M
d
dla 1 mola
gdzie: M - masa 1 mola
V - objętość 1
mola
dla gazu doskonałego w warunkach normalnych:
3
3
o
o
dm
g
=
mol
/
dm
mol
/
g
22,415
M
V
M
d
7
WŁASNOŚCI GAZÓW
RZECZYWISTYCH
•mają swoją objętość
•między cząsteczkami występują siły
oddziaływania
•zderzenia nie są idealnie sprężyste
a,b - stałe
van der
Waalsa
P =
a
V
2
; V
= b
Równanie stanu gazu rzeczywistego - Van der
Waalsa:
RT
b
-
V
v
a
(P
2
)
RT
V'
-
V
P'
(P
)
P - ciśnienie wewnętrzne powstałe w wyniku
wzajemnego
oddziaływania
cząsteczek
gazu
rzeczywistego na wskutek przyłożonego z zewnątrz
ciśnienia
V - tj. objętość własna cząsteczek.
Dla n moli gazu:
nRT
b
-
V
v
a
(P
2
)

8
Ciecze różnią się od gazów wielokrotnie większą
liczbą cząsteczek w jednostce objętości.
Np. 1 mol wody w T = 373 K i P = 101,3 kPa zajmuje objętość
V = 19 cm
3
1 mol pary wodnej T = 373 K i P = 101,3 kPa zajmuje
objętość V = 30600 cm
3
STAN CIEKŁY
STAN CIEKŁY
CECHY
•mniejsze odległości między cząsteczkami cieczy niż
gazu
•silniejsze oddziaływanie pomiędzy cząsteczkami
cieczy niż gazu
•przyjmują kształt naczynia
•nie zmieniają swojej objętości - są nieściśliwe lub
bardzo trudno ściśliwe
•struktura cieczy - quasi krystaliczna, istnieją
obszary przypominające sieć krystaliczną
•brak równania stanu c i e k ł e g o analogicznego
jak dla gazów d o s k o n a ł y c h .

9
NAPIĘCIE POWIERZCHNIOWE
NAPIĘCIE POWIERZCHNIOWE
D e f i n i c j a:
występowanie sił działających w kierunku
stycznym
do
powierzchni
(usiłujących
zmniejszyć powierzchnię) nazywamy siłami
napięcia
powierzchniowego
-
napięciem
powierzchniowym, dlatego
C I E C Z wykazuje dążność do zmniejszania
liczby cząsteczek na swej powierzchni -
przyjmuje
powierzchnię
najmniejszą
z
możliwych, a więc kuli (bryła o najmniejszej
powierzchni przy tej samej objętości).
uzupełn
ić
L E P K O Ś Ć
- własność cieczy dostrzegalna podczas
jej ruchu.
Ciecz wprawiona w ruch, po krótkim czasie wraca do
spoczynku, gdyż występuje tarcie wewnętrzne -
lepkość.
Lepkość jest miarą tarcia wewnętrznego

10
STAN STAŁY
STAN STAŁY
Do stanu stałego zaliczamy taką postać materii,
w której elementy struktury - atomy, cząsteczki,
jony są ułożone w siatki przestrzenne i tworzą
postacie k r y s t a l i c z n e.
Jeżeli atomy, cząsteczki lub jony nie są ułożone
w regularne siatki krystaliczne to są to c i a ł a
b e z p o s t a c i o w e np. szkło, kauczuk,
włókna naturalne, włókna syntetyczne.
Stan stały może zatem występować w dwóch
postaciach:
•w postaci
krystalicznej
•jako substancja
bezpostaciowa
.

11
1. ruch atomów, cząsteczek, jonów tworzących ciała
stałe,
ograniczony jest do drgań
(oscylacji ) wokół położeń równowagi,
2. elementy budowy ( w/w ) tworzą uporządkowane
struktury, kryształy,
3. kryształy są anizotropowe tzn. mają:
- różne właściwości fizyczne i chemiczne w różnych
kierunkach przestrzennych np. przewodnictwo
elektryczne, cieplne, przenikalność dielektryczna,
kruchliwość
- własny kształt,
- własną objętość trudno ulegającą zmianie przy
zwiększaniu ciśnienia,
- topią się w ostro zaznaczonej temperaturze.
CECHY
KRYSZTAŁÓW
12
1. nieuporządkowana struktura, pośrednia
pomiędzy cieczą a ciałem krystalicznym
2. są izotropowe tzn. mają:
- nieostrą temperaturę topnienia, miękną
w przedziale temperatury,
- własności fizyczne jednakowe we
wszystkich kierunkach,
3. powstają wskutek przechłodzenia
cieczy
CECHY CIAŁ
BEZPOSTACIOWYCH

13
UKŁADY WIELO-
UKŁADY WIELO-
SKŁADNIKOWE -
SKŁADNIKOWE -
Roztwory
Roztwory
Roztwór
Roztwór
– układ wieloskładnikowy,
jednofazowy znajdujący się w stanie
równowagi.
Po zmieszaniu dwóch lub więcej substancji
może zajść reakcja chemiczna lub powstać :
mieszanina niejednorodna
mieszanina jednorodna
– ROZTWÓR
ROZTWÓR
-przy powstawaniu roztworu nie obowiązują prawa
stałości składu i stosunków wielokrotnych jak przy
tworzeniu związków chemicznych;
- skład roztworów w pewnym zakresie ciśnienia i temp.
może się zmieniać (skład związków chemicznych jest
stały);
- są jednorodne – przy ich powstaniu występują efekty
energetyczne
w
odróżnieniu
od
mieszanin
niejednorodnych.
14
UKŁADY WIELO-
SKŁADNIKOWE -
Roztwory
Roztwór
Roztwór
Rozpuszczal
Rozpuszczal
nik
nik
Substancja
Substancja
rozpuszczon
rozpuszczon
a
a
Proces rozpuszczania jest
SAMORZUTNY
.
Biorąc pod uwagę wielkość substancji
rozpuszczonej
wyróżniamy:
1. ROZTWORY WŁAŚCIWE
ROZTWORY WŁAŚCIWE
- < 1 nm
2. ROZTWORY KOLOIDALNE - = 1 – 100 nm
15
Roztwory
STĘŻENIE ROZTWORU
- masa (objętość) substancji rozpuszczonej i
roztworu mają te
same jednostki
- mają różne jednostki.
i
i
i
i
n
n
x
Przykłady:
% masowy; Molowość: mol/dm
3
, kmol/m
3
masa subst.rozp./obj.roztworu, np. g/dm
3
; kg/m
3
Ułamek molowy (x):
Dla roztworów gazowych stężenie wyraża się
często za pomocą ciśnienia cząstkowego
składnika (p
i
)
i
i
i
i
p
P
P
x
p
Prawo Daltona
P - ciśnienie
całkowite

16
Roztwory
ROZTWÓR
DOSKONAŁY
:
• brak efektów energetycznych podczas
rozpuszczania ΔH
r
= 0,
• objętość roztworu jest sumą objętości
składników: ΔV = 0
gdzie: V
r-ru
= V
rozp.
+ V
s.r.
ROZTWÓR
NASYCONY
- roztwór o maksymalnym
stężeniu substancji rozpuszczonej w danej
temperaturze.
Rozpuszczalność
- stężenie roztworu nasyconego
(g/100 g rozpuszczalnika.
Zależy od rodzaju substancji rozpuszczonej oraz
temperatury.
17
Roztwory gazów w
cieczy
Ad.
1
Roztwory gazów dobrze rozpuszczalnych,
NH
4
OH
H
2
CO
3
H
2
SO
3
np.H
2
O + NH
3
H
2
S
CO
2
SO
2
Tworzą
wiązania
chemiczn
e
Ilość GAZU rozpuszczonego w CIECZY zależy
od:
1. rodzaju gazu i cieczy
2. parametrów stanu układu: temperatury, ciśnienia.
Roztwory gazów słabo rozpuszczalnych,
np. H
2
, O
2
, N
2
+ H
2
O
np. 1 dm
3
H
2
O rozpuszcza: 710 dm
3
NH
3
,
a tylko 0,017 dm
3
H
2
.
Wniosek
Wniosek:
Rozpuszczalność
różnych gazów w
tym
samym
rozpusz-czalniku
zależy zatem od
różnego
wzajemne-go
oddziaływania
cząsteczek gazu i
cieczy.
18
Roztwory gazów w
cieczy
Rozpuszczalność gazu w cieczy zależy od
ciśnienia
–
PRAWO HENRY’EGO
dla T=const.
c = k·p
c = k·p
gdzie: c – stężenie gazu w roztworze
k – stała Henry’ego; charakteryzuje
rozpuszczalność gazu pod ciśnieniem
normalnym.
p – ciśnienie gazu nad roztworem
Ad.
2
Rozpuszczalność gazu jest wprost proporcjonalna
do ciśnienia gazu nad roztworem (w fazie gazowej)
Rozpuszczalność gazów w cieczach zależy od
temperatury
temperatury. Ponieważ rozpuszczanie gazu w cieczy
jest procesem
EGZOTERMICZNYM
ΔH
r
< 0
rozpuszczalność gazu w cieczy MALEJE ZE
MALEJE ZE
WZROSTEM TEMPERATURY
WZROSTEM TEMPERATURY

19
Roztwory cieczy w
cieczy
Rozpuszczalność dwóch cieczy jest zawsze
WZAJEMNA
, tzn. jeżeli ciecz A rozpuszcza
ciecz B to również ciecz B rozpuszcza ciecz A.
2 grupy roztworów ciecz-ciecz:
1. Wzajemna rozpuszczalność dwóch cieczy
jest
NIEOGRANICZONA
– np. H
2
O –
etanol
2. Wzajemna rozpuszczalność jest
OGRANICZONA
– np. H
2
O – eter
20
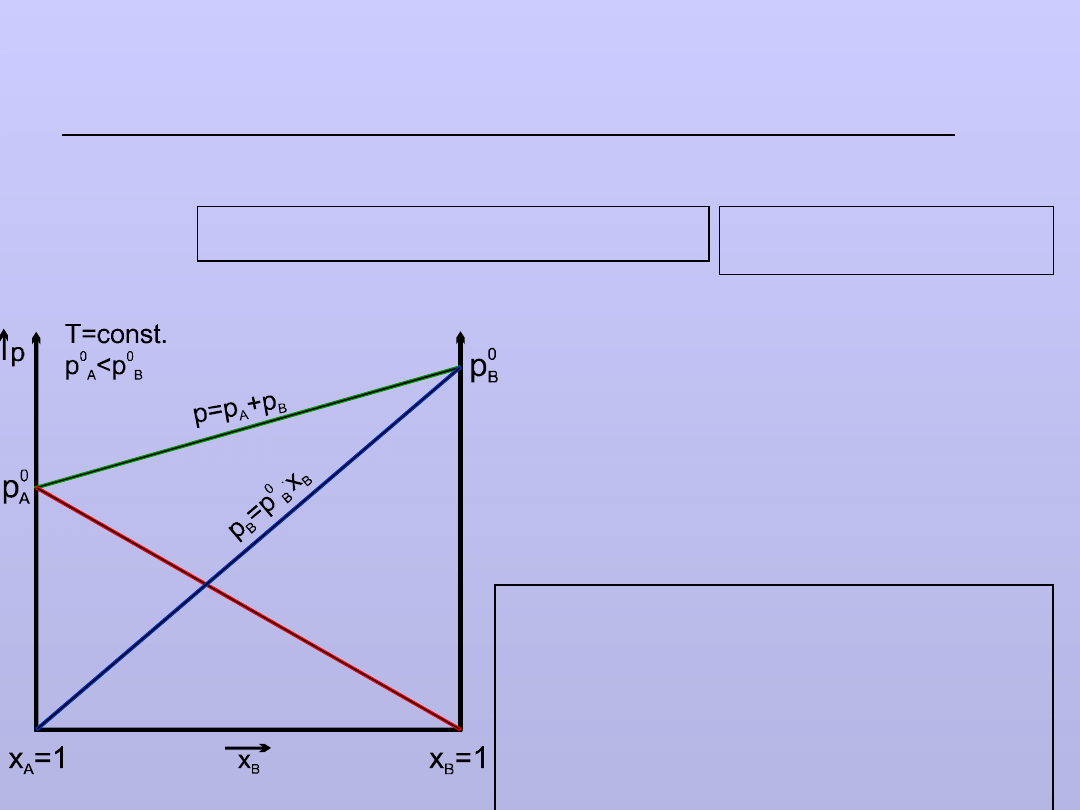
Roztwory cieczy w cieczy
Prawo Raoulta
Dotyczy roztworów cieczy o
NIEOGRANICZONEJ WZAJEMNEJ
NIEOGRANICZONEJ WZAJEMNEJ
ROZPUSZCZALNOŚCI.
ROZPUSZCZALNOŚCI.
ROZTWÓR CIECZY
A
i
B
PARA NASYCONA
X
A
,
X
B
Ułamki molowe
p
A
,
p
B
Ciśnienia
cząstkowe
Mamy układ dwufazowy – dwuskładnikowy w
równowadze
równowadze
:
Wg prawa DALTONA:ciśnienie całkowite P = p
A
+ p
B
PRAWO RAOULTA -
PRAWO RAOULTA -
liniowa zależność
prężności pary (p
A
,
p
B
)
nad roztworem od
stężenia roztworu (X
A
,
X
B
)
.
21
Roztwory cieczy w cieczy
Prawo Raoulta
p
A
= p
0
B
x
A
A
A
A
0
.
Roztwór doskonały:
(np. CH
3
OH-C
2
H
5
OH)
- prężność pary
nasyconej składnika A i B
nad czystą cieczą
o
B
o
A
p
,
p
;
x
p
p
i
x
p
p
B
o
B
B
A
o
A
A
Wówczas
:
z prawa
Daltona
B
o
B
A
o
A
x
p
x
p
p
Roztwór doskonały oraz T = const.
Roztwory rzeczywiste -
występują odchylenia od
prawa Raoulta, które mogą
być dodatnie (większe) lub
ujemne (mniejsze).
22
Roztwory ciał stałych w
cieczy
Układ:
ROZTWÓR PARA
Stosuje się PRAWO RAOULTA:
Wniosek:Po wprowadzeniu STAŁEJ substancji do
cieczy następuje
OBNIŻENIE PRĘŻNOŚCI PARY
NAD ROZTWOREM
(w porównaniu z czystym
rozpuszczalnikiem):
dla roztworu ciała stałego w cieczy:
p
B
= 0
wówczas:
p
x
p
p
A
o
A
A
ponieważ
B
A
x
1
x
,
więc
)
x
(1
p
p
B
o
A
A
x
B
– ułamek molowy
substancji
rozpuszczonej
Ciśnienie całkowite
B
o
B
B
A
o
A
A
x
p
p
x
p
p
Wówczas:
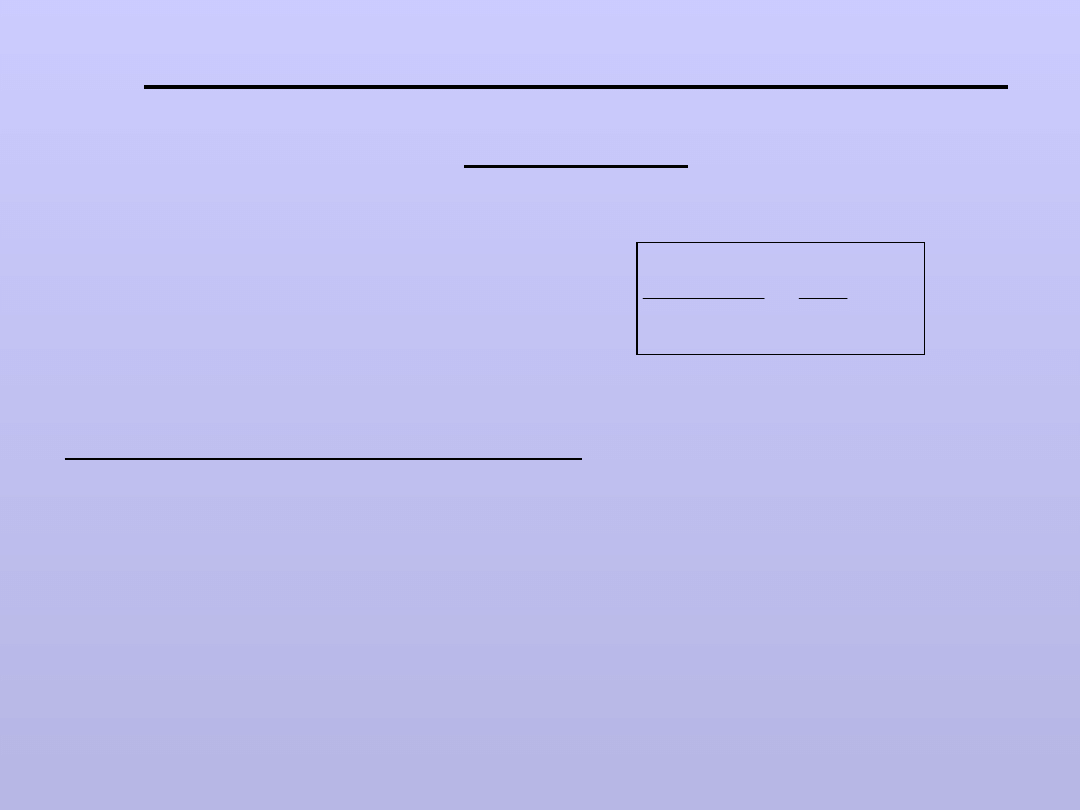
jeżeli: A – rozpuszczalnik i B – substancja rozpuszczona (stała)
Wg prawa
Raoulta
23
Roztwory ciał stałych w
cieczy
Można zatem stwierdzić, że:
WZGLĘDNE
OBNIŻENIE
PRĘŻNOŚCI
PARY
ROZPUSZCZALNIKA JEST PROPORCJONALNE DO
UŁAMKA
MOLOWEGO
SUBSTANCJI
ROZPUSZCZONEJ, zatem:
NIE ZALEŻY OD RODZAJU SUBSTANCJI
ROZPUSZCZONEJ
.
Obniżenie prężności
pary:
Obniżenie względne
wyniesie:
B
o
A
o
A
A
o
A
x
p
p
p
p
p
B
o
A
A
o
A
x
p
p
p
p

24
Roztwory ciał stałych w
cieczy
Jakie są konsekwencje obniżenia prężności pary
rozpusz-czalnika nad roztworem?
1. Podwyższenie temp. wrzenia roztworu
2. Obniżenie temp. krzepnięcia roztworu (w
stosunku do czystego rozpuszczalnika)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
4 Stany skupienia i roztwory03
Stany skupienia przemiany fazowe roztwory dyfuzja
1 Stany skupienia materii Zdefiniować pojęcie płynu
Trzy stany skupienia wody
44 Trzy stany skupienia substancji
stany skupienia wody, przyroda, scenariusz. lekcji kl.4
trzy stany skupienia i ich wlasciwosci, ściagi za free
04 Stany skupienia materii gazy Nieznany (2)
trzy stany skupienia wody, przyroda, scenariusz. lekcji kl.4
Ściągi z fizyki-2003 r, Stany skupienia wody
2 Stany skupienia materii 2009
Stany skupienia materii, CHEMIA, semestr 1, chemia ogólna
stany skupienia wody edukacja srodowiskowo-przyrodnicza, Konspekty
Trzy stany skupienia substancji
STANY SKUPIENIA MATERII konspekt
Stany skupienia wody notka do zeszytu
więcej podobnych podstron