
.
Podstawowe
czynności
laboratoryjne

Ogrzewanie
Ogrzewanie często stosuje się przy wytrącaniu osadów,
stapianiu,
odparowywaniu,
rozpuszczaniu
itp..
Ogrzewa się bezpośrednio palnikiem lub w łaźni
wodnej –powietrznej i piaskowej, ogrzewanych
elektrycznie lub za pomocą palnika.
1. W płomieniu palnika – probówkę mocujemy w
drewnianej łapie i ruchem wahadłowym najpierw
ogrzewamy całą probówkę , potem przystępujemy do
ogrzewania jej od spodu. Uważać należy aby wylot
probówki nie był skierowany w stronę pracujących.
2. Ogrzewanie
w
parowniczkach
i
tyglach
przprowadzamy na siatce azbestowej ogrzewanej
palnikiem gazowym.
3. Ogrzewania ciągłe w stałej temperaturze prowadzi się
na łaźni wodnej wypełnionej do 2/3 wodą.

.
• Ogrzewanie jest jedną z najczęściej wykonywanych
czynności laboratoryjnych. Ogrzewa się:
•
a)
bezpośrednio płomieniem palnika
gazowego lub lampki spirytusowej,
•
b)
palnikiem gazowym poprzez siatkę
azbestową lub płytkę ceramiczną,
•
c)
w łaźni wodnej,
•
d)
w łaźni olejowej lub metalowej,
•
e)
na łaźni parowej,
•
f)
na łaźni piaskowej,
•
g)
na łaźni powietrznej,
•
h)
na grzejniku elektrycznym,
•
i)
promiennikiem podczerwieni.
• Inne sposoby ogrzewania stosowane są rzadko

.
SUSZENIE
Suszenie polega na odparowaniu rozpuszczalnika. Można to
wykonać na jeden z dwóch sposobów:
a) w temperaturze pokojowej,
b) w temperaturze podwyższonej.
a) Suszenie w temperaturze pokojowej polega na pozostawieniu
odsączonej substancji na kartce papieru, lub na płytce z innego
materiału, na odpowiednio długi okres czasu. Można też suszyć w
eksykatorze nad czynnikiem pochłaniającym wodę (stężony kwas
siarkowy (VI), pięciotlenek fosforu, chlorek wapnia, żel
krzemionkowy lub inny środek suszący).
Suszenie w temperaturze podwyższonej można wykonać pod
normalnym lub pod zmniejszonym ciśnieniem. Pod normalnym
ciśnieniem można suszyć:
- przez nadmuchiwanie ogrzanego powietrza,
- w suszarce elektrycznej z automatyczną regulacją temperatury,
- pod promiennikiem podczerwieni.

.
METODY WYODRĘBNIANIA
I OCZYSZCZANIA
ZWIĄZKÓW
CHEMICZNYCH

.
• Do podstawowych zadań w chemii należy m.in. wydrębnianie
połączeń z produktów naturalnych lub mieszanin poreakcyjnych
oraz oczyszczanie substancji uzyskanych ze źródeł naturalnych
lub w wyniku syntezy chemicznej. Do najważniejszych metod
stosowanych w tym celu należą:
•
- krystalizacja ,
•
- destylacja ,
•
- sublimacja ,
•
- ekstrakcja ,
•
- chromatografia .
Proces krystalizacji polega na sporządzeniu nasyconego na gorąco
roztworu
oczyszczanej
substancji
w
odpowiednim
rozpuszczalniku, a następnie pozostawieniu go do ochłodzenia.
Wykorzystuje się przy tym zjawisko różnej rozpuszczalności w
zależności od temperatury roztworu. W miarę oziębiania roztwór
staje się przesycony i następuje wykrystalizowanie rozpuszczonej
substancji. Wykrystalizowuje czysty związek, a zanieczyszczenia
pozostają nie rozpuszczone albo w roztworze, gdyż ich stężenie w
roztworze jest znacznie mniejsze niż oczyszczanej substancji.

.
• Wydzielone kryształy odsącza się na lejku sitowym i suszy.
Dobór rozpuszczalnika uzależniony jest od właściwości
fizycznych i chemicznych krystalizowanej substancji.
• Ogólnie: podczas krystalizacji obowiązuje reguła, że
rozpuszczalniki polarne (np. woda, alkohole, ketony, estry,
kwasy, dimetyloformamid, pirydyna) lepiej rozpuszczają
związki o charakterze polarnym, to jest takie, które
posiadają moment dipolowy. Natomiast związki niepolarne
lepiej rozpuszczają się w rozpuszczalnikach niepolarnych
(np. benzyna, benzen, eter, tetrachlorek węgla). Często
korzystne wyniki uzyskuje się stosując mieszaninę
rozpuszczalników.
• W celu dokładnego oczyszczenia substancji proces
krystalizacji powtarza się kilkakrotnie, aż do chwili, gdy
temperatura topnienia oczyszczanego związku nie ulega
już zmianie podczas kolejnych krystalizacji.

.
• DESTYLACJA
•
Destylacja jest jednym z najczęściej stosowanych sposobów
oczyszczania i rozdzielania substancji ciekłych. Ciała stałe
destyluje się tylko wtedy, gdy oczyszczanie ich przez krystalizację
nie daje pożądanych wyników. Destylację przeprowadza się często
pod zmniejszonym ciśnieniem lub z parą wodną. Za pomocą
destylacji oddziela się te zanieczyszczenia, które nie mogą być
usunięte przez odsączenie lub ekstrakcję odpowiednimi
rozpuszczalnikami.
•
Destylacja polega na przeprowadzeniu cieczy w stan pary, a
następnie skropleniu pary w chłodnicy. Do najczęściej
stosowanych rodzajów destylacji należą:
•
a) destylacja pod normalnym ciśnieniem,
•
b) destylacja frakcyjna,
•
c) destylacja pod zmniejszonym ciśnieniem,
•
d) destylacja pod zwiększonym ciśnieniem,
•
e) rektyfikacja,
•
f) destylacja z parą wodną.

.
Pierwsze krople destylatu, aż do chwili ustalenia się
temperatury, zbiera się osobno, gdyż zawierają one
zanieczyszczenia. Jest to tzw. przedgon. Ustalenie się
temperatury oznacza, że destyluje substancja jednorodna.
b) Mieszaniny substancji, znacznie różniących się temperaturą
wrzenia poddaje się destylacji frakcjonowanej. Zbiera się
wówczas frakcje o temperaturze wrzenia leżącej w
określonym przedziale w pobliżu temperatury wrzenia
poszczególnych składników mieszaniny.
c) Mieszaniny substancji, znacznie różniących się temperaturą
wrzenia poddaje się destylacji frakcjonowanej. Zbiera się
wówczas frakcje o temperaturze wrzenia leżącej w
określonym przedziale w pobliżu temperatury wrzenia
poszczególnych składników mieszaniny.
d) Destylację pod zwiększonym ciśnieniem stosuje się do
destylacji skroplonych gazów.

.
e) Rektyfikacja polega na wielokrotnej destylacji mieszaniny
dwu- lub wieloskładnikowej, przeprowadzanej w jednym
aparacie, zwanym kolumną destylacyjną lub rektyfikacyjną.
Kolumna rektyfikacyjna składa się z półek, w których
znajdują się otwory nakryte dzwonami oraz przelewy.
Rektyfikacja polega na tym, że na każdej półce następuje
zetknięcie się fazy parowej ze skroploną fazą ciekłą, a
następnie wymiana masy, w wyniku której lżejszy składnik
z fazy ciekłej przechodzi do fazy parowej, a jednocześnie
równoważna ilość cięższego składnika przechodzi z fazy
parowej do fazy ciekłej.
f) Destylacja z parą wodną jest stosowana do oczyszczania
albo oddzielania substancji ciekłych lub stałych, które mają
dostateczną lotność, a nie rozpuszczają się i nie wchodzą w
reakcję z wodą.

.
• SUBLIMACJA
Sublimacja polega na tym, że niektóre substancje
bezpośrednio ze stanu stałego, nie topiąc się, przechodzą
w stan pary, a po oziębieniu par z powrotem zestalają się
bez pośrednictwa fazy ciekłej. Do oczyszczania przez
sublimację bardzo małych ilości substancji używa się
dwóch złożonych szkiełek
zegarkowych: na dolne
szkiełko wsypuje się substancję sublimowaną i po
przykryciu drugim szkiełkiem zegarkowym, ogrzewa się
mikropalnikiem
dolne
szkiełko.
Pary
substancji
sublimowanej zestalają się na wewnętrznej
powierzchni górnego szkiełka. Do sublimacji większych
ilości substancji używa się wysokiej zlewki. Na dno zlewki
wsypuje się substancję przeznaczoną do sublimacji. Otwór
zlewki nakrywa się kolbą kulistą, napełnioną zimną wodą.
Zlewkę z substancją ogrzewa się na łaźni piaskowej lub
palnikiem. Sublimowana substancja osadza się na zimnej
powierzchni dna kolby, z której można ją zeskrobać.

.
Do często wykonywanych czynności w laboratorium
chemicznym należą: wytrącanie i roztwarzanie
osadów, oddzielanie osadów od roztworu i ich
przemywanie, a także sporządzanie roztworów
wodnych różnych substancji o określonym stężeniu.
Wytrącanie osadu polega na wydzieleniu trudno
rozpuszczalnego związku, np. typu AB, podczas
dodawania do jednego roztworu, zawierającego
jon A, drugiego roztworu, zawierającego jon B
(odczynnik strącający).
Aby wytrącenie osadu było możliwe, iloczyn stężenia
reagujących jonów musi być większy, niż to wynika z
iloczynu rozpuszczalności powstającego związku.
Otrzymany osad powinien być trudno rozpuszczalny,
czysty i o odpowiedniej postaci, która ułatwiałaby jego
oddzielenie od roztworu.

.
W zależności od właściwości osadów można podzielić je wg
następującego schematu:
Osady
• krystaliczne:
→ drobnokrystaliczne, np. BaSO4 krystaliczne
→ grubokrystaliczne, np. MgNH
4
PO
4
• koloidowe:
→ serowate, np. AgCl
→ galaretowate, np. Fe(OH)
3
Osad krystaliczny
- jest to osad złożony z cząstek o
uporządkowanej budowie sieciowej, tworzący podczas
rozpuszczania na ogół roztwory rzeczywiste.
Osad koloidalny
- złożony jest z cząstek o nie uporządkowanej
budowie sieciowej, tworzący podczas rozpuszczania na ogół
roztwory koloidalne (galaretowate).

.
Roztwór rzeczywisty jest to roztwór, w którym
substancja rozpuszczona występuje w postaci
pojedynczych atomów, jonów lub cząsteczek
mniejszych od 1 nm.
Roztwór koloidalny lub, krótko, zol zawiera
cząstki o rozmiarach pomiędzy 1 a 200 nm. W
roztworze koloidalnym substancja rozpuszczona
znajduje się w stanie rozproszenia koloidalnego.
Jeżeli cząstki substancji rozproszonej w roztworze są
większe od 200 nm, to układ taki nazywamy
zawiesiną.
Podstawowymi procesami związanymi z osadami
koloidowymi, mającymi praktyczne znaczenie nie
tylko w chemii analitycznej ale i w farmacji są:
koagulacja i peptyzacja. Zależność między tymi
procesami można przedstawić schematycznie:
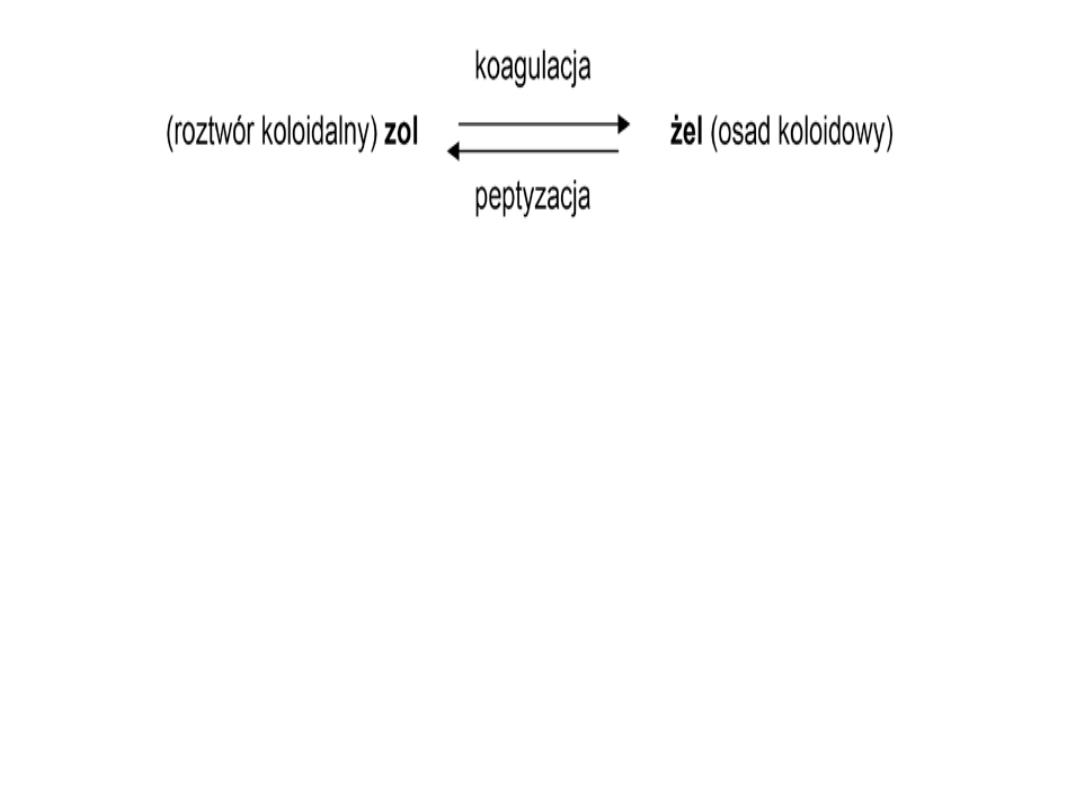
.
Żele stanowią wówczas zawiesinę o cząsteczkach większych,
które łatwiej pod wpływem sił grawitacyjnych osadzają się
(sedymentują) na dnie naczynia. Proces powstawania żelu nosi
nazwę koagulacji .
Aby uzyskać w tym wypadku osad o najlepszej postaci, nadający
się do szybkiego oddzielenia od roztworu i odmycia od
zanieczyszczeń, należy przestrzegać następujących zasad przy
wytrącaniu :
odczynnik
strącający
należy
dodawać
powoli
przy
jednoczesnym mieszaniu;
wytrącanie osadu powinno odbywać się w podwyższonej
temperaturze;
badany roztwór i dodawany odczynnik nie powinny być
roztworami stężonymi;

.
Strącanie osadów
Podczas strącania jony znajdujące się w roztworze reagują ze sobą i w
wyniku może się utworzyć osad substancji stałej. Wytrącone osady, w
zależności od warunków strącania, mogą mieć bardzo różnorodną
postać.
Nieraz w wyniku nieprawidłowego strącania osadów krystalicznych
możemy otrzymać bardzo drobne kryształy, które nie zatrzymują się na
sączku i przechodzą przez niego w postaci zmętnienia.
Wszystkie osady są mniej lub bardziej rozpuszczalne w wodzie i
roztworach
Należy w związku z tym tak dobrać roztwór strącający, aby zawierał takie
jony, jakie stworzą z wytrąconymi związek najtrudniej rozpuszczalny.
W celu maksymalnego strącenia osadu należy roztwór strącający dodać w
nadmiarze. Nadmiar 10-15% jest optymalny – większe ilości mogą
spowodować rozpuszczenie osadu.
Ustalając warunki strącania osadu bierzemy pod uwagę to, że:
• Osad powinien mieć postać możliwie najdogodniejszą do łatwego
odsączenia i całkowitego obmycia zanieczyszczeń
• Powinien być w stanie chemicznie czystym, a po przemyciu, wysuszeniu
lub prażeniu powinien mieć ściśle określony skład chemiczny
• Powinien się charakteryzować małą rozpuszczalnością

.
Należy dążyć do tego, aby osad wytrącił się w postaci
stosunkowo dużych kryształów, gdyż takie osady łatwiej
odsączyć i przemyć.
Dodatkowo osady bezpostaciowe, w tym galaretowate są trudne
do przemycia i mają przy strącaniu skłonność do okludowania
(pochłaniania) substancji znajdujących się w roztworze.
Postać i budowa osadu zależy od:
• Stężenia. Zwiększenie stężenia roztworów zwiększa szybkość
tworzenia się osadu, co prowadzi do powstania osadów
drobnokrystalicznych. W przypadku osadów koloidowych
zwiększenie stężenia sprzyja szybszemu przejściu nietrwałej
postaci galaretowatej osadu w postać żelu.
• Temperatury. Wzrost temperatury przyspiesza otrzymanie
osadu w zwartej postaci.
• Kolejności i szybkości strącania oraz czasu odstania osadu
po strąceniu.
• Obecności różnych soli w roztworze.

.
Aby uzyskać wygodny do sączenia osąd należy dostosować się
do następujących reguł:
• Strącanie przeprowadzamy z gorących roztworów, gdyż
wszystkie procesy prowadzące do tworzenia się bardziej
trwałej struktury krystalicznej przebiegają szybciej w
podwyższonej temperaturze.
• Roztwór strącający należy dodawać powoli, mieszając , tak
aby stężenie reagujących jonów było w całej objętości
równomierne.
• Można dodać substancji zwiększającej rozpuszczalność
osadu, gdyż z łatwiej rozpuszczalnych osadów powstają
osady grubokrystaliczne.
• Otrzymane osady należy poddać odstaniu na pewien czas
(znikają kryształy drobnokrystaliczne, grubokrystaliczne –
rosną)

.
Operację wytrącania osadu można zakończyć dopiero wtedy
gdy sprawdzimy całkowitość wytrącenia. W tym celu
czeka się na opadnięcie osadu, dodaje kilka kropel,
po ściance naczynia, odczynnika strącającego i
obserwuje czy nie wytrąca się osad. Jeśli osad nie
został całkowicie wytrącony, należy wytrącanie
kontynuować.
W pracy laboratoryjnej uzyskany osad bardzo często należy
oddzielić od roztworu.
W zależności od tego jaki rodzaj osadu został wytrącony i do
jakich
celów
chcemy
go
wykorzystać,
stosujemy
odpowiednią metodę oddzielania.
• Przez dekantację
• Na sączku
• Przez parokrotne strącanie

.
Dekantacja
– polega na zlewaniu cieczy znad osadu,
stosuje się jedynie w wypadku osadów gruboziarnistych,
ciężkich, łatwo opadających na dno naczynia.
Na sączek dekantujemy przezroczysty roztwór znad osadu,
a osad w zlewce zalewamy cieczą przemywającą ,
mieszamy bagietką, pozwalamy mu znowu osiąść , po
czym ponownie zlewamy odstaną ciecz.
Taką dekantację powtarzamy kilka razy (5-6razy przy
osadach krystalicznych można 2-3 razy), a dopiero potem
przenosimy osad na sączek, tzn. przystępujemy do
właściwego sączenia.
Ciecz zlewamy koniecznie po bagietce!
Osad mieszamy z taką ilością cieczy przemywającej jaka
mieści się na sączku za jednym napełnieniem. Otrzymaną
mętną ciecz zlewamy po bagietce, na sączek, nie
pozwalając osiąść osadowi. Przy użyciu tryskawki
przemywamy zlewkę i też przenosimy na sączek.

Rozpuszczanie substancji
Rozpuszczanie czyli przeprowadzenie substancji do
roztworu przy czym roztwór zachowuje wszelkie
właściwości chemiczne substancji wyjściowej (np.
NaCl w wodzie - po odparowaniu ponownie NaCl).
Można to wykonać w dwojaki sposób:
1. Przez rozpuszczenie w wodzie,
2. Rozpuszczenie w rozpuszczalnikach.
Do
substancji
dodajemy
w
probówce
wodę
destylowaną i wstrząsamy lub mieszamy bagietką,
aż do uzyskania jednorodnego roztworu. Większe
kryształy
należy
uprzednio
rozdrobnić
w
moździerzu.
Proces
rozpuszczania
możemy
przyspieszyć przez ogrzanie probówki.

Sączenie
W pracy laboratoryjnej uzyskany osad często
należy oddzielić od roztworu.
Sączenie
–
polega
na
przepuszczeniu
(przefiltrowaniu) mieszaniny przez ciało
porowate (bibuła filtracyjna, spiek) o
wielkości por odpowiednio dobranych do
charakteru osadu (w zależności od wielkości
uzyskanych kryształów osadu).
Oddzielanie osadu przez sączenie przeprowadzamy
wtedy, gdy osad lub roztwór wykorzystywany jest
następnie w celach analitycznych.
W laboratorium używa się specjalnych sączków o
różnym stopniu przepuszczania roztworu.

.
W analizie ilościowej używa się sączków, które po spaleniu
mają mniej niż 0,0001 g popiołu.
Jeżeli bibuła jest w arkuszach, sączek przygotowuje się w
następujący sposób: kawałek bibuły składa się na czworo a
następnie nożyczkami obcina się rogi tak, aby po rozłożeniu
uzyskać koło. Sączek składamy na czworo i wkładamy do
lejka. Następnie sączek przemywamy wodą destylowaną.
Roztwór z osadem wlewamy powoli po bagietce szklanej.
Najpierw zlewamy sam roztwór, a następnie osad. Osad
pozostawiony w zlewce wymywamy wodą z tryskawki.
Należy uważać aby wysokość roztworu na sączku nie była
większa od wysokości sączka. W przypadku sączenia przy
zmniejszonym ciśnieniu lejek umieszczamy szczelnie w
korku gumowym a ten z kolei w kolbie ssawkowej.
Następnie włączamy pompkę wodną. Używając lejków z
dziurkowanym dnem należy pamiętać aby wielkość sączka
dokładnie odpowiadała wielkości dna i aby sączek nie
odstawał w żadnym miejscu
.

.
W szczególnych przypadkach stosuje się specjalne sączki o
różnym stopniu porowatości:
• o do sączenia osadów drobnokrystalicznych, jak np.
BaSO4, CaC2O4, stosuje się sączki o najmniejszych
porach. Sączki te nazywa się „twardymi” I oznacza
niebieskim kolorem i numerem 390.
• o do grubokrystalicznych osadów stosuje się sączki
„średnie” oznaczone kolorem żółtym i numerem 389.
• o osady galaretowate, serowate sączy się na sączkach
„miękkich” o największych porach. Sączki te oznacza się
kolorem czerwonym lub szarym z numerem 388.
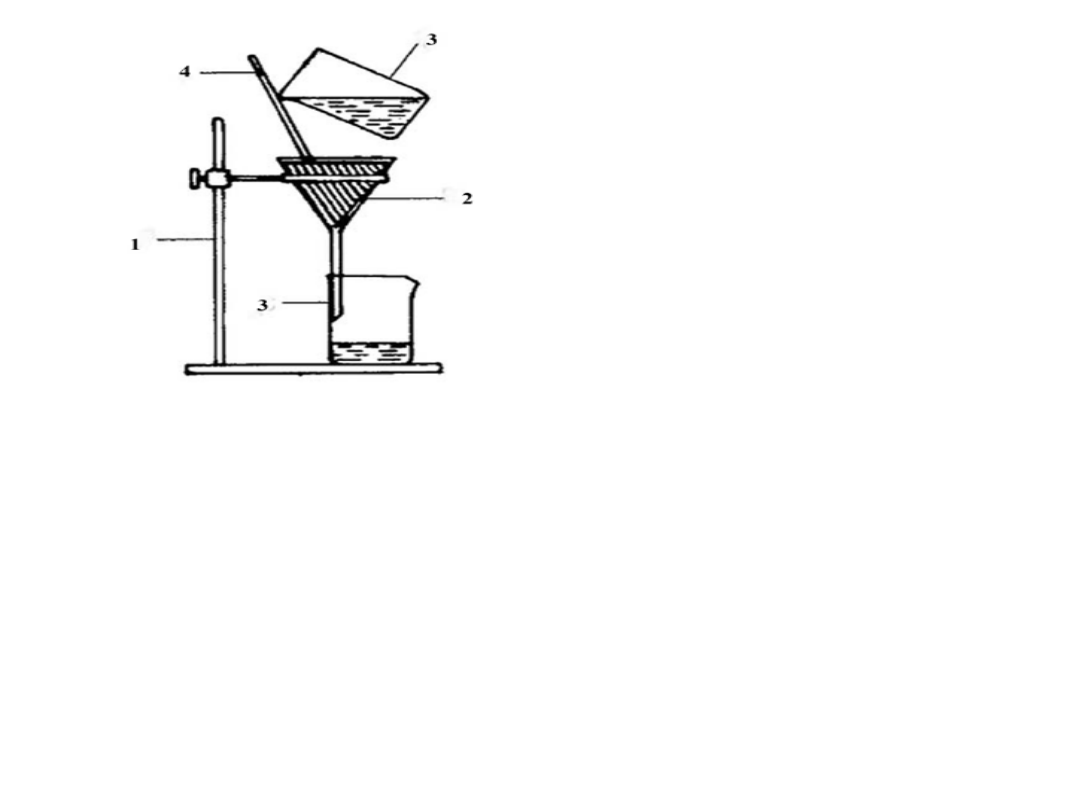
Zestaw do sączenia:
1 – statyw,
2 – lejek z sączkiem,
3 – zlewka,
4 – bagietka
Typowy zestaw do sączenia składa się z lejka szklanego umieszczonego
w kółku metalowym i zlewki podstawionej pod wyciek z lejka w ten
sposób, aby nóżka lejka dotykała ścianki zlewki. W lejku umieszcza
się sączek o odpowiedniej wielkości (aby nie wystawał poza górną
krawędź lejka, a raczej poniżej ok. 0,5 cm) i twardości, złożony na
czworo i przemyty wodą destylowaną. Do sączenia stosujemy dwa
rodzaje lejków: zwykły - z krótką nóżką i analityczny – z długą nóżką.
Lejki z długą nóżką umożliwiają szybsze sączenie. Aby wytrącony
osad mógł być wykorzystany w celach analitycznych, musi być
przemyty w celu usunięcia wszelkich zanieczyszczających go jonów
.

.
Przemywanie osadów można przeprowadzać
kilkoma metodami.
Jedną z nich jest przemywanie przez
dekantację. W tym przypadku po zlaniu
cieczy znad osadu, wlewa się 10-30 cm3
roztworu przemywającego, miesza, pozwala
osadowi opaść na dno naczynia, a klarowną
(przezroczystą) ciecz ponownie zlewa znad
osadu (naturalnie przez sączek). Czynności
te zwykle powtarza się od 2 do 5 razy (zależy
od wymagań stawianych wobec osadu), po
czym osad przenosi się na sączek przy
pomocy bagietki i tryskawki (z wodą
destylowaną).

.
Nieco inaczej przeprowadza się przemywanie
osadu na sączku. Osad przemywa się małymi
porcjami
roztworu
przemywającego,
pozwalając każdorazowo cieczy na całkowite
przesączenie się przez osad, przed dodaniem
następnej porcji. Po kilkakrotnym przemyciu
osadu przystępuje się do sprawdzenia, czy
przemycie jest dostateczne. W tym celu
pobiera się kilka kropli z ostatniej porcji
przesączu i przeprowadza odpowiednią
reakcję, charakterystyczną dla danego jonu,
który stanowił zanieczyszczenie osadu.

.
Procesem przeciwnym do wytrącania osadów jest ich
roztwarzanie
w
odpowiednio
dobranych
rozpuszczalnikach. W laboratorium chemicznym
jako rozpuszczalniki stosuje się przede wszystkim
wodę i roztwory wodne innych substancji np.
roztwory kwasów lub zasad.
Często zamiast słowa „roztwarzanie” zwyczajowo używa
się słowa „
rozpuszczanie
”, chociaż jest to określenie
prawidłowo użyte tylko w przypadku czysto
fizycznego procesu przeprowadzania substancji
stałej do roztworu. Jeżeli substancja przechodzi z
fazy stałej do roztworu w wyniku reakcji
chemicznej danej substancji z rozpuszczalnikiem to
jest to proces roztwarzania. Mówimy więc o
rozpuszczaniu cukru czy soli kuchennej w wodzie,
ale o roztwarzaniu wodorotlenku żelaza w kwasie
solnym czy miedzi w kwasie azotowym.

Odparowywanie
. Często w pracy laboratoryjnej konieczne jest
zagęszczenie roztworu lub całkowite jego
odparowanie. Odparowywanie przeprowadza się
w porcelanowych parowniczkach o odpowiednim
kształcie. Roztwór odparowywany nie powinien
wrzeć, gdyż istnieje możliwość nagłego
wyrzucenia cieczy z parowniczki.
Odparowywanie przeprowadza się w łaźni
wodnej, piaskowej lub na siatkach metalowych
ogrzewanych małym płomieniem palnika
gazowego.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Podstawowe czynności laboratoryjne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
PODSTAWOWE CZYNNOŚCI LABORATORYJNE - ściąga, Pracownia Chemii kosmetycznej
01 Podstawowe czynności laboratoryjne instrukcja
1 - Podstawowe czynności laboratoryjne, sprawko
PODSTAWOWE CZYNNOŚCI LABORATORYJNE, Pracownia Chemii kosmetycznej
1 Podstawowe czynności laboratoryjne instrukcja
1 Podstawowe czynności laboratoryjne sprawkoid 8789
1 Podstawowe czynności laboratoryjne instrukcja
Podstawowe czynności laboratoryjne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
01 Wykonywanie podstawowych czynności laboratoryjnych
04 Wykonywanie podstawowych czynności laboratoryjnych
1 Podstawowe czynności laboratoryjne instrukcja
2 1 Podstawowe czynności pomiarowe w geodezji
więcej podobnych podstron