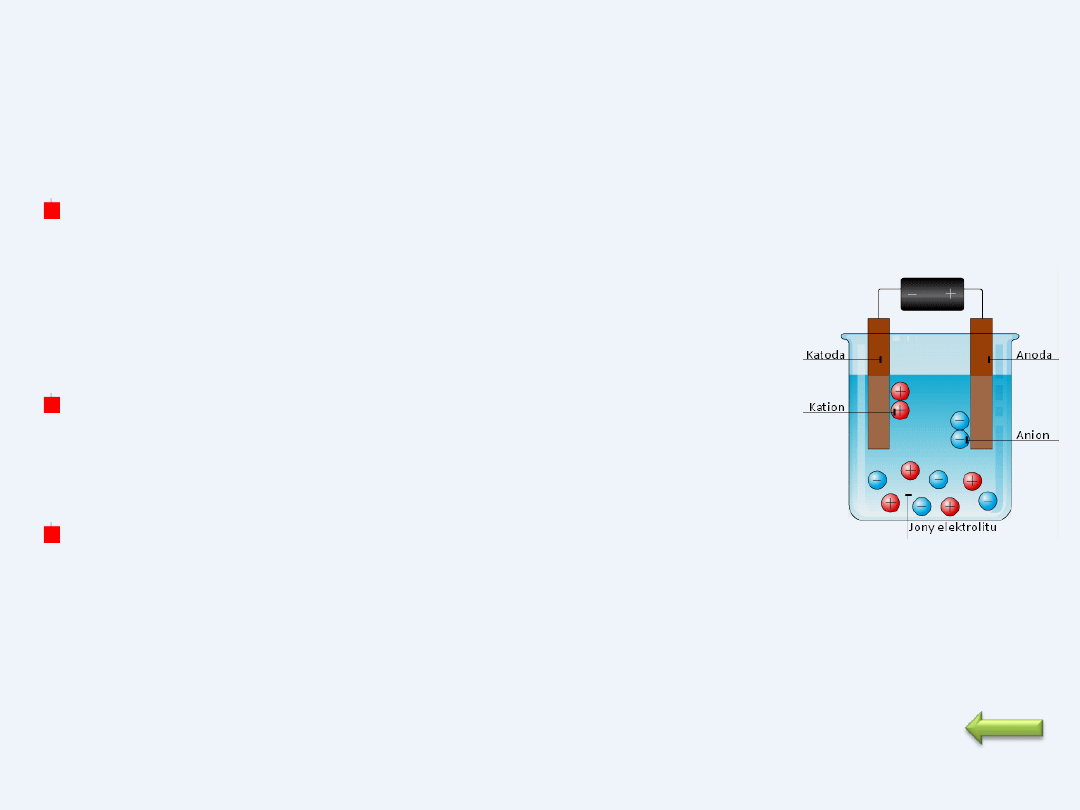
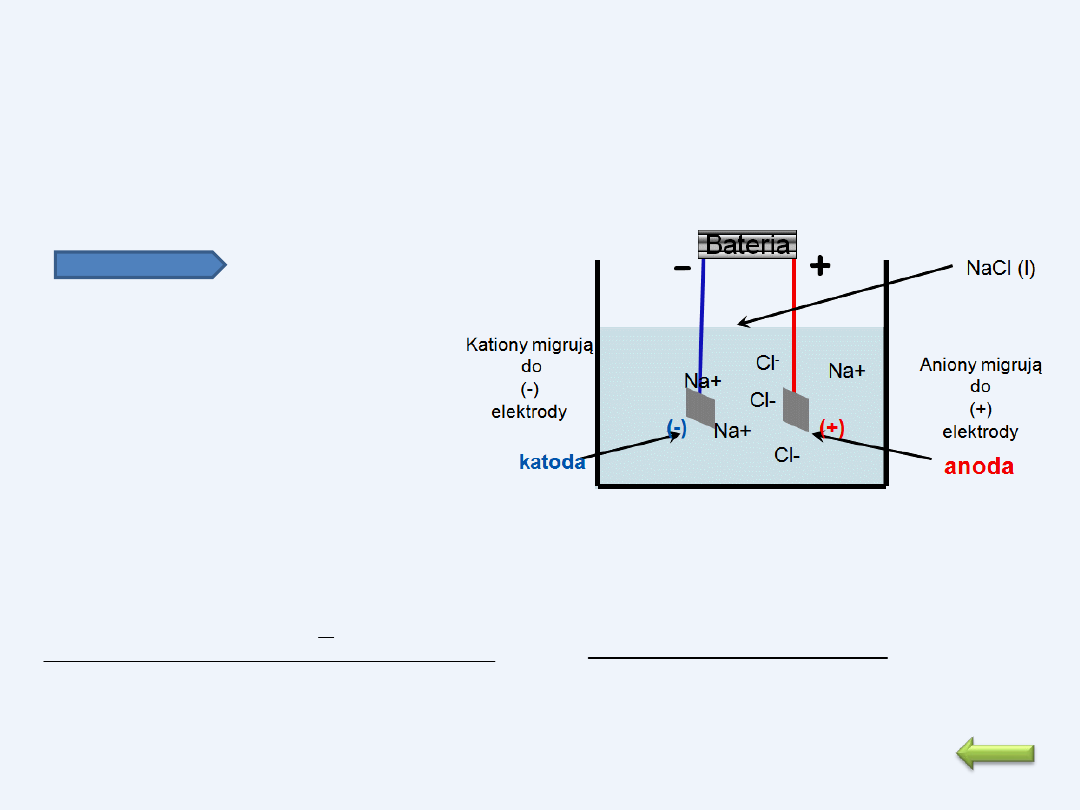
W czasie elektrolizy w polu elektrycznym między
elektrodami wędrują jony dodatnie (kationy) w
kierunku katody połączonej z ujemnym biegunem źródła
prądu, a jony ujemne (aniony) w kierunku anody
połączonej z dodatnim biegunem źródła prądu.
Na granicy faz elektroda - elektrolit biegną reakcje
utleniania (na anodzie) i redukcji (na katodzie)
jonów elektrolitów.
Podczas elektrolizy zachodzą procesy odwrotne do
przemian zachodzących w czasie pracy ogniwa (przepływ
prądu wywołuje reakcje elektrodowe).
ELEKTROLIZA
to proces, w którym przepływ prądu
elektrycznego przez roztwór elektrolitu (lub stopiony
elektrolit) wymusza reakcje chemiczne.
Elektrolizer to urządzenie składające się z dwóch przewodników
metalicznych, które są zanurzone w przewodniku jonowym.
Przewodniki metaliczne (elektrody) są podłączone do źródła prądu
stałego.
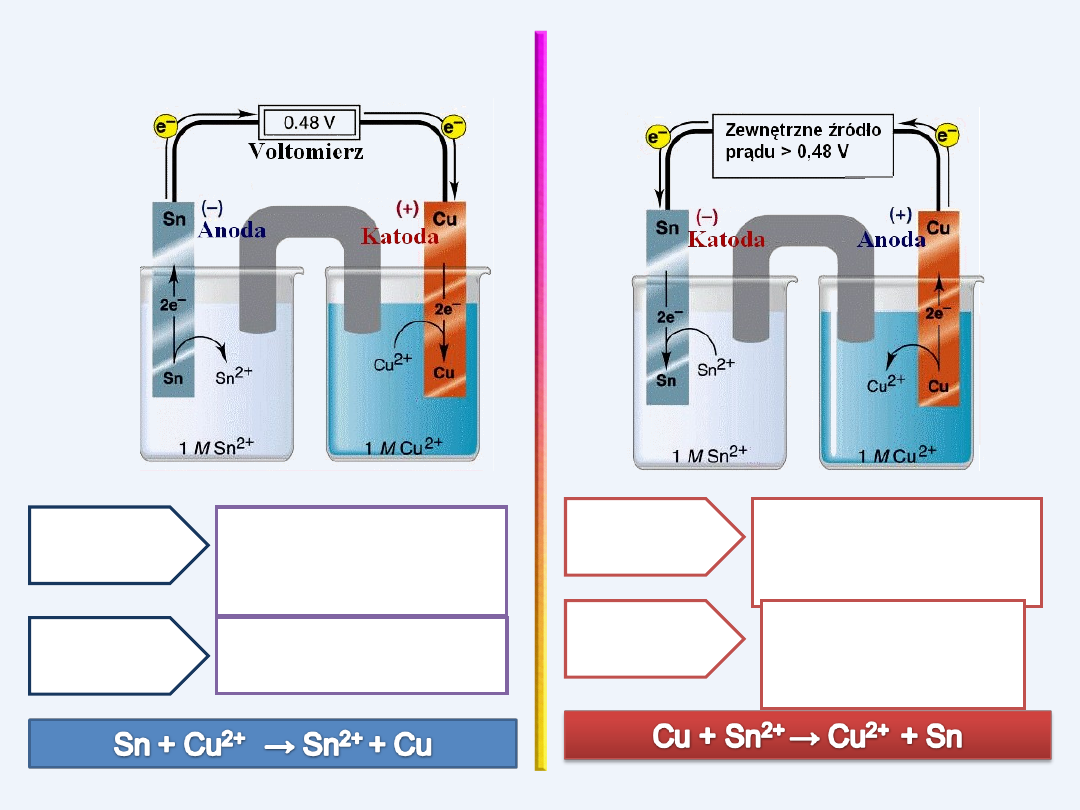
OGNIWO GALWANICZNE
ELEKTROLIZER
Reakcja
utleniania
Cu → Cu
2+
+ 2 e
-
Reakcja
redukcji
Sn
2+
+2e
-
→ Sn
Reakcja
utleniania
Sn → Sn
2+
+ 2 e
-
Reakcja redukcji
Cu
2+
+2e
-
→ Cu
ANODA
(-)
KATODA
(+)
ANODA
(+)
KATODA
(-)

Przebieg procesów chemicznych na powierzchni elektrod zależy od:
A.
Własności chemicznych składników elektrolitu
B.
Stężeń jonów
C.
Rodzaju elektrod
D.
Różnicy potencjałów między elektrodami
Uproszczone reguły pozwalają przewidzieć kolejność rozładowania
jonów w roztworach wodnych elektrolitów o stężeniach jonów
zbliżonych do 1 mol/dm
3
.
KATODA (-)
Kolejność redukcji jonów jest z reguły
zgodna z szeregiem potencjałów
standardowych półogniw.
1.
Najpierw redukują się kationy metali
mniej aktywnych od glinu
Me
m+
+ me --> Me
Najważniejsze wyjątki od tych reguł:
Rozładowywanie kationu Na
+
na elektrodzie
rtęciowej
Równoczesne wydzielanie wodoru i metalu
w środowisku kwaśnym
2.
Po metalach mniej aktywnych
redukują się jony H
+
lub cząsteczki
H
2
O w zależności od środowiska /
wydziela się wodór
a.W śr kwasowym
: 2H
+
+ 2e -- >
H
2
↑
b.W roztworach soli litowców,
berylowców, glinu:
2H
2
O + 2e
H
2
+
2OH
-
ANODA (+)
1. Najpierw utleniają się aniony kwasów
beztlenowych i ich soli / wydziela się
gazowy niemetal.
2X
-
- 2e -- > X
2
2. W następnej kolejności utleniają się:
a.W roztworach wodorotlenków jony OH
-
/
wydziela się tlen:
4OH
-
- 4e -- >
O
2
+ 2H
2
O
b.W roztworach kwasów tlenowych i ich
soli
utleniają się cząsteczki H
2
O /
wydziela się tlen
2H
2
O – 4e -- >
O
2
+ 4H
+
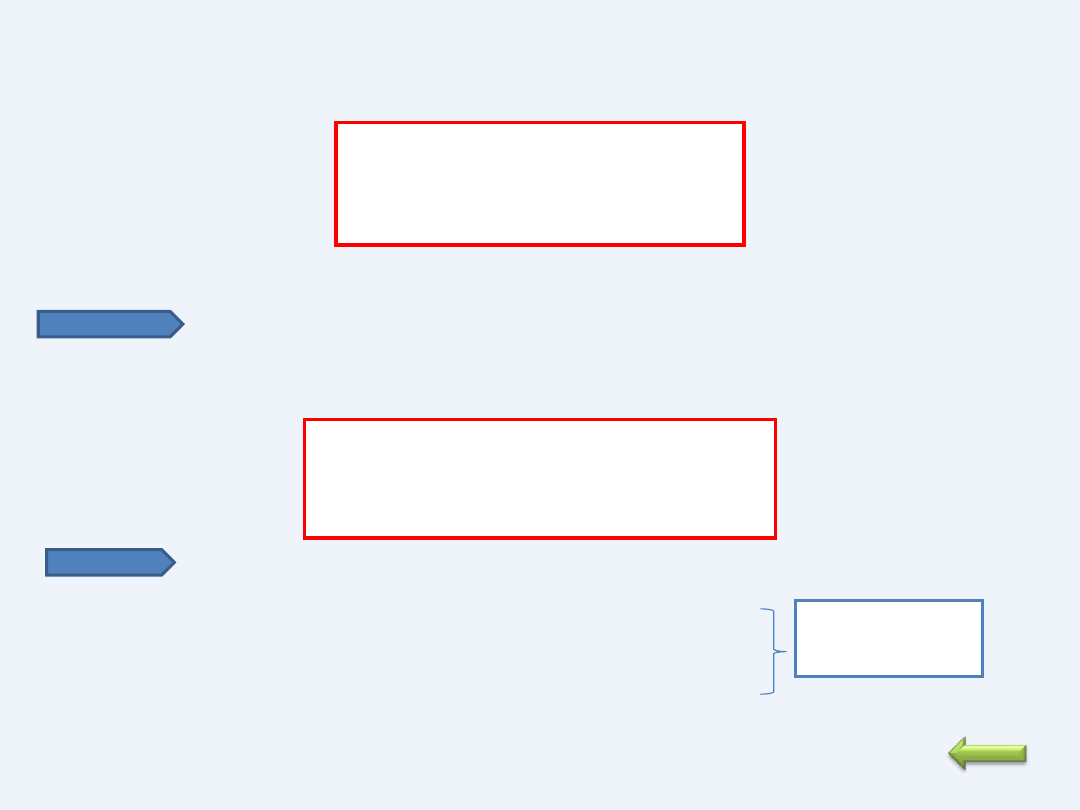
ELEKTROLIZA WODNYCH ROZTWORÓW KWASÓW
Kwasy beztlenowe
2e
X
2X
)
A(
H
2e
2H
)
K(
0
2
0
2
Stężenie jonów wodorowych maleje, więc pH roztworu wzrasta
e
H
O
O
H
)
A(
H
2e
2H
)
K(
2
2
0
2
4
4
2
A (+) Stężenie jonów wodorowych wzrasta, więc pH maleje
Kwasy
tlenowe
PRZYKŁAD
HCl K(-) : 2H
+
+2e --> H
2
; A (+) 2Cl
-
-- > Cl
2
+ 2e
Sumarycznie : 2HCl -- > H
2
+ Cl
2
PRZYKŁA
D
H
2
SO
4
-- >2H
+
+ SO
4
2-
K(-) 2H
+
+ 2e -- > H
2
↑ ; A (+) H
2
O – 2e -- >1/2 O
2
+
2H
+
Sumarycznie: H
2
O -- > H
2
+ ½ O
2
Elektroliza
wody
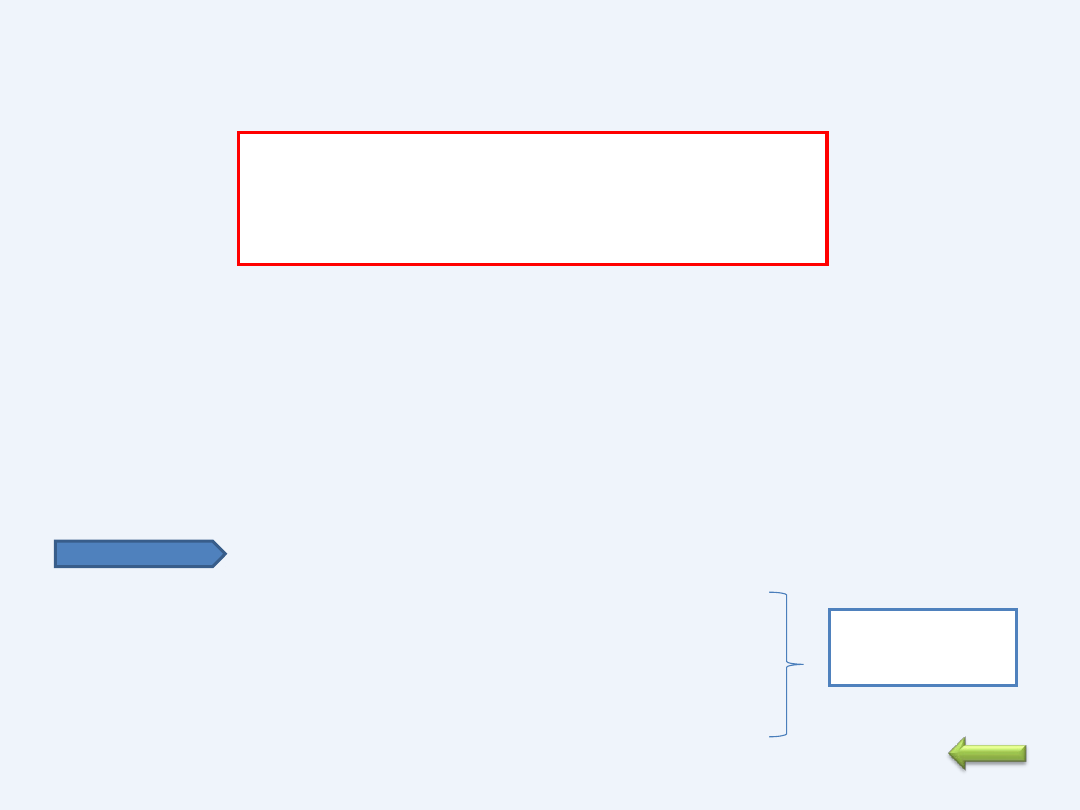
ELEKTROLIZA WODNYCH ROZTWORÓW ZASAD
e
O
O
H
OH
)
A(
2OH
H
2e
O
2H
)
K(
2
2
2
2
4
2
4
Metale znajdujące się na początku szeregu napięciowego ( do glinu
włącznie) nie ulegają redukcji na katodzie.
Na katodzie zachodzi redukcja wody. Wydziela się gazowy wodór. PH
roztworu wzrasta
Na anodzie zachodzi utlenienie jonów OH-. Wydziela się gazowy tlen.
pH roztworu maleje
PRZYKŁAD
NaOH NaOH -- > Na
+
+ OH
-
K (-) 2H
2
O + 2e H
2
+ 2OH
-
;
Wzrost pH wokół
katody
A(+) 2OH
-
- 2e -- >1/2 O
2
+ H
2
O
Sumarycznie : H
2
O --> H
2
+ ½ O
2
2H
2
O 2H
2
+
O
2
Elektroliza
wody

ELEKTROLIZA WODNYCH ROZTWORÓW SOLI
KATODA(-)
Na katodzie rozkładają się metale leżące za glinem w szeregu
elektrochemicznym, jeśli nie ma takich jonów to rozkłada się woda
2H
2
O +2e -> H
2
+2OH
-
Elektroliza wodnego roztworu NaCl
Elektroliza wodnego roztworu NaCl prowadzi do otrzymania chloru i
wodorotlenku sodowego.
ANODA(+)
Najpierw utleniają się aniony kwasów beztlenowych / wydziela
się gazowy niemetal.2X
-
- 2e -- > X
2
Aniony kwasów beztlenowych wydzielają się w kolejności:
S
2-
, I
-
, Br
-
, Cl
-
(
F
-
nie daje się wydzielić z roztworu
wodnego)
W roztworach kwasów tlenowych i ich soli utleniają się cząsteczki
H
2
O/wydziela się tlen
H
2
O – 2e -- >1/2 O
2
+ 2H
+
PRZYKŁAD
2
2
2
2
2
2
H
Cl
2OH
2Na
O
2H
2NaCl
Cl
2e
2Cl
)
A(
2OH
H
2e
O
2H
)
K(
Elektroliza wodnego roztworu azotanu(V) srebra prowadzona na
elektrodach grafitowych. Określ jakie produkty wydzielą się na
elektrodach
AgNO
3
= Ag
+
+ NO
3
-
Katoda(-):Ag
+
; H
2
O
Anoda(+): NO
3
-
H
2
O
PRZYKŁAD
PRZYKŁAD
Przebieg elektrolizy siarczanu(VI)sodu
Katoda(-):Na
+
; H
2
O
Anoda(+): SO
4
2-
,
H
2
O
2
2
2
-
2
Cl
Cu
2Cl
sum..Cu
Cl
2e
2Cl
)
A(
Cu
2e
Cu
)
K(
4H
O
4e
O
2H
)
A(
e
A
)
K(
2
2
Ag
g
PRZYKŁAD
Przebieg elektrolizy chlorku miedzi(II)
Katoda(-):Cu
2+
; H
2
O
Anoda(+): Cl
-
,
H
2
O
2
2
2
2
2
2
2
O
2H
O
sum..2H
4H
O
4e
O
2H
)
A(
2
|
2OH
H
2e
O
2H
)
K(
Katoda(-):
2Na
+
+ 2e -- > 2Na
Anoda(+):
2Cl
-
-- >Cl
2
+ 2e
Sumarycznie : 2NaCl 2Na +
Cl
2
ELEKTROLIZA STOPIONYCH SOLI
Elektroliza zachodzi również w przypadku stopionych soli i
wodorotlenków.
W wyniku wysokiej temperatury sieć krystaliczna zostaje zniszczona,
dzięki czemu możliwy staje się swobodny ruch jonów w kierunku elektrod
i zachodzenie reakcji elektrodowych.
PRZYKŁAD
Stopiony wodorotlenek sodu NaOH
O
2H
O
4e
)4OH
A(
4Na
4e
)4Na
K(
2
|
O
H
O
2e
2OH
)
A(
2
|
2Na
2e
2Na
)
K(
2
2
2
2
2
1
Stopiony chlorek ołowiu(II)
2
2
2
2
Cl
Pb
PbCl
Cl
2e
2Cl
)
A(
Pb
2e
Pb
)
K(

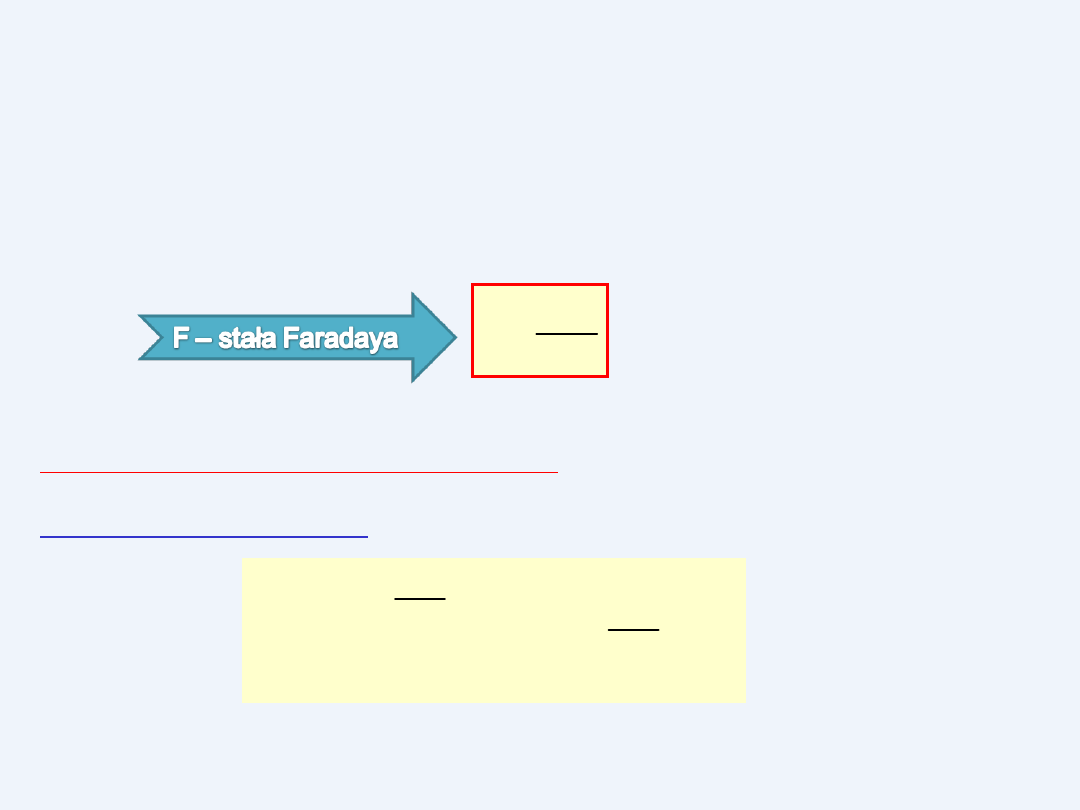
I PRAWO FARADAY’A
Masa wydzielonej substancji na
elektrodach podczas elektrolizy jest
proporcjonalna
do natężenia prądu i czasu trwania
elektrolizy
kIt
kq
m
q – ładunek [ C]
I – natężenie prądu [A]
t – czas [s]
k –równoważnik elektrochemiczny [kg/C]
Równoważnik elektrochemiczny równy jest masie substancji
wydzielonej na elektrodzie przy przepływie ładunku 1C.
Współczynnik proporcjonalności k jest stały i charakterystyczny dla
danego procesu elektrodowego.
Wartości równoważników elektrochemicznych wyznacza się
doświadczalnie.
II PRAWO FARADAY’A
Drugie prawo Faradaya określa wielkość elektrochemicznego
równoważnika k.
Stosunek masy molowej
M
substancji wydzielającej się na
elektrodzie do iloczynu równoważnika elektrochemicznego
k
i
liczby ładunkowej
n
reakcji elektrodowej dla jednego mola tej
substancji jest wielkością stałą
k
n
M
F
F = 96500 [C/mol
= A ∙ s / mol ]
1F – ładunek 1 mola elektronów !!
Równanie elektrolizy
to zależność łącząca oba prawa Faradaya
t
I
m
t
I
k
m
k
F
n
M
F
n
M
2
1
Document Outline
Wyszukiwarka
Podobne podstrony:
Elektrotechnika 3 - Kopia, ZiIP Politechnika Poznańska, Elektrotechnika i elektronika
Elektrotechnika 4 - Kopia, ZiIP Politechnika Poznańska, Elektrotechnika i elektronika
bezpieczeństwo elektryczne kopia do foliogramów
elektronika Kopia
Elektrotechnika 2 - Kopia, ZiIP Politechnika Poznańska, Elektrotechnika i elektronika
Elektroforeza Kopia
Kopia Elektrotechnologie egzamin
Kopia (2) pchrezonans, Energetyka I stopień PŚk, sem1 Elektrotechnika, Laboratorium elektrotechnika,
Kopia pchrezonans, Energetyka I stopień PŚk, sem1 Elektrotechnika, Laboratorium elektrotechnika, rez
KOPIA(~2, Szkoła, penek, Przedmioty, Elektrotechnika, Laborki
Kopia Elektrotecnika temat 4 i 5
Elektronika sciaga Kopia
Kopia ściąga bmikroskopowe stali węglowych wyżarzonych i żeliw, Elektrotechnika, dc pobierane, pnom
Kopia spawanie elektr
Kopia zad 5 elektrochemia
Kopia Spawanie elektryczne
Działanie prądu elektrycznego na organizm człowieka Kopia
więcej podobnych podstron