
POLITECHNIKA POZNAŃSKA
Wydział Technologii Chemicznej
CIECZE
JONOWE
Juliusz Pernak
Seminarium – Poznań
3.06.2005

Stan wiedzy o cieczach jonowych
Badania własne

Definicja
Ciecz jonowa to związek chemiczny,
organiczny składający się z kationu i
anionu.
Sól ta charakteryzuje się temperaturą
topnienia poniżej temperatury wrzenia
wody.
Ciecz jonowa
• nie jest stopioną solą,
• nie jest wodnym roztworem
Słowo kluczowe
ciecz jonowa
ionic liquid – Chemical Abstracts
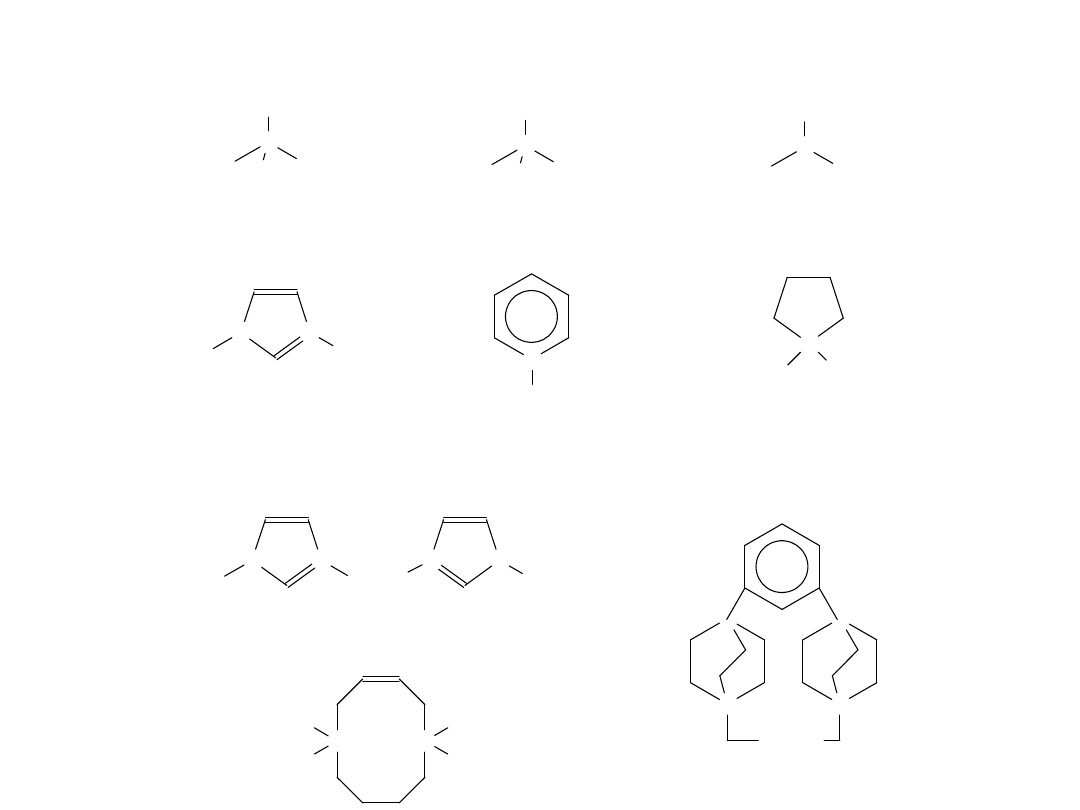
Kation
R1
R3
N
R2
R4
R1
R3
S
R2
R1
R3
P
R2
R4
+
+
+
N
N
R1
R2
N
R2
R1
N
R
+
+
+
N
N
R2
R1
N
N
(CH
2
)x
N
N
(CH
2
)x
N
N
N
N
CH
3
CH
3
H
3
C
H
3
C
+
+
+
+
+
+
+
+

Anion
Nieorganiczny
BF
4
PF
6
SbF
6
ZnCl
3
NO
3
NO
2
CF
3
SO
3
(CF
3
SO
2
)
2
N (C
2
F
5
SO
2
)N (CF
3
SO
2
)
3
C CH
3
SO
3
CF
3
CF
2
CF
2
CF
2
SO
3
itp.
Organiczny
CF
3
COO, Ace, Sac, salicylany, mleczany itd
.

1914
C
2
H
5
NH
2
+ st. HNO
3
[C
2
H
5
NH
3
]
+
[NO
3
]
–
• Walden P. Bull. Acad. Imper. Sci. (St. Petersburg) 1800 (1914)
1948
bromek 1–etylopirydyniowy + AlCl
3
• Hurley F. H. U. S. Pat. 4,446,331 (1948)
• Wier T.P. Jr., Hurley F. H. U. S. Pat. 4,446,349 (1948)
• Wier T. P. Jr. U. S. Pat. 4,446,350 i 4,446,350 (1948)
1963
Major dr L. A. King – Air Force Academy
chlorogliniany – baterie
• Carpio R. A., King L. A., Lindstrom R. E., Nardi J. C., Hussey
C. L.,
J.Electrochem. Soc., 126, 1644 (1979) [alkylpyr]Cl +
AlCl
3
• Fannin A. A., King L. A., Levisky J. A., Wikes J. S., J. Phys.
Chem.,
88, 2609 oraz 2614 (1984) [alkylmim]Cl + AlCl
3
1990
dr M. Zaworotko – staż w Air Force Academy
ciecze jonowe – BF
4
–
, PF
6
–
...
• Wilkes J. S., Zaworotko M. J. J. Chem. Soc., Chem. Commun. 965(1992)
Chemia czwartorzędowych soli amoniowych
Rok
Zastosowanie praktyczne
Autor
189
0
190
2
Synteza
soli amoniowych
soli iminiowych
Menschutkin
191
6
Właściwości bakteriobójcze
Jacobs i współ.
Właściwości powierzchniowe
193
5
Dezynfekcja
Domagk
60–
te
Zmiękczacze tkanin
196
5
Kataliza przeniesienia
międzyfazowego
Jarousse–
Mąkosza
70–
te
Antyelektrostatyki
197
7
80–
te
Ochrona drewna
czysta forma
kombinacja z biocydami
Butcher i współ.
80–
te
Modyfikatory asfaltów
90–
te
Modyfikatory gliny
199
8
Ciecze jonowe
Rogers Seddon
Synteza
Reakcja Menschutkina
Reakcja wymiany anionu
anion–
R1
R3
N
R2
R4
+
R1
R3
N
R2
R4
+
Cl–
c) wymiana jonowa
+ MCl
BF
4
–
R1
R3
N
R2
R4
+
+ MBF
4
R1
R3
N
R2
R4
+
Cl–
b) z solami
+ HCl
BF
4
–
R1
R3
N
R2
R4
+
Cl–
+ HBF
4
a) kwasem Broensteda
+
R1
R3
N
R2
R4
Chlorogliniany
(wrażliwe na kontakt z wodą i powietrzem)
Cl-
+
R1
R3
N
R2
R4
+ xAlCl
3
+
R1
R3
N
R2
R4
AlxCl3x+1-
Sól: zasadowa obojętna kwaśna
N
N
+
+
N
N
+
N
N
Cl-
AlCl
4
-
Al
2
Cl
7
-
N
0.5
N = 0.5
N
0.5
N =
x
1 + x

Ciekłe w temp. umiarkowanych (< 100
o
C)
Rozpuszczają związki nieorganiczne i organiczne
Stabilne termicznie – wysoka temp. wrzenia
Niska prężność par w temp. pok. (są niepalne)
Mogą być hydrofobowe jak i hydrofilowe
Rozpuszczają i zachowują aktywność katal. (kompleksy metali
przejściowych)
Zachowują aktywność enzymów i rozpuszczają je
Zwilżają powierzchnię metali, polimerów i minera–łów
Wykazują działanie katalityczne [Al
x
Cl
3x+1
]
Ekstrahują związki siarki z oleju napędowego
Wykazują działanie smarujące
Rozpuszczają celulozę i jej pochodne
Przewodzą prąd i charakteryzują się dużym oknem
elektrochemicznym
1. Wykazują właściwości antyelektrostatyczne
2. Wykazują aktywność wobec bakterii i grzybów
3. Utrwalają tkanki miękkie (zamiennik formaliny)
4. Balsamują tkanki
5. Konserwują drewno i papier
6. Modyfikują powierzchnię krzemionki
Cechy cieczy jonowych
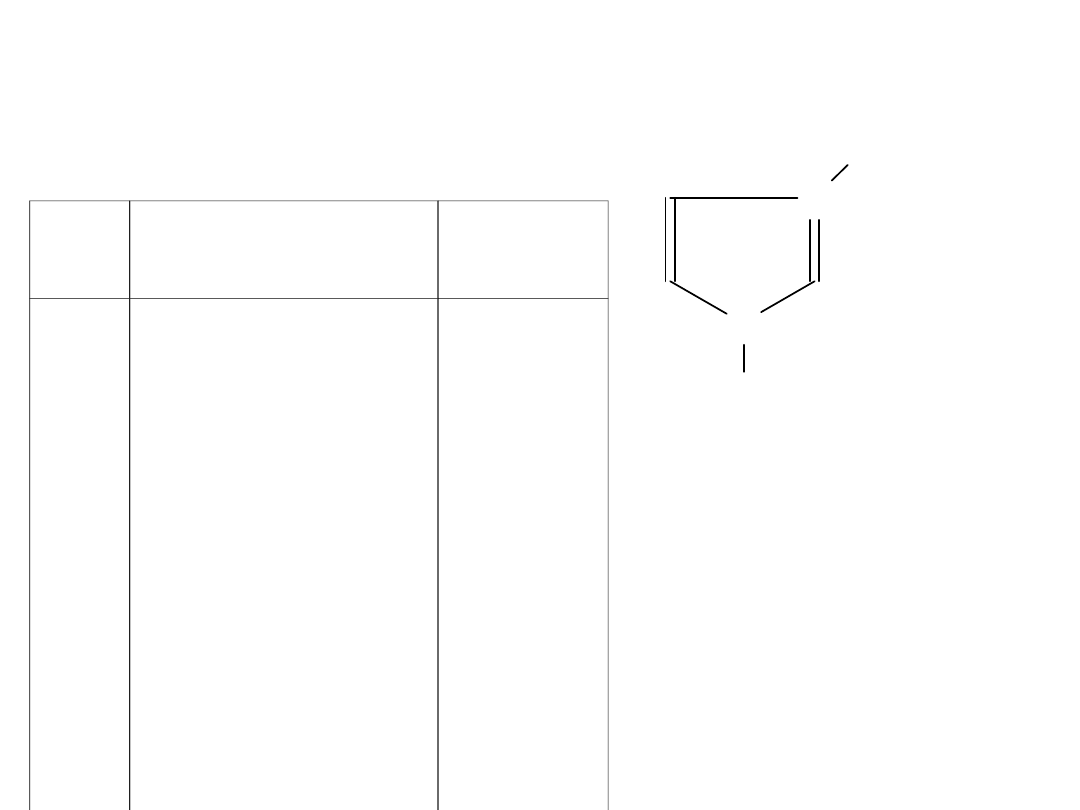
Temperatura topnienia soli imidazoliowych
N
N
CH
3
C
2
H
5
+
A-
[C
2
mim] [A]
Lp.
Anion
Temp.to
p. [
o
C]
1
2
3
4
5
6
7
8
9
10
Cl
PF
6
NO
2
CH
3
CO
2
NO
3
CF
3
CF
2
CF
2
CF
2
SO
3
CF
3
CO
2
CF
3
SO
3
BF
4
(CF
3
SO
2
)
2
N
87
58–60
55
45
38
28
14
9
6
4
[C
2
mim] [PF
6
];
[C
2
mim] [BF
4
];
[C
2
mim] [TfO];
[C
2
mim] [Tf
2
N]
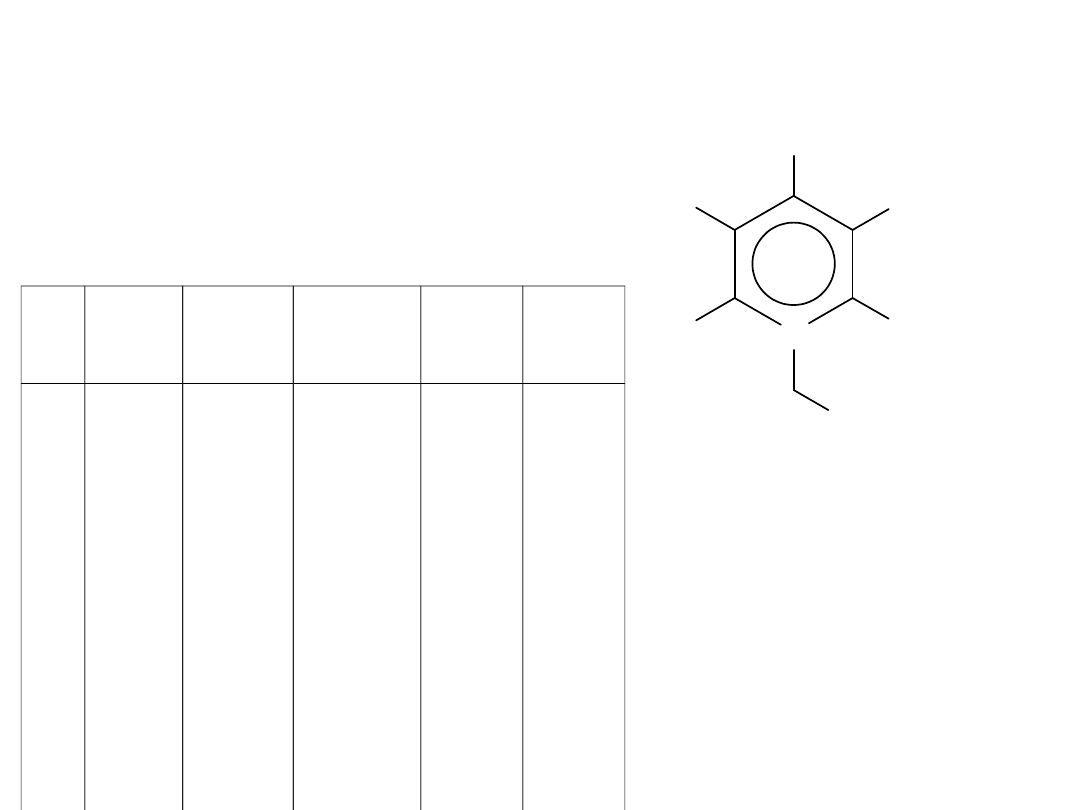
Tetrafluoroboran 1–butoksymetylo–X–pirydyniowy
+
N
OC
4
H
9
R1
R2
R3
R4
R5
BF
4
-
RTILs
L
p
R
1
R
2
R
3
R
4
R
5
1
2
3
4
5
6
7
8
9
H
H
H
H
CH
3
CH
3
H
CH
3
H
H
CH
3
H
C
2
H
5
H
H
CH
3
H
H
CH
3
H
C
2
H
5
H
CH
3
H
H
CH
3
t–
C
4
H
9
H
H
H
H
H
CH
3
CH
3
H
H
H
H
H
H
H
H
H
CH
3
H
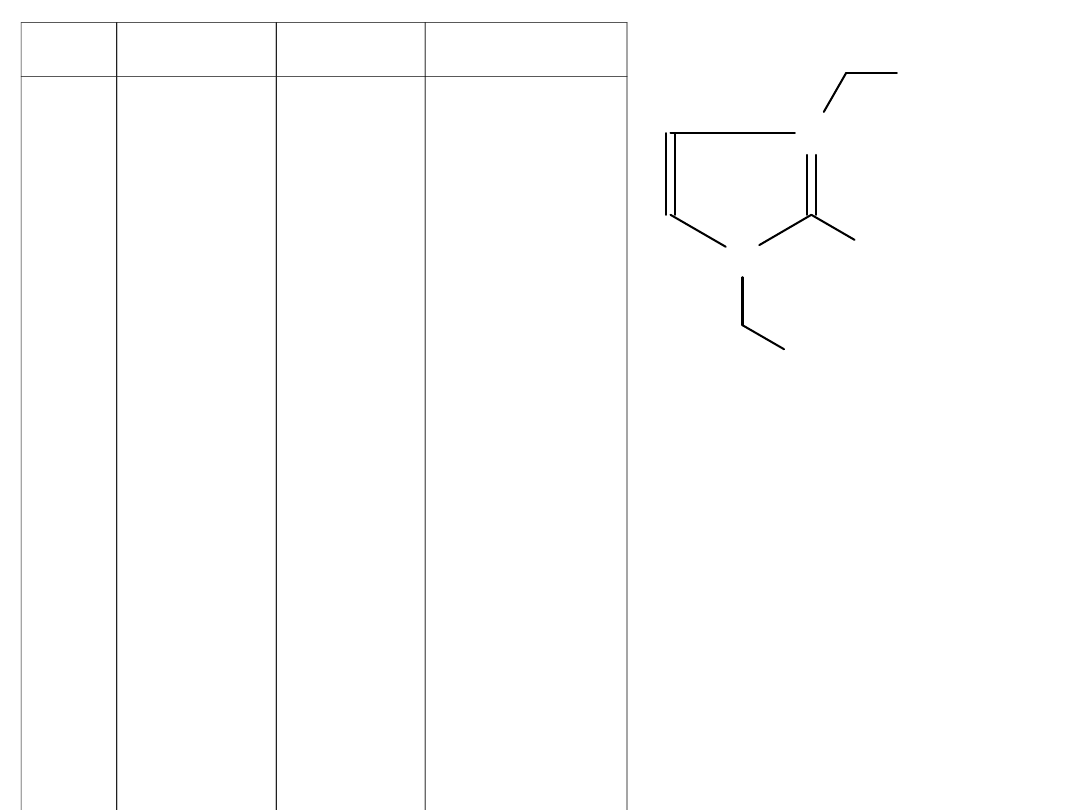
N
N
OC
4
H
9
OR
CH
3
+
A-
Sól
R
A
T. t. [
o
C]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C
3
H
7
C
4
H
9
C
5
H
11
C
6
H
13
C
7
H
15
C
8
H
17
C
9
H
19
C
10
H
21
C
3
H
7
C
4
H
9
C
5
H
11
C
6
H
13
C
7
H
15
C
8
H
17
C
9
H
19
C
10
H
21
BF
4
BF
4
BF
4
BF
4
BF
4
BF
4
BF
4
BF
4
PF
6
PF
6
PF
6
PF
6
PF
6
PF
6
PF
6
PF
6
5–7
ciecz
ciecz
ciecz
ciecz
ciecz
ciecz
ciecz
38–40
69–71
34–36
ciecz
ciecz
ciecz
ciecz
32–34
16 – 4 = 12 cieczy jonowych
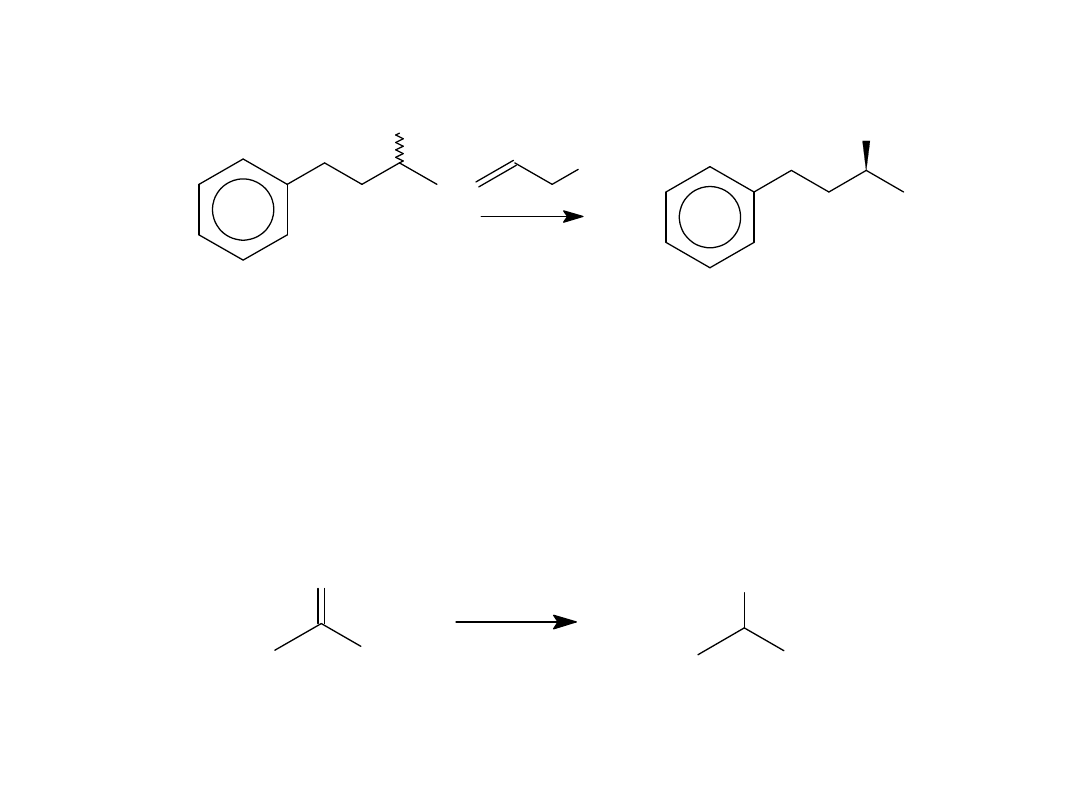
Lipsae–Catalyzed Acetylation
OH
OAc
OAc
lipaza
[bmim][PF
6
]
K. W. Kim, B. Song, M–Y. Choi and M–J. Kim, Org. Lett. 2001, 3, 1507
ee > 99.5% wyd. 42 %
Baker’s Yeast Reduction of Ketones
R1
R2
O
R1
R2
OH
[bmim]PF
6
baker's yeast
J. Howarth, P. Jannes and J. Dai, Tetrahedron Lett. 2001, 42, 7517
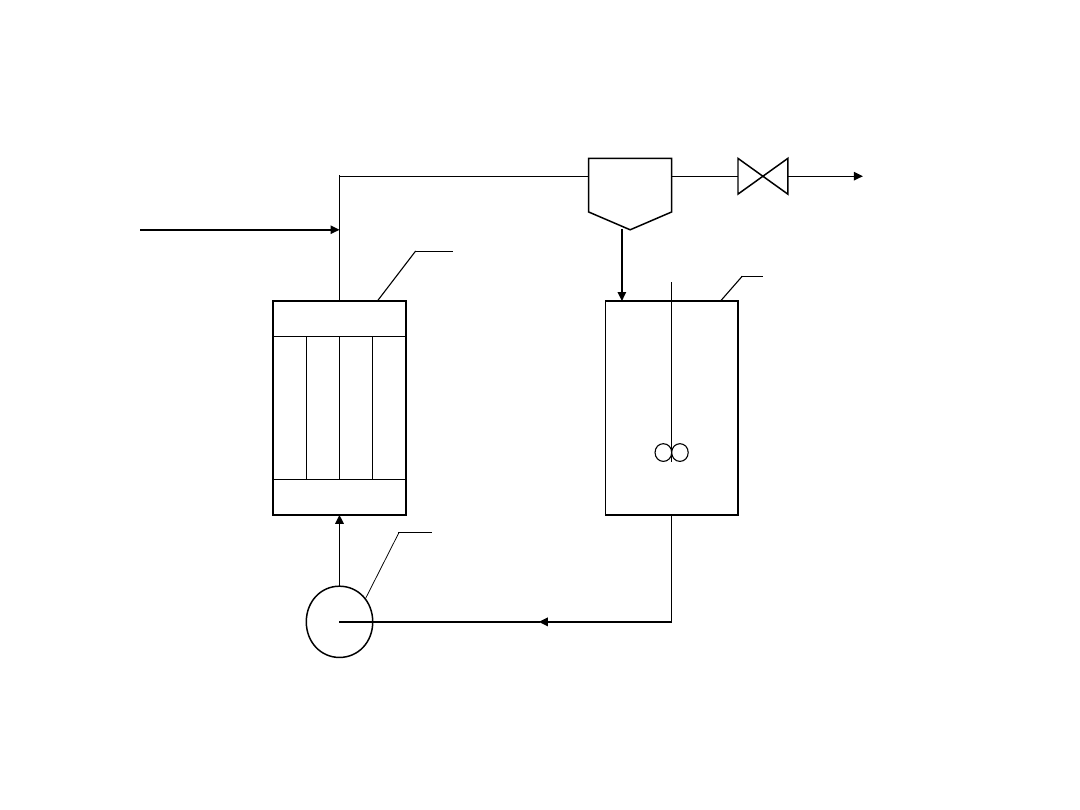
produkt
3
4
2
loop reactor
substr
aty
1
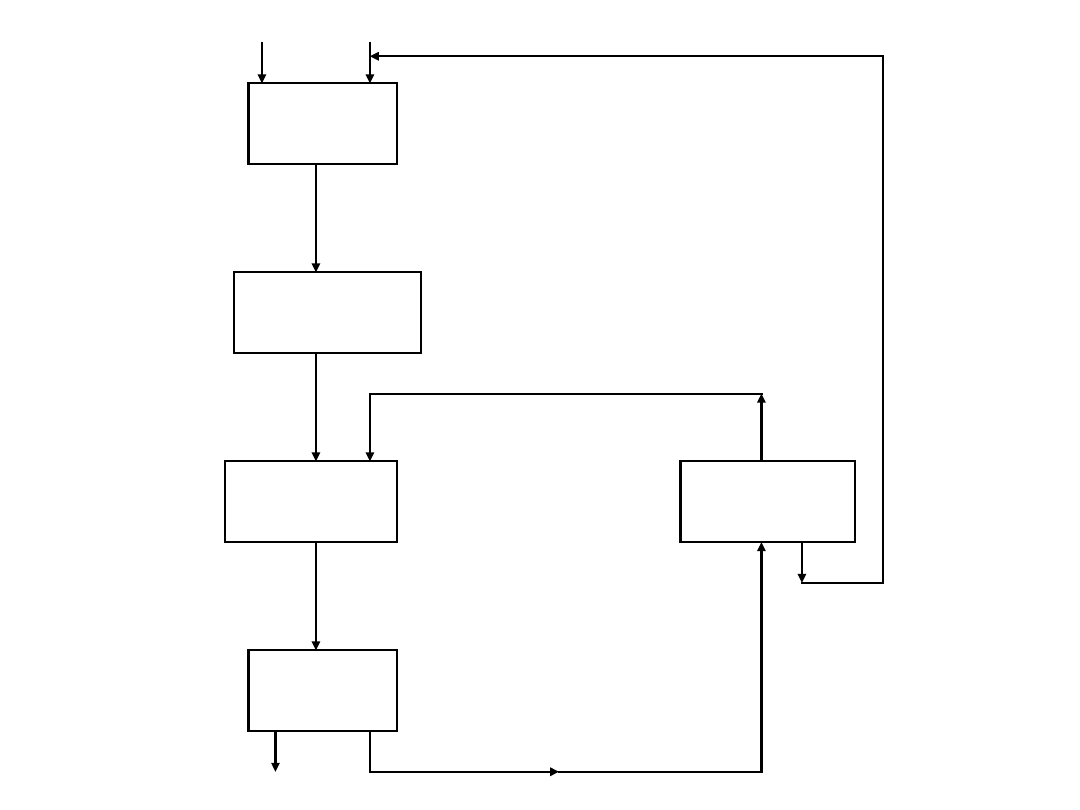
Reakcj
a
(grzani
e)
Chłodzen
ie
Mieszani
e
Sączen
ie
Destylac
ja
substraty ciecz jonowa
produkt
MeO
H
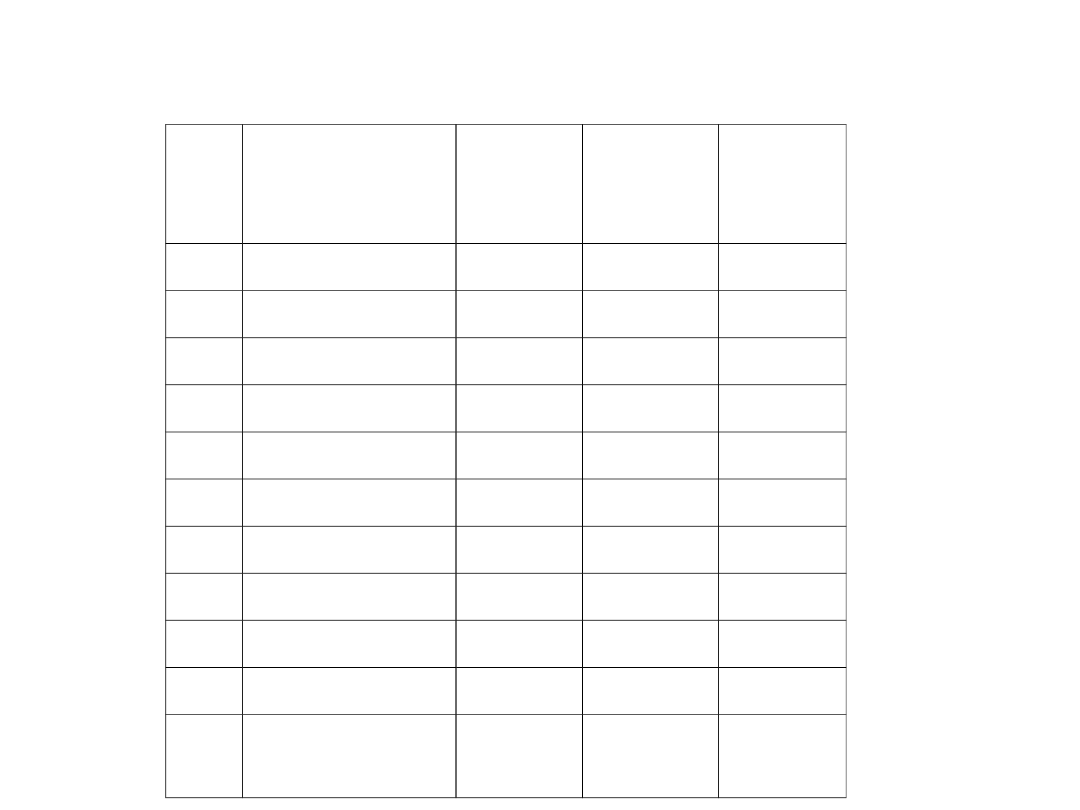
Popularne rozpuszczalniki
Lp Rozpuszczal
nik
Tt [
o
C] Tw [
o
C]
Tw –
Tt
(ciecz)
1
Amoniak
– 78
– 34
44
2
Benzen
5
80
75
3
Woda
0
100
100
4
Chloroform
– 63
61
124
5
Aceton
– 94
56
150
6
Octan etylu
– 84
77
161
7
Metanol
– 98
65
163
8
Heksan
– 95
69
164
9
Nitrobenzen
6
211
205
10 DMF
– 61
153
214
11 Ciecz
jonowa
– 90
> 400
500
Tt – temp. top. Tw – temp. wrzenia

XII zasad zielonej chemii
1
Zapobieganie
2
Ekonomia atomowa
3
Mniej niebezpieczne syntezy
4
Bezpieczne chemikalia
5
Bezpieczniejsze rozpuszczalniki i materiały
pomocnicze
6
Wydajność energetyczna
7
Użycie surowców odnawialnych
8
Redukcja pochodnych
9
Kataliza
10
Degradacja
11
Analityka "w czasie rzeczywistym"
12
Bezpieczniejsza chemia
Ciecze jonowe – zasada 5, 6 i 9
generują mało odpadów (w produkcji i użyciu), możliwość
wielokrotnego użycia, w niskiej temp. wysoka wydajność i
selektywność reakcji, efektywny rozpuszczalnik katalizatorów

• Ciecze jonowe są potencjalnym zagrożeniem dla
środowiska
wodnego (kation imidazoliowy działa podobnie jak
toluen i
dichlorometan) Chemistry in Britain 39(3) 2003
• Spalanie cieczy jonowych generuje toksyczne gazy (F
2
czy HF)
• Problem z otrzymaniem chemicznie czystej cieczy jonowej
(obecność soli, kolor, zapach)
• Anion heksafluorofosforanowy (PF
6
→ HF, ciecz ciemnieje)
• Anion tetrafluoroboranowy (KBF
4
, NaBF
4
, NH
4
BF
4
)
Jak utylizować zużyte ciecze jonowe?
Jaka jest toksyczność cieczy jonowych?
Ionic liquids: Not so green

Możliwa liczba kombinacji
kation–anion
10
18
Zastosowanie cieczy jonowych
jest jedynie limitowane przez
naszą wyobraźnię
Spodziewana cena za 1 dm
3
cieczy jonowej: 25–50 euro
Badania własne
+
Cl-
N
OR
+ MA
N
OR
A-
+
+ MCl
rozpuszczalnik: H
2
O lub CH
3
OH
MA = NaBF
4
, KPF
6
, LiNTf
2
temp. pok., czas – 1 godz., wyd. 89–95%
MCl – wymywanie wodą destylowaną (AgNO
3
)
woda – temp. 60
o
C, 16 godz., próżnia
IMIDAZOLIOWE CIECZE JONOWE
aprotonowe
N
N
R1
OR
+
A-
N
N
OC
4
H
9
RO
R1
+
A-
symetryczne
A-
+
N
N
OR
RO
protonowe
N
N
OR
H +
[CH
3
CH(OH)CO
2
]-
N
N
OR
H +
[HOC
6
H
4
CO
2
]-
chiralne
N
N
R1
R2
O
+
X
-
Synteza
N
N
H
+ 2ROCH
2
Cl
DMF
N
N
OR
RO
+
Cl-
J. Pernak, K. Sobaszkiewicz, J. Foksowicz–Flaczyk, Chem.Eur. J., 2004 10, 3479
temp. 30
o
C, 4 godz. wyd. 85%
R1OCH
2
Cl + (C
2
H
5
)
3
N
R1OCH
2
N(C
2
H
5
)
3
+
Cl-
temp. pok. 5 min wyd. 100%
Cl-
+
R1OCH
2
N(C
2
H
5
)
3
N
N
H
+
N
N
OR1
(C
2
H
5
)
3
NH
+
Cl-
+
temp. 80
o
C, 15 min. wyd. 70–80%
Cl-
+
N
N
OR1
R2O
+ R2OCH
2
Cl
N
N
OR1
got. w toluenie wyd. 75–90%
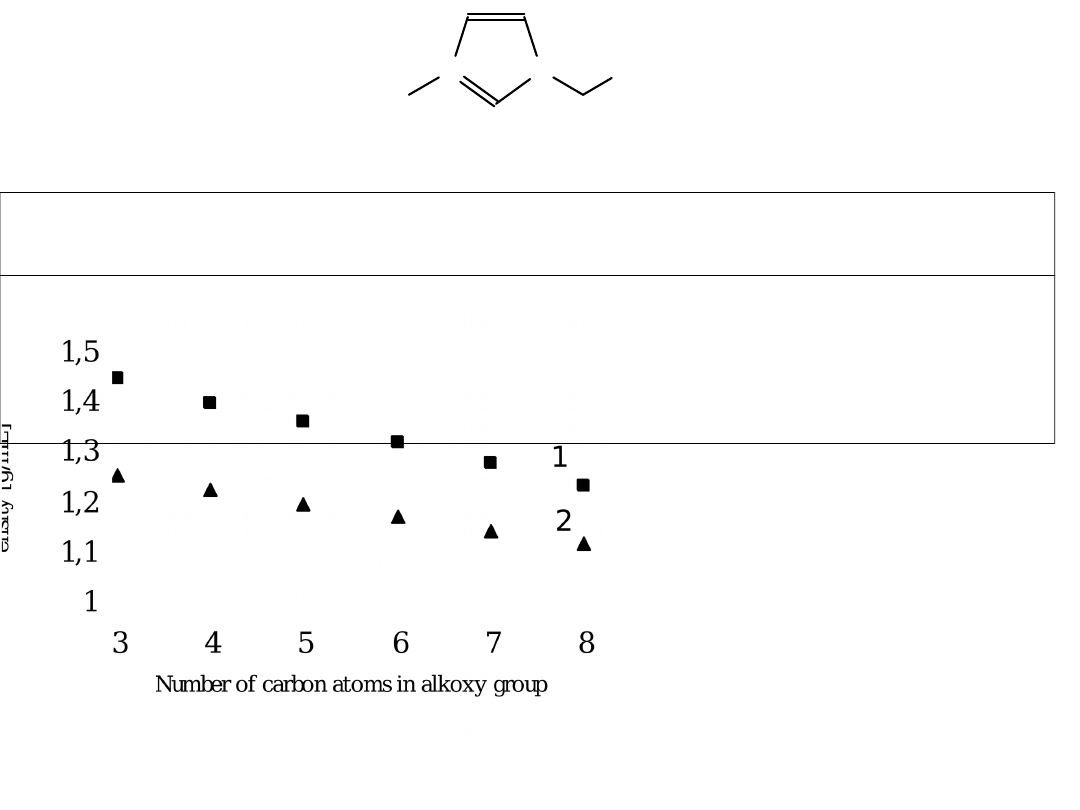
N
N
OR
+
A-
[Cl] – silnie higroskopijne
Sól 3 4 5 6 7 8 9 10
11 12
BF
4
liq liq liq liq liq liq liq 56–57
61–62 62–64
PF
6
liq liq liq liq liq liq 47–49 46–47
52–53 61–63
Gęstość 1 – A=PF
6
2
– A=BF
4
J. Pernak, A. Czepukowicz, R. Poźniak, Industrial & Engineering
Chemisty Research 2001, 40, 2379
toksyczność: [(C
6
Om)mim][BF
4
]
LD
50
= 1400 mg/kg dla szczurów Wistara
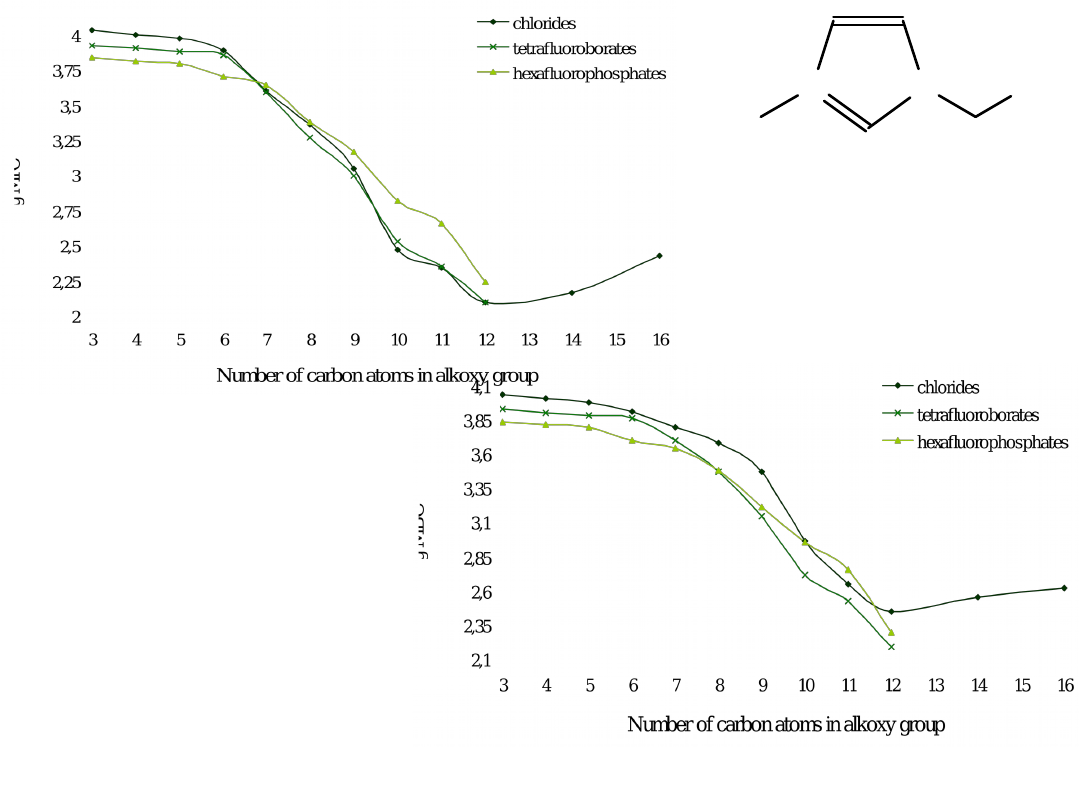
N
N
OR
+
A-
Wartości średnie MIC I MBC
wobec bakterii i grzybów
J. Pernak, K. Sobaszkiewicz, I. Mirska, Green Chem. 2003,5, 52
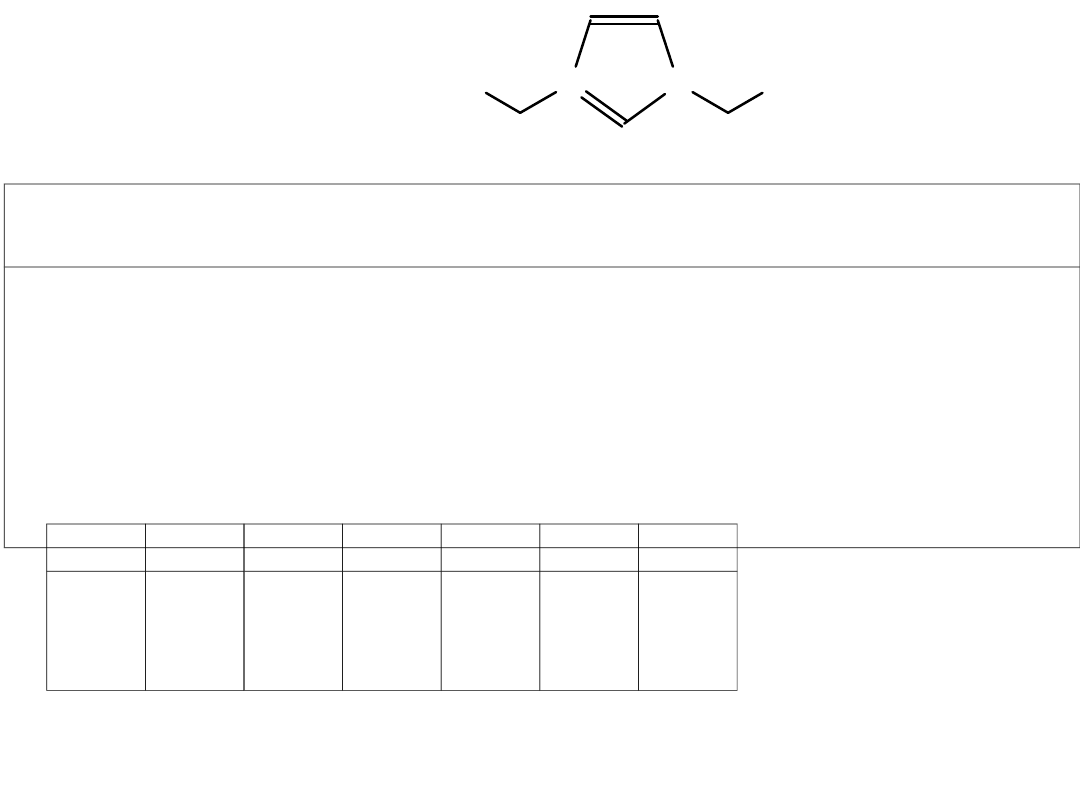
A-
+
N
N
OR
RO
• [Cl] – silnie higroskopijne
Sól 3 4 5 6 7 8 9 10
11 12
BF
4
liq liq liq 42–43 39–40 53–54 55–57 67–70
70–72 78–80
PF
6
69–73 53–56 50–54 60–62 63–66 77–80 84–87 97–99
103–105 104–107
Tf
2
N liq liq liq liq liq liq 26–30 31–32
45–46 44–45
• RTILs są cieższe od wody (1.391–1.105 g/cm
3
)
• Lepkość [cP] temp. pok.
Sól
3
4
5
6
7
8
BF
4
Tf
2
N
166
83
314
87
>40
0
95
115
145
154
• Temp. zeszklenia
:
od –39 do –44
o
C, T
onset
: od 200 do 240
o
C
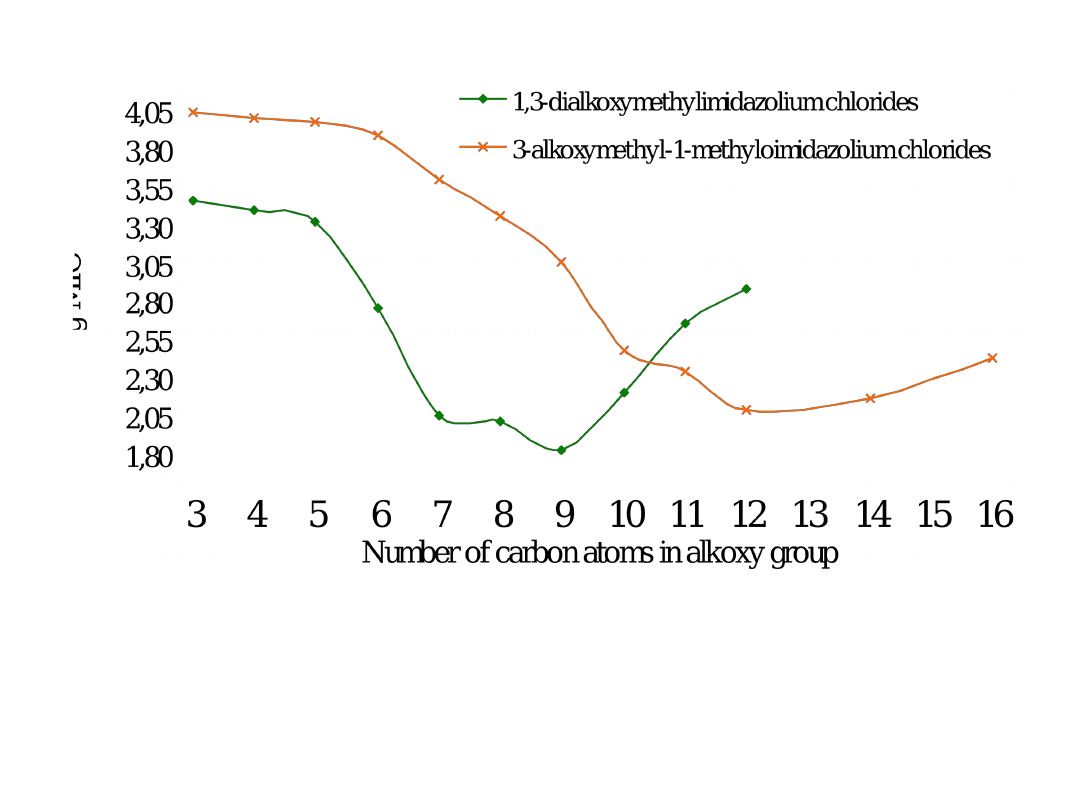
Średnia wartość MIC wobec bakterii i grzybów
N
N
OR
H +
[CH
3
CH(OH)CO
2
]-
N
N
OR
H +
[HOC
6
H
4
CO
2
]-
RTILs dla R od C
4
H
9
do C
12
H
25
Gęstość – od 1.0695 do 0.9804 g/cm
3
T
g
–71 do –67
o
C a T
onset
od 245 do 187
o
C
Przewodnictwo elektryczne 1 do 0.07 mS cm
–1
Lepkość przy 25
o
C dla [(C
10
Om)im][mleczan] = 120 cP
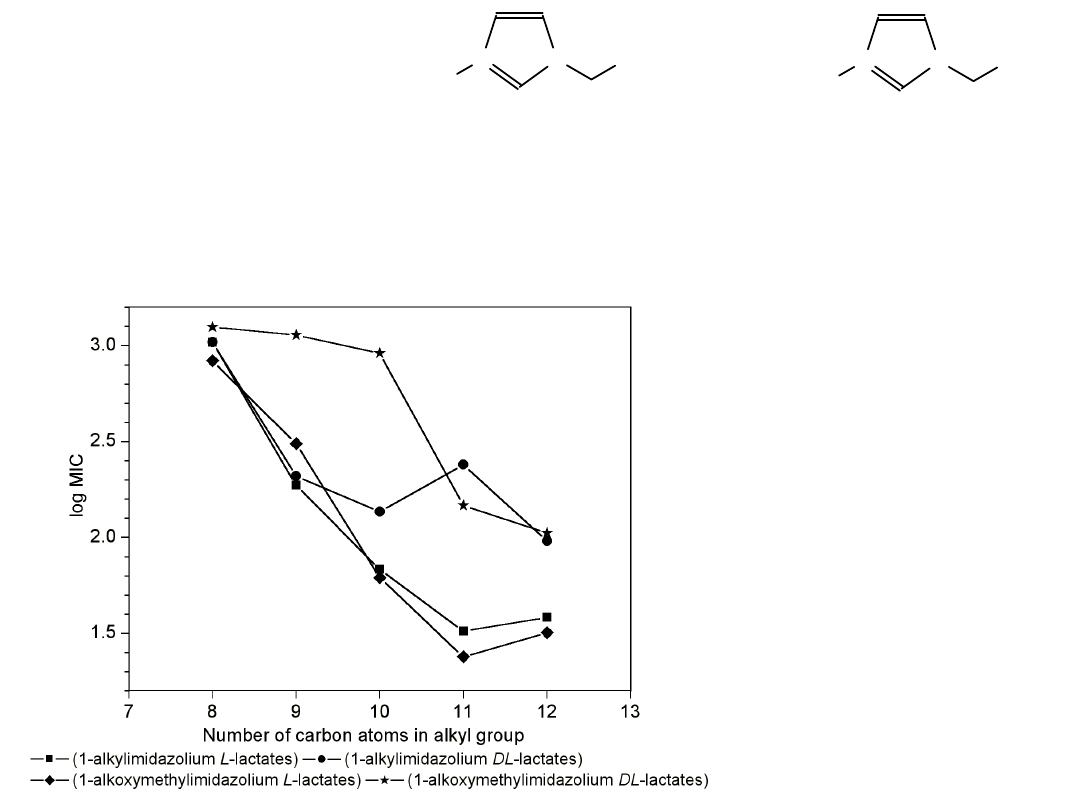
Wartość średnia MIC
wobec ziarenkowców
N
NH
O
+
O
O
OH
-
O
3
CO
2
+ H
2
O
Rozkład ozonem w roztworze wodnym
J. Pernak, I. Goc, Polish J. Chem.2003, 77, 975
J. Pernak, I. Goc, I. Mirska, Green Chem., 2004, 6, 323
+
N
N
OC
4
H
9
RO
BF
4
-
PF
6
-
N
N
OC
4
H
9
RO
+
17–24 36–39
BF
4
-
N
N
OC
4
H
9
RO
+
+
N
N
OC
4
H
9
RO
PF
6
-
25, 28–32 44–47
Sól 3 4 5 6 7 8
9 10
BF
4
17–24 liq liq liq liq liq liq
liq liq
PF
6
36–39 38–40
*
69–71
*
34–36
*
liq liq liq
liq 32–34
*
*
biały kryształ
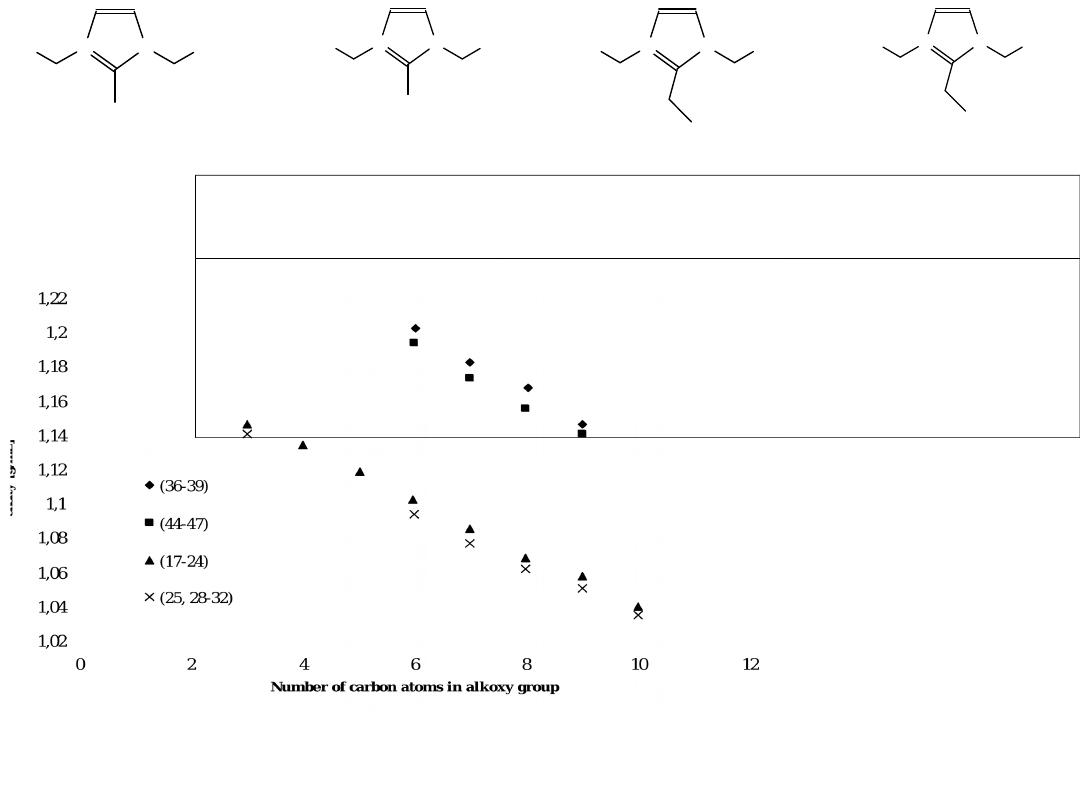
Dla 17–24 soli: Gęstość = –0.0162(liczba atomów C) + 1.1934 (r
2
= 0.987)
T
onset
200 – 240
o
C
J. Pernak, A. Olszówka, R. Olszewski, Polish J. Chem., 2003, 77, 179
Gęstość – zależność liniowa
TSILs (pochodne choliny)
+
R1O
N
OR
Tf
2
N-
wyd. 78–99%, hydrofobowe RTILs
Gęstość w 25
o
C Lepkość w 25
o
C T
onset
R
1
= H 1.453–1.194 g/cm
3
R
1
= H 73–232 cP R
1
=
H 209–250
o
C
R
1
= Ac 1.426–1.200 g/cm
3
R
1
= Ac 170–293 cP R
1
=
Ac 170
o
C
OH
N
O
N
OH
N
O
H
N
+
CH
2
OR
O
H
N
+
CH
2
OR
Cl
O
N
O
H
N
+
CH
2
OR
O
N
R'
O
Cl
O
H
N
+
CH
2
OR
Cl
R'
O
O
N
+
+
Cl
phase limit
OH
-
water phase
organic phase - IL
+
+
J. Pernak, P. Chwała, A. Syguda, Polish J. Chem. 2004, 78, 539
C
H
2
O
C
H
2
C
H
2
(CH
2
)
9
O
C
H
2
C
H
2
N
+
CH
3
C
H
3
C
H
3
O
CH
3
X
Chiralne czwartorzędowe sole amoniowe
+
O
Cl
N
R
2
R
1
R
3
O
N R
2
R
3
R
1
Cl
-
+
(1R,2S,5R)–(–)–menthol
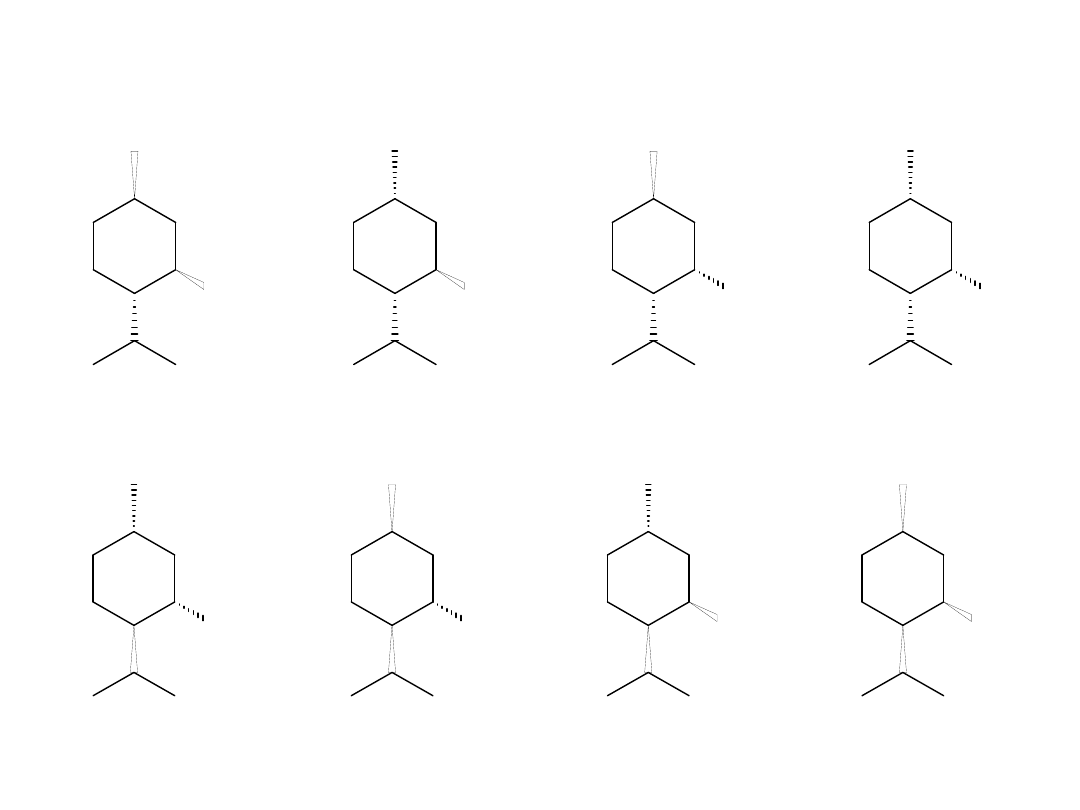
OH
OH
OH
OH
OH
OH
OH
OH
8 isomers of menthol
(–)–menthol (–)–isomenthol (–)–neomenthol (–)–
neoisomenthol
(+)–menthol (+)–isomenthol (+)–neomenthol (+)–neoisomenthol
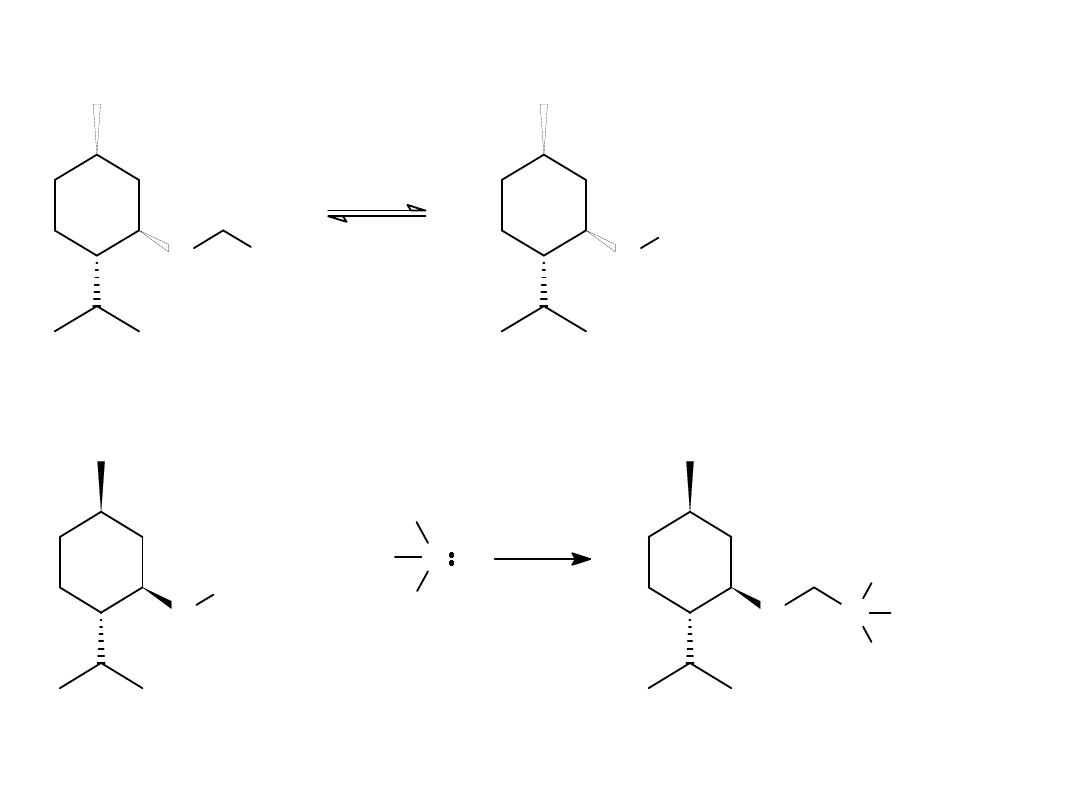
O
CH
2
+
+
N
R
2
R
1
R
3
O
N R
2
R
3
R
1
+
(fast)
O
Cl
+
Cl
-
(slow)
O
CH
2
+
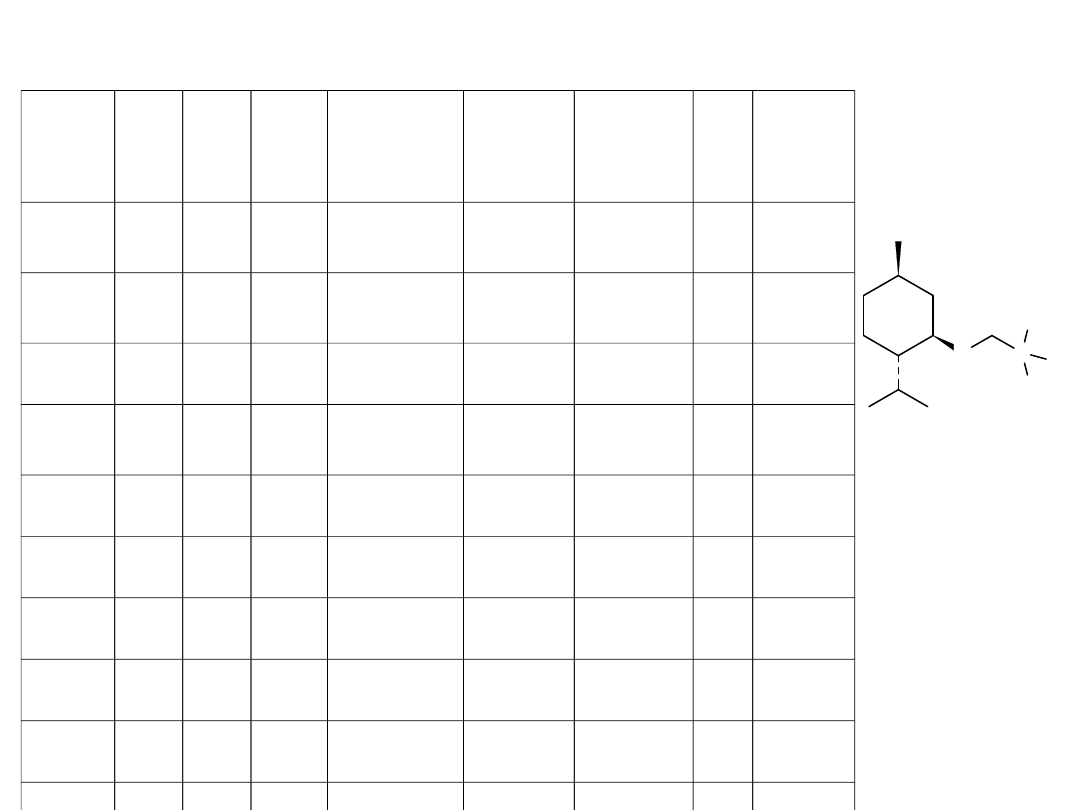
O
N
R1
R3
R2
+
Tf
2
N
–
R
1
R
2
R
3
Yield
[%]
Specific
rotation
[d]
[]
20
D
Density
[
e]
[g ml
–1
]
Viscosity
[e]
[mPa s]
T
g
[f]
[
0
C
]
Glass
transiti
on
[
0
C]
C
2
H
5
C
2
H
5
C
2
H
5
85.5
–38.6
(c=1.4)
1.25
876
17
9
–45.8
C
2
H
5
C
2
H
5
CH
3
94.5
–39.1
(c=1.2)
1.26
754
19
7
–48.5
C
2
H
5
CH
3
CH
3
89.0
–40.6
(c=1.1)
1.27
714
19
9
–49.9
izoC
3
H
7
CH
3
CH
3
99.0
–39.5
(c=1.1)
–
–
–
–
C
4
H
9
CH
3
CH
3
87.5
–38.2
(c=0.9)
1.24
745
20
0
–50.1
C
6
H
13
CH
3
CH
3
84.5
–41.6
(c=1.0)
1.21
774
20
0
–50.2
C
7
H
15
CH
3
CH
3
89.5
–34.8
(c=1.2)
1.19
787
20
2
–52.8
C
8
H
17
CH
3
CH
3
93.5
–35.6
(c=1.4)
1.18
806
20
0
–53.0
C
9
H
19
CH
3
CH
3
95.0
–33.2
(c=1.4)
1.17
829
19
9
–53.2
C
10
H
21
CH
3
CH
3
91.0
–37.8
(c=1.1)
1.15
840
20
0
–54.4
C
11
H
23
CH
3
CH
3
92.5
–32.7
(c=1.6)
1.14
844
20
6
–54.3
C
12
H
25
CH
3
CH
3
99.5
–31.5
(c=1.2)
–
–
–
–
CH
2
Ph
CH
3
CH
3
99.0
–39.1
(c=1.0)
–
–
–
–
[a]M.p. 40–42°C, plates. [b] M.p. 28–30°C, plates. [c] 46–48°C, plates. [d]c in ethanol.
[e]At 30°C. [f]Thermal degradation temperature
Chiralne, hydrofobowe czwartorzędowe sole amoniowe
J. Pernak, J. Feder-Kubis, Chem. Eur. J., 2005, 11 w druku
Zastosowanie cieczy jonowych
Impregnacja papieru cieczą jonową
N
N
CH
3
OR
N
N
CH
3
R
N
N
CH
3
OR
BF
4
-
BF
4
-
(CF
3
SO
2
)
2
N
-
+
+
+
[C
n
mim][BF
4
] [C
n
Omim][BF
4
] [C
n
Omim][Tf
2
N]
K. Przybysz …. J. Pernak, Industrial & Engineering Chemisty Research 2005 w druku
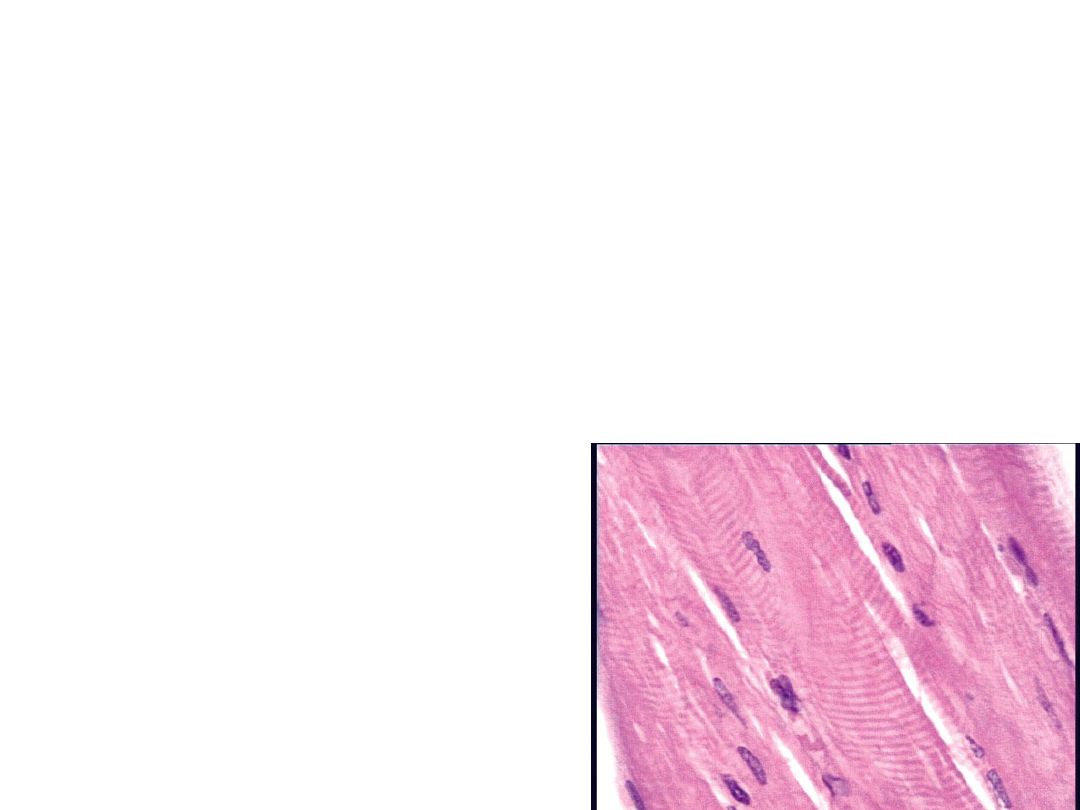
Konserwacja drewna cieczami jonowymi
• J. Pernak, J. Zbielska-Matejuk, A. Kropacz, J. Foksowicz-
Flaczyk,
Holzforschung, 2004, 58, 286
• J. Pernak, I. Goc, A. Fojutowski, Holzforschung, 2005 w
druku Utrwalanie tkanek cieczami jonowymi
Ionic Liquids in Embalming and Tissue Preservation
Can traditional formalin-fixation be replaced safely?
• P. Majewski, A. Pernak, M. Grzymisławski, K. Iwanik, J.
Pernak
Acta Histochemica, 2003, 105, 135-142
• A. Pernak, P. Majewski, K.
Iwanik, M.
Grzymisławski, J. Pernak, Acta
Histochemica, 2005 w druku
„Słodkie” ciecze jonowe
O
S
N
O
O
O
(C
6
H
13
)
3
PR
+
_
R = alkyl
J. Pernak, F. Stefaniak, J. Węglewski, Eur. J. Org. Chem.,
2005 650
E. Frąckowiak, G. Lota, J. Pernak, Appl. Phys. Lett.
2005 w druku
A. W. Morawski, M. Janus, I. Goc-Maciejewska, A.
Syguda, J. Pernak:
Utylization of Ionic Liquids by Photocatalysis, J.
Hazardous Materials,
2005 w druku

Współpracownicy:
Dr Andrzej Skrzypczak Dr inż. Monika Branicka
Dr Lucyna Michalak Dr Józef Węglewski
Doktorzy:
Dr Przemysław Chwała
Dr inż. Kinga Sobaszkiewicz
Dr inż. Joanna Foksowicz-Flaczyk
Doktoranci:
Mgr inż. Izabela Goc-Maciejewska Mgr inż. Małgorzata Zygadło
Mgr Joanna Feder-Kubis Mgr inż. Anna Syguda
Mgr inż. Filip Stefaniak Mgr inż. Radosław Olszewski
Mgr inż. Marcin Śmiglak
Finansowanie:
grant KBN nr 4 T09 B 008 22 (zakończony – pierwszy polski grant z cieczy jonowych)
COST D29
polski lider grupy ILIAD
Współpraca:
prof. P. Majewski AM w Poznaniu
prof. E. Frąckowiak PP
prof. A. Morawski Pol. Szczecińska
dr Ilona Mirska AM w Poznaniu
dr Cieniecka-Rosłonkiewicz IPO - Warszawa
dr inż. Jadwiga Zabielska-Matejuk – ITD.
dr inż. Andrzej Fojutowski - ITD
The University of Alabama – prof. Robin Rogers
The Queen’s University of Belfast – prof. Ken Seddon
Cytec Canada Inc., Niagara Falls, Canada

Zapraszam do współpracy
VI Sympozjum nt:
Czwartorzędowe sole amoniowe i obszary
ich zastosowania w gospodarce
Poznań, 30 czerwca 2005
Instytut Technologii Drewna
ul. Winiarska 1
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
Wyszukiwarka
Podobne podstrony:
Ciecze jonowe
ciecze jonowe
Ciecze jonowe
Ciecze jonowe związki na miarę XXI wieku J Pernak Przemysł Chemiczny
3 Równowagi jonowe w roztworach
chemia pytania wiązania jonowe i kowalencyjne
Rozpylanie jonowe
Ciecze
4 ciecze
Nowy Mendel cz1 CIECZE
Ciecze
Reakcje jonowe
REAKCJE JONOWE + ZADANIA POWTÓRZENIE BCH, Szkoła, Biologia
Ciecze izolacyjne - referat, dielektryki ciekle, Dielektryki izolatory materiały które bardzo słabo
Kanały jonowe
chemia roztwory i reakcje jonowe
Reakcje jonowe (2), Mechanika i Budowa Maszyn, Chemia sprawozdania
więcej podobnych podstron