
TECHNOLOGIA
TECHNOLOGIA
W O D Y
W O D Y

Z M I Ę K C Z A N I
E
W O D Y

U s u w a n i e t w a r d o ś c i
W
oda twarda nie nadaj się na
potrzeby gospodarki wodnej w
energetyce oraz jest niepożądana
do picia i na potrzeby gospodarcze.
T
og
≤ 500 mgCaCO
3
/dm
3

U s u w a n i e t w a r d o ś c i
S
tosowane metody zmiękczania
wody to:
termiczna,
chemiczna,
wymiana jonowa.

Jonity, wymieniacze jonowe
polimery
posiadające zdolność
wymiany jonów z roztworem.
Jonity wymieniające aniony noszą
nazwę anionitów, a wymieniające
kationy – kationitów.
Niektóre jonity mają zdolność
równoczesnej wymiany obu rodzajów
jonów (jonity amfoteryczne).

Jonity, wymieniacze jonowe
Ich
makrocząsteczki mają postać
przes-trzennego szkieletu, w który
wbudowane są grupy funkcyjne
dysocjujące w wodzie i zdolne do
wymiany swoich jonów na jony z
otaczającego je roztworu w równowa-
żnych ilościach.

Jonity, podział
Rozróżnia się jonity:
•
naturalne,
•
pół- syntetyczne
•
syntetyczne.

Jonity, wymieniacze jonowe
Do naturalnych należą:
•
zeolity
•
montmorylonity,
•
glaukonity,
•
torf,
•
celuloza.

Jonity, wymieniacze jonowe
Aktualnie używa się wyłącznie
jonitów syntetycznych. Ich szkielety
stanowią najczęściej polimery
styrenu i diwinylobenzenu DVB.
DVB jest czynnikiem sieciującym.
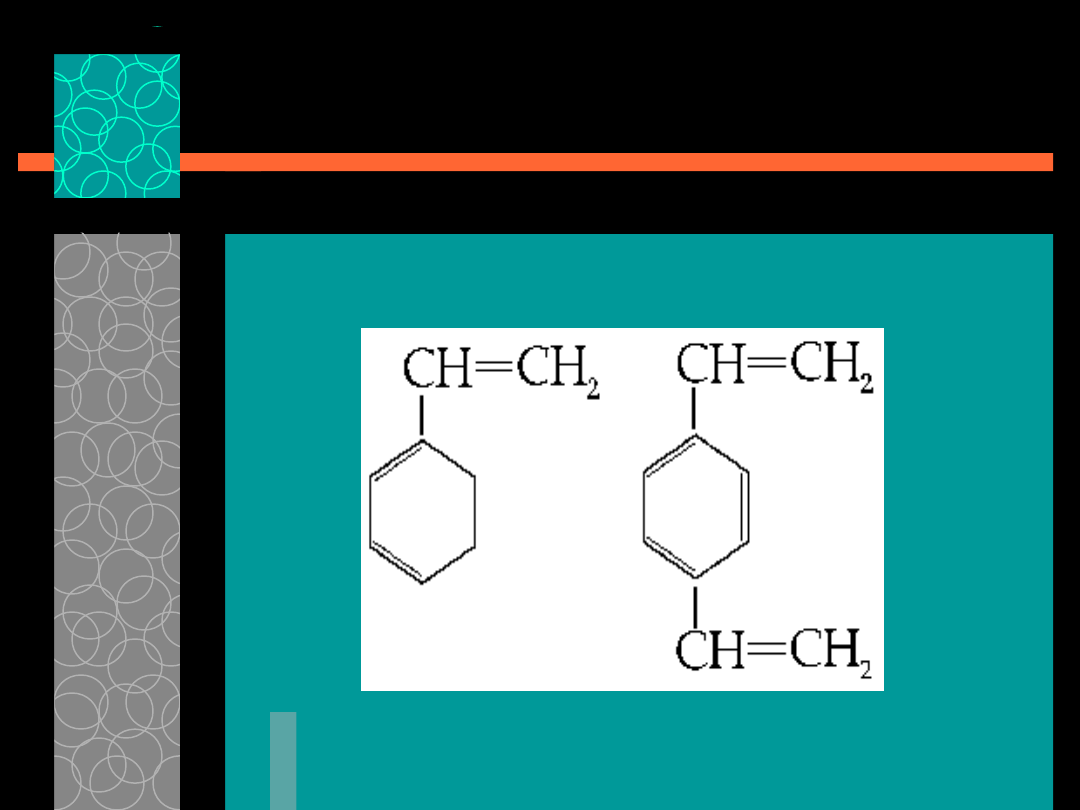
Styren +
diwinylobenzen

G R U P Y F U N K C Y J N E
I
stnieje również inny podział w
zależności od aktywności grupy
funkcyjnej na mocne i słabe.
Kationity mocne
: R-SO
3
H ;
Kationity słabe
: R-COOH
W anionitach grupami funkcyjnymi są
grupy aminowe np. -NH
2
(słabe),

G R U P Y F U N K C Y J N E
Średnie : -NHR, -NR
2
Silne : czwartorzędowe grupy
amoniowe -[NR
3
]
+
.
Kationity mogą występować również
w formie soli sodowych lub anionity
jako chlorki. Ich praca będzie jednak
prowadziła do zmiękczenia, a nie
demineralizacji wody.

K A T I O N I T Y
C
ząsteczki kationitów zawierają
poniższe grupy funkcyjne:
•
(-SO
3
)-H
+
,
•
(-PO
3
) -H
+
,
•
(-COO) -H
+
,
•
(-O) -H
+
,
•
(-S) -H
+
;

A N I O N I T Y
N
atomiast cząsteczki anionitów
zawierają najczęściej pochodne
hydroksy-amoniowe:
•
(-NH
3
)
+
OH
-
,
•
(=NH
2
)
+
OH
-
,
•
(≡NH)
+
OH
-
,
•
(≡ N- )
+
OH
-
,

Jonity, wymieniacze jonowe
J
onitami pół- syntetycznymi
są
węgle sulfonowane.
Jonity syntetyczne
są na ogół
pochodzenia organicznego, do ich
produkcji stosuje się najczęściej
kopolimery styrenu lub monomeru
alifatycznego i diwinylobenzenu.

Jonity, wymieniacze jonowe
Jonity syntetyczne – do ich
produkcji stosuje się również :
żywicę fenolowoformaldehydową,
polimery – fenylodiaminowy oraz
mocznikowo-guanidynowo-
formaldehydowy,
polietylenoiminę
inne polimery zawierające pirydynę lub jej
pochodne.

Z E O L I T Y
grupa minerałów, uwodnione
glinokrzemiany sodu i wapnia, rzadziej
baru, magnezu, manganu, potasu i strontu.
Należą do nich :
chabazyt - (Ca, Na)
2
[Al
3
Si9O
24
] ⋅ 9H
2
O,
desmin (stilbit) - Ca[Al
2
Si
7
O
18
] ⋅ 7H
2
O,
filipsyt - KCa[Al
3
Si
5
O
16
] ⋅ 6H
2
O;

Z E O L I T Y
grupa minerałów, uwodnione
glinokrzemiany :
filipsyt - KCa[Al
3
Si
5
O
16
] ⋅ 6H
2
O,
harmotom - Ba[Al
2
Si
6
O
16
] ⋅ 6H
2
O,
heulandyt - Ca[Al
2
Si
7
O
18
] ⋅ 6H
2
O,

Jonity, wymieniacze jonowe
Jonity syntetyczne, odpowiednio
usieciowane, formowane są w postaci
perełek lub ziaren o silnie rozwiniętej
powierzchni, które po zanurzeniu
w roztworze wodnym pęcznieją, wskutek
dyfuzji wody do wnętrza struktury
jonitów.

Jonity, wymieniacze jonowe
Wymiana jonowa za pomocą jonitów
odbywa się w przepływowych
aparatach kolumnowych.
Jonity służą głównie do zmiękczania
wody, mają także zastosowanie
w analizie chemicznej do usuwania
przeszkadzających jonów z roztworu.

Jonity, wymieniacze
jonowe
M
ożna stosować jonity także do :
oznaczania stężenia niektórych soli
w roztworze, zagęszczania śladów oraz
w chromatografii jonowymiennej.
D
o bardziej popularnych jonitów należą:
Dowex, Wofatyt, Amberlit, Duolite,
Gamranityt, Lewatyt, Varion.

STACJE DEMINERALIZACJI
WODY
Instalacje tego typu wytwarzają wodę
zdemineralizowaną przy zastosowaniu
techniki wymiany jonowej.
Stosowane są między innymi w szpitalach i
laboratoriach, w przemyśle do
przygotowania wody technologicznej
oraz wody do kotłów parowych i
wysokociśnieniowych kotłów grzewczych
oraz do przygotowania wody chłodniczej.

STACJE ZMIĘKCZANIA
Podczas zmiękcza-
nia sole wapniowe
i magnezowe
zostają
wymienione na
sole sodowe, które
nie wpływają
niekorzy - stnie na
twardość wody.

STACJE ZMIĘKCZANIA
T
a metoda jest wykorzystywana w
przemyśle i instytucjach do
uzdatniania wody stosowanej
do kotłów parowych, w kotłach
wodnych, pralniach, chłodniach
kominowych, procesach płukania,
mycia, zmywarkach itd.

Wymiana jonów
M E C H A N I Z M
M E C H A N I Z M (1) :
dla kationów :
nY
XA
R
nAY
RX
n
n
)
(
M E C H A N I Z M
M E C H A N I Z M (2) :
dla anionów :
mB
XZ
R
mBZ
RX
m
m
)
(

Wymiana jonów
Proces wymiany jonowej zależy od
Proces wymiany jonowej zależy od :
struktury jonitu,
energii wymiennej jonów,
stężenia jonów w roztworze,
odczynu i temperatury.

Mechanizm wymiany jonowej
Proces wymiany jonów z roztworu
przebiega według w
pięciu
etapach
:
1.
Transport jonu z roztworu do
powierzchni ziarna,
2.
Transport jonu wewnątrz ziarna do
miejsca wymiany,
3.
Reakcja podwójnej wymiany,

Mechanizm wymiany jonowej
Proces wymiany jonów z roztworu
przebiega według w
pięciu
etapach
:
3.
Transport jonu wypartego
wewnątrz ziarna od miejsca
wymiany do powierzchni ziarna,
4.
Transport jonu wypartego z
powierzchni ziarna do roztworu.

Wymiana jonów
Proces wymiany jonowej zależy od :
struktura jonitu,
To cechy fizyczno-chemiczne jonitu, takie
jak odporność mechaniczna oraz
zdolność do pęcznienia. Również
budowa chemiczna, liczba grup funk. itp.

Energia wymienna jonów
Energia wymienna jonów
Jest to
Jest to
energia wejścia jonu
energia wejścia jonu
do jonitu.
do jonitu.
Jest tym wyższa, im wyższy jest ładunek i
Jest tym wyższa, im wyższy jest ładunek i
mniejszy promień hydrodynamiczny
mniejszy promień hydrodynamiczny
zhydratowanego jonu wymiennego :
zhydratowanego jonu wymiennego :
Na
Na
+
+
< NH
< NH
4
4
+
+
< K
< K
+
+
< Mg
< Mg
2+
2+
< Ca
< Ca
2+
2+
< Al
< Al
3+
3+
< Fe
< Fe
2+
2+
< H
< H
+
+
Cl
Cl
-
-
< NO
< NO
3-
3-
< SO
< SO
4
4
2-
2-
< PO
< PO
4
4
3-
3-

S t ę ż e n i e j o n ó w
Wpływ niejednoznaczny :
Przy wymianie jonów o tej samej
wartościowości – nie ma wpływu stężenia.
Przy wymianie jonu dwuwartościowego z
roztworu na jednowartościowy z jonitu
(cykl pracy) – zdolność wymienna
wzrasta
z rozcieńczeniem
roztworu (II)

Zdolność wymienna
jonitów
Jest to liczba milivali jonów, które
mogą być wymienione przez
jednostkę masy lub objętości
jonitu.
Rozróżnia się całkowitą zdolność
wymienną i roboczą zdolność
wymienną jonitów.

Zdolność wymienna
jonitów
Praktycznie wymianę jonową
prowadzi się do momentu
osiągnięcia roboczej zdolności
wymiennej, a następnie jonity
poddaje się regeneracji.
Robocze zdolności wymienne jonitów
wynoszą od ok. 0,5 do 1,5 mval/cm
3
.

Zdolność wymienna jonitów
]
[mval/cm
V
F
Z
]
[mval/cm
V
C
(C
V
Z
]
[mval/cm
V
C
(C
V
Z
3
j
C
3
j
kA)
o
B
C
3
j
kA)
o
A
R
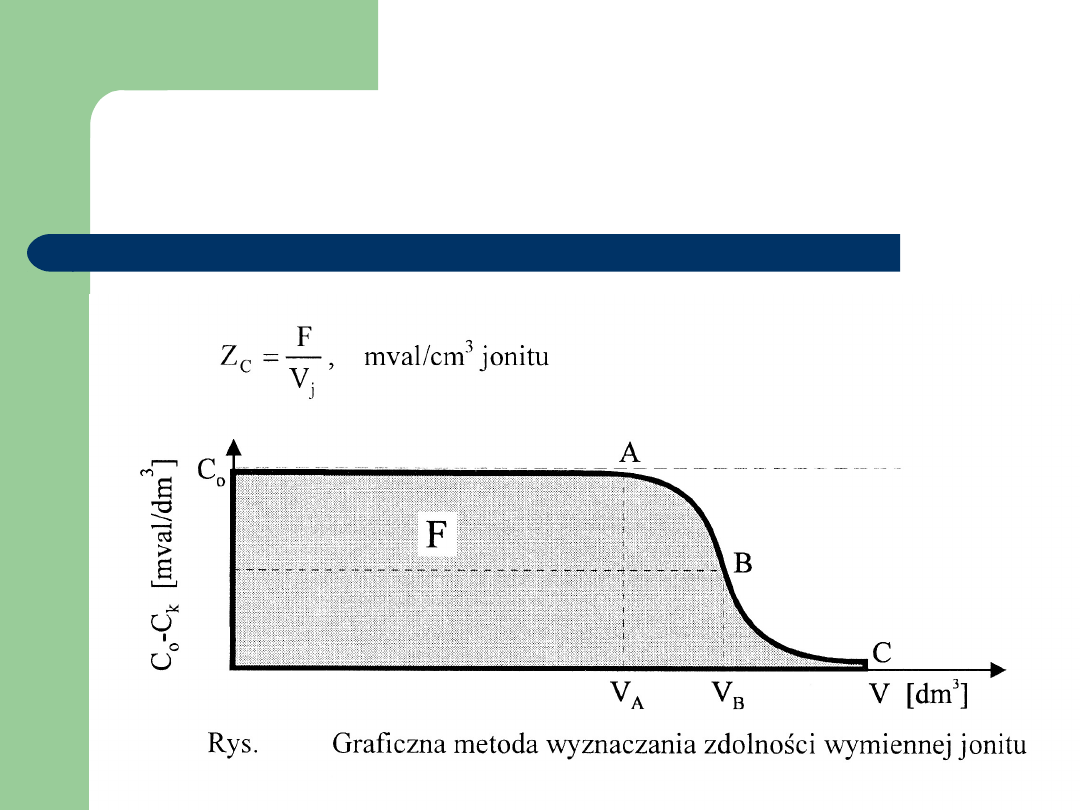
Krzywa obsadzania

O D C Z Y N i T E M P E R
A TURA
Podwyższenie odczynu poprawia dysocjację grup
słabo- kwaśnych -COOH, obniża słabo-
zasadowych –NH
3+
Podwyższenie temperatury zwiększa szybkość
procesów dyfuzyjnych.
Rozluźnia strukturę jonitu i rozszerza kanaliki.

K
O N I E C
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
Wyszukiwarka
Podobne podstrony:
Cicha woda (24)
TPL PRAC 12 09 24 Woda koprowa
(TPL PRAC 2012-09-24 Woda koprowa)
(TPL PRAC 2012 09 24 Woda koprowa)id 1431
TPL PRAC 12 09 24 Woda koprowa
24 piątek
Ochrona budowli przed wodą i wilgocią gruntową
Kopia woda
24(45)RUP
woda plus oplaty
Tajemnice szklanki z wodą 1
ostre białaczki 24 11 2008 (kurs)
ZPSBN T 24 ON poprawiony
24 NIEDZIELA ZWYKŁA A
Środowisko bytowania woda, powietrze, gleba 2
woda 2 druk
więcej podobnych podstron