Układ okresowy pierwiastków
chemicznych, a budowa atomu i
właściwości pierwiastków.
Wykonał:
Piotr Wujec
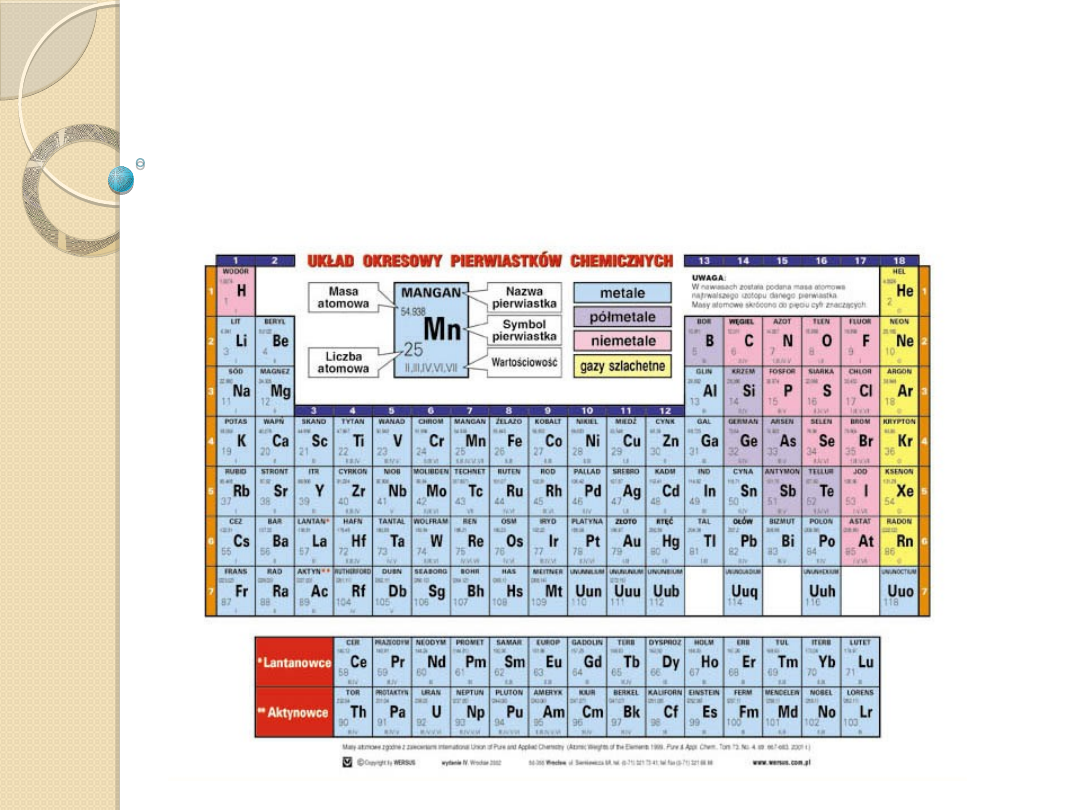
Układ okresowy
pierwiastków chemicznych
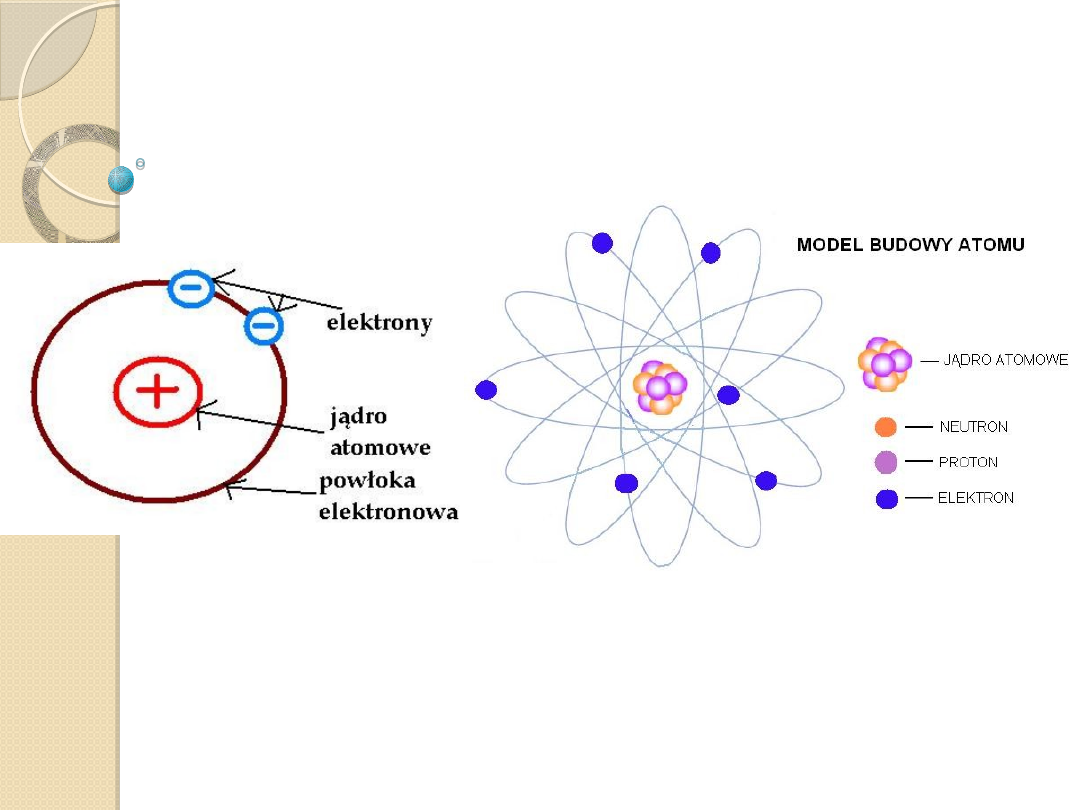
Budowa atomu
Atomy składają się z jądra i otaczających to jądro
elektronów. W jądrze znajdują się z kolei nukleony:
protony i neutrony. Neutrony są cząstkami
obojętnymi elektrycznie, protony noszą ładunek
elektryczny dodatni, zaś elektrony – ujemny.


Właściwości pierwiastków
chemicznych
Pierwiastek chemiczny, substancja prosta stanowiąca zbiór
atomów o tej samej liczbie atomowej. Atomy danego pierwiastka
chemicznego mogą się różnić liczbą neutronów, a zatem i masą
jądra. Atomy takie nazywamy izotopami danego pierwiastka.
Niektóre pierwiastki chemiczne tworzą odmiany alotropowe.
Pierwiastki chemiczne najogólniej dzielimy na metale, niemetale i
półmetale (obecnie nazwa półmetale nie jest zalecana). Większość
z nich występuje we Wszechświecie w związkach chemicznych lub
w postaci mieszaniny izotopów. Obecnie znanych jest 115
pierwiastków (usystematyzowanych w układzie okresowym
pierwiastków chemicznych) odpowiadających liczbom atomowym
od 1 do 118.
Pierwsze dwie grupy główne (oprócz wodoru) grupują atomy o
bardzo silnych własnościach metalicznych, zaś trzy przedostatnie
(grupy V, VI i VII) grupują atomy o mniej lub bardziej wyraźnych
własnościach niemetalicznych. Wreszcie grupa VIII to gazy
szlachetne.

Zastosowanie pierwiastków
chemicznych w budownictwie
Przykładem zasady wśród materiałów budowlanych
jest wapno gaszone (Ca(OH)2).
Żelazo (Fe) jest podstawowym pierwiastkiem z
którego tworzy się stal konstrukcyjną.
Gips to dwuwodny siarczan wapnia (CaSO4·2H2O).
Glinu (Al) oraz krzemu(Si) używa się do produkcji
cegły.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Właściwości pierwiastków chemicznych
- Zastosowanie pierwiastków chemicznych w budownictwie
Wyszukiwarka
Podobne podstrony:
Budowa atomu a układ okresowy pierwiastków chemicznych
Budowa atomu a układ okresowy pierwiastków chemicznych
Układ okresowy pierwiastków chemicznych, szkoła. hist -gosp
Układ okresowy pierwiastków chemicznych
Układ okresowy pierwiastków chemicznych
7 układ okresowy pierwiastków, wiązania chemiczne
Uklad okresowy pierwiastkow a budowa atomu
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
ukladokres, Układ okresowy pierwiastków, układ periodyczny pierwiastków, tablica grupująca pierwiast
UKŁAD OKRESOWY PIERWIASTKÓW
36 Atomy wieloelektronowe, układ okresowy pierwiastków
Walkowiak, Chemia ogólna, Układ okresowy pierwiastków
Wyklad 6. Uklad okresowy pierwiastkow, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Powt. Dz. II, Powtórzenie wiadomości z działu II: Układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW (WERSJA SKRÓCONA) kolor, Dokumenty - chemia
Układ okresowy pierwiastków2, Chemia
Współczesny Układ Okresowy Pierwiastków, Chemia
uklad-okresowy-pierwiastkow
88 Uklad okresowy pierwiastkow 2
więcej podobnych podstron