
Określanie żywotności i proliferacji
komórek metodami
spektrofotometrycznymi

Spektrofotometria
Spektrofotometria UV-VIS oparta jest na pomiarze absorbancji A
l
badanego roztworu przy określonej długości fali l (200 – 780 nm)
zgodnie z prawem Lamberta-Beera:
A
l
= e
l
x l x c
e
l
– współczynnik absorbcji
l – grubość warstwy absorbującej
c – stężenie analitu w roztworze
Absorbancję definiujemy jako :
A
l
= log I
0
/I
I
0
- natężenie promieniowania padającego na ośrodek
I – natężenie promieniowania po przejściu przez ośrodek
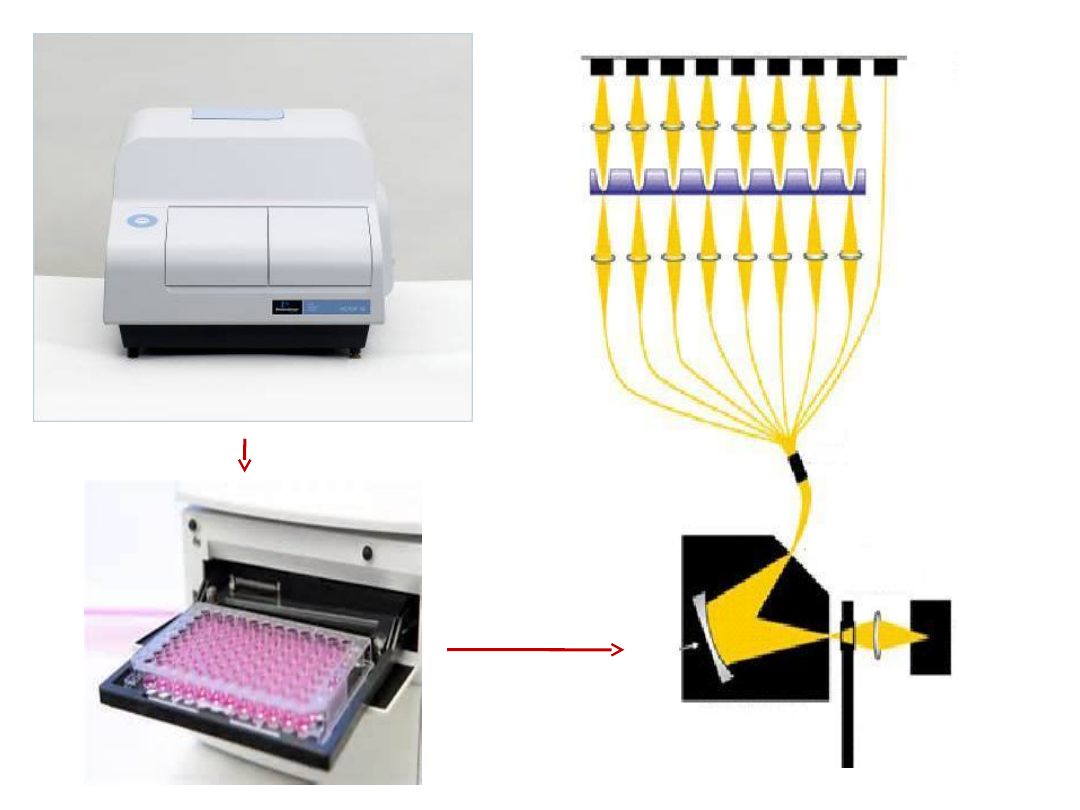
Źródło
światł
a
Monochromator filtr
Rozdzielacz
Płytka 96
dołkowa
detektor
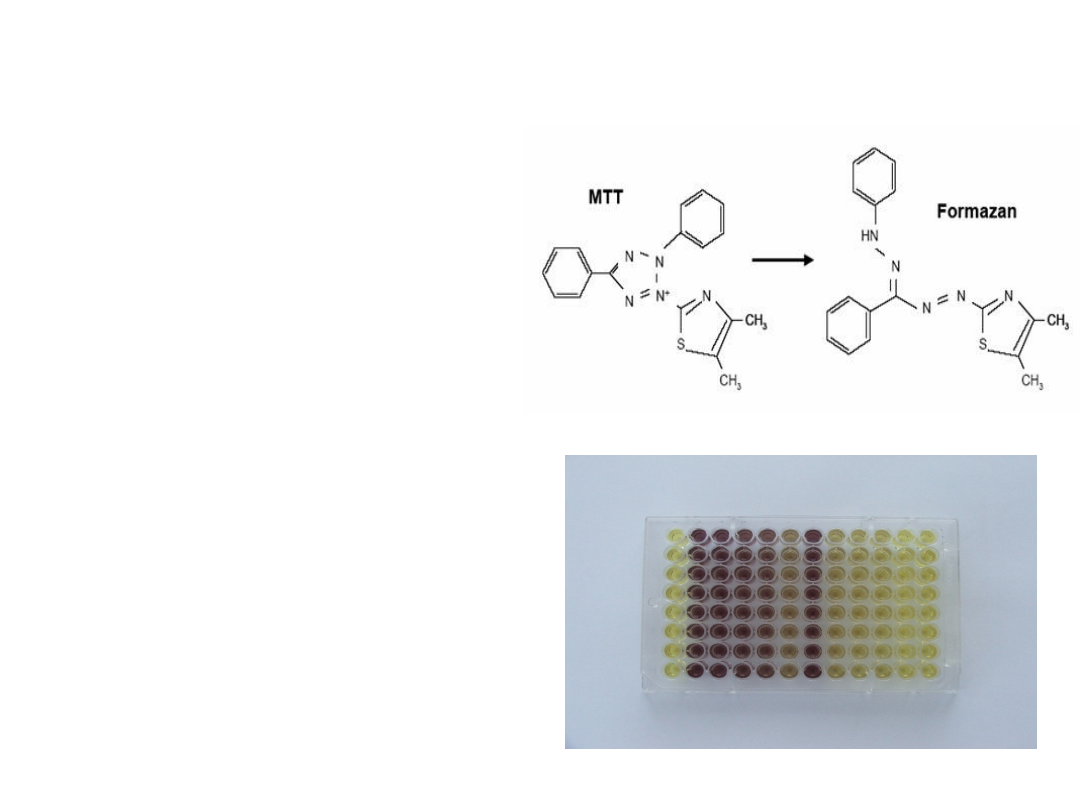
Określanie proliferacji i żywotności -
test MTT
Zasada testu: dehydrogenaza
bursztynianowa, enzym
obecny w wewnętrznej błonie
mitochondrium przekształca
rozpuszczalną w wodzie żółtą
sól tetrazoliową - MTT (bromek-
3[4,5-dwumetylotiazylo-2-yl]-
2,5-dwufenylotetrazolu) do
nierozpuszczalnych kryształów
formazanu o barwie
purpurowej. Kryształy
rozpuszcza się stosując różnego
rodzaju detergenty (np. SDS).
Intensywność zabarwienia
(mierzona
spektrofotometrycznie) jest
wprost proporcjonalna do ilości
żywych komórek. W zależności
od czasu inkubacji, test MTT
może służyć do określania
cytotoksyczności substancji
(24h inkubacja) lub jej wpływu
na proliferacje komórek (96h).
Przekształcenie MTT do formazanu
Płytka 96 dołkowa z wykonanym testem MTT
dehydrogenaza
redukcja
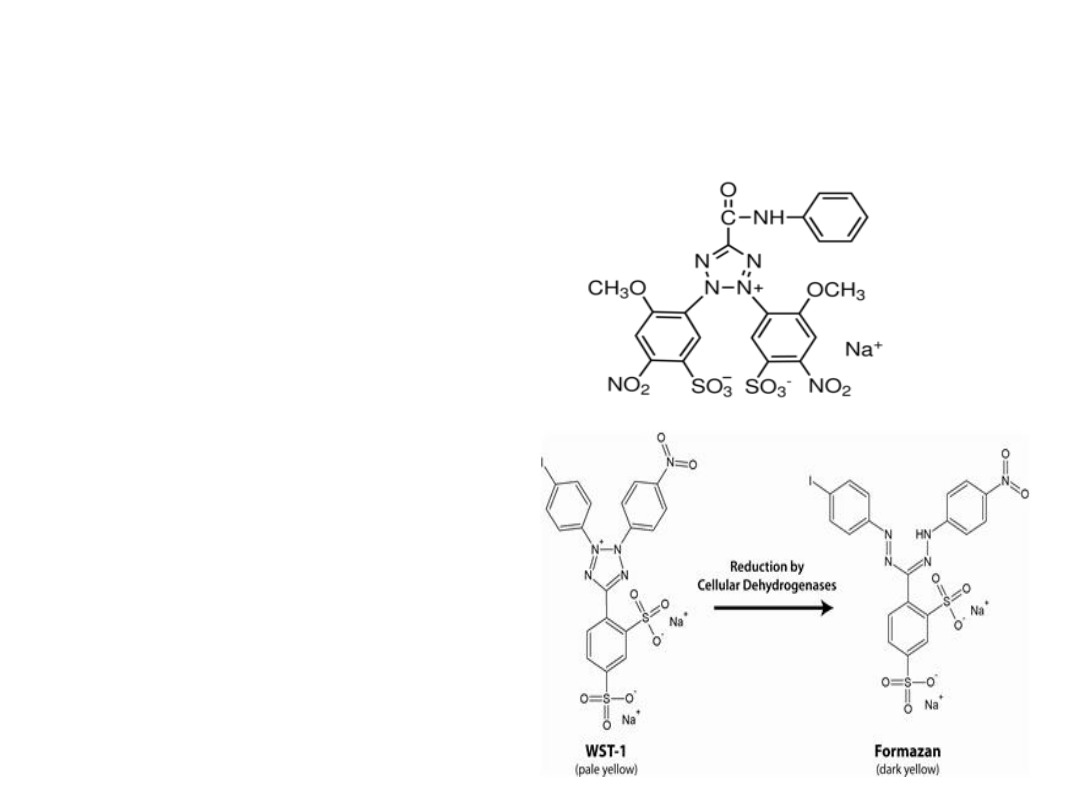
Inne sole tetrazoliowe
• XTT - większa czułość,
krótszy czas inkubacji
oraz produkt
rozpuszczalny w wodzie.
• WSTs (Water soluble
Tetrazolium salts) –
Wykorzystując transport
elektronów związany z
NAD(P)H i 1-metoksy PMS
dochodzi do redukcji WST
na zewnątrz komórki
(większa czułość, produkt
rozpuszczalny w wodzie).
XTT
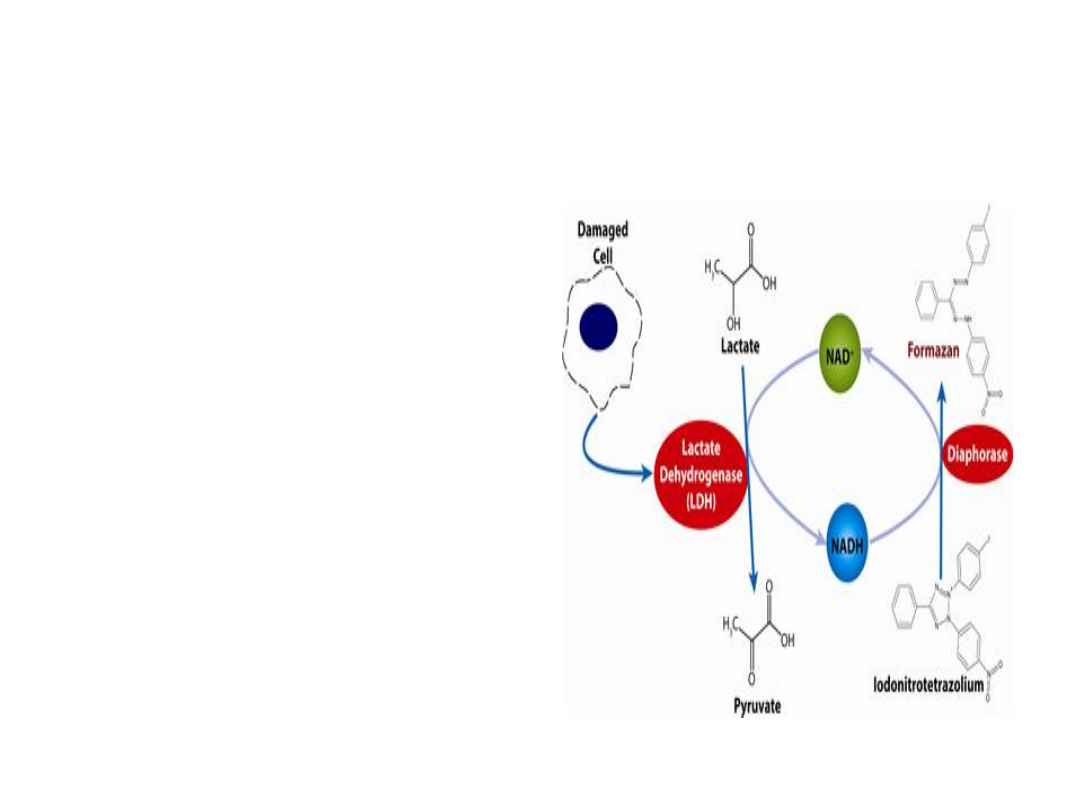
Stopień uszkodzenia błon
komórkowych - test LDH
Test pozwala ocenić
cytotoksyczność związku.
Badanie opiera się na pomiarze
aktywności dehydrogenazy
mleczanowej (LDH) uwalnianej
do środowiska na skutek
uszkodzenia błony komórkowej
przez badaną substancje. LDH
przekształca mleczan do
pirogronianu, czemu
towarzyszy redukcja NAD
+
do
NADH. Następnie diaforaza
redukuje przy udziale NADH sól
tetrazoliową (żółta) do
formazanu (purpurowy).
Intensywność barwy, mierzona
spektrofotometrycznie jest
proporcjonalna do ilości
uwolnionego LDH, a więc jest
miarą cytotoksyczności
badanego związku.
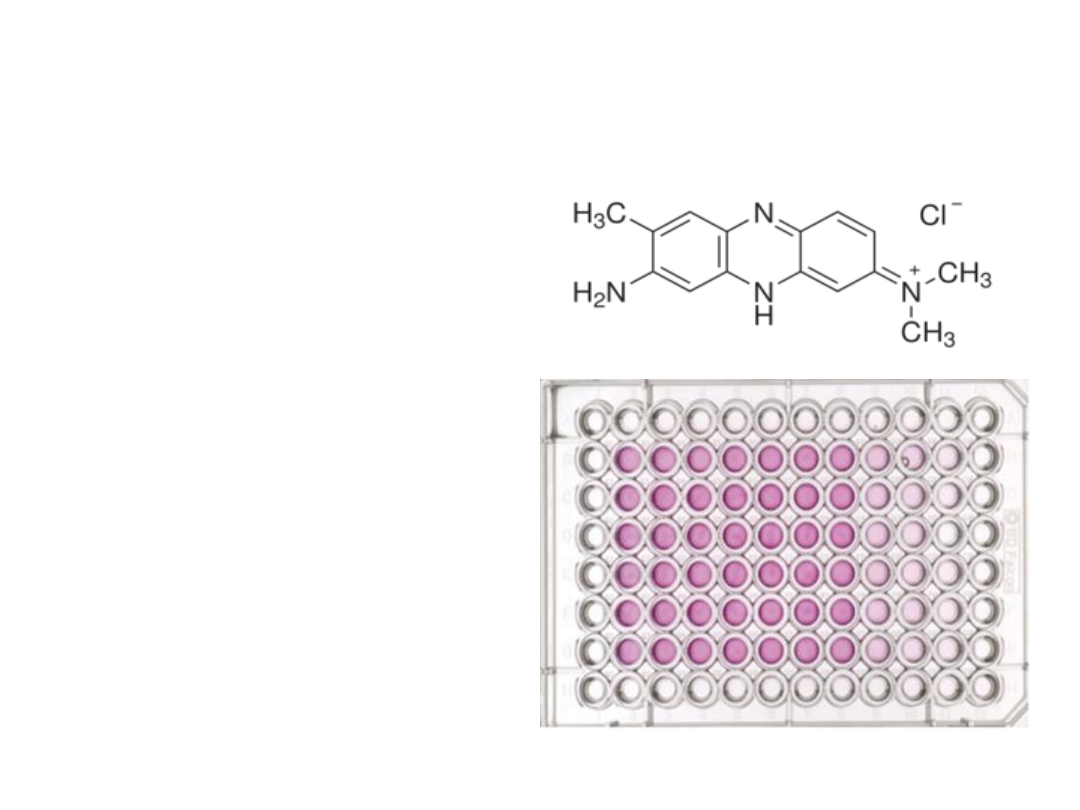
Neutral Red (NR)
Wychwyt czerwieni
obojętnej polega na
pobieraniu barwnika (Neutral
Red/Toluylene Red/Basic Red
5) przez żywe komórki i
gromadzeniu go w lizosomach
(słaby kation, pH lizosomów <
pH cytoplazmy, co umożliwia
NR wiązanie się miejscami
anionowymi do macierzy
lizosomalnej. Zazwyczaj 3
godzinna inkubacja z
roztworem NR). Następnie
komórki utrwala się, lizuje i
uwalnia barwnik. Komórki
martwe lub uszkodzone nie
pobierają NR. Ilość
pochłoniętego barwnika jest
więc wprost proporcjonalna do
ilości żywych komórek co
umożliwia przeprowadzenie
pomiaru metodami
spektrofotometrycznymi i
określenie cytotoksyczności
badanego związku.
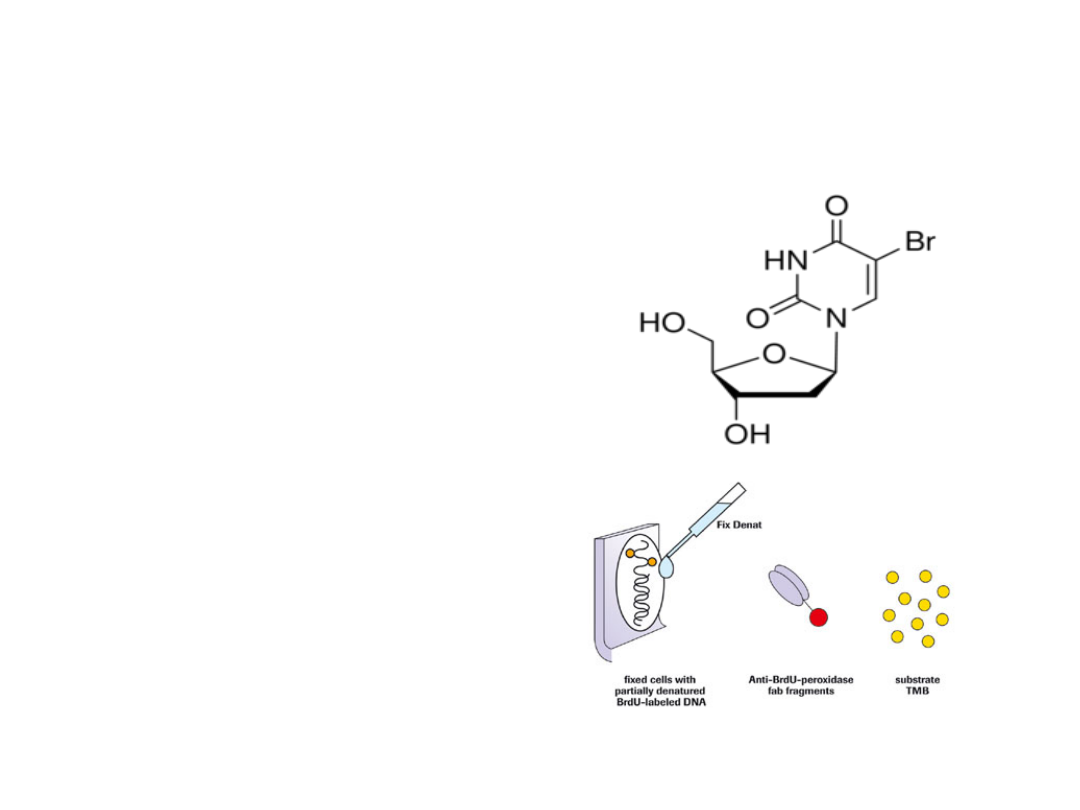
Immunoenzymatyczny test
BrdU
Polega na wykrywaniu przy
pomocy przeciwciał
monoklonalnych znakowanych
enzymem (test ELISA)
analogu tyminy - BrdU (5-
bromo-2-deoksyurydyny),
która wbudowuje się do nowo
syntezowanych nici DNA. Po
denaturacji dsDNA, stosuje się
przeciwciała anty-BrdU
znakowane np. peroksydazą
chrzanową, która przekształca
bezbarwny substrat
tetrametylbenzydyne (TMB) w
barwny produkt (żółty, po
zatrzymaniu reakcji kwasem
siarkowym - niebieski).
Intensywność zabarwienia jest
proporcjonalna do poziomu
syntezy DNA i liczby
dzielących się komórek.
BrdU
Elementy testu BrdU
Document Outline
- Slide 1
- Spektrofotometria
- Slide 3
- Określanie proliferacji i żywotności - test MTT
- Inne sole tetrazoliowe
- Stopień uszkodzenia błon komórkowych - test LDH
- Neutral Red (NR)
- Immunoenzymatyczny test BrdU
- Slide 9
Wyszukiwarka
Podobne podstrony:
Określanie żywotności i proliferacji komórek metodami spektrofotometrycznymi
Ćw 03c Izolacja limfocytów ze śledziony oraz określanie żywotności komórek
Oznaczanie żywotności komórek metodą MTT
Liczenie komórek, określanie żywotności komórek
Ćw 03c Izolacja limfocytów ze śledziony oraz określanie żywotności komórek
Liczenie komórek, określanie żywotności komórek
Badanie aktywności dehydrogenaz mikroorganizmów osadu czynnego metodą spektrofotometryczną z TTC
Oznaczanie formaldehydu na stanowisku pracy metodą spektrofotometryczną z kwasem chromotropowym
Oznaczanie formaldehydu na stanowisku pracy metodą spektrofotometryczna z kwasem chromotropowym ćwic
W02b Patofizjologia zaburzeń proliferacji komórek
06 Patofizjologia zaburzeń proliferacji komórek
Patofizjologia zaburzeń proliferacji komórek
CW2 3, POMIAR EFEKTÓW PODSTAWNIKOWYCH METODĄ SPEKTROSKOPII ABSORPCYJNEJ W PODCZERWIENI
więcej podobnych podstron